冷烫液中溴酸钠含量的测定
烫发剂中硫醇基乙酸成分之鉴别及含量测定

烫发剂中硫醇基乙酸成分之鉴别及含量测定Identification and Assay for Thioglycolic Acid in Permanent Wave1. 适用范围:本检验方法适用于烫发剂中硫醇基乙酸(thioglycolic acid)之鉴别及含量测定。
2. 检验方法:2.1. 装置:加热板。
2.2. 器具及材料:2.2.1. 三角烧瓶:250 mL。
2.2.2. 容量瓶:100 mL。
2.2.3. 试管:20 mL。
2.2.4. 烧杯:500 mL。
2.2.5. 滴定管:褐色,25 mL,刻度0.1 mL。
2.3. 试药:醋酸、醋酸镉、氨水、硫酸及淀粉均采试药级;0.1N碘液为已标定滴定液(titrisol)。
2.4. 试剂之调制:2.4.1. 稀醋酸溶液:量取醋酸60 mL加水使成100 mL。
2.4.2. 10%醋酸镉溶液:称取醋酸镉10 g溶于水,加水使成100 mL。
2.4.3. 30%硫酸溶液:量取硫酸17.1 mL徐徐加入水10 mL中,冷却后再加水使成100 mL。
2.4.4. 淀粉指示剂:称取淀粉1 g溶于水10 mL,徐徐加入沸水200 mL中,搅拌,煮沸1分钟,冷却后置于冰箱中备用,临用时取上清液使用。
2.5. 鉴别试验:量取检体2 mL,置于试管中,加水稀释至10 mL,以稀醋酸溶液调整pH值约6,续加稀醋酸溶液5 mL,混合均匀,加10%醋酸镉溶液2 mL,混合均匀,即生白色胶状沉淀。
再加过量之氨水,混合均匀,使呈碱性,则沉淀溶解。
2.6. 含量测定:精确量取检体10 mL,置于100 mL容量瓶中,加水定容,混合均匀,供作检液。
精确量取检液20 mL,置于三角烧瓶中,加水50mL及30%硫酸溶液5 mL,置于加热板,煮沸5分钟。
冷却后,加淀粉指示剂3 mL,以0.1N碘液滴定至呈蓝色为止。
另精确量取水20 mL作空白试验。
每mL 0.1N碘液相当于0.009212 g之硫醇基乙酸。
溴化钠检验操作方法

溴化钠检验操作方法
1. 取一张白色试纸,用滴管滴入一滴溴化钠试液
2. 将试液滴在试纸上,待试液干燥
3. 在光线充足的地方观察试纸,若试纸颜色变黄,则为阳性反应,说明该物质中含有碘离子。
注意事项:
1. 操作时需戴上手套、眼镜等防护用品。
2. 操作过程中应注意卫生和安全。
以下是更详细的溴化钠检验方法:
1. 将待测物质加入试管中。
2. 加入1-2滴溴化钠试液,并轻轻摇动试管使试液充分混合。
3. 观察试管内液体颜色变化。
4. 若发生颜色变化,说明该物质中可能含有碘离子。
特别注意:在检验过程中,为了排除可疑结果,应使用白纸和蒸馏水作对照,以确保检验结果准确无误。
烫发剂中溴酸钠成分之鉴别及含量测定

燙髮劑中溴酸鈉成分之鑑別及含量測定Identification and Assay for Sodium Bromate in Permanent Wave1. 適用範圍:本檢驗方法適用於燙髮劑中溴酸鈉(sodium bromate)之鑑別及含量測定。
2. 檢驗方法:2.1. 裝置:加熱板。
2.2. 器具及材料:2.2.1. 碘瓶:250 mL。
2.2.2. 容量瓶:200 mL。
2.2.3. 試管:10 mL。
2.2.4. 燒杯:500 mL。
2.2.5. 滴定管:25 mL,刻度0.1 mL。
2.3. 試藥:焦銻酸鉀(potassium pyroantimonate)、氫氧化鉀、氫氧化鈉、氨水、硫酸、二硫化碳、澱粉及碘化鉀均採試藥級;0.1N硫代硫酸鈉溶液為已標定滴定液(titrisol)。
2.4. 試劑之調製:2.4.1. 氫氧化鉀溶液:稱取氫氧化鉀6.5 g溶於水,加水使成100 mL。
2.4.2. 1N氫氧化鈉溶液:稱取氫氧化鈉4 g溶於水,加水使成100 mL。
2.4.3. 焦銻酸鉀溶液:稱取焦銻酸鉀2 g,加水95 mL,加熱使其溶解後,快速冷卻,再加氫氧化鉀溶液50mL及1N氫氧化鈉溶液5 mL,靜置24小時後過濾,取濾液加水至150 mL。
2.4.4. 稀硫酸溶液:量取硫酸5.7 mL徐徐加入水10 mL中,冷卻後再加水使成100mL。
2.4.5. 碘化鉀試液:稱取碘化鉀16.5 g溶於水,加水使成100 mL。
2.4.6. 澱粉指示劑:稱取澱粉1 g溶於水10 mL,徐徐加入沸水200 mL中,攪拌,煮沸1分鐘,冷卻後置於冰箱中備用,臨用時取上清液使用。
2.5. 鑑別試驗:2.5.1. 溴酸鹽:量取檢體1 mL置於試管中,徐徐滴加硫酸2 mL,混合均勻,釋出褐色氣體。
冷卻後,加二硫化碳 2 mL,混合均勻,下層液(二硫化碳層)應呈黃~紅色。
2.5.2. 鈉鹽:量取檢體 1 mL置於試管中,加氨水使呈鹼性,加焦銻酸鉀溶液,即生成白色結晶性沈澱。
溴酸钠含量的测定原理

溴酸钠含量的测定原理
溴酸钠是一种常用的化学试剂,广泛应用于化学分析、制药、电子工业等领域。
在实际应用中,需要对溴酸钠的含量进行测定,以保证其质量和稳定性。
本文将介绍溴酸钠含量的测定原理。
一、溴酸钠的化学性质
溴酸钠的化学式为NaBrO3,是一种白色晶体,易溶于水。
在水中可以形成弱酸性溶液,可以与酸反应生成溴酸和二氧化碳。
溴酸钠还可以与还原剂反应,生成溴化物和氧气。
二、溴酸钠含量的测定方法
1. 碘量法
碘量法是一种常用的溴酸钠含量测定方法。
其原理是利用溴酸钠与过量的碘酸钾反应,生成碘酸钠和溴化钾。
反应后,用亚硫酸钠溶液滴定剩余的碘酸钾,计算出溴酸钠的含量。
2. 氧化还原滴定法
氧化还原滴定法是一种快速、准确的溴酸钠含量测定方法。
其原理是利用溴酸钠与还原剂反应,生成溴化物和氧气。
反应后,用标准的碘酸钾溶液滴定剩余的还原剂,计算出溴酸钠的含量。
3. 紫外分光光度法
紫外分光光度法是一种基于溴酸钠的吸收特性进行测定的方法。
其原理是利用溴酸钠在紫外光谱区域的吸收特性,通过测量样品的吸光度来计算出溴酸钠的含量。
三、结论
以上三种方法都可以用于溴酸钠含量的测定,具有各自的优缺点。
在实际应用中,需要根据具体情况选择合适的方法进行测定。
无论采用哪种方法,都需要注意实验条件的控制和数据的准确性,以保证测定结果的可靠性。
溴酸钠

闽南师范大学溴酸钠姓名:赵品学号:1106000235专业:化学教育班级:11化本2班2013年11月25日摘要:溴酸钠,无色结晶、白色颗粒或结晶性粉末。
无气味。
在381℃时分解同时放出氧。
溶于水,不溶于乙醇,水溶液呈中性。
相对密度 3.34。
用作分析试剂和氧化剂、烫染发药剂。
关键词:溴酸钠;烫染发药剂;危险品一、基本信息中文名称:溴酸钠英文名称:Sodium bromate英文别名:bromatedesodium;bromatedesodium[french];dyetone;neutralizerk-126;neutralizerk-140;neutralizerk-938;BROMIDE ION CHROMA TOGRAPHY STANDARD;BROMIDE分子式:NaBrO3分子量:150.89二、理化性质(一)物理性质外观与性状:白色结晶或晶状粉末,无味。
熔点(℃):381(分解)相对密度(水=1):3.339(17.5℃),折光率1.594溶解性:溶于水,不溶于乙醇(二)化学性质1、制法:由溴蒸汽通入碳酸钠溶液后,再将生成的溴酸钠和溴化钠用结晶法分离而得。
Br2+ H2O+2Na2CO3=:NaBrO3+ NaBr+2NaH CO32、在室温下,水在氢氧化钠中可歧化生成溴化钠和溴酸钠3 Br2+6NaOH= NaBrO3+ 5NaBr+3 H2O在产物中加酸,会发生上述反应的逆反应3、溴酸钠分解NaBrO3 =2 NaBr+3O24、采用强氧化剂可将溴酸钠氧化成高溴酸钠BrO3- +F2+2OH-= BrO4-+2F-+H2OBrO3-+Xe F2+ H2O= BrO4-+Xe+2HF5、溴酸钠与铵盐、金属粉末、可燃物、有机物或其它易氧化物形成爆炸性混合物,经摩擦或受热易引起燃烧或爆炸。
与硫酸接触容易发生爆炸。
能与铝、砷、铜、碳、金属硫化物、有机物、磷、硒、硫剧烈反应。
三、作用与用途主要用作制备无机化学产品、酚类测定的化学试剂。
化学冷烫液中巯基乙酸含量的测定

化学冷烫液中巯基乙酸含量的测定(碘量法)√一、实验原理HI I COOH HSCH COOH SCH COOHSCH 22|2222+→+二、仪器及试剂1、仪器:容量瓶、碘量瓶、量筒、移液管、电炉、碱式滴定管、烧杯 2、试剂:30%、0.5%淀粉指示剂、0.05mol/L 碘液、0.1mol/L 标液、、3mol/L 、KI 固体、试样:化学冷烫液。
三、实验步骤1、0.1mol/L 硫代硫酸钠标液的配制与标定:配制:称取 12.5g 硫代硫酸钠和0.1g 碳酸钠溶于500ml 水中。
标定:准确称取3份重铬酸钾,每份约0.13~0.15g ,分别置于500ml 碘量瓶中,加蒸馏水25ml ,溶解后,取其中一个碘量瓶加3mol/L 硫酸15ml 和KI 固体2g ,混匀后盖上瓶塞,瓶口封少量蒸馏水,在暗处静置5min,然后加150ml 蒸馏水,立即用0.1mol/L 硫代硫酸钠标液滴定至浅黄绿色,加入3ml0.5%淀粉指示剂,继续滴定至溶液由黄色变为亮绿色,即为终点。
计算公式如下:3227227223226O S Na O Cr k O Cr k O S Na V M m c ⨯=式中—722O Cr k M =294.19g/mol 。
2、1/2I 2溶液的配制与标定:标定:量取35.00~40.00ml 配置好的碘溶液置于碘量瓶中,加150ml 蒸馏水,用硫代硫酸钠标液滴定,近终点时加2ml 淀粉指示剂,继续滴定至蓝色消失。
计算公式:23223222I O S Na O S Na I V V c c =3、样品测定:取冷烫液样品2.00ml 于锥形瓶中,加入2滴甲基红,用1:1盐酸调节PH 至溶液呈红色,加入2滴淀粉指示剂,用碘标液滴至溶液便为蓝褐色及为终点。
计算公式如下:00.2mg/ml 22巯基乙酸)巯基乙酸(M V c I I式中:巯基乙酸M=92.11,g/mol 。
四、实验记录及数据处理1、硫代硫酸钠标液的标定:相对平均极差为:0.045%。
溴化钠检验操作规程
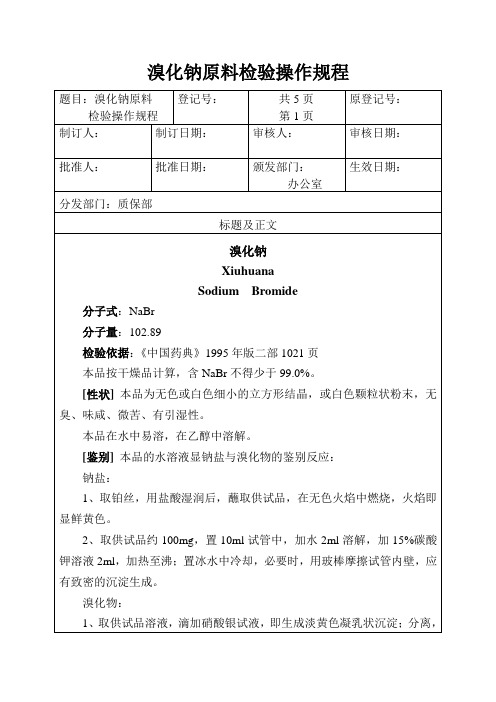
5、硫酸盐:取本品2.0g加水溶解使成约40ml(溶液如显碱性,可滴加盐酸使成中性);溶液如不澄清,应滤过;置50ml纳氏比色管中,加稀盐酸2ml,摇匀,即得供试品溶液。另取标准硫酸钾溶液4.0ml,置50ml纳氏比色管中,加水使成约40ml,加稀盐酸2ml,摇匀,即得对照溶液。于
题目:溴化钠原料
检验操作规程
登记号:
共5页
第3页
原登记号:
标题及正文
供试品溶液与对照溶液中,分别加入25%氯化钡溶液5ml,用水稀释至50ml,充分摇匀,放置10分钟,同置黑色背景上,从比色管上方向下观察,比较,供试品溶液不得比对照液更浓(0.020%)。
6、溴酸盐:取本品1.0g,加新沸过的冷水10ml溶解后,加10%碘化钾溶液0.1ml,淀粉指示液1ml与稀硫酸0.15ml,摇匀,放置5分钟,不得显蓝色或紫色。
本品按干燥品计算,含NaBr不得少于99.0%。
[性状]本品为无色或白色细小的立方形结晶,或白色颗粒状粉末,无臭、味咸、微苦、有引湿性。
本品在水中易溶,在乙醇中溶解。
[鉴别]本品的水溶液显钠盐与溴化物的鉴别反应:
钠盐:
1、取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显鲜黄色。
2、取供试品约100mg,置10ml试管中,加水2ml溶解,加15%碳酸钾溶液2ml,加热至沸;置冰水中冷却,必要时,用玻棒摩擦试管内壁,应有致密的沉淀生成。
溴化物:
1、取供试品溶液,滴加硝酸银试液,即生成淡黄色凝乳状沉淀;分离,
题目:溴化钠原料
检验操作规程
登记号:
共5页
冷汤液中溴酸钠的测定

操作步骤
称取定型剂0.15g与碘量瓶中称准至0.0002g用去离子水25毫升溶解,加百分之20的碘化钾10毫升,稀硫酸15毫升。盖好盖后与冷暗处放置5分钟。用0.2mol/L硫代硫酸钠滴定至浅黄色。加碘粉指示剂1毫升继续用硫代硫酸钠滴定至无色为终点平行做三次并作空白。次数 Nhomakorabea内容
1
2
洗发液PH测定
操作步骤略用回归方程
数据记录和表格处理由考生自己设计并填写
3
称量瓶和试样质量(倾出前)
称量瓶和试样质量(倾后前)
定型剂试样质量
试样实验
滴定消耗硫代硫酸钠体积
滴定管校正值
溶液温度校正值
实际消耗硫代硫酸钠体积
空白试验
滴定消耗硫代硫酸钠体积
滴定管校正值
溶液温度校正值
实际消耗硫代硫酸钠体积
溴酸钠含量C(V1-V2).0.02515/m
平均值
平行测定结果极差
极差与平均值的比
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
惠州市职业技能大赛(职工组)
冷烫液中溴酸钠含量的测定
(实验操作步骤)
一、配制0.017mol·L-1 K2Cr2O7标准溶液250mL
准确称取0.48~0.52g K
2Cr
2
O
7
(电子天平减量法称量)于100mL烧杯中,加适
量蒸馏水溶解后,定量转入100mL容量瓶中,用蒸馏水稀释至刻度,摇匀,计算其
准确浓度(基准等级的K
2Cr
2
O
7
必须在150℃下干燥后使用)。
二、Na2S2O3的配制和标定
1、在台称上称取13g Na
2S
2
O
3
·5H
2
O溶于500mL新煮沸的冷蒸馏水中,加0.1g
Na
2CO
3
(或1/3勺无水Na
2
CO
3
)保存于棕色瓶中,进行标定。
2、Na2S2O3溶液的标定
用移液管吸取20mL K
2
Cr
2
O
7
标准溶液于250mL锥形瓶中,加5mL 6mol·L-1
HCl,加入10mL 100g·L-1的 KI,于暗处放置5min,然后用100mL蒸馏水稀释
(注:离开暗处后应立即用水稀释),用Na
2S
2
O
3
滴液滴至浅黄绿色后,加入2mL
淀粉指示剂,继续滴定至溶液蓝色消失并变为绿色即为终点,平行测定三次。
计算标准溶液的浓度和相对平均偏差。
相关物质的相对化学式量:M(K
2Cr
2
O
7
)294.18,M(NaBrO
3
)150.89
三、样品的测定
准确称取定型剂3.2~3.4g(电子天平直接法称量),用蒸馏水溶解并定容于100mL容量瓶中,再用移液管吸取10mL于碘量瓶中,加入蒸馏水40mL、10mL
100g·L-1的KI及稀硫酸15ml,盖好瓶盖后于冷暗处放置5min加淀粉指示剂3mL,用0.1mol/L硫代硫酸钠滴定至无色,并做空白实验。
计算定型剂中溴酸钠的含量
特别提醒:请选手自备计算器。
