氯化钠溶液浓度对比表
饱和氯化钠溶液浓度

饱和氯化钠溶液浓度
氯化钠是一种常见的无机盐,它由氯原子和氢原子组成。
它是一种白色固体,无毒,味道微咸,提供了许多食物和工业应用。
饱和氯化钠溶液也被称为纯净水源中含有分子量较大的氯化钠溶液。
它是以氯化钠晶体为基础的溶液,在受控温度下,可以自然凝结,并能达到浓度稳定。
饱和氯化钠溶液的浓度由两个因素共同决定:温度和溶液之间的比例。
温度越高,浓度越高;反之,温度越低,浓度越低。
此外,溶液的比例也会影响浓度。
如果晶体和溶剂的比例越多,饱和氯化钠溶液的浓度就会越高;反之,溶剂和晶体的比例越低,饱和氯化钠溶液的浓度就会越低。
通常,标准饱和氯化钠溶液的浓度是1.33g/ml,而在20℃下,饱和氯化钠溶液的浓度可以高达600g/ml。
饱和氯化钠溶液的浓度可以改变人们对于溶液的配方,以达到所需要的特定目的。
氯化钠溶液浓度的测定~(doc文档)
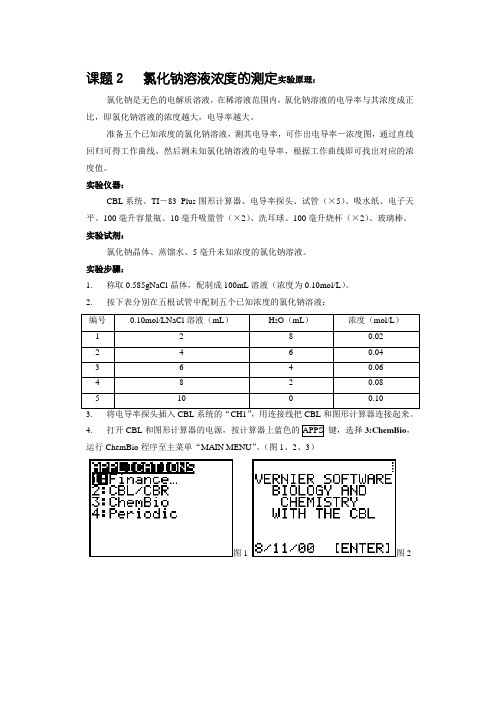
课题2氯化钠溶液浓度的测定实验原理:氯化钠是无色的电解质溶液,在稀溶液范围内,氯化钠溶液的电导率与其浓度成正比,即氯化钠溶液的浓度越大,电导率越大。
准备五个已知浓度的氯化钠溶液,测其电导率,可作出电导率-浓度图,通过直线回归可得工作曲线。
然后测未知氯化钠溶液的电导率,根据工作曲线即可找出对应的浓度值。
实验仪器:CBL系统、TI-83 Plus图形计算器、电导率探头、试管(×5)、吸水纸、电子天平、100毫升容量瓶、10毫升吸量管(×2)、洗耳球、100毫升烧杯(×2)、玻璃棒。
实验试剂:氯化钠晶体、蒸馏水、5毫升未知浓度的氯化钠溶液。
实验步骤:1. 称取0.585gNaCl晶体,配制成100mL溶液(浓度为0.10mol/L)。
2. 按下表分别在五根试管中配制五个已知浓度的氯化钠溶液:编号0.10mol/LNaCl溶液(mL)H2O(mL)浓度(mol/L)1 2 8 0.022 4 6 0.043 64 0.064 8 2 0.085 10 0 0.104. 打开CBL和图形计算器的电源,按计算器上蓝色的APPS 键,选择3:ChemBio,运行ChemBio程序至主菜单“MAIN MENU”。
(图1、2、3)图1 图2图3 图4 5. 在图形计算器中设置电导率探头。
➢在“MAIN MENU”中选择1:SET UP PROBES。
(图4)➢按 1 ENTER 输入电极的数目。
(图5)图5 图6 ➢在“SELECT PROBE”菜单中选择6:CONDUCTIVITY。
(图6)➢按ENTER 。
(图7)➢按 1 ENTER 作为通道的编号。
(图8)图7 图8 ➢选择1:USE STORED,用已储存的校准值。
(图9)图9➢选择5:H 0-20000 MICS为量程,并把电导率探头上的量程开关也调到相应位置。
6. 采集数据。
➢在“MAIN MENU”中选择2:COLLECT DATA,在“DATA COLLECT”菜单中选择3:TRIGGER/PROMPT。
氯化钠饱和溶液浓度

氯化钠饱和溶液浓度介绍氯化钠饱和溶液是一种常见的化学溶液,特点是在特定温度下溶解度达到最大。
本文将探讨氯化钠饱和溶液的浓度相关内容,包括定义、计算公式、影响因素等。
什么是氯化钠饱和溶液浓度氯化钠饱和溶液浓度是指在特定温度下,溶液中氯化钠的质量分数或摩尔浓度。
质量分数是指溶液中溶质的质量与溶液的总质量之比;摩尔浓度是指溶质的摩尔数与溶液的体积之比。
计算氯化钠饱和溶液质量分数的方法计算氯化钠饱和溶液质量分数的公式如下:质量分数 = 溶质质量 / 溶液总质量* 100%其中溶质质量是指溶液中氯化钠的质量,溶液总质量是指溶液中氯化钠和溶剂(通常为水)的总质量。
计算氯化钠饱和溶液摩尔浓度的方法计算氯化钠饱和溶液摩尔浓度的公式如下:摩尔浓度 = 溶质摩尔数 / 溶液体积其中溶质摩尔数是指溶液中氯化钠的摩尔数,溶液体积是指溶液的体积。
影响氯化钠饱和溶液浓度的因素氯化钠饱和溶液的浓度受到以下因素的影响:温度温度是影响氯化钠饱和溶液浓度的重要因素。
在较高的温度下,溶质的溶解度通常会增加,导致溶液的浓度也增加。
压力压力对氯化钠饱和溶液浓度的影响相对较小。
在一定范围内,压力对溶液浓度的影响可以忽略不计。
溶剂种类溶剂种类对氯化钠饱和溶液浓度也有一定影响。
不同的溶剂具有不同的溶解度,从而影响溶液的浓度。
溶质质量溶质质量是决定氯化钠饱和溶液浓度的关键因素。
溶质质量越大,饱和溶液的浓度就越高。
氯化钠饱和溶液在生活中的应用氯化钠饱和溶液在生活中有许多常见的应用,例如:1.食盐制备:氯化钠饱和溶液是食盐的主要原料,通过蒸发溶液中的水分可以制备食盐。
2.医疗用途:氯化钠饱和溶液可用于生理盐水的制备,用于输液和药物稀释。
3.调味品:氯化钠饱和溶液也是许多调味品的成分之一,用于增加食物的口感。
4.果蔬保鲜:氯化钠饱和溶液可以用于浸泡果蔬,延长其保鲜时间。
结论氯化钠饱和溶液浓度是指在特定温度下溶液中氯化钠的质量分数或摩尔浓度。
可以通过相应的计算公式来计算浓度值。
氯化钠溶液不同浓度都折射率的影响doc资料

氯化钠溶液不同浓度都折射率的影响光学设计性实验氯化钠浓度对折射率的影响摘要利用阿贝斯折射计证明不同浓度的透明液体折射率.在饱和度范围内,取不同浓度氯化钠溶液,利用阿贝斯折射计测出折射率。
将待测液体滴在指定地点可以直接读出折射率,在进行不同浓度液体的折射率与浓度大小的关系.最后证明出折射率与浓度大小成正比例关系.关键字: 阿贝斯折射;折射率;浓度:AbstractUse of Abbes refractometer that different concentrations of refractive index of transparent liquid. In saturation range, for different concentrations of sodium chloride solution, the Abbes refractometer measuring refractive index. Will the test liquid droplets in the designated locations can be directly read out the index of refraction, in different concentration of liquid refractive index and concentration and size relations. Finally prove the refractive index and concentration size proportional relationship.Keywords: Abbes refraction; refractive index; concentration引言折射率是透明材料的重要光学常数,测量折射率的方法很多,其中,利用阿贝折射仪是相当简单的一种。
阿贝折射仪是利用全反射法制成的、专门用于测量透明或半透明液体的固体折射率及平均色散nF—nC的仪器,它还能测量糖溶液的含糖浓度[1]。
一种渗透压的调节计算方法

一种渗透压的调节计算方法摘要】注射剂、滴眼剂必须对渗透压进行控制。
渗透压除直接根据所用原辅料的分子量及用量计算外,通常采用冰点降低数据法或是氯化钠等渗当量法,但实际生产中无法将渗透压精确调节到位。
根据氯化钠溶液浓度与渗透压的关系,提供了一种新的渗透压调节计算方法,可通过加等渗调节剂或溶剂的方法对渗透压进行精确调整。
【关键词】渗透压;调节计算;注射剂;滴眼剂【中图分类号】R77 【文献标识码】A 【文章编号】2095-1752(2015)18-0216-02在制备注射剂、滴眼剂等药物制剂时,必须关注其渗透压。
溶液的渗透压,依赖于溶液中粒子的数量,是溶液的依数性之一,可根据粒子总量进行计算。
但实测的渗透压摩尔浓度与理想状态下的计算值有一定的偏差。
实际生产中往往还受到其它因素影响,渗透压与理论值偏差大,需要调节渗透压。
用冰点降低数据法或氯化钠等渗当量法往往误差较大或无法计算,利用氯化钠溶液浓度与渗透压摩尔浓度的关系做成公式,可解决此问题。
1.方法来源2015版药典中渗透压摩尔浓度测定法提供了氯化钠溶液浓度及渗透压的关系,见下表表1 渗透压摩尔浓度测定仪校正用标准溶液的配制每1kg 水中氯化钠的重量(g)毫渗透压摩尔浓度(mOsmol/kg)3.087 1006.260 2009.463 30012.684 40015.916 50019.147 60022.380 70032.23 1000以上图表为药典上标准溶液配制方法,以此为依据,做氯化钠用量与渗透压的关系图。
因正常人体血液的渗透压摩尔浓度范围为285~310mOsmol/kg,所以取200、300、400 mOsmol/kg及其对应的氯化钠量做图,得出下图及计算公式。
图1 氯化钠溶液浓度与渗透压的关系根据此公式可计算出200~400mOsmol/kg范围内各浓度的氯化钠溶液相应的渗透压,或是由相应的渗透压推算出氯化钠溶液的浓度。
以此公式计算,可通过加氯化钠或是加水的方法将溶液的渗透压调节至任意值。
氯化钠溶液冰点表

氯化钠溶液冰点表引言氯化钠是一种常见的盐类化合物,广泛应用于医药、食品工业等领域。
本文将探讨氯化钠溶液的冰点表现象。
溶液与冰点的关系溶液的冰点降低在常温下,水的冰点约为0℃,但当溶质溶解于水中时,其冰点会降低。
这是由于溶质分子与溶剂分子之间的相互作用力,导致溶液的冰点比纯溶剂的冰点低。
冰点降低的原理溶质分子的存在使溶剂分子的有序性降低,破坏了溶剂分子之间的氢键结构,因此水分子形成冰晶的能力减弱。
而溶质分子与溶剂分子的相互作用力使溶液的分子间距增大,这进一步增加了形成冰晶的难度。
所以,冰点降低是由溶质阻碍了溶剂形成冰晶所致。
氯化钠溶液冰点表氯化钠溶液冰点表是描述氯化钠溶液冰点降低程度的表格。
根据浓度的不同,可以得到不同浓度的氯化钠溶液冰点。
0.1 mol/L氯化钠溶液的冰点浓度为0.1 mol/L的氯化钠溶液的冰点约为-3.7℃。
0.2 mol/L氯化钠溶液的冰点浓度为0.2 mol/L的氯化钠溶液的冰点约为-7.4℃。
0.3 mol/L氯化钠溶液的冰点浓度为0.3 mol/L的氯化钠溶液的冰点约为-11.1℃。
0.4 mol/L氯化钠溶液的冰点浓度为0.4 mol/L的氯化钠溶液的冰点约为-14.8℃。
浓度与冰点降低的关系浓度与冰点降低的线性关系根据理论计算和实验测定,浓度与冰点降低呈线性关系。
当溶液的浓度增加一倍时,冰点降低也相应增加一倍。
理论与实际的偏差在高浓度溶液中,溶质分子之间的相互作用力增强,使溶质分子聚集形成一个类似于新相的结构,这可能影响了冰点降低的线性关系。
因此,在较高浓度下,理论计算得到的冰点降低值与实际测定值可能存在偏差。
冰点降低应用盐对道路的影响在冬季,许多地区会使用盐溶液来融化路面上的积雪和冰。
这是由于盐溶液的冰点降低作用,使得溶液与路面接触后迅速形成液态,加快融雪效果。
食品冷冻保鲜在食品加工和冷冻保鲜过程中,盐溶液常被用作冷冻介质。
通过降低冰点,盐溶液能更有效地降低食品的温度,从而达到冷冻保鲜的目的。
不同浓度的硫酸、氢氧化钠、氯化钠、磷酸缓冲溶液配制

实验不同浓度的硫酸、氢氧化钠、氯化钠、磷酸缓冲溶液
配制
1、调节pH的酸碱溶液
(1)1M的H2SO4溶液:用移液枪移取5.56ml浓硫酸,缓慢滴入94.44ml去离子水中,边滴边搅拌,搅拌均匀后移入150mL的白色广口瓶中。
(2)0.1M的H2SO4溶液:移取10mL的1M的H2SO4溶液于90mL的去离子水中,并充分搅拌均匀后,移入150mL的白色广口瓶中。
(3)1M的NaOH溶液:称取8gNaOH固体(称取要快速,因NaOH易潮解)于塑料瓶中,加入200mL去离子水,超声搅拌溶解。
(4)0.1M的NaOH溶液:移取10mL的1M的NaOH溶液于装有90mL的去离子水的白色塑料瓶中,充分混合均匀。
2、磷酸缓冲溶液:
(1)1M的磷酸一氢钠溶液:称取89.5g磷酸一氢钠于250mL烧杯中,加入约200mL去离子水,超声搅拌溶解后转移至250mL的棕色容量瓶(注意润洗烧杯),加去离子水至刻度线,充分混匀;
(2)1M的磷酸一氢钠溶液:称取31.2g磷酸二氢钠(NaH2PO4·2H2O)于250mL 烧杯中,加入约100mL去离子水,超声搅拌溶解后转移至200mL的棕色容量瓶(注意润洗烧杯),加去离子水至刻度线,充分混匀;
(3)磷酸缓冲溶液:分别移取39mL磷酸二氢钠溶液和61mL磷酸一氢钠溶液于100mL的比色管中,混合均匀。
3、100mM NaCl溶液
称取0.5844gNaCl溶于约50mL去离子水中,后移至100比色管中,润洗烧杯,加去离子水至刻度线,充分混匀。
氯化钠检测方法

中华人民共和国国家标准中华人民共和国国家标准食品中氯化钠的测定方法GB/T 12457-90Method for determination of sodium chloride in foods───────────────────────────────────────本标准参照采用国际标准ISO 1841-1981《肉与肉制品中氯化钠的测定》和ISO 3634-1979《蔬菜制品中氯化钠的测定》。
2 主题内容与适用范围本标准规定了使用容量法或电位滴定法测定食品中氯化钠的方法。
本标准的容量法适用于肉食制品、水产制品、蔬菜制品、腌制品、调味品等食品中氯化钠的测定,不适用于深色食品;电位滴定法适用于上述各类食品中氯化钠的测定。
2 容量法(铁铵矾指示剂法)2.1 原理样品经处理、酸化后,加入过量的硝酸银溶液,以硫酸铁铵为指示剂,用硫氰酸钾标准滴定溶液滴定过量的硝酸银。
根据硫氰酸钾标准滴定溶液的消耗量,计算食品中氯化钠的含量。
2.2 试剂所用试剂均为分析纯;水为蒸馏水或同等纯度的水(以下简称水)。
2.2.1 冰乙酸(GB 676)。
2.2.2 蛋白质沉淀剂试剂Ⅰ:称取106g亚铁氰化钾(GB 1273)溶于水中,转移到1 000mL容量瓶中,用水稀释至刻度。
试剂Ⅱ:称取220g乙酸锌(HG 3--1098)溶于水中,并加入30mL冰乙酸,转移到1 000mL容量瓶中,用水稀释至刻度。
2.2.3 硝酸溶液(1:3):量取1体积浓硝酸(GB 627)与3体积水混匀。
使用前须经煮沸、冷却。
2.2.4 80%乙醇溶液:量取80mL 95%乙醇(GB 679)与15mL水混匀。
2.2.5 0.1mol/L硝酸银标准滴定溶液:称取17g硝酸银(GB 670)溶于水中,转移到1000mL容量瓶中,用水稀释至刻度,摇匀,置于暗处。
2.2.6 0.1mol/L硫氰酸钾标准滴定溶液:称取9.7g硫氰酸钾(GB 648)溶于水中,转移到1000mL容量瓶中,用水稀释至刻度,摇匀。
