04第四章 重排反应
重排反应——精选推荐

重排反应有机化学中重排反应很早就被⼈们发现,研究并加以利⽤。
第⼀次被Wohler 发现的,由⽆机化合物合成有机化合物,从⽽掀开有机化学神秘⾯纱的反应—加热氰酸铵⽽得到尿素,今天也被化学家归⼊重排反应的范畴。
⼀般地,在进攻试剂作⽤或者介质的影响下,有机分⼦发⽣原⼦或原⼦团的转移和电⼦云密度重新分布,或者重键位置改变,环的扩⼤或缩⼩,碳架发⽣了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、⾃由基反应和周环反应四⼤类。
也有按照不同的标准,分成分⼦内重排和分⼦间重排,光学活性改变和不改变的重排反应,等等。
⼀、亲核重排重排反应中以亲核重排为最多,⽽亲核重排中⼜以1,2重排为最常见。
(⼀)亲核1,2重排的⼀般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发⽣亲核1,2重排的条件(1)转变成更稳定的正离⼦(在⾮环系统中,有时也从较稳定的离⼦重排成较不稳定的离⼦)(2)转变成稳定的中性化合物(3)减⼩基团间的拥挤程度,减⼩环的张⼒等⽴体因素。
(4)进⾏重排的⽴体化学条件:带正电荷碳的空p轨道和相邻的C-Z 键以及α碳和β碳应共平⾯或接近共平⾯(5)重排产物在产物中所占的⽐例不仅和正电荷的结果有关,⽽且和反应介质中存在的亲核试剂的亲核能⼒有关3.迁移基团的迁移能⼒(1)多由试验⽅法来确定基团的固有迁移能⼒(2)与迁移后正离⼦的稳定性有关(3)邻位协助作⽤(4)⽴体因素4.亲核1,2重排的⽴体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进⾏迁移的相对时机5.记忆效应:后⼀次重排好像和第⼀次重排有关,中间体似乎记住了前⼀次重排过程(⼆) 亲核重排主要包括基团向碳正离⼦迁移,基团向羰基碳原⼦迁移,基团向碳烯碳原⼦迁移,基团向缺电⼦氮原⼦转移,基团向缺电氧原⼦的迁移,芳⾹族亲核重排,下⾯就这六种迁移作简要介绍:1.基团向碳正离⼦迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)⽚那醇重排:邻⼆醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)⼆烯酮-酚重排:4,4-⼆取代环⼰⼆烯酮经酸处理重排成3,4-⼆取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作⽤⽣成⾼⼀级的同系物(6)烯丙基重排:烯丙基系统中双键发⽣位移的反应2.基团向羰基碳原⼦迁移:(1) Benzil-Benzilic Acid重排:α-⼆酮经强碱处理会发⽣重排,⽣成α-羟基⼄酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另⼀种酮3.基团向碳烯碳原⼦迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成⾼⼀级同系物的⽅法(2) 其他的碳烯重排反应,主要是1,2氢迁移⽣成烯4.基团向缺电⼦氮原⼦转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上⽆取代基酰胺经溴及碱处理,脱羰⽣成伯胺(3)Curtius重排:酰基叠氮热分解⽣成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,⽣成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍⽣物经类似Hoffmann的重排⽣成少⼀个碳的胺(6)Neber重排:肟酮的磺酸酯在⼄醇钾处理后⽔解⽣成α-氨基酮5.基团向缺电氧原⼦的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原⼦迁移到氧原⼦上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作⽤,在分⼦中插⼊氧⽣成酯的反应6.芳⾹族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺⼆、⾃由基重排反应1.1,2迁移:⽐正离⼦重排反应少得多,主要发⽣在:(1)某些双⾃由基的1,2-烷基和氢(2)烯基(迁移的⼄烯基若是环的⼀部分,则发⽣重排)2.⾮1,2迁移:多发⽣1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4.Hofmann-loffler-freytag反应:质⼦化N-卤化胺经热分解或光解形成六氢吡啶等的反应。
第四章 重排反应

C C O
Br(CH2)9 C CHN2 O
NH3.H2O/AgNO3 Br(CH2)9CH2CONH2
49%
O N2
hν CH3OH
H
75%
H3COOC
RCOOH
RCOCl
CH2N2
RCOCHN2
RCH C O COCl
H2O
RCH2COOH
1. CH2N2 2. PhCOOAg/EtOH/TEA CH2COOC2H5
84~92%
Arndt-Eistert同系列羧酸的合成反应 同系列羧酸的合成反应
Arndt-Eistert合成是将一个酸变成它的高一级同系 合成是将一个酸变成它的高一级同系 物或转变成同系列酸的衍生物, 如酯或酰胺 如酯或酰胺)的反 物或转变成同系列酸的衍生物,(如酯或酰胺 的反 该反应可应用于脂肪族酸和芳香族酸的制备。 应。该反应可应用于脂肪族酸和芳香族酸的制备。 反应包括下列三个步骤: 反应包括下列三个步骤: 1.酰氯的形成 酰氯的形成; 1.酰氯的形成; 2.酰氯和重氮甲烷作用生成重氮酮 酰氯和重氮甲烷作用生成重氮酮; 2.酰氯和重氮甲烷作用生成重氮酮; 3.重氮酮经Wolff重排变为烯酮 重氮酮经Wolff重排变为烯酮, 3.重氮酮经Wolff重排变为烯酮,再转变 为羧酸或衍生物。 为羧酸或衍生物。
R1 C C R2 OH OH
羟基离去后碳正离子的稳定性:叔碳 仲碳 仲碳>伯碳 羟基离去后碳正离子的稳定性:叔碳>仲碳 伯碳
P CH3OC6H5 Ph P CH3OC6H5 C C Ph OH OH P CH3OC6H5 P CH3OC6H5 C Ph + P CH3OC6H5 C O C Ph O Ph C Ph C6H5OCH3 P H2SO4
第四章重排反应解读

R2
R1 R3 C C R4 OH OH
H
R2
R1 C C R4 R3 O
1. 反应机理:
II
H 3C CH3 C CH3 C CH3 H+ H 3C CH3 C CH3 C CH3 -H 2O H 3C CH3 C OH CH3 CH3 C O C CH3 CH3 C + CH3
HO OH CH3 重排 CH3 C C CH3
HO
CH2
O (4)
OH
OH
三、苯偶酰-二苯乙醇酸型重排
• 二苯基乙二酮(苯偶酰)类化合物用碱处理,生成二苯基-羟 基酸(二苯乙醇酸)的反应称为苯偶酰-二苯乙醇酸型重排反 应。
O Ar C
O C Ar
OH O KOH
△
Ar
C Ar
C
OK
1. 反应机理
C6H5 C C C6H5 + OH O O O O C C OH C6H5
HO +OH2 -H+
HO + CH3
CH3
III 重排反应的动力是:由三级C+生成更加稳定的质子化的酮
注意问题:
1)驱动力? 2)两个羟基中谁先离去?(生成的正碳离子稳定性) 3)哪个基团迁移? 4)立体化学上离去基与迁移基成反式共平面
5)扩展反应
6)应用
羟基位于脂环上的邻二叔醇化合物在酸或Lewis酸的催 化下发生重排,生成扩环脂肪酮、螺环酮
H+ -H2 O H+
(CH3)3C-CH2 (CH3)3C-CH-CH3
2. 迁移基团迁移顺序 易带负电荷或带负电荷后相对稳定、且易给出电子的基团容易
迁移。据此, 可得出一般情况下迁移基团的活性顺序。
有机重排反应总结

有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4.Hofmann-loffler-freytag反应:质子化N-卤化胺经热分解或光解形成六氢吡啶等的反应。
第四章 重排反应

重排开始 O 环丙酮
R1 R3
R1 R3
A
R2 C C.. R4 ROH R2 C CHR4
OC OR
重排结束O
C OR
R1 R3
R1 R3
B
R2 C.. C R4 CO
ROH
R2CH C R4 RO 中R=H C O 时则得到羧酸
OR
OR
反应中究竟以A方式开环,还是以B方式开环,
则决定于碳负离子的稳定性。
• 酸催化质子化脱水后重排 • 酰卤催化剂则是将羟基酯化后脱去酰氧基
R
OH R''COCl
CN
R'
O
R C
O N
C R'' -CH3COO-
R'
[ R C N R'
R C N R' ]
H2O
-H+
R C NH R' O
• 空间结构的影响
O2N
Ph N
PClO5 2N
O
O2N
NHPh H2O
Br OH
对甲氧基苯基 > 对甲基苯基 > 苯基 > 对溴苯基 > 烷基 > 氢
优先产生稳定
碳正离子
Ph2C CH2 H+ Ph2C+ CH2
OH OH -H2O
OH
Ph2CH CH +OH
H+
Ph2CH
CH O
PhHC CHPh H+ PhHC CHPh
OH OH -H2O
+
OH
Ph2CH CH +OH
H+
1、片呐醇(Pinacol)重排—分子内C→C重排
重排反应

C CH
5 Hoffmann重排
6 Curtius重排
C6H5C6H5 CH3 C C CH3 OH OH
H
C6H5C6H5 CH3 C C CH3 OH
C6H5 CH3 C C CH3 C6H5 OH
-H
C6H5 H3C C C6H5O
7 Backmann重排
C CH
主页
பைடு நூலகம்
Department of Material and Engineering, Soochow University
6 Curtius重排
7 Backmann重排
主页
Department of Material and Engineering, Soochow University
重 排 反 应 4 Wolff重排
1
2
一、缺电子重排
重排
重氮甲烷与酰氯反应得到重氮酮,重氮酮在氧化银存在下 加热发生Wollf重排得到烯酮。
5 Hoffmann重排
CH3 C CH2 Cl CH3 -H Ag H3C C CH2 H 3C CH3 C CH2 CH2
6 Curtius重排
7 Backmann重排
(CH3)2C CHPh
主页
Department of Material and Engineering, Soochow University
导航
主页
Department of Material and Engineering, Soochow University
专题
重排反应
一、缺电子重排 二、富电子重排 二、芳环上的重排反应
本章导航
主页
Department of Material and Engineering, Soochow University
有机化学重排反应-总结
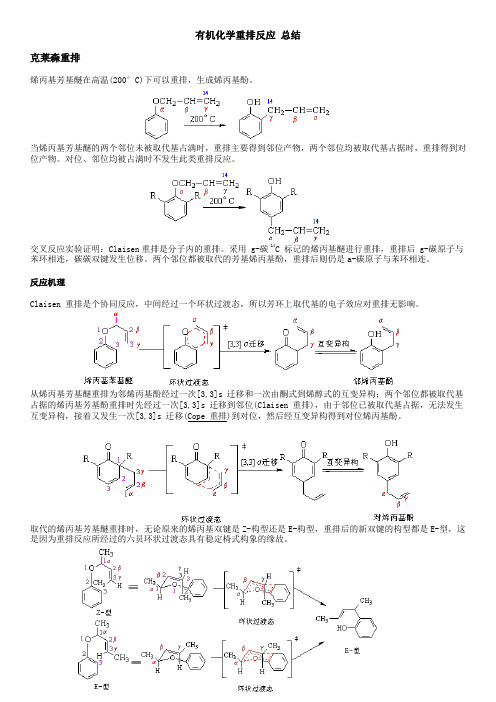
有机化学重排反应总结克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:3.Bamberger,E.重排苯基羟胺〔N-羟基苯胺〕和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基〔或甲氧基〕苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
第四章 重排反应

二、Pinacol重排反应 重排反应
若反应中形成正离子,除了上面的相应双键进行亲电加成外, 若反应中形成正离子 , 除了上面的相应双键进行亲电加成外 ,还 可以由迁移H原子、烃基、芳基或其它带有一对电子的基团而变得稳定。 可以由迁移 原子、烃基、芳基或其它带有一对电子的基团而变得稳定。 原子 当这些迁移进行十分顺利时,在合成上就有应用价值。 当这些迁移进行十分顺利时,在合成上就有应用价值。特别是与形成正 离子的相邻碳原子上带有羟基时, 离子的相邻碳原子上带有羟基时,由羟基转变为羰基化合物是一个有利 的重排方式。由酸催化邻二醇形成酮的反应,称为“ 重排。 的重排方式。由酸催化邻二醇形成酮的反应,称为“Pinacol”重排。 重排
O TFA, C6H6
O
∆
H 2400C
100% H
H
H 83%
2、Claisen 重排 、
其与Cope重排完全相似, 只不过将其中的一个 重排完全相似,只不过将其中的一个CH2 变为氧 。 在有 变为氧。 其与 重排完全相似 机合成中常用于构建一些难以合成的官能团,具有非常重要的应用价值。 机合成中常用于构建一些难以合成的官能团,具有非常重要的应用价值。
烯烃 异丁烯 苯乙烯
.CCl3 1.00 >19
:CBr2 1.00 0.4 3.2
Br2 1.00 0.6 1.9
环氧化反应 1.00 0.1 13.5
3-甲基 丁烯 0.17 甲基1-丁烯 甲基
一些与环状共轭体系相连的卡宾如环丙烯卡宾和环庚三烯卡宾, 一些与环状共轭体系相连的卡宾如环丙烯卡宾和环庚三烯卡宾,在 这些分子中,空的P轨道参与共轭体系 不显示明显的缺电子特征, 轨道参与共轭体系, 这些分子中,空的 轨道参与共轭体系,不显示明显的缺电子特征,实 际上是环丙烯正离子和卓鎓离子的共轭碱。 际上是环丙烯正离子和卓鎓离子的共轭碱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)形成乃春(Nitrene,氮烯,氮宾) 如酰基叠氦化 物分解形成乃春(其N原子上仅有6个电子,而缺电 子 ):
R C O N N N R C O N + N2
3、重排中的立体化学
(1)迁移基W的构型 一般的1,2-亲核重排,由于迁移基W并不成为游 离的阴离子,这样重排前后可保持原有的构型。 (2)关于起点A和终点B的构型 这由重排机理中三个分步反应的方式来决定: a、若按SN1反应机理形成B+,则A、B两端(因可旋 转)而发生消旋; b、若重排过程的第一、二步是协同的,即按SN2机 理形成中间态桥式正离子,重排结果是:B点发生构 型反转,A点消旋; c、若X-或Y-负离子直接向桥式正离子中的A点进攻, 则A、B均发生构型反转。
NHCH2CH3
C N
4
AlCl3
Et2O
PhCH2NHPh
e.在二苯酮肟中,若亲核性的羟基或氨基位于肟基 邻位,则酸性重排时会产生苯并杂环衍生物:
Ph C N
OH
H -H2O
Ph (H2N)HO
C
N
-H
N Ph O N Ph N H
OH(NH2)
2、Hofmann重排(酰胺-胺重排)
酰胺用溴(或氯)和碱处理转变为少一个碳 原子(失去羰基)的伯胺的反应,称为 Hofmann酰胺-胺重排,或称为Hofmann降解 反应(Hofmann Degradation)。
N F3 C N CONH2 NH2 Br2/KOH 0~5, 105min N F3 C N F3 C N N OH N H
72%
N C O N NH2
d.双酰胺衍生物可得多种结构的重排产物
H2C CONH2 H2C CONH2 H N
NaOBr / OH H2O
H2C N C O H2C O NBr
1、亲核重排的一般反应过程
分为三步(见下图):形成缺电中心;转移基团W从 A到B迁移(Whitmore 1,2-转移),形成新缺电中心; 亲核试剂进攻或消除,得重排产物。
W A B L -L I W A B II A W B 消除 Y YA A B B W W
2、两种最重要的形成缺电中心的途径: (1)形成碳正离子 途径较多,最常用的方法是酸催 化,如对醇的处理:
δ+ OH2
R -H2O C R' N R' -H N
OH2 C O R C H N R'
支持上述机理的实验(1):
Ph C Ph O Ph C SO2Ph H2O N Ph -PhSO3H Ph C N OH PhSO2Cl Py., r.t. Ph O H N Ph Ph C N OSO2Ph Slow O Ph C N Ph SO2Ph
P CH3OC 6H5 Ph H2SO4 P CH3OC 6H5 C C Ph OH OH P CH3OC 6H5 P CH3OC6H5 C Ph + P CH3OC 6H5 C O 28% C Ph O Ph C Ph C 6H5OCH3 P
72%
CH3 Ph H2SO4 Ph C C CH3 Ph C Ac O 2 OH OH Ph Ph C C CH3
H
R C H O
H
R R C C R O H R R C O C R R
R
(2)邻二叔醇结构与取代基迁移能力对重排反 应的影响
a.对称的连二乙醇 两个C原子形成正碳离子 机会一样
R2 R1 C
R2 C R1
OH OH
实验表明基团迁移能力有如下规律: 芳基>烃基; 供电子取代芳基>吸电子取代芳基; Ph>>Me>Et.
R N C + R O R H N C O C O H N C O R H2O N X R N C O X N C O R H2O -HOX
RNH2 + RCONH2 + CO2
c.溴用量对产物的影响
新配制的次溴酸盐水溶液含量为80~90%,需用的 溴过量10~20%。若溴与碱过量过大,会使生成的伯 胺氧化成腈。对不易氧化成腈的伯胺(如苯胺),过量 溴与碱可促进反应速度和收率的提高。
Ph Ph C OH
Ph
CH3 C CH3 OH
CH3 O
CH3 C CH3
(3) 羟基位于脂环上,重排环扩大或缩小
OH OH C Ph Ph
H2SO4/Et2O r.t.2h Ph Ph
99%
O
H3C H3C
OH H
H3C H3C
OH2
OH H3C H3C OH H
OH CH3 CH3C O
◆ 缺电子重排(亲核重排,或称阴离子 型迁移重排,Anionotropic rearrangement); ◆ 富电子重排(亲电重排,或称阳离子 型迁移重排,Cationotropic rearrangement); ◆ 自由基重排(Radical rearrangement).
2、按重排过程起、终原子的性质等 分类
第四国药科大学 姚其正
引言
一、定义:
受试剂或介质等条件的影响,同一 有机分子内的一个基团或原子从一个原 子迁移到另一个原子上,使分子内结构发 生变化,如构架发生改变而形成一个新 的分子的反应称为重排反应(或称分子重 排)。
二、重排类型 1、按终点原子电荷分类
RCONH2 + Br2 + 4 OH
2 RNH2 + CO3
+ 2 Br + 2 H2O
(1)反应机理
R C O NH2
Br2
R
C O
NHBr
OH
R
C O
N
Br
-Br slow
H2O/ OH
R
NH2
+ CO32
R
C O
N
R
N
C
O
R'OH
R
NHCOOR'
氨基甲酸酯
▼ ▼
供电性R速度快于吸电性R; 重排后R保留原来手性.
(2)反应条件
a.常规反应条件:低温(0℃左右),卤素加至NaOH溶 液中,制得次卤酸盐水溶液,冷却后将酰胺分批加 入,溶解,加热至70~80℃,重排,水解得伯胺。 b.不同链长脂肪酰胺的反应条件:
i、8个C原子以下的脂肪酰胺,因能形成水溶性的卤酰胺盐, 在NaOH水溶液中重排;ii、多于8个C原子的脂肪酰胺,因在 NaOH水溶液生成的异氰酸酯易和未重排的卤酰胺反应,生 成烷基酰脲,使伯胺收率降低,故宜在醇钠溶液中重排,生 成易分离的氨基甲酸酯,收率较高。
CH3
unstable state
(4)Beckmann重排的应用
a.将酮转变为酰胺 b.确定酮的结构 c.扩环成内酰胺化合物
H3CO
O
LiAlH4
H3CO
O CH3 N H
85%
CH3 N OH
Et2O, refl. 24 h
O
d.制备仲胺
H3C C N OH LiAlH4 AlCl3 THF Ph Ph OH LiAlH
RCH2NH2 + 2 OX NO2 RCN + 2 X + H2O NO2
O2N
CONH2
O 2N
NH2
(3)酰胺结构对反应的影响
a.适于Hofmann降解反应的酰胺范围:包括脂肪、脂 环、芳脂、芳香及或杂环等的单酰胺,用以制备各类 伯胺;其中低于8个C原子的脂肪酰胺重排为伯胺收率 均高; b.脂肪酰胺基α-位有-NH2、-OH、卤素、α,β-不饱和 键时,重排和水解生成不稳定的胺或烯胺,会进一步 水解,生成醛;
OH N 80~85% H2SO4 H N O
t oC y% 120 75 140 95 160 85
c.酮肟结构对反应速度的影响
CH3 R COCH3 CH3
NH2OH HCl
CH3
NH2OH HCl
R
quick
CH3 CH3 N R C CH3 CH3 OH
NHCOCH3 R
H3C C H3C N
支持上述机理的实验(2):
R''OH(ArOH) NH2R'' HN3 (Ar)R''O R R C N R' R''HN R R C C C N N N N N N R' R' R'
O R C N R' R C N H R'OH R C H N R'
(2)肟的立体异构化
由于Beckmann重排中迁移基团位于肟羟基反位, 故当肟基C原子上连有不同烃基时,会有Z /E异构体, 重排后产物酰胺也为混合物,这是不希望的结果。 为此,应了解造成肟异构化的可能性:
R H C Y CONH2 R H C Y NH2 RCHO Y = OH, X, NH2 C H NH2 RCHO
RHC
CHCONH2
RHC
若α,β-位含炔键的酰胺,重排则得腈类:
RC CCONH2 RCH2CN
c.芳环邻位有-NH2、-OH等亲核基团时,形成异氰 酸酯中间体可进行分子内环合,形成新杂环:
a.在质子极性溶剂中易发生异构化
R C R' N OH R H R' R C R' N C N H R' OH R C N OH H
E (R<R')
Z
OH
-H
b.在酮的肟化过程中发生异构化
取决于构型稳定性和肟结构的立体与电子效应, 常规是:位阻大的烃基常处于肟羟基的反位(E式), 当位阻足够大时,即使在极性溶剂中也仅为单一E式 肟。
