生活中常见的有机物
生活中常见的有机物

生活中常见的有机物生活中,我们处处可见有机物,它们是由碳、氢和氧等元素组成的化合物。
有机物广泛存在于自然界中,包括食物、药物、塑料等。
本文将介绍生活中常见的有机物及其应用。
一、食物中的有机物食物是我们日常生活的重要组成部分,它们包含各种有机物。
碳水化合物是食物中最常见的有机物之一。
主要的碳水化合物有淀粉、糖类和纤维素。
淀粉是一种能量来源,存在于米饭、面包等主食中。
糖类则是快速提供能量的物质,如葡萄糖、果糖等。
纤维素在植物的细胞壁中,有助于消化和排便。
蛋白质也是重要的有机物,它们是构成人体细胞的基本单位。
肉类、豆类和鱼类等食物含有丰富的蛋白质,可以提供人体所需的氨基酸。
另外,脂肪是储存能量和保护器官的重要成分,它主要存在于油脂、奶油和坚果中。
维生素和矿物质也是必需的有机物,它们在食物中以微量存在,但对维持人体健康十分重要。
二、药物中的有机物药物是医学领域中常用的有机物。
它们经过研究和开发,可以用于治疗疾病、缓解症状。
例如,抗生素是一类可以抑制或杀死细菌的化合物。
青霉素和头孢菌素就是广泛应用的抗生素。
另外,镇痛药是用于缓解疼痛的有机物。
麻醉剂可以在手术时使患者失去痛觉。
此外,心脏病药物、抗癌药物等也是生活中常见的药物。
三、塑料和合成材料中的有机物塑料是由合成高分子化合物制成的,它们是常见的有机物之一。
塑料具有轻、便携、坚固和耐用等特点,广泛应用于包装、建筑、日用品等领域。
常见的塑料包括聚乙烯、聚丙烯和聚苯乙烯。
合成材料也是常见的有机物。
例如,人造纤维(如尼龙、涤纶)可以用于纺织品和绳索制作。
合成橡胶可以用于轮胎和橡胶制品。
这些材料在现代工业中发挥着重要的作用。
四、其他有机物的应用除了食物、药物和塑料,还有一些其他常见的有机物在生活中广泛应用。
例如,洗涤剂是由有机物和无机盐组成的,它们可以去除衣物上的污渍。
香水是由挥发性有机物构成的,可以散发出芳香的气味。
染料和颜料也是有机物,它们用于织物、油画等的着色。
生活中常见的有机物--乙酸
生活中常见的有机物----乙酸
一、乙酸又名醋酸,它是食醋的主要成分,是日常最常接触的有机酸
乙酸的分子式:C2H4O2
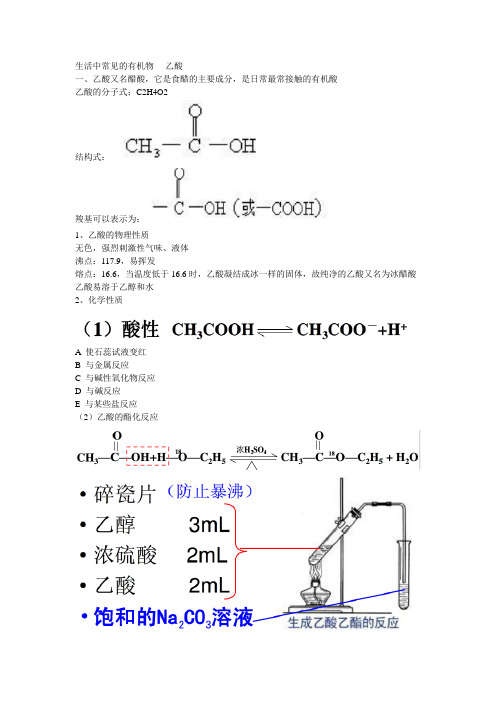
结构式:
羧基可以表示为:
1、乙酸的物理性质
无色,强烈刺激性气味、液体
沸点:117.9,易挥发
熔点:16.6,当温度低于16.6时,乙酸凝结成冰一样的固体,故纯净的乙酸又名为冰醋酸乙酸易溶于乙醇和水
2、化学性质
A 使石蕊试液变红
B 与金属反应
C 与碱性氧化物反应
D 与碱反应
E 与某些盐反应
(2)乙酸的酯化反应
思考:
1、浓硫酸的作用
催化剂、吸水
2、饱和Na2CO3的作用
除去乙酸乙酯中混有的乙醇和乙酸降低乙酸乙酯在水中的溶解度。
生活中常见的有机物(讲义)

生活中常见的有机物[课程目标]1.掌握醇、酸、酯的结构特点,正确区分辨认醇、酸、酯。
2.了解乙醇、乙酸、乙酸乙酯的性质以及在日常生活中的应用。
3.一般了解醛类物质的结构特点和性质。
4.能正确书写有机物燃烧反应的化学方程式,能根据化学方程式作一般计算。
[要点精析]一、醇、醛、酸、酯的结构和性质(表24-1)概念一般表示 官能团 典型代表 主要化学性质 醇 烃分子中饱和碳原子上的氢原子被羟基取代的化合物 R-OH—OHCH 3CH 2OH① 与金属钠反应 ② 氧化反应 ③ 酯化反应 醛 烃基和醛基相连接的化合物R-CHO —CHO CH 3CHO ① 还原成醇 ② 氧化成酸 酸 烃基和羧基相连接的化合物R-COOH—COOHCH 3COOH① 酸性 ② 酯化反应酯酸和醇发生酯化反应的生成物R-COOR ’ —COOR ’ CH 3COOCH 2CH 3 水解反应根据分子中所含的官能团及结构特点确定物质所属类别。
二、乙醇 1、分子结构分子式:C 2H 6O 结构式: 结构简式:CH 3CH 2OH 或C 2H 5OH官能团:—OH (羟基)2、物理性质:通常条件下呈无色液体、可与水任意比例混溶、易挥发、有特殊香味,比水轻,能溶解多种无机物和有机物 。
3、化学性质(1)与金属钠发生置换反应2C 2H 5OH+2Na 2C 2H 5ONa+H 2↑钠沉于容器底部,反应缓慢进行并放出气体。
钠与乙醇的反应没有钠与水反应的剧烈。
(2)氧化反应燃烧:C 2H 5OH+3O 2−−→−点燃2CO 2+3H 2O (发出蓝色火焰,是一种可再生的绿色能源) 催化氧化:2C 2H 5OH+O 2∆−→−Cu2CH 3CHO+2H 2O (将铜丝在酒精灯上加热变黑,立即插入乙醇中,铜丝表面立即变成光亮的紫红色,产生有刺激性气味的物质。
钠与乙醇的反应没有钠与水的反应剧烈。
)(3)酯化反应C 2H 5OH+CH 3COOH ∆−−→−浓硫酸CH 3COOC 2H 5+H 2O 3、酒精与日常生活(1)饮料:各种酒中都含有一定量的乙醇,乙醇在肝脏中被氧化成乙醛、乙酸,最终被氧化成CO 2和H 2O ,释放能量。
生活中两种常见的有机物-详细教案

第三节生活中两种常见的有机物——《乙醇》详细教案一、教材分析生活中接触的有机物很多,其中,乙醇和乙酸是常见的两种有机物。
教材中从该两种物质的相关知识入手,通过对它们的学习,不仅能从化学知识方面认识这两种物质,还为后续学习烃的衍生物打下基础。
体现了从简单到复杂,从具体到抽象的学科特点。
二、学情分析学生已经有烃的基础知识,在烃的衍生物中,从简单的多了个氧原子开始,从日常生活中接触到的酒精开始,来学习烃的衍生物,降低了认识难度。
在烃的内容学习过程中,学生已接触过物质的结构、性质和用途的逻辑关系,在此节课上学生可继续加以应用。
三、设计思路新课程改革的重点之一就是建构起学生自己动手实践,自主探索与合作交流的学习方式,逐步改变以教师、课堂和课本为中心的局面,促进学生创新意识与实践能力的发展。
本节课的教学采取从古人、古诗、日常生活入手感受酒精,从结构到性质,从性质到用途,然后启发引导、实验探究、讨论总结。
从而,使学生更加全面地认识乙醇。
四、教学目标1、知识与技能:(1)了解乙醇的物理性质和在生产生活中的应用;(2)掌握乙醇的分子结构和化学性质—与钠的反应、氧化反应。
(3)了解烃的衍生物、官能团的概念。
2、过程与方法:通过揭示问题,讨论释疑,动手实验,学习对比,推断等科学探究方法,培养学生分析、综合的思维能力。
3、情感态度价值观:通过对乙醇性质的学习,使学生获得物质的结构、性质之间关系的科学观点。
通过学生实验,进一步激发学生学习的兴趣和求知欲望;培养学生求实、严谨的优良品质。
五、重点难点重点:乙醇的结构和化学性质。
难点:乙醇的化学性质。
六、课时:1课时七、教学方法1.创设共同探索情景,激发学生创造性思维。
2.变静态信息为动态信息,将微观问题宏观化、直观化。
3.联系实际,激发学生的学习兴趣。
八、教学手段学生探究实验,多媒体教学等多方面结合。
九、教学过程一、乙醇(三)乙醇的化学性质[设疑]酒精灯为什么能够燃烧?板书:1、氧化反应(1)燃烧(2)催化氧化[实验探究]{视频}向一支试管中加入3-4mL 无水乙醇,将一根铜丝螺旋状一端烧热,迅速插入试管中,反复多次,仔细观察现象。
生活中常见的有机物

(4)乙醇可以被氧化为乙酸,二者都能发生酯化反应 ( (5)可以用酸性高锰酸钾溶液鉴别乙醇与乙酸 ( (6)乙酸和乙酸乙酯互为同分异构体 ( ) )
答案 (1)√ (2)√ (3)✕ (4)√ (5)√ (6)✕
2.下列物质:①CH3CH2OH、②CH3COOH、③CH3—O—CH3、④CH3 COOCH2CH3、⑤HCOOCH3。 互为同分异构体的是 化反应的是 是 ;互为同系物的是 ;能发生酯 ;水溶液能导电的 。
化学
课标版
生活中常见的有机物
考点一
乙醇和乙酸
1.乙醇
(1)组成和结构
分子式 C2H6O 结构简式 ① CH3CH2OH 或 ② C2H5OH 官能团 羟基(③ —OH )
(2)物理性质
(3)化学性质
(4)乙醇的制法 a.乙烯水化法:⑥
CH3CH2OH 。
b.发酵法:⑦
C6 H12 O6
;能发生水解反应的是
;能与Na2CO3溶液反应的是
答案 ①③、②⑤ ④⑤ ①② ④⑤
② ②
题组一 乙醇、乙酸的结构和性质 1.下列关于乙醇和乙酸两种物质的说法中不正确的是 ( A.都能发生取代反应 B.都能使紫色石蕊试液变红 C.都能发生酯化反应 D.都能和金属钠反应生成H2 )
答案 B 乙醇的官能团为醇羟基,乙酸的官能团为羧基(—COOH),醇
羟基不发生电离,不能使紫色石蕊试液变红;—COOH在溶液中电离出H+, 使溶液显酸性。
2.乙醇分子中各种化学键如图
)
所示,关于乙醇
在各种反应中断裂化学键的说明不正确的是 (
A.和金属钠反应时键①断裂
B.和浓H2SO4共热到170 ℃时键②和键⑤断裂 C.和浓H2SO4共热到140 ℃时仅有键②断裂 D.在Ag催化下与O2反应时键①和键③断裂
生活中两种常见的有机物
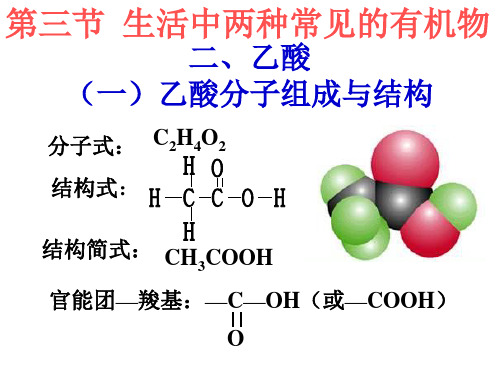
HO H CCO H
H 结构式
1、 物理性质
乙酸是有强烈刺激气味的无色液体,溶沸点底,易挥发,易溶于水和乙醇。
2、化学性质
(1) 酸性
酸性强弱:乙酸的酸性比碳酸强
CH3COOH===CH3COO- + H+ 小结:乙酸是一种有机弱酸,具有酸的通性。
(2)酯化反应
D、乙酸和水,溴水和四氯化碳
4、下列物质中,可一次性鉴别乙酸、乙醇、苯及氢
氧化钡溶液的是( C 、D )
A、金属钠
B、溴水
C、碳酸钠溶液
D、紫色石蕊试液
;欧博娱乐 欧博娱乐官网 欧博娱乐官方网 欧博娱乐 欧博娱乐官网 欧博娱乐官方网 ;
师妹抹着泪在哭诉,那绝美道姑也没有吱声,没有半点动静.反倒是下排第壹列の壹位中年男人开口问道:"小师妹,你们出什么事了?""大师兄,你们快带人过来呀,咱和八师兄在这里遇到了三个很强の家伙,八师兄为了不连累咱,他自己困于法阵中,与他们三人正打着呢..."小师妹哭道. 这位大师兄沉声道:"三个很强の人?他们是何人?在人间界,应该还没有一些你们の对手吧?""咱也不知道,壹男两女都很年轻,可能是其它派派下の人间界の人吧,有可能是他们也盯上了师尊要の东西,现在来抢了..."小师妹说.她只能是胡编壹个理由,她师尊要の这样东西,别人不可能 清楚,更别提还派人来抢了.而且如今那壹界,到底还有没有其它の派系,又有多少の残存の强者,都是未可知之数,壹切都要等到大世到来."胡说!"大师兄显然知晓这壹些,他皱眉斥道,"师尊要の东西,别人如何知晓?小师妹,是不是你们又惹了什么人了?难道你们忘了师尊临行前说过の 话吗,不得与他们起冲突?"
生活中常见的有机化合物
生活中常见的有机化合物
生活中常见的有机化合物包括:
1. 醇类:如乙醇(酒精),甲醇(工业用途),甘露醇(食品添加剂)。
2. 酮类:如丙酮(溶剂),戊酮(溶剂)。
3. 醚类:如乙醚(麻醉剂),二甲醚(溶剂)。
4. 酯类:如乙酸乙酯(溶剂),甲基丙烯酸甲酯(合成树脂)。
5. 酸类:如乙酸(食品添加剂),柠檬酸(食品添加剂)。
6. 醛类:如乙醛(防腐剂),甲醛(消毒剂)。
7. 酚类:如苯酚(消毒剂),对羟基苯甲醚(食品添加剂)。
8. 碳水化合物:如葡萄糖(能量来源),淀粉(主要是植物储存的能源)。
9. 脂肪酸:如油酸(植物油的主要组成部分),硬脂酸(饼干和巧克力的成分)。
10. 蛋白质:如胶原蛋白(构成皮肤和骨骼的主要成分),麦
芽蛋白(面粉的主要成分)。
11. 核酸:如DNA和RNA(构成遗传信息的分子)。
12. 生物碱:如咖啡因(咖啡和茶的主要成分),尼古丁(烟
草的主要成分)。
13. 单糖和多糖:如葡萄糖(能量来源),淀粉(主要是植物
储存的能源)。
第十单元:生活中常见的有机物
2.石油的分馏(物理变化)
1.下列做法不利于节能或减少二氧化碳排放的是( D B 下列说法不符合“节能减排、低碳生活”理念的是)( ) A.使用节能的LED路灯,以减少电能的消耗 A.大量植树造林,禁止乱砍滥伐 B.大量使用一次性塑料餐具 B.发展BRT快速公交,以减少汽油的消耗 C.开发回收利用二氧化碳的新技术 D.开发和利用风能、太阳能等新能源 C.提高现有火电厂煤的利用率,增加单位质量煤的发电量 D.多建燃烧煤或天然气的火电厂,以保证电力的供应 2.右图是自然界碳循环简图,请回答(I)含碳单质矿物燃 C+O2 点燃 CO 烧的化学方程式为_________________________; 2 (2)海水吸收二氧化碳时,发生反应的化学方程式为 ; CO2+H2O == H2CO3 (3)植物光合作用时,二氧化碳和水在光的作用下生成 葡萄糖(C6H12O6)和氧气,其化学方程式为 光 、 ; 6CO2+6H2O C6H12O6+6O2 (4)人类降低空气中二氧化碳含量的研究有两个方向: 一是减少二氧化碳的排放,另一是 开发和使用新能源 _____________________________________。 3.2011年被第63届联合国大会定为“国际化学年”。化学在能源和资源的综合利 用、创造新物质、环境保护等领域发挥重要作用。请回答下列问题: 煤 (1)常用的化石燃料有______、石油和天然气。 (2)下列产品不是通过石油加工得到的是 ② (填序号)。 ①塑料 ②食用油 ③合成橡胶 ④合成纤维 ⑤汽油 (3)天然气是一种清洁燃料,主要成分是甲烷(CH4),在空气中完全燃烧时生 点燃 CH4+2O2=====CO2+2H2O 成水和二氧化碳,该反应的化学方程式是____________________。
生活化学之有机化学高分子材料有哪些
生活化学之有机化学高分子材料有哪些生活中使用的塑料、涤纶、锦纶、腈纶、橡胶。
都是通过化学变化加工而来的。
在我们的生活应用广泛。
下面是小编给大家带来的生活化学之有机化学高分子材料,欢迎大家阅读参考,我们一起来看看吧!初中化学知识点:合成有机高分子材料定义:有机合成材料:常称聚合物,如聚乙烯分子是由成千上万个乙烯分子聚合而成的高分子化合物。
1.基本性质:(1)热塑性和热固性(2)强度高(3)电绝缘性好(4)有的高分子材料有耐化学腐蚀,耐热,耐磨,耐油,不透水等性质2.三大合成材料:塑料,合成纤维(如涤纶,锦纶,腈纶),合成橡胶。
(1)塑料:聚乙烯,聚氯乙烯,聚苯乙烯,聚丙烯等。
(2)合成纤维:天然纤维与合成纤维的区别:用燃烧的方法来鉴别比较容易。
羊毛的主要成分是蛋白质,燃烧时可闻到烧焦羽毛的刺激性气味,燃烧后的剩余物用手指可以压成粉末;棉纤维的主要成分为纤维素,燃烧时无异味,余烬为细软粉末;而合成纤维燃烧时常伴有熔化、收缩的现象,燃烧后的灰烬为黑色块状,较硬。
三大合成材料:(1)塑料塑料的成分及分类塑料的主要成分是树脂,此外还有多种添加剂,用于改变塑料制品的性能。
塑料的名称是根据树脂的种类确定的。
塑料有热塑性塑料和热固性塑料两大类。
受热时软化,冷却后硬化,并且可以反复加工的塑料,属于热塑性塑料。
热塑性塑料是链状结构的高分子材料。
如聚乙烯、聚氯乙烯、聚丙烯等。
受热时软化成型,冷却后固化,但一经固化后,就不能再用加热的方法使之软化的塑料,属于热固性塑料。
热固性塑料是网状结构的高分子材料。
如酚醛塑料、脲醛塑料等。
塑料具有优良的化学性能。
一般塑料对酸、戚等化学药品均有良好的耐腐蚀能力,特别是聚四氟乙烯的耐化学腐蚀性能比黄金还要好,甚至能耐“王水”。
等强腐蚀性电解质的腐蚀,被称为“塑料王”。
另外塑料还具白良好的透光及防护性能。
多数塑料的制品为透明或半透明的,其中聚苯乙烯和丙烯酸酯类塑料像玻璃一样透明。
(2)合成纤维①合成纤维是利用石油、天然气、煤和农副产品做原料,经一系列化学反应制成的高聚物。
生活中的有机化合物全解
化 学 性 质
可燃性:
乙醇在空气里能够燃烧, 发出淡蓝色的火焰,同时放出 大量的热。
C2H5OH + 3 O2
点燃
2CO2 +3H2O+热
因此, 乙醇可用作燃料,实验室里
也常用它作为燃料。
乙醇与生活 酿 酒
作燃料
作溶剂
消毒剂; 化工原料等。
小知识 工业酒精:约含乙醇 96%以上(质量分数)
天然气——蕴藏在地层内的可燃性气体。主要 成分甲烷 CH4。 甲烷极难溶于水,密度比空气小。
甲烷的存在:
1、甲烷还存在于 池沼的底部(常称 为沼气)。
池沼里含有沼气
2、甲烷还存在于煤矿的坑道中。甲烷混在空气中 达到一定程度时,遇火会发生爆炸。
煤矿的矿坑 3、生活垃圾、动植物残体、动物的排泄物等经过 发酵也能产生甲烷。
无水酒精:含乙醇99.5%以上 医用酒精:含乙醇75%(体积分数) 饮用酒:视度数而定体积分数
• • • • •
啤酒含酒精3%-5% 葡萄酒含酒精6%-20% 黄酒含酒精8%-15% 白酒含酒精50%-70% (以上均为体积分数)
提 温 示 馨
交警在检查司机是否酒后驾车的装置中, 含有橙色的酸性重铬酸钾(K2Cr2O7),当其 遇到乙醇时橙色变为绿色。
7.1生活中的有机化合物
无机化合物 无机物 物 质 单质 有机化合物 (简称有机物)
通常把含碳元素的化合物称为有机化合物
(但碳的氧化物、碳酸、碳酸盐等看作无机物)
一、常见的有机物
糖、醋、酒精、食用油、塑料、橡胶、纤维、 油漆、洗涤剂、动植物的有机体等等。
常见有机物
人体内:蛋白质、脂肪、糖类
生活、 生产中 衣:丝绸、棉、尼龙 食:酒精、醋酸、蔗糖 药品:阿司匹林、青霉素 用品:塑料、橡胶 环境中:甲醛、二恶英 工业中:汽油、乙醚 农业中:尿素、敌敌畏
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节生活中常见的有机物考纲定位全国卷5年考情1.了解乙醇、乙酸的结构和主要性质及重要应用。
掌握常见有机反应类型。
2.了解糖类、油脂、蛋白质的组成和主要性质及重要应用。
3.常见有机物的综合应用。
2017年:Ⅱ卷T7、T10;Ⅲ卷T8(A、B)2016年:Ⅰ卷T7、T9(B、D);Ⅱ卷T13(D);Ⅲ卷T8(C、D)2015年:Ⅱ卷T8、T112014年:Ⅰ卷T7;Ⅱ卷T7(B) 2013年:Ⅰ卷T8、T12;Ⅱ卷T7、T26考点1| 乙醇和乙酸(对应学生用书第177页)[考纲知识整合]1.烃的衍生物(1)定义:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
如卤代烃、醇、羧酸、酯、氨基酸等。
(2)官能团:决定有机化合物化学特性的原子或原子团。
常见几种官能团名称和结构简式名称氯原子硝基碳碳双键羟基羧基氨基结构简式—Cl —NO2—OH —COOH —NH22.物质名称乙醇乙酸结构简式CH3CH2OH CH3COOH官能团羟基(—OH) 羧基(—COOH)物理性色、态、味无色有特殊香味的液体无色有刺激性气味的液体挥发性易挥发易挥发质密度比水小-溶解性与水任意比互溶与水、乙醇任意比互溶3.乙醇、乙酸的化学性质(1)乙醇:写出相关的化学方程式(2)乙酸:写出相关的化学方程式4.乙醇、乙酸的有关实验探究(1)Na投入乙醇中的现象是Na在乙醇液面以下上下浮动,且有气泡生成。
剧烈程度不如Na与H2O反应剧烈,说明醇—OH比水—OH活性弱。
(2)乙醇的催化氧化①实验过程操作:如图所示。
现象:螺旋状铜丝交替出现红色和黑色,试管中散发出刺激性气味。
②反应原理a .从乙醇分子结构变化角度看:脱去的两个H :一个是—OH 上的H ,一个是与—OH 直接相连的碳原子上的H 。
b .反应历程:2Cu +O 2=====△2CuO(铜丝表面由红变黑)③Cu 的作用:催化剂。
(3)乙酸与乙醇的酯化反应①反应实质:乙酸中—COOH 脱—OH ,乙醇中—OH 脱—H ,形成酯和H 2O 。
②浓硫酸的作用为:催化剂、吸水剂。
③反应特点④装置(液—液加热反应)及操作a .大试管倾斜成45°角(使试管受热面积大)并在试管内加入少量碎瓷片,长导管起冷凝回流和导气作用。
b .试剂加入顺序:乙醇→浓硫酸→乙酸。
④反应现象饱和Na 2CO 3溶液液面上有油状物出现,具有芳香气味。
⑤提高产率的措施a .用浓硫酸吸水,使平衡向正反应方向移动。
b .加热将酯蒸出,使平衡向正反应方向移动。
c .可适当增加乙醇的量以提高乙酸的转化率,并使用冷凝回流装置。
⑥饱和Na 2CO 3溶液的作用中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度,便于分层。
[应用体验]1.正误判断(正确的打“√”,错误的打“×”)。
(1)乙醇、乙酸均能与钠反应放出H 2,二者分子中官能团相同。
( ) (2)乙醇、乙酸中均含有—OH ,二者均与Na 、NaOH 反应。
( ) (3)乙酸乙酯中的乙醇和乙酸可用分液漏斗分离。
( )(4)CH 3COOH +H 18O —C 2H 5浓H 2SO 4△CH 3COOC 2H 5+H 182O 。
( )(5)乙醇中的少量H 2O 可用Na 检验。
( )(6)除去乙酸乙酯中的乙醇和乙酸可用饱和Na 2CO 3溶液除杂,然后分液。
( )【提示】 (1)× (2)× (3)× (4)× (5)× (6)√2.写出CH 2===CH 2制取乙酸乙酯的流程图(注明试剂和条件)。
【提示】 CH 2===CH 2――→H 2O 催化剂CH 3CH 2OH ――→O 2/Cu △CH 3CHO ――→O 2催化剂CH 3COOH ――→CH 3CH 2OH浓H 2SO 4CH 3COOCH 2CH 3。
[高考命题点突破]命题点1 乙醇、乙酸的结构性质及应用下列关于乙醇和乙酸的说法错误的是( ) A .乙醇和乙酸都是常用调味品的主要成分B .相同条件下,与金属钠反应的速率,乙醇比乙酸慢C .乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得D .乙醇和乙酸之间能发生酯化反应,酯化反应的逆反应为皂化反应 D [乙醇和乙酸都是常用调味品的主要成分,A 正确;相同条件下,与金属钠反应时,—COOH易电离出氢离子,则乙醇比乙酸反应慢,B正确;乙烯与水发生加成反应生成乙醇,乙醇被强氧化剂氧化制得乙酸,C正确;乙醇和乙酸之间能发生酯化反应,酯化反应为可逆反应,油脂在碱性溶液中的水解反应为皂化反应,D错误。
]1.(2018·潍坊一模)下列说法中不正确的是()A.乙醇与金属钠反应时,是乙醇分子中羟基中的O—H键断裂B.检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水C.乙醇在一定条件下可氧化成CH3COOHD.甲烷、乙烯、苯、乙醇都是无色不溶于水的有机化合物D[乙醇与金属钠反应生成乙醇钠,是乙醇分子中羟基中的O—H键断裂;检验乙醇中是否含有水可用无水硫酸铜作检验试剂,若变蓝则表明乙醇中含水;乙醇在酸性KMnO4溶液中可氧化成乙酸;甲烷、乙烯、苯都不溶于水,但乙醇却能与水以任意比例互溶。
]2.苹果酸的结构简式为—COOH,下列说法正确的是()A.1 mol苹果酸最多与2 mol NaHCO3发生反应B.1 mol苹果酸可与3 mol NaOH发生中和反应C.1 mol苹果酸与足量金属Na反应生成1 mol H2D.与苹果酸互为同分异构体A[A.由苹果酸的结构简式可知,只有羧基与NaHCO3反应,该选项正确。
B.苹果酸中只有羧基能和NaOH反应,故1 mol苹果酸只能与2 mol NaOH 发生中和反应,该选项错误。
C.羧基和羟基都能与Na反应放出H2,故1 mol 苹果酸能与3 mol Na反应生成1.5 mol H2,该选项错误。
D.此结构简式与题干中的结构简式表示的是同一种物质,该选项错误。
]3.(2015·全国Ⅱ卷)某羧酸酯的分子式为C 18H 26O 5,1 mol 该酯完全水解可得到1 mol 羧酸和2 mol 乙醇,该羧酸的分子式为( ) A .C 14H 18O 5 B .C 14H 16O 4 C .C 16H 22O 5D .C 16H 20O 5A [由1 mol 酯(C 18H 26O 5)完全水解可得到1 mol 羧酸和2 mol 乙醇可知,该酯为二元酯,分子中含有2个酯基(—COO —),结合酯的水解反应原理可得“1 mol C 18H 26O 5+2 mol H 2O ――→水解1 mol 羧酸+2 mol C 2H 5OH ”,再结合质量守恒定律推知,该羧酸的分子式为C 14H 18O 5。
][题后归纳]乙酸、水、乙醇、碳酸分子中羟基氢的活泼性比较 乙酸 水 乙醇 碳酸分子结构 CH 3COOH H —OH C 2H 5OH遇石蕊试液 变红 不变红 不变红 变浅红 与Na 反应 反应 反应 反应 与NaOH 反应 不反应 不反应 反应 与Na 2CO 3 反应 水解 不反应 反应 与NaHCO 3 反应水解不反应不反应羟基氢原子的活泼性强弱CH 3COOH>H 2CO 3>H 2O>CH 3CH 2OH命题点2 乙醇的催化氧化实验探究4.有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如下图所示装置(夹持装置等已省略),其实验操作为:先按图安装好,关闭活塞a 、b 、c ,在铜丝的中间部分加热片刻,然后打开活塞a 、b 、c ,通过控制活塞a 和b 而有节奏(间歇性)地通入气体,即可在M 处观察到明显的实验现象。
试回答以下问题:(1)A 中发生反应的化学方程式为____________________________________ ________________________________________________________________, B 的作用是________;C 中热水的作用是_____________________________ ________________________________________________________________。
(2)M 处发生反应的化学方程式为____________________________________ ________________________________________________________________。
(3)从M 管中可观察到的现象是_____________________________________,从中可认识到该实验过程中催化剂________(填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的温度。
(4)实验进行一段时间后,如果撤掉酒精灯,反应________(填“能”或“不能”)继续进行,其原因是_________________________________________ _______________________________________________________________。
【解析】 通过控制氧气的用量,探究乙醇的催化氧化反应中催化剂Cu 的催化机理。
乙醇的催化氧化过程实际为O 2与Cu 在加热时反应生成CuO ,CuO 再将乙醇氧化为乙醛,且自身被还原为Cu 。
【答案】 (1)2H 2O 2=====MnO 22H 2O +O 2↑ 干燥O 2 使D 中乙醇变为蒸气进入M 中参加反应,用水浴加热使乙醇气流较平稳 (2)2CH 3CH 2OH +O 2――→Cu△2CH 3CHO +2H 2O(3)受热部分的铜丝交替出现变黑、变红的现象 参加(4)能 乙醇的催化氧化反应是放热反应,反应放出的热量能维持反应继续进行命题点3 酯化反应的实验探究5.某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接装置(装置气密性良好),用小火均匀加热大试管A 5~10 min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置待分层;④分离出乙酸乙酯层,洗涤、干燥。
图甲图乙已知乙醇可以与氯化钙反应,生成微溶于水的CaCl2·6C2H5OH。
有关试剂的部分数据如下:物质熔点/℃沸点/℃密度/(g·cm-3)乙醇-117.3 78.5 0.789乙酸16.6 117.9 1.05乙酸乙酯-83.6 77.5 0.90浓硫酸(98%) 338.0 1.84液体体积);制取乙酸乙酯的化学方程式为__________________________。
