玻璃工艺玻璃的着色和脱色共44页文档
玻璃工艺玻璃的着色和脱色

(2)亮度brightness 垂直观察物的每单位投射面积上的光强。
(3)色调hue 色调主波长 指透过率最大的波长。
(4)色饱和度(纯度P)saturation 主波长在消色混合中所占的比例。 (2)(3)(4)是用于区别彩色的。 2. X-Y颜色图(自学)
?色品图中哪个区域的颜色饱和度最高?
3. 着色玻璃的分类 (1)光吸收型着色玻璃 离子着色 高能辐射着色
1802年生理学家汤麦斯·杨根据人眼的视觉生理特征提出了 新的三原色理论。他认为色光的三原色并非红、黄、蓝,而是 红、绿、紫。这种理论又被物理学家马克思韦尔证实。他通过 物理试验,将红光和绿光混合,这时出现黄光,然后掺入一定 比例的紫光,结果出现了白光。此后,人们才开始认识到色光 和颜料的原色及其混合规律是有区别的。
(8)铜
Cu0 红色、金星。 Cu+ 3d全充满,无 色。Cu2+天蓝色,与铬共用可制绿色 信号玻璃。
在钠硼玻璃中随钠的增多 绿→青绿→蓝
稀土金属 主要为f-f 跃迁,着色稳定。 (9)铈 Ce4+ 强烈吸收紫外线,可见光透过率高。
紫外吸收带进入可见光区产生淡黄色。
铈钛黄 不同基玻璃、比例可得黄、金黄、棕、蓝等 色。
反应平衡受到温度、气氛、时间等的影响。
·温度升高,利于高价离子分解 ·气氛 还原气氛利于高价离子降价 ·时间 时间延长,利于高价离子降价 d. 光照和热处理 ②非着色离子的影响 a. 阳离子场强
氧离子的有效电场q是可变的,受阳离子场强的作 用改变。高场强阳离子对氧的极化作用强,使q减小。 ∵Δ∝q,∴吸收光波长向长波方向移动。
把两种或多种色并置于一个圆盘上,通过动力令其快速 旋转,而看到的新的色彩。颜色旋转混合效果在色相方面与 加法混合的规律相似,但在明度上却是相混各色的平均值。 B:空间混合:
第8章-9章 玻璃的光学性质着色和脱色

2 (d d ) 2 M V 2 ( 1 cos ) 4 2 2 d r
颗粒的数量
颗粒的光密度 颗粒的体积
入射光波长
观测点的距离 (样品厚度)
8.3.2
散射
波长比较长的红光透射性最大,大部分能够直接透过大气中的微粒射向
地面。
而波长较短的蓝、靛、紫等色光,很容易被大气中的微粒散射。 当光穿过大气层时,被空气微粒散射的蓝光约比红光多5.5倍。因此晴天 天空是蔚蓝的。
由于谱线位置的移动,吸收光谱由气态自由离子的线状 光谱转变为化合物或溶液(玻璃)中的带状光谱。
3. 稀土金属离子着色
3. 稀土金属离子着色
稀土元素的电子能级和谱线比一般元素更多种多样,它们可以吸收 或发射从紫外,可见到红外区的各种波长的电磁辐射。稀士元素也 是良好的荧光和激光物质。
⑴ 具有f0(Y、La),f14(Yb、Lu)结构的在200~100nm区城无吸收, 故无色。
⑴ D态离子:只有一个宽广的吸收带,Ti3+ 与Mn3+ 类似呈紫色,Fe2+ 与Cu2+ —蓝色; ⑵ F态离子:有两个或两个以上吸收带,V3+ 与Cr3+ —绿色,Co2+(蓝色) 与Ni2+(灰紫 色) 都带紫色色调; ⑶ S态离子:不出现或出现很弱的吸收带,Ti4+、Cu+的3d轨道分别为全空和全满, 无不能发生d-d轨道跃迁,无色;Mn2+、Fe3+的3d轨道半充满,5个3d轨道各有1个电 子,轨道跃迁是自旋禁戒的。产生很弱的吸收,弱呈色。 ⑷ 在钠硅酸盐玻璃中,当以Na2O取代SiO2,以Li2O取代Na2O,或以Na2O取代K2O 时,吸收峰均向短波方向移动。在这方面D态离子表现得特别明显。
第五章玻璃的着色与脱色

¨³ ² ¤£ ¨Ä É Ã ×£ ©
气泡 与硫化物和硫酸盐比值有关。
•还原条件下,硫酸盐分解成O2或SO2成气泡 。 •氧化条件下,S2-转成S0蒸气,成凹气泡,内 有少量黄色沉淀(S0)
•水的影响:水以(OH) -形式进入玻璃 [—Si—O—Si—]+H2O→2[—Si—OH] 玻璃中SiO2量越多 ,网络外阳离子极化 力越大,进入的H2O越多,易析出成气泡。
硒:在中性条件下成淡紫红色,氧化条 件紫色更纯更美,氧化过分无色(硒酸 盐)。还原条件会生成无色碱硒化物和 棕色硒化铁。
硫硒混合:棕红色
(2)硫碳着色
颜色:棕红,琥珀色 ①着色机理 3+ 2Fe 为中心原子,被三个氧离子(O ) 2和一个硫离子(S )包围,成四面体结构。 3+ 着色中心含有一个氧化物(Fe )一个 2还原物(S ) 2+ 3+ 22Fe /Fe 和S /SO4 有重要作用 23+ 色心浓度=[Fe ][S ] 色心浓度越大,颜色越深。
2. 金属胶体着色 (1)着色机理 金属(Au Ag Cu)以单质形式存在于玻璃中, 形成晶体并聚集而成胶粒,对光产生选择性吸收, 使玻璃着色。 (2)工艺过程 ①金属离子的溶解(前提) ②金属离子的还原 热还原法(预先加入多价元素) 2Au+ + Sn2+ → 2Au0 + Sn4+ 2Ag+ + Sn2+ → 2Ag0 + Sn4+ 2Cu+ + Sn2+ → 2Cu0 + Sn4+
例:见右图。
5 4 3 2 1
•以Li2O取代Na2O, 2Li2O极化力大,S 量↓。 •以K2O取代Na2O,由于 K-O给氧能力大,也使 2S 含量↓,从而影响色 心浓度。
玻璃脱色

玻璃脱色对于无色玻璃来说,应当有良好的透明度。
由于玻璃原料中含有铁、铬、钛、钒等化合物和有植物的有害杂质,在熔制过程时,从耐火材料中,引入有害的杂质是玻璃着成不希望的颜色。
因此在配合料中加入脱色剂。
脱色剂分类:主要分化学脱色剂和物理脱色剂两种。
一、化学脱色剂化学脱色剂是借助于脱色剂的氧化作用,使玻璃黄色,以及时着色能力强的低价铁变成着色能力弱的高价铁(一般说FeO着色能力为Fe2O3的十倍),使玻璃接近无色,增加透明度。
常用的化学脱色剂:硝酸钠、硝酸钾、硝酸钡、白砒、三氧化二锑、氧化铈等。
1.硝酸钠、硝酸钾分解温度低必须与白砒和三氧化二锑共用,脱色效果才好。
2.白砒和三氧化二锑他的脱色作用也是氧化作用。
它还可消除硒和氧化锰脱色时,因用量过多而引起的淡红色。
3.氧化铈:氧化铈用于脱色即使能保证最好的脱色,其脱色作用基于玻璃熔制的温度下分解放出氧,通常与硝酸盐共用。
4.卤族化合物:萤石、氟硅酸钠、氯化钠、冰晶石等。
在熔制过程中生成挥发性的FeF3、FeCl3或者生成色的NaFeF6。
化学脱色剂的常用量:1.硝酸钠为配合料的1—1.5%。
2.白砒为配合料的0.3—0.5%.3.三氧化二锑为配合料的0.3—0.4%。
4.氧化铈与硝酸盐共用时,氧化铈为配合料的0.15—0.4%;硝酸盐为0.5—1.2%,氟化物为0.5—1%。
二、物理脱色剂物理脱色剂是往玻璃中加入一定量的能互补的着色剂,使玻璃的黄色、蓝绿色得到互补。
物理脱色一般不使用一种着色剂,以应选适当的两种着色剂。
通过物理脱色能使玻璃色调消除,但却使玻璃的广吸收增加,使玻璃的透明度降低。
物理脱色常与化学脱色的结合使用。
常用的物理脱色剂有:二氧化锰、硒、氧化钴、氧化钕、氧化镍等。
1.二氧化锰、硒、氧化钴、氧化钕、氧化镍等。
2.脱色剂的用量:脱色剂的用量关键是玻璃含铁的高低,一般讲玻璃中含铁量大于0.1%时,不能采用脱色方法来制得无色玻璃。
最好含铁量在0.06%一下,脱色效果好,否则玻璃脱色后呈现灰色,脱色效果不好。
6-玻璃的着色与脱色
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
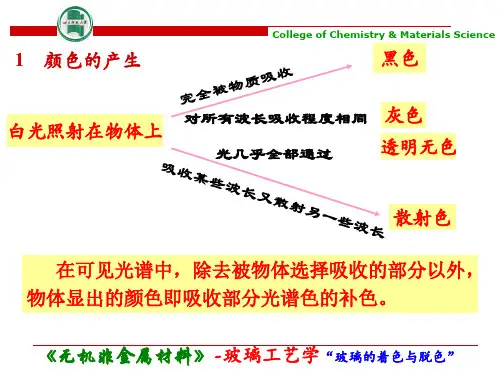
3 原因 玻璃对光的吸收是由于原子中的电子在接受光照 射后由较低的能级(E1)跃迁到较高的能级(E2)。 当E2-E1=可见光的能量时,就呈颜色。能量差 愈小、吸收光的波长愈长,呈现的颜色愈深。 颜色还同时采用亮度(透射或反射光的强度),是 颜色在“量”方面的特征。色调(是色玻璃透过的透 光中最显著的波长),是颜色质方面的特征。饱和度 (主波长在与白光混合中所占的百分数)。色调和饱 和度称为“色品” 。
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
配位数间的平衡
即与周围氧离子的配位数有关
[Fe3+O6] (淡红色) [Fe3+O4] (黄褐色) [Co2+O6] (粉红色) 着色离子浓度 [Co2+O4] (青色]
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
6.4.3 硫碳着色
1 硫碳在玻璃中的着色(掌握) “硫碳”着色玻璃,颜色棕而透红,色 似琥珀,广泛用于瓶罐玻璃和器皿玻璃。 碳的作用:还原剂作用,并不参加着色
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
玻璃杯的着色工艺

玻璃杯的着色工艺引言:玻璃杯作为我们日常生活中常见的用品之一,不仅具有实用性,还可以添加一些艺术感和装饰效果。
其中,着色工艺是赋予玻璃杯独特外观的重要环节。
本文将介绍玻璃杯的着色工艺以及常用的着色方式。
一、喷涂着色:喷涂着色是最常见的一种玻璃杯着色方式。
制作过程中,首先选取适合的颜料,然后使用专业的喷涂设备对玻璃杯进行均匀的喷涂。
通过控制颜料的浓度和喷涂的厚度,可以实现不同的着色效果。
喷涂着色具有操作简便、成本低廉的优点,易于大规模生产。
二、烧结着色:烧结着色是一种将颜料与玻璃杯表面烧结在一起的着色方式。
该工艺通常使用颜料添加到玻璃材料中或是将颜料涂抹在玻璃杯的表面,然后将玻璃杯送入高温炉中进行烧结。
在高温下,颜料与玻璃发生化学反应,使其永久融合在一起。
烧结着色的优点是色彩饱满、持久耐用,但制作工艺复杂。
三、电镀着色:电镀着色是通过电化学反应在玻璃杯表面镀上一层着色膜的方法。
首先,在玻璃杯表面涂上电解液,然后在电解槽中进行电解处理,使金属离子在玻璃杯表面析出形成金属膜。
该工艺中使用的金属离子决定了玻璃杯的颜色。
电镀着色具有色彩多样、光泽度高的特点,被广泛应用于高档玻璃杯的制作。
四、热剥离着色:热剥离着色是将特定颜料电控粉末通过喷涂的方式固定在玻璃杯表面,然后经过高温加热,使颜料与玻璃杯粘结,形成着色图案。
与传统的着色方式相比,热剥离着色具有更好的图案精细度和牢固性。
这种着色方式常用于个性化定制的玻璃杯制作,能够满足人们对特定图案和个性化需求的追求。
总结:玻璃杯的着色工艺丰富多样,每种着色方式都有各自的特点和应用场景。
喷涂着色简单易行,适用于大规模生产;烧结着色色彩持久耐用,但工艺复杂;电镀着色色彩多样、光泽度高,常用于高档玻璃杯;热剥离着色能够实现个性化的需求,具有较好的图案精细度和牢固性。
无论是品牌定制还是个人喜好,玻璃杯的着色工艺都能够满足不同需求,为我们的生活增添一丝艺术色彩。
玻璃着色方法
一、涂漆法
涂漆法是给玻璃上色的一种常用方法,需要用到特殊的油性玻璃漆。
首先,将玻璃器皿或物品擦洗干净,确保表面干燥无尘垢。
然后将油性玻璃漆搅拌均匀,再利用毛刷或喷涂器将漆均匀地涂在玻璃表面上。
大约30分钟后,玻璃表面的颜色会变得浓郁起来。
二、粘贴彩色胶纸法
这种方法非常简单,只需要买一些彩色的胶纸,然后剪成您需要的形状和大小,再粘贴在玻璃上即可,这是最容易和经济的方法之一。
在使用胶纸之前,用纸巾或棉球将玻璃表面擦干净,以免影响颜色粘度。
这种方法可以为玻璃器皿及各种装饰物增添气息。
三、涂抹彩色蜡笔法
这种方法最适合于玻璃上的细节着色。
首先,涂抹一层白色蜡笔作为底色,然后为您想要的颜色涂抹顶层,最后再在颜色表面轻轻地涂抹一层白色蜡笔,使颜色均匀。
最后,用纸巾轻轻地擦去表面多余的蜡笔,这样使颜色更加鲜明。
9 玻璃的着色和脱色
(3)铜+铬 以CuO:Cr2O3=1.5:1为中心(绿)得
黄绿→蓝绿 铜多偏蓝,铬多偏黄。 不可推测的混合色 (4)铬+锰 少量K2Cr2O7使紫色增强,再多则变灰色。
可制黑色和黑色透红外玻璃
(5)铁+锰 褐紫色和黄棕色,色调无规律。
三、金属胶体着色
1. 着色机理 金属(Au Ag Cu)以单质形式存在于玻璃中,形成晶体并 聚集而成胶粒,对光产生选择性吸收,使玻璃着色。 2. 工艺过程 (1)金属离子的溶解(前提) (2)金属离子的还原 ① 热还原法(预先加入多价元素) 2Au+ + Sn2+ → 2Au0 + Sn4+ 2Cu+ + Sn2+ → 2Cu0 + Sn4+
当6个配位体沿±x、±y、±z接近阳离பைடு நூலகம்时,使dx2-y2、 dz2轨道能量上升,而另外三轨道能量下降。
轨道分成两组:两个高能轨道(eg或dr),
三个低能轨道(t2g或de) 两组轨道能量差:Δ=eg-t2g=10Dq Δ为配位场分裂能 eg=6Dq t2g= -4Dq
b. 四面体配位(4配位) 高能轨道三个dxy dxz dyz 分裂能 Δ四=4/9 Δ八 低能轨道两个dx2-y2 dz2
Na2O CaO
SiO2重量百分比变化值
克分子比S/SO4
②结构因素 S2-大多处于两个Si4+之间, 似 桥氧。 S2--Si4+稳定性:M的场强大, 稳定性差。 S2-含量少,色心浓度小。
5 4 3 2 1 0 1 2 3 4 5
Na20移去重量%
K2O Li2O
例:以Li2O取代Na2O, S 量 减小。见右图。 * K2O是因影响氧活度 而影响色心浓度。
第8章-9章 玻璃的光学性质着色和脱色
从上述三种阳离子类型的特点,可以得出如下规律:
⑴ 最外层(或次外层)上含有未配对电子或“轨道”部分填充者, 电子容易在3d或4f“轨道”中发生跃迁,因此都是有色的。 ⑵ 最外层(或次外层)上的电子都已配对(包括全充满、全空)或 半充满者,都是无色的(或着色很弱)。
⑶ 在玻璃中凡是变价的阳离子,由于金属阳离子与周围氧离子 之间有电荷迁移,产生荷移吸收,因此在紫外或近紫外区有强 烈的吸收。
3. 稀土金属离子着色
稀土族(或镧系)是属于内过渡元素 特点是着色稳定,颜色鲜艳优美。
4f轨道:f-f 跃迁
4f亚层为(5S2)(5P6)电子壳所屏蔽,使4f亚层受邻近其 它原子的势场(配位场)影响较小。因此镧系元素在玻璃 中(或化合物中)的吸收光谱,基本保持自由离子的线状 光谱。
H5 F4
F5/2
3
980nm
525nm 545nm 658nm
1800nm 793nm
476nm
ET4
3
2
F7/2
4
I15/2
H6
Yb
3+
Er
3+
Tm
3+
Yb
图4-73 Er3+和Tm3+离子能级图以及980 nm泵浦下可能的能量转移机制
980nm
2
F7/2
3+
9.2.4
离子着色理论
在游离氧较少的酸性玻璃中,离 影响离子价态和光谱特性的因素 子趋向形成低价位和高配位;而在 碱性玻璃中,则趋向形成高价位, 熔制温度越高、熔制时间越长, 低配位。 越有利于高价氧化物的分解,使离 (1)玻璃的基础成分 子从高价转向低价。此外,气氛也 有重要的影响
玻璃的着色和脱色解析
b. 四面体配位(4配位) 高能轨道三个dxy dxz dyz 分裂能 Δ四=4/9 Δ八
低能轨道两个dx2-y2 dz2
c. 分裂能公式(八面体) 5
eq r4
3ห้องสมุดไป่ตู้R5
e--电子电荷 r--3d电子离原子核平均距离(离子半径)
颜色
弱黄 红 紫红
蓝
(2)胶粒浓度
影响色饱和度
(3)着色剂种类
四、硫、硒极其化合物着色
1. 单质着色
硒在中性条件下成淡紫红色,氧化条件紫色更美,氧化过分 无色(硒酸盐)。还原条件会生成无色碱硒化物和棕色硒化铁。
硫只在硼很高的玻璃中存在(蓝色),不实用。
2. 硫碳着色 (1) 着色机理
Fe3+为中心原子,被三个氧离子(O2-)和一个硫离子 (S2-)包围,成四面体结构。
黄绿→蓝绿 铜多偏蓝,铬多偏黄。
不可推测的混合色 (4)铬+锰 少量K2Cr2O7使紫色增强,再多则变灰色。
可制黑色和黑色透红外玻璃 (5)铁+锰 褐紫色和黄棕色,色调无规律。
三、金属胶体着色 1. 着色机理
金属(Au Ag Cu)以单质形式存在于玻璃中,形成晶体并 聚集而成胶粒,对光产生选择性吸收,使玻璃着色。
紫外吸收带进入可见光区产生淡黄色。 铈钛黄 不同基玻璃、比例可得黄、金黄、棕、蓝等色。
(9)钕 Nd3+紫红色,有双色效应 吸收峰复杂且稳定,可做校正分光光度计的标准玻璃。 固体激光材料。
4. 混合着色 可从透光曲线迭加推测混合色 (1)锰+钴 紫到蓝间颜色,锰调节色调。 (2)钴+铜 钴消除铜绿,铜消除钴红,得浅蓝→淡青 (3)铜+铬 以CuO:Cr2O3=1.5:1为中心(绿)得
