2015铜与硝酸反应实验现象的探究资料
浅析铜与硝酸反应的实验探究与拓展

在上面的三组实验中提供的硝酸的体积均一样,仅仅是铜的质量不相同。
A组中,铜的质量相同,即反响后溶液中Cu2+的浓度相同,而浓硝酸反响后溶液为绿色,稀硝酸为蓝色;B组中,与浓硝酸反响的铜的质量要小一些,即反响后Cu2+浓度低一些,然而溶液仍然为绿色;C组中Cu2+的浓度大,溶液仍然是绿色。
可见,Cu(NO3)2溶液为绿色不是由Cu2+浓度引起的。
猜测二、可能是硝酸铜溶于浓硝酸引起的。
将Cu(NO3)2晶体溶于浓硝酸,溶液仍然为蓝色。
可见此假设不成立猜测三、可能是温度不同引起的方案1:将绿色的Cu(NO3)2溶液加热。
溶液仍然为绿色,且在试管中产生大量的红棕色气体。
原因是在加热的时候,浓硝酸不断的分解,致使NO2源源不断的生成,因此不可能将NO2和Cu(NO3)2分开,因此溶液仍为绿色。
方案2:将正在反响的试管壁不断地用流水冲,溶液颜色为蓝色。
这个改变的核心因素是降低温度。
因为Cu+4HNO3〔浓〕==Cu〔NO3〕2+2NO2+2H2O的反响是放热反响,降温反响速度减慢,产生的NO2减少;而2NO2==N2O4〔正反响为放热反响〕,因此降温平衡向右移动,生成无色的N2O4,NO2的量逐渐减少,故溶液很快变成蓝色。
猜测四、可能是NO2溶于Cu(NO3)2溶液形成的。
方案1:将Cu和浓硝酸反响后的溶液迅速倒入枯燥的烧杯中,再转移到另一个枯燥的烧杯中,溶液迅速变蓝。
方案2:在Cu和浓硝酸反响后的试管口上塞一团沾有NaOH溶液的棉花,放置半天后,溶液为蓝色。
其原因是随着时间的推移,反响后的溶液温度降低,NO2慢慢从溶液中逸出被棉花中的NaOH吸收,溶液的颜色仅仅由Cu(NO3)2呈现出来。
由此可见,Cu(NO3)2溶液的绿色是由蓝色的Cu(NO3)2溶液和黄色的HNO3溶液〔溶有NO2〕的两者混合而成的。
二、原型拓展1方案评价型[例1]某化学课外兴趣小组在做铜与浓硝酸、稀硝酸反响实验时发现:“相同质量的铜分别与等体积且足量的浓硝酸、稀硝酸充分反响后,前者溶液颜色是绿色的,后者溶液的颜色是蓝色的。
铜与硝酸的反应实验

铜与硝酸的反应实验铜与硝酸的反应实验是化学实验中常见的一种实验,通过观察反应过程和产物的变化,可以深入理解金属与酸发生反应的原理。
本文将详细介绍铜与硝酸反应的实验方法、实验步骤、观察结果和实验原理。
一、实验方法1. 实验器材:铜片、试管、试管夹、滴管、橡胶塞等。
2. 实验药品:浓硝酸、稀硝酸等。
二、实验步骤1. 准备工作:a) 将铜片切割成适当大小的片状并清洗干净。
b) 准备好试管,装入一定量的硝酸。
2. 实验操作:a) 用试管夹夹住铜片,将其悬挂置于试管中,确保铜片完全浸泡在硝酸中。
b) 注意避免与硝酸接触皮肤和眼睛,做好实验室安全防护。
3. 反应观察:a) 观察反应过程中是否有气体的生成、溶液的颜色变化等现象。
b) 反应结束后,观察产物的性质和形态。
三、观察结果1. 反应过程中,铜片表面逐渐出现气泡,溶液呈现淡绿色至蓝色。
2. 反应结束后,可以观察到一种蓝色的产物,它是铜与硝酸反应生成的一种化合物。
四、实验原理铜与硝酸发生反应的化学方程式为:Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O根据上述化学方程式,可知铜与硝酸发生反应后,生成了硝酸铜和一氧化氮气体。
硝酸铜是一种蓝色的化合物,形态多样,可以是固体或溶液。
该反应属于一种氧化还原反应,铜是一种较活泼的金属,可以被硝酸氧化。
在反应过程中,铜原子失去了电子,被氧化成Cu2+离子,而硝酸中的HNO3分子在还原过程中被还原成为NO2和H2O。
五、安全注意事项1. 实验过程中要佩戴实验手套、护目镜等个人防护装备,避免硝酸溅到皮肤或眼睛。
2. 硝酸是一种强酸,具有腐蚀性,注意操作时不要接触皮肤或吸入其蒸汽。
3. 实验后,将废液妥善处理,不要直接倒入下水道。
六、实验应用铜与硝酸的反应实验可以用于教学和科研中,通过实际观察和实验操作,帮助学生深入理解化学反应的机理和变化过程。
此外,该反应所产生的硝酸铜也可用于其他实验或制备其他化合物。
铜与硝酸反应实验现象的探究

分析问题:可能影响溶液颜色的微粒
反应物
产物
稀硝酸
铜片
Cu2+
(蓝色)NO3_源自H+(可能)NOH2O
浓硝酸
铜片
Cu2+
(蓝色)
NO3_
H+(可能)NO2
H2O
(红棕
色)
观点1:铜离子浓度不同 设计方案:加水稀释绿色溶液,观察现象。
绿色溶 液
稀释后
观点1:铜离子浓度不同
设计方案:配制饱和硝酸铜溶液,观察现象。
实验结论: 该实验现象,支持观点2。
设计方案:向硝酸铜溶液中通入二氧化氮 气体,观察溶液颜色变化。
实验结论: 该实验现象,支持观点2
实验结论:通过实验探究,我们认为是 “NO2的影响”造成了溶液颜色的差异。
谢谢!再见!
实验现象: 硝酸铜的饱和溶液呈蓝色
饱和硝酸铜 溶液
实验结论: 该实验现象,不支持观点1。
观点2:NO2的影响 设计方案:加热绿色溶液,观察现象。
实验结论: 该实验现象,支持观点2。
观点2:NO2的影响 设计方案:将绿色溶液装入针筒内,向外拉动活 塞,观察现象。
实验现象: 向外拉动针 筒活塞,装 置内有红棕 色NO2逸出。
铜与硝酸反应现象的探究
铜与稀硝酸反应的实验设计
温馨提示:针筒吸入稀硝酸 时速度要缓慢,避免吸入空 气
铜与浓硝酸反应的实验设计
温馨提示:打开塑料袋中间 的活结,动作轻缓,防止铜 片划破塑料袋,然后迅速将 袋子放入瓶中盖好。
铜与硝酸反应
绿色溶液 蓝色溶液
发现问题:浓、稀硝酸和铜反应所得 硝酸铜溶液的颜色为何不同?
铜与硝酸反应的实验现象探究

铜与硝酸反应的实验现象探究铜与浓稀硝酸反应的实验,是中学化学教材中两个非常重要的演示实验,由于硝酸的浓度不同,反应现象不同,硝酸的还原产物也不相同。
⑴铜与浓硝酸反应取一支试管,加入一小块铜片,滴入浓硝酸后,立即有气泡产生,反应剧烈,放出红棕色气体,溶液很快变成绿色;⑵铜与稀硝酸反应取一支试管,加入一小块铜片,滴入稀硝酸后,也有气泡产生,反应缓慢,反应开始阶段,试管内气体呈红棕色,随着反应的进行,试管内气体逐渐变浅,最终呈无色,溶液变成蓝色。
综上可见,铜与浓稀硝酸反应,除了在反应现象和气体产物上有明显不同以外,还有一个明显不同,就是反应后生成的溶液颜色明显不同。
对这个问题存在着不同的解释,但同学们通过对以下这个例题的分析与解答,不仅能够更好地认识铜与浓、稀硝酸反应现象的不同,也会对反应后溶液颜色的不同有新的理解。
例题铜与浓硝酸和铜与稀硝酸反应,产物不同,实验现象不同。
为此,某高二化学学习兴趣小组在教师的指导下开展了积极的实验探究活动,他们为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。
⑴请根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤。
药品:稀硝酸、稀盐酸、锌粒、碳酸钙固体。
步骤:①检查装置的气密性;②;③;④待反应完全后,将右边的导管插入试管内接近液面;⑤;⑥用注射器向试管内推入空气(或氧气)。
⑵推入氧气或空气的目的是。
⑶分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差引起的,你同意吗?原因是。
另一同学提出溶液呈绿色是Cu2+溶液颜色与NO2气体颜色复合的结果,请设计一个实验证明之(简述实验方案与实验现象)。
分析:此题探究的内容有两个:一是对如何能观察到铜与稀硝酸的反应产物NO呈无色进行探究,其关键是如何有效排除试管内的空气,使生成的NO不被氧化,又能很方便地检验出无色NO的存在;二是对铜与浓硝酸反应溶液呈绿色的原因进行探究,其关键是如何能通过实验证明浓硝酸与铜反应后的溶液呈绿色不是铜离子浓度差引起的。
铜与硝酸反应的实

打开止水夹,向外拉注射器活塞,吸 入5ML稀硝酸,排除装置内的空气, 关闭止水夹。一会儿铜与稀硝酸发生 反应,溶液变蓝色,产生无色气体。 产生一定体积的气体后,打开止水夹, 吸入一定量的空气,气体迅速变红棕 色。吸入适量的氢氧化钠。
【说明】 稀硝酸浓度不能太稀,否则反应太 慢,这时要用热稀硝酸。要排尽装 置内的空气。要等红棕色全部消失 后,才能拆除装置。
当碳酸钙反应完后再挤压长滴管使浓硝酸从小试管中溢出与铜丝反应产生大量的红棕色气体溶液变蓝色
铜与硝酸反应的实验设计
邵东十中 刘海平
【目的】铜与硝酸的反应是中学化学的 重要反应,是硝酸的重要性质。本实验 通过铜与浓﹑稀硝酸反应产物分析,使 学生加深对该知识点的理解。由于一氧 化氮和二氧化氮是对环境污染很严重的 物质,因此需注意防止排放到空气中。 一氧化氮容易与氧气反应,须注意在铜 与稀硝酸反应时,排除装置内的空气。
装置图:
【操作】 连接好装置。打开短导管的止水夹, 挤压长滴管,滴入几滴浓硝酸。碳酸 钙与浓硝酸反应产生二氧化碳排出装 置内的空气(与铜和稀硝酸反应对 照)。当碳酸钙反应完后,再挤压长 滴管,使浓硝酸从小试管中溢出与铜 丝反应,产生大量的红棕色气体,溶 液变蓝色。关闭止水夹。用塞子塞住 干燥管,混合两试管中得溶液。
【说明】 实验完毕后,要等红棕色全部消 失后,才能拆除装置。
二:铜与稀硝酸反应 【原理】 3Cu﹢8HNO3(稀)= 3Cu(NO3)2﹢2NO2↑﹢4H2O↑
【准备】
配制1:3的稀硝酸,一根20ML或 50ML的注射器。注射器前端连接带 橡皮管的玻璃管,玻璃管内嵌一粒 玻璃球或用止水夹。注射器内放少 许铜丝。
一:铜与浓硝酸反应 【原理】
Cu﹢4HNO3(浓)=Cu(NO3)2﹢2NO2↑﹢2H2O↑
实验探究铜与硝酸反应的实验设计
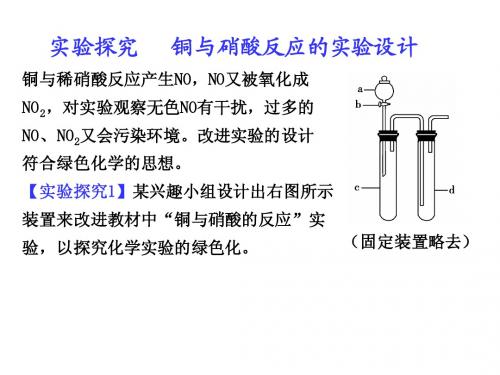
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口, 实验前,关闭活塞b,试管d中加水至浸没长导管口, b,试管 塞紧试管c 塞紧试管c和d的胶塞,加热c,其目的是 的胶塞,加热c 。 (2)在d中加适量NaOH溶液,c中放一小块铜片,由分 中加适量NaOH溶液, 中放一小块铜片, NaOH溶液 液漏斗a 浓硝酸, 液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 中加入2 mL浓硝酸 。 再由a 蒸馏水, 再由a向c中加2 mL蒸馏水,c中的实验现象是 中加2 mL蒸馏水 。 (3)下表是制取硝酸铜的三种方案,能体现绿色化学理 下表是制取硝酸铜的三种方案, 念的最佳方案是 ,理由是 。
解析
①CO具有还原性,且与空气混合达到一定比例时 CO具有还原性, 具有还原性
易爆炸,所以反应之前,应向装置中通入N 易爆炸,所以反应之前,应向装置中通入N2赶出装置内 的空气,以免出现爆炸事故。 的空气,以免出现爆炸事故。 ②CO和NO在催化剂和加热条件下发生反应生成N2和 CO和NO在催化剂和加热条件下发生反应生成N 在催化剂和加热条件下发生反应生成 通过装置Ⅲ CO2,通过装置Ⅲ中澄清石灰水是否变浑浊来验证是否 生成了CO 生成了CO2。 ③由于有部分NO没有转化为N2,向装置中通入空气时, 由于有部分NO没有转化为N 向装置中通入空气时, NO没有转化为 装置Ⅱ中的NO与 反应生成红棕色NO 装置Ⅱ中的NO与O2反应生成红棕色NO2。 NO ④由于尾气中仍残留未反应的有毒的CO、NO气体,所 由于尾气中仍残留未反应的有毒的CO、NO气体, CO 气体 以应在装置Ⅳ后面增加尾气处理装置。 以应在装置Ⅳ后面增加尾气处理装置。
实验探究
铜与硝酸反应的实验设计
铜与稀硝酸反应产生NO,NO又被氧化成 铜与稀硝酸反应产生NO,NO又被氧化成 NO 对实验观察无色NO有干扰, NO有干扰 NO2,对实验观察无色NO有干扰,过多的 NO、 又会污染环境。 NO、NO2又会污染环境。改进实验的设计 符合绿色化学的思想。 符合绿色化学的思想。 【实验探究1】某兴趣小组设计出右图所示 实验探究1 装置来改进教材中“铜与硝酸的反应” 装置来改进教材中“铜与硝酸的反应”实 验,以探究化学实验的绿色化。 以探究化学实验的绿色化。 (固定装置略去) 固定装置略去)
铜与硝酸反应的实验现象探究

铜与硝酸反应的实验现象探究铜与浓稀硝酸反应的实验,是中学化学教材中两个非常重要的演示实验,由于硝酸的浓度不同,反应现象不同,硝酸的还原产物也不相同。
⑴铜与浓硝酸反应取一支试管,加入一小块铜片,滴入浓硝酸后,立即有气泡产生,反应剧烈,放出红棕色气体,溶液很快变成绿色;⑵铜与稀硝酸反应取一支试管,加入一小块铜片,滴入稀硝酸后,也有气泡产生,反应缓慢,反应开始阶段,试管内气体呈红棕色,随着反应的进行,试管内气体逐渐变浅,最终呈无色,溶液变成蓝色。
综上可见,铜与浓稀硝酸反应,除了在反应现象和气体产物上有明显不同以外,还有一个明显不同,就是反应后生成的溶液颜色明显不同。
对这个问题存在着不同的解释,但同学们通过对以下这个例题的分析与解答,不仅能够更好地认识铜与浓、稀硝酸反应现象的不同,也会对反应后溶液颜色的不同有新的理解。
例题铜与浓硝酸和铜与稀硝酸反应,产物不同,实验现象不同。
为此,某高二化学学习兴趣小组在教师的指导下开展了积极的实验探究活动,他们为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。
⑴请根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤。
药品:稀硝酸、稀盐酸、锌粒、碳酸钙固体。
步骤:①检查装置的气密性;②;③;④待反应完全后,将右边的导管插入试管内接近液面;⑤;⑥用注射器向试管内推入空气(或氧气)。
⑵推入氧气或空气的目的是。
⑶分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差引起的,你同意吗?原因是。
另一同学提出溶液呈绿色是Cu2+溶液颜色与NO2气体颜色复合的结果,请设计一个实验证明之(简述实验方案与实验现象)。
分析:此题探究的内容有两个:一是对如何能观察到铜与稀硝酸的反应产物NO呈无色进行探究,其关键是如何有效排除试管内的空气,使生成的NO不被氧化,又能很方便地检验出无色NO的存在;二是对铜与浓硝酸反应溶液呈绿色的原因进行探究,其关键是如何能通过实验证明浓硝酸与铜反应后的溶液呈绿色不是铜离子浓度差引起的。
铜与硝酸反应的实验现象探究

铜与硝酸反应的实验现象探究
铜与硝酸反应是化学一组常见的反应,其实验现象很明显。
当铜粒放入硝酸中时,表面会出现沿被硝酸挥发现象,大量的硝酸蒸气容易四处飘散,温度会随之升高,使得实验中心产生负责热量。
启动反应过程之后,将会伴随着火花出现,视觉上的变化会加速反应的发展,融化的铜就会变为深绿色的汞酸。
该反应是一种发光反应,也称为复杂的氧化还原反应,在铜放入硝酸的过程中,硝酸的氧原子会被挥发,从而形成铜离子和质子,并迅速聚集成颗粒形式,最后形成硝酸铜沉淀。
而在氧化还原反应过程中,吸热也是一个重要现象,这对最终的温度和反应结果有很大的影响。
在铜与硝酸反应的实验中,温度的升高由于吸热的存在而加快,被证实的的温
度为539K,而在光照的作用下,反应更为迅速,温度从室温升高到5400K,在此条件下形成绿色的汞酸钠(即氢氧化铜)easy。
在铜与硝酸反应实验中,观察到大量的沿被硝酸挥发、吸热、发光等实验现象,都显示出氧化还原反应磁浓度快速变化,也说明实验温度也会迅速提升,发现氢氧化铜。
所有上述变化现象提示,铜与硝酸反应行为确实是一个比较复杂的氧化还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析问题:可能影响溶液颜色的微粒
反应物
稀硝酸 铜片
反应后溶液中的微粒
_ 2+ Cu NO3 (蓝色)
H+(可能)NO H2O H (可能)NO2 H2O
(红棕 色)
+
浓硝酸 铜片
_ 2+ Cu NO3 (蓝色)
观点1:铜离子浓度不同
设计方案:加水稀释绿色铜离子浓度不同 设计方案:配制饱和硝酸铜溶液并稀释至不同 的浓度,观察现象。 实验现象: 硝酸铜的饱和溶液以及稀 释后的溶液均呈蓝色。
饱和硝酸铜 溶液
实验结论: 该实验现象,不支持观点1。
观点2:NO2的影响
设计方案:加热绿色溶液,观察现象。
实验结论: 该实验现象,支持观点2。
观点2:NO2的影响 设计方案:将绿色溶液装入针筒内,向外拉动活 塞,观察现象。
实验现象: 向外拉动针 筒活塞,装 置内有红棕 色NO2逸出。
实验结论: 该实验现象,支持观点2。
铜与硝酸反应现象的探究
池州一中
夏婷婷
铜与稀硝酸反应的实验设计
温馨提示:针筒吸入稀硝酸 时速度要缓慢,避免吸入空 气
铜与浓硝酸反应的实验设计
温馨提示:打开塑料袋中间 的活结,动作轻缓,防止划 破塑料袋,然后迅速将袋子 放入瓶中盖好。
铜与硝酸反应
绿色溶液
蓝色溶液
发现问题:浓、稀硝酸和铜反应所得 硝酸铜溶液的颜色为何不同?
设计方案:向硝酸铜溶液中通入二氧化氮 气体,观察溶液颜色变化。
实验结论: 该实验现象,支持观点2
实验结论:通过实验探究,我们认为是 “NO2的影响”造成了溶液颜色的差异。
欢迎同学们加我QQ:89594225或者 微信号:xtt216与我联系与沟通!
谢谢!再见!
