芳香性的判断
芳香性的判断
苯既具有平面的离域体系,电子数也符合4n+2规则; 萘、蒽、菲等也满足休克尔规则,因此都具有芳香性。
专题一
芳香性与休克尔规则
二、非苯型芳香烃
一些不含苯环的环烯,因符合休克尔规则,故也具有 芳香性,此类烃叫做非苯芳香烃。
(一)轮烯
[10]轮烯
[14]轮烯 [18]轮烯
专题一
芳香性与休克尔规则
二、非苯型芳香烃
专题一
芳香性与休克尔规则
三、休克尔规则的修正
1954年伯朗特(Platt)提出了周边修正法,认为可以 忽略中间的桥键而直接计算外围的电子数,对Hückel规则 进行了完善和补充。
两个前提:
使尽量多的双键处在外周上; 处在外周内外的双键写成其共振的正负电荷形式;
专题一
芳香性与休克尔规则
三、休克尔规则的修正
(二)芳香离子
环丙烯 正离子
环戊二烯 负离子
环庚三烯 正离子
专题一
芳香性与休克尔规则
二、非苯型芳香烃
(三)稠合环系
薁(蓝烃),为青蓝色片状物,符合休克尔规则具有芳香性
薁能发生典型的亲电取Βιβλιοθήκη 反应,取代基主要进入1位专题一
芳香性与休克尔规则
判断下列是否芳香性?
16个电子
12个电子
8个电子
都具有芳香性!
专题一
芳香性与休克尔规则
芳香性与休克尔规则
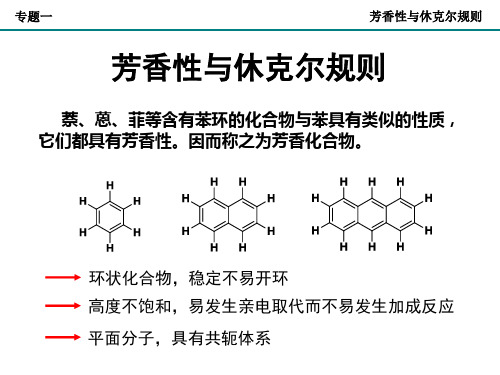
萘、蒽、菲等含有苯环的化合物与苯具有类似的性质, 它们都具有芳香性。因而称之为芳香化合物。
环状化合物,稳定不易开环 高度不饱和,易发生亲电取代而不易发生加成反应
平面分子,具有共轭体系
专题一
芳香性与休克尔规则
一、休克尔规则
成环原子处于同一平面,形成一个闭合的环状π电子 离域体系,且π电子数为4n+2(n = 0,1,2…)时,化合物 具有芳香性。
芳香性判断技巧

芳香性判断技巧-标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π 电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π 电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π 电子数分别位 2,2,6,6,符合 4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π 电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,。
有机化学基础知识点整理芳香性和芳香化合物的性质

有机化学基础知识点整理芳香性和芳香化合物的性质芳香性和芳香化合物的性质有机化学是化学领域中的一个重要分支,研究有机物的结构、性质和合成方法等。
芳香性和芳香化合物是有机化学中的重要概念和研究内容之一。
本文将对芳香性和芳香化合物的基础知识点进行整理。
一、芳香性的概念芳香性是指含有芳香环结构的化合物所特有的性质或现象。
它是由芳香环中的π电子云形成的高度共轭体系所决定的。
具备芳香环结构的化合物表现出一系列独特的性质,包括稳定性高、反应活性低、呈现特殊的气味等。
二、芳香性的规则和条件1. 符合Hückel规则Hückel规则是判断一个化合物是否具备芳香性的一个重要准则。
根据Hückel规则,一个环状分子具备芳香性必须满足:- 分子是平面的;- 分子中含有 4n+2 个π电子,其中 n 是非负整数。
2. 产生高度共轭体系芳香性是由共轭体系中的π电子云形成的,因此产生芳香性的分子通常具有大范围的共轭结构。
对于苯环来说,由于其电子云在整个环上共轭,因此苯是最简单的芳香化合物。
3. 具备极性芳香化合物中的芳香环带有电负性较大的原子团,如氧、氮等,因此具备一定的极性。
然而,芳香化合物整体上常表现出较弱的极性,主要由于π电子在环上的扩散。
三、芳香化合物的性质1. 化学稳定性芳香化合物的共轭结构使其更加稳定。
对于具有芳香性的化合物,由于能量更低,其化学稳定性也相对较高。
这也是为什么芳香化合物常用作药物、染料和香料等方面的原料。
2. 同位素标记由于芳香化合物的稳定性,可以通过同位素标记来追踪其在化学反应中的转化过程。
同位素标记技术在有机化学的研究和应用中扮演着重要的角色,有助于揭示化学反应的机理和动力学。
3. 气味和香味芳香化合物常常具有独特的气味和香味,广泛应用于香水、香料和食品添加剂等方面。
因为芳香化合物形成的芳香环结构能够与嗅觉受体结合,产生特殊的感官效应。
4. 光谱特性芳香化合物在红外光谱、紫外光谱和核磁共振光谱等光谱中表现出特殊的峰值和吸收特性,这对于准确鉴定和表征芳香化合物具有重要意义。
芳香性判定

(个人感悟详细版)芳香性:环状闭合共轭体系,π电子高度离域,具有离域能,体系能量低,较稳定.在化学性质上表现为易进行亲电取代反应,不易进行加成反应和氧化反应,这种物理,化学性质称为芳香性. 一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π 电子数是否符合4n+2.[18]轮烯环上碳原子基本上在一个平面内,π 电子数为4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π 电子数分别位2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π 电子数分别为10 和14,符合Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有10 个,相当于[10]轮烯,符合Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.(成环的四个碳原子和一个杂原子都是sp2杂化,所以你看的图中 N还要再连接一个H. N总共5个电子,连接了三个达到八电子饱和故其还有一对电子对未画出,所以是两个双键4个再加N的一对孤电子对2个总共六个)吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.(貌似是一个原子提供一个π电子既然已经双键提供过一次就只算一次跟三键有点类似)两个N都与双键相连,孤对电子也都不算,还是6个π电子(跟刚才上面解释差不多相当于3个双键)有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子(上面三个题的组合即没有双键的N提供电子对有双键的按提供一个所以是两个双键加一个电子对的2个π电子共六个)这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.(遇到这种没双键的但是有正负电子的我一般是先数双键然后数几个折角即连接处然后是正的话减去减去正的个数是负的话加上负的个数理论依据是正电荷的话使其sp杂化而负电荷的话使其sp2杂化)这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.(理由同上)图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.(遇到这种先拆开难理解的双键然后再分成若干小原子团)因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,(貌似是无机的知识三键算一个双键)。
芳香性和构型的判断依据

从休克尔规则我们可以得知,具有芳香性的通常是具有如下四个特点的分子:
(1)它们是包括若干数目键的环状体系,具有(4n+2)个π电子(这里n是大于或等于零的整数),换句话说,不在环状体系中的双键不要算在里面;
2.费舍尔(Fischer)式中判断依据:
在费舍尔(Fischer)式中如何快速的判断R/S呢?当最小的基团处在横轴方向上时,其他基团从大到小按顺时针方向旋转,是S,按逆时针时,是R;当最小的基团处在竖轴的方向上时,其他基团从大到小按顺时针方向旋转,是R,按逆时针时,是S.(记忆方法,与立体状态下判断依据相比,竖同横不同。)
例如: ,所以是R构型。
2011年9月18日
例如: 中i双键不算在内,该化合物具有芳香性。
(2)它们具有平面结构,或至少非常接近平面(平面扭转不大于0.1nm);
例如: 不具有芳香性,因为1,2号碳上的氢的排斥力使两个苯环不在同一个平面上
(3)环上的每一个原子必须是sp2杂化(某些情况也可以是sp杂化);
例如: 不具有芳香性,1号碳是sp3杂化,变成 就具有芳香性了。
(4)环上的电子能够发生离域。
按照上面的几点判断,能够解决绝大多数考试题目了,但并不是所以的芳香性判断问题。
二.关于R/S构型的判断
1.立体状态下判断依据:将与手性碳相连的四个基团按顺序排列大小(关于大小次序一般的教材上有,自己查找),将最小的基团放在力离眼睛最远的地方,其他三个基团按由大到小的方向旋转,顺时针的为R,逆时针的为S.(可以这么记忆,顺时针就是箭头向右转,right的首字母是R,相对的,是S。)
芳香性判断

(3)轮烯内部通过单键相连,且单键碳与轮烯共用,单键忽略后,下列物质萘、蒽、菲均有芳香性:
(4)轮烯外部通过单键相连,且单键碳与轮烯共用,单键忽略后,分别计算单键所连的轮烯的芳香性,下列物质均有芳香性:
二、 芳香性具备的一些特点:
1. 较高的C/H比
芳香性化合物多数都有较高的C/H比,而脂肪族化合物绝大多 数的C/H比都较低。
2. 键长趋于平均化
如:X-衍射测定苯的6个C—C键长相等,均为0.139nm,没有单键(0.154nm)和双键(0.134nm)之分。
3. 分子共平面性
组成芳香环的原子都在一个平面或接近一个平面。
(2)环丙烯正离子,环丙烯体系有一个成键轨道和一对反键轨道,环丙烯正离子的2个电子占据成键轨道,其碳-碳键长都是0.140nm,π电子及正电荷离域于三元环共轭体系中。
(3)环丁二烯双正离子, 按照Hückel规则,环丁二烯双正离子应具有芳香性。如下列化合物:
和 R=CH3或C6H5
已被合成。二茂铁[Fe(C5H5)2]是芳香性的环戊二烯负离子的另一特例。二茂铁是π络合物类的金属有机化合物,由两个环戊二烯负离子与亚铁离子构成一种夹心结构,桔红色,熔点173℃。可以用环戊二烯钠与氯化亚铁在四氢呋喃中反应或用环戊二烯在二乙胺存在下直接与亚铁盐反应制备。
对于一些稠环烃也可将之看成轮烯,画经典结构式时,应使尽量多的双键处在轮烯上,处在轮烯内外的双键写成其共振的正负电荷形式,将出现在轮烯内外的单键忽略后,再用Hückel-Platt规则判断。
(1)双键碳处在不与轮烯共用的内部,计算电子时,只计算轮烯上的电子,内部的不记。下面的化合物A和D周边分别有双键6个和5个,如此时判断他们的芳香性就会造成错误。而它们的B和E式分别有双键7个和6个,将内部的双键写成其共振的正负电荷形式C和F后,将出现在轮烯内外的单键忽略后,用Hückel-Platt规则判断得A为芳香性物质,而D不是芳香性物质。
芳香性判断

芳香性:环状闭合共轭体系,π电子高度离域,具有离域能,体系能量低,较稳定.在化学性质上表现为易进行亲电取代反应,不易进行加成反应和氧化反应,这种物理,化学性质称为芳香性. 一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把 n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π电子数分别位 2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π电子数的计算也许你在做题目的时候对于π电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性. 两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,http://206.108.48.51/forumdisplay.php?fid=63。
芳香性与同芳香性

植物精油中的同芳香性
同芳香性是指具有相似或相同芳香特 性的植物精油成分。植物精油是由植 物的特定部位提取的挥发性油状液体, 其中包含了许多具有芳香特性的化合 物。
芳香性判断规则
Hückel规则
对于平面环状分子,如果其π 电子数符合4n+2(n为整数), 则该分子具有芳香性。例如,
苯、吡啶等。
休克尔分子轨道法
通过计算分子轨道的能量和 波函数,判断其是否具有芳 香性。该方法可以用于更复
杂的分子体系。
共振结构法
通过分析分子的共振结构, 判断其是否具有芳香性。共 振结构法可以用于解释一些 不符合Hückel规则的芳香性 分子。
02 同芳香性概念
同芳香性与芳香性的关系
同芳香性是指分子具有相似的电子排布和对称性,从而表现出相似的化学性质。芳香性是指具有环状 闭合共轭体系的分子所特有的稳定性,使其在化学反应中不易发生氧化或加成反应。同芳香性分子具 有相似的电子排布和对称性,因此也表现出芳香性的稳定性特征。
同芳香性与芳香性之间存在密切的联系,同芳香性分子通常也具有芳香性,而芳香性分子则不一定具 有同芳香性。同芳香性有助于解释和理解分子的化学性质和反应行为,对于化学反应的设计和预测 有一定的指导意义。
芳香性与同芳香性的未来研究方向
新型芳香性分子的设计与合成
未来研究将致力于设计和合成新型芳香性分子,以拓展芳香性分子的应用领域。
同芳香性在新能源和环境科学中的应用
随着新能源和环境科学的发展,同芳香性有望在这些领域发挥重要作用,未来的研究将探索其在新能源和环境科 学中的应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同芳香性
• 同芳香性是指共平面,π电子数为4n+2,共面的 原子均为sp2或sp杂化的轮烯上带有不与轮烯共 平面的取代基或桥。如:
H
R
10e 14e
反同芳香性
• 反同芳香性是指共平面,π电子数为4n,共面的 原子均为sp2或sp杂化的轮烯上带有不与轮烯共 平面的取代基或桥。如:
4e
8e
同芳结构的物质得到或失去电子成为4n体系是很 难的,因为要生成更不稳定的反同芳结构。
反芳香性
• 轮烯,共平面,π电子数为4n,共面的原子均为 sp2或sp杂化),它的稳定性小于同类开链烃。如:
稳定性:
>
>
非芳香性
• 非芳香性分子不共平面的多环烯烃或电子 数是奇数的中间体。如环辛四烯、10-轮烯、 14-轮烯等。
HH
H
H HH
3e
5e
•10-轮烯、14-轮烯均是由于内H的位阻使其不能共 平面。将14-轮烯中的一个双键换成三键,由于消 除了两个氢的位阻,而具有芳香性。
10e
6e
6e
14e
O
O
2e
6e
O
O
6e
10e
6e
2e
• ②轮烯内部通过单键相连,且单键碳与轮 烯共用,单键忽略后,下列物质萘、蒽、 菲均有芳香性。
8e
10e
12e
14e
12e
14e
• ③轮烯外部通过单键相连,且单键碳与轮 烯共用,单键忽略后,分别计算单键所连 的轮烯的芳香性,下列物质均有芳香性。
谢谢观看! 2020
芳香性的判断
• 1931年德国化学家休克尔(Hückel)从分子轨道理论 的角度,对环状多烯烃(亦称轮烯)的芳香性提出了如 下规则,即Hückel规则。
• 其要点是:化合物是轮烯,共平面, • 它的π电子数为4n+2 (n为0,1,2,3…,n整数), • 共面的原子均为sp2或sp杂化。
1954年伯朗特(Platt)提出了周边修正法,认为可 以忽略中间的桥键而直接计算外围的电子数,对 Hückel规则进行了完善和补充。
Hückel理论的修正
• 周边修正法 • 一些稠环烃可将之看成轮烯。 • 画经典结构式时,应使尽量多的双键处在轮
烯上,处在轮烯内外的双键写成其共振的正 负电荷形式,将出现在轮烯内外的单键忽略 后,再用Hückel-Platt规则判断芳香性。
14e
AБайду номын сангаас
B
C
12e
D
E
F
14e
G
H
①双键与轮烯直接相连,计算电子数时,将双键写成 其共振的电荷结构,负电荷按2个电子计,正电荷按0 计,内部不计。如下面物质均有芳香性:
