2019届中考化学复习第二编专题7综合探究一物质成分问题探究(三)反应后溶液中溶质成分的探究(精练)课件
中考化学复习专题提高训练《化学反应后物质成分探究专题》

化学反应后物质成分探究专题提高训练【解题策略】1.进行化学反应后物质的成分的探究要先根据题意写出相关的化学方程式2.作出猜想与假设根据化学反应前后元素的种类不变,反应后成分只可能有以下两种情况:(1)只含生成物(2)含有生成物和其中一种反应物(即有一种反应物过量)(3)一般情况下反应物不会共存一、选择题1.向氢氧化钠溶液中不断滴入盐酸,得到如右图的曲线,下列有关判断不正确的是()A.a点时溶液中有氢氧化钠和氯化钠B.a点到b点溶液中盐酸的量不断增大C.b点时,HCl与NaOH恰好完全反应D.b点到c点时,溶液中氯化钠的量不再增加2.形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。
下列说法正确的是( )A.开始时左边溶液呈蓝色,右边溶液呈红色B.开始时左边溶液呈无色,右边溶液呈红色C.充分反应后U形管中溶液可能呈红色D.充分反应后U形管中溶液一定呈无色3.碱石灰是NaOH与CaO的混合物,取一定量露置于空气中部分变质的碱石灰,加水充分搅拌后过滤,所得物质成分可能是选项A B C D 滤液中的溶质 NaOH、Ca(OH)2 NaOH NaOH、Na2CO3Na2CO3滤渣CaCO3、Ca(OH)2Ca(OH)2CaCO3、Ca(OH)2CaCO34.“碱石灰”是CaO和NaOH固体的混合物,是实验室常用的干燥剂。
同学们对一瓶久置的“碱石灰”样品的成分,进行如下实验探究:(1)取“碱石灰”样品,加足量水溶解,过滤,得滤渣和滤液。
(2)取滤液少许与试管中,加足量CaCl2溶液,有白色沉淀生成,再加无色酚酞试液,变红。
下列关于样品成分的分析正确的是( )A.一定含NaOH B.一定含Na2CO3C.一定含NaOH、CaO中的一种或两种D.一定含有CaCO35.将一定质量的铁粉和铜粉的混合物加入AgNO3溶液中,反应结束后过滤,分别向滤液和滤渣中加入稀盐酸,均无明显现象,下列对滤渣和滤液的说明中,不正确的是A.滤渣中一定含有银B.滤液中一定含有Fe元素C.滤渣中可能含有铜D.滤液中一定含有Cu元素6.现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验下列判断正确的是A.无色溶液B的溶质是硝酸钙B.原溶液中的杂质一定是氯化钙C.原溶液中的杂质可能由三种物质组成D.该实验中涉及的基本反应类型不止一种二、填空题1.将稀盐酸,碳酸钠溶液,氢氧化钡溶液倒入同一烧杯中,充分反应后过滤。
2018届中考化学复习第二编专题7综合探究一物质成分问题探究(三)反应后溶液中溶质成分探究练习!

(三)反应后溶液中溶质成分探究,常考分析)考查的知识点:酸碱盐的相关知识,复分解反应,常见离子的鉴别方法。
试题多以酸碱盐溶液反应后混合物中存在哪些溶质为载体,展开物质成分的实验探究。
,策略攻略)1.进行反应后溶液中溶质成分的探究要先根据题意写出相关的化学方程式。
2.作出猜想与假设根据化学反应前后元素的种类不变,反应后溶液中溶质成分只可能有以下两种情况:(1)只含生成物。
(2)含有生成物和其中一种反应物(即有一种反应物过量)。
3.设计实验(1)检验反应后溶液中的溶质成分只需要检验过量的反应物就可以了。
(2)对于反应物的检验有两种情况:①若生成物不会对反应物的检验造成干扰,只需检验反应物即可[检验方法见P1附:常见物质(离子)的检验]。
②若生成物会对反应物的检验造成干扰,先排除干扰,再检验反应物。
,典题精讲)【例】(2016云南中考)某同学在课外阅读中得知:实验室用电石(主要成分CaC2)与水反应制取乙炔(C2H2)反应的方程式为CaC2+2H2O===Ca(OH)2+C2H2↑。
在实验室中该同学把一定量的CaC2加入到Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
【提出问题】滤液中溶质的成分是什么?【猜想与假设】猜想一:NaOH猜想二:NaOH,Ca(OH)2猜想三:NaOH,Na2CO3【设计并实验】实验实验操作实验现象实验结论实验一取少量滤液于试管中,向试管中滴入适量的碳酸钠溶液猜想二不成立实验二另取少量滤液于试管中,向其中加入过量稀盐酸产生气泡猜想成立写出实验二中产生气泡的化学方程式:。
【拓展延伸】①若向Cu(NO3)2溶液中加少量CaC2,充分反应,产生的现象是。
②实验室保存电石应注意。
【解析】根据题意写出相关的化学方程式:CaC2+2H2O===Ca(OH)2+C2H2↑,Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。
再根据实验一中“猜想二不成立”,可推知向滤液中加入碳酸钠之后,观察不到白色沉淀的产生(猜想二中含有氢氧化钙,它会与碳酸钠反应生成碳酸钙白色沉淀);实验二中另取少量滤液于试管中,向其中加入过量稀盐酸,产生气泡,说明溶液中含有碳酸盐,加入盐酸之后会有气泡冒出,从而得出猜想三是正确的结论;由于CaC2可以与水反应生成气体和Ca(OH)2,Ca(OH)2又能与Cu(NO3)2反应生成Cu(OH)2蓝色沉淀,故向硝酸铜溶液中加入碳化钙可观察到溶液中有气泡和蓝色沉淀产生的现象;由于电石会和水反应而变质,所以电石应密封保存。
人教版初中化学复习课:《实验探究反应后溶液中的溶质成分》教学设计

2.教学难点:
(1)如何引导学生从实验现象中提炼出一般性规律,培养学生的逻辑思维和批判性思维。
(2)提高学生的实验操作技能,确保实验过程的安全性和准确性。
(3)培养学生合作交流、共同解决问题的能力。
(二)教学设想
1.针对重点内容的设想:
(2)学生分组讨论,共同分析实验现象,提出解决方案。
(3)各小组汇报讨论成果,其他小组进行评价、补充。
(四)课堂练习
1.教学内容:设计具有梯度性的练习题,让学生巩固所学知识,提高理论联系实际的能力。
2.教学方法:采用自主练习、互评互改等方式,培养学生的自主学习能力和评价能力。
3.教学活动:
(1)教师发放练习题,学生独立完成。
教学设计具体内容如下:
1.导入:通过展示生活中常见的溶液现象,引发学生对溶液中溶质成分的好奇心,为新课的学习做好铺垫。
2.知识讲解:详细讲解溶质、溶剂的概念及其相互关系,为学生后续实验探究打下基础。
3.实验探究:分组进行实验,让学生亲自动手探究反应后溶液中的溶质成分。实验过程中,教师巡回指导,解答学生疑问。
(2)加强实验操作指导,注意个体差异,提高学生的实验技能。同时,强调实验安全意识,确保实验过程的安全性。
(3)采用小组合作模式,让学生在讨论、交流中解决问题,提高学生的合作能力和沟通能力。
3.教学策略:
(1)运用启发式教学,激发学生的思维活力,引导学生主动探究、发现问题。
(2)注重过程评价,关注学生在实验探究、合作交流等方面的表现,鼓励学生积极参与课堂活动。
2.对学生的作业进行评价时,既要关注知识掌握程度,也要关注学生的创新能力、实践操作能力和情感态度。
中考化学二轮复习对反应后溶液中溶质成分的探究课件

实验步骤
实验现象及结论
猜想
实验步骤
实验现象及结论
3、
NaOH和
Na2CO小3 组讨论如何设计实验步骤验证猜想二和三
猜想
2
NaOH 和Ca(OH)2
实验步骤
取反应后溶液加入适量的 酸钠溶液
实验现象及结论
产生白色沉淀,说明反应后 溶液中溶质为NaOH和Ca(OH)2
猜想
3
NaOH和 Na2CO3
实验步骤
对反应后溶液中溶质成分的探究
(科学探究)
学
1. 掌握化学实验探究的基本环节
习
2. 学会用所学的化学基础知识来解决
目
化学实验探究问题。
标
- Learning objectives -
科学探究的基本环节
提出问题→猜想与假设 → 制定计划 → 进行实验 →收集证据 →解释与结论→反思与评价→表达与交流
注意:在分析化学反应后所得物质成分时,除考 虑 生成物外还需考虑反应物是否有剩余。
Thank you Have a rest
没有明显现象
假设 ①成立
(3)根据设计的实验方案,在上述滤液中加入足
量稀盐酸,视察到有大量气泡产生,产生该现象的化 学方程式为Na2CO3+2HCl====2NaCl+CO2↑+H2O 。 因此得出的结论是只有假设 ② 成立,该假设成 立说明实验是 Na2CO3过量 (选填“恰好完全反
应”“Ca(OH)2过量”或“Na2CO3过量”)。
②若剩B: 则为B+生成物
2、验证: 找准对象→对症下药→排除干扰 ①反应本身有明显现象的可互相检验。
3、反思: ②不溶于水的物质不能做为溶质考虑。(如CaCO3)
2024年中考化学复习专题7反应后溶质成分的探究

专题7 反应后溶质成分的探究【解题模型】写出反应的化学方程式:A +B=== C +D↓明确物质的状态,因为是对溶液中溶质成分的探究,故难溶物及气体无需考虑↓根据生成物一定有、反应物中可能有一种过量来思考,一般猜想有三种(假设D 为沉淀或气体或水);①恰好反应:C ①A 过量:A 、C ①B 过量:B 、C↓一定错误的猜想:A 、B 在同一猜想中,因为二者会发生反应,不能共存↓验证猜想时首先确定要检验的物质:C 是生成物、一定存在,无需检验⎩⎪⎨⎪⎧A――→根据性质添加试剂现象――→判断A 是否存在B――→根据性质添加试剂现象――→判断B 是否存在 注:若生成物对反应物的检验造成干扰,则需要先除去生成物,再进行检验例 [一题多设问] 向氯化钙溶液中加入一定量的碳酸钠溶液,探究反应后溶质的成分。
第1步:写出反应的化学方程式。
根据反应原理书写________________________________。
第2步:判断反应物和生成物。
反应物:________、________;生成物:________、________。
第3步:根据是否恰好完全反应,对反应后溶质成分进行猜想。
猜想1:恰好完全反应,溶质为__________。
猜想2:氯化钙溶液过量,溶质为______________。
猜想3:碳酸钠溶液过量,溶质为______________。
第4步:确定需要检验的物质。
生成物一定存在,只需检验反应物即可,比较猜想1、2、3的差异,确定需要检验的物质是________、________。
第5步:设计方案检验待检验物。
待检验物质待检验离子检验试剂现象结论①________①________①________(写一种)①_____________________________猜想2正确①________①________①________(写一种)①_____________________________猜想3正确若在检验这两种物质时,均无明显现象,说明①__________正确。
2021年中考化学(3)反应后溶液中溶质成分探究精讲

2021年中考化学(3)反应后溶液中溶质成分探究精讲(三)反应后溶液中溶质成分探究,常考分析)考查的知识点:酸碱盐的相关知识,复分解反应,常见离子的鉴别方法。
试题多以酸碱盐溶液反应后混合物中存在哪些溶质为载体,展开物质成分的实验探究。
,策略攻略)1.进行反应后溶液中溶质成分的探究要先根据题意写出相关的化学方程式。
2.作出猜想与假设根据化学反应前后元素的种类不变,反应后溶液中溶质成分只可能有以下两种情况:(1)只含生成物。
(2)含有生成物和其中一种反应物(即有一种反应物过量)。
3.设计实验(1)检验反应后溶液中的溶质成分只需要检验过量的反应物就可以了。
(2)对于反应物的检验有两种情况:①若生成物不会对反应物的检验造成干扰,只需检验反应物即可[检验方法见P1附:常见物质(离子)的检验]。
②若生成物会对反应物的检验造成干扰,先排除干扰,再检验反应物。
,典题精讲)【例】(2021云南中考)某同学在课外阅读中得知:实验室用电石(主要成分CaC2)与水反应制取乙炔(C2H2)反应的方程式为CaC2+2H2O===Ca(OH)2+C2H2↑。
在实验室中该同学把一定量的CaC2加入到Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
【提出问题】滤液中溶质的成分是什么?【猜想与假设】猜想一:NaOH 猜想二:NaOH,Ca(OH)2 猜想三:NaOH,Na2CO3 【设计并实验】实验实验一科网][来源学实验二科网ZXXK][来源学实验操作取少量滤液于试管中,向试管中滴入适量的碳酸钠溶液另取少量滤液于试管中,向其中加入过量稀盐酸实验现象实验结论猜想二不成立产生气泡猜想成立写出实验二中产生气泡的化学方程式:。
【拓展延伸】[来源:]①若向Cu(NO3)2溶液中加少量CaC2,充分反应,产生的现象是。
②实验室保存电石应注意。
【解析】根据题意写出相关的化学方程式:CaC2+2H2O===Ca(OH)2+C2H2↑,Na2CO3+Ca(OH),可推知向滤液中加入碳酸钠之后,观察不到白色沉淀2===CaCO3↓+2NaOH。
2019年中考化学专题复习:反应后物质成分的探究(共18张PPT)

硫酸铜 溶液
酚酞
反应后
的溶液
反应后 的溶液
检验溶液中是否有过量的氢氧化钠
则成分为: NaCl 、NaOH
硫酸铜 溶液
酚酞
反应后
的溶液
反应后
的溶液
继续设计实验,探究上述试管中的溶 液是否恰好完全中和?
检验溶液中是否有过量的盐酸
步骤
现象
结论
恰好完全中和
( NaCl)
★ ★
取少量反应后溶 液于试管中, 若溶液仍为紫色 加几滴石蕊试液 若溶液由紫变红
Ca(OH)2 + Na2CO3 = CaCO3 + 2NaOH
猜想反应后的溶质为(写出所有可能的 组成) 。
NaOH;NaOH和Ca(OH)2; NaOH和Na2CO3
Ca(OH)2 + Na2CO3 = CaCO3 + 2NaOH 1、NaOH 2、NaOH 和 Ca(OH)2 3、NaOH 和 Na2CO3
检验是否含有 在滤液中滴加酚酞试 溶液变红色 _________ NaOH 液
NaOH
Thank You!
(1)先向广口瓶中加入一定量盐酸溶液至固体恰好全部 溶解为止,关闭活塞,振荡,观察到气球变大。然后 再将一定量氢氧化钠溶液加入广口瓶中,关闭活塞, 振荡,发现气球明显变小,同时在广口瓶中还能观察 有白色沉淀生成 到的现象是__________ .
(2)实验结束后,同学们对广口瓶中的溶液进行探究。 提出问题:广口瓶中的溶液含有哪些溶质? 交流讨论:经过大家对广口瓶中所发生的反应进行分 析,认为瓶内一定含有的一种溶质是(填化学式,下同)_ NaCl _______. 小明取广口瓶内溶液少量于试管中,向其中加入过量稀 盐酸,发现有气泡产生。由此得出结论:广口瓶溶液中 Na2CO3 还含有的溶质是_________. 小红认为,可能还存在BaCl2,大家一致认为小红的结论 BaCl2和Na2CO3不共存 是错误的,理由是_____________________. 后经大家 讨论,达成共识:广口瓶溶液中还可能存在NaOH.
中考化学反应后溶液成份的探究(试题+答案+解析)
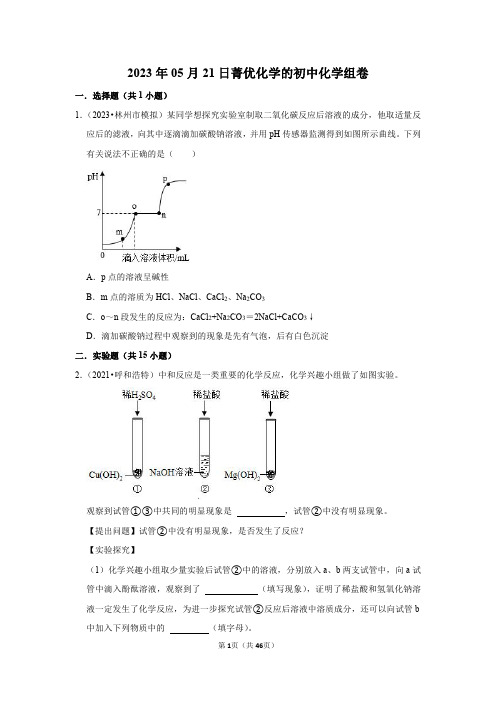
2023年05月21日菁优化学的初中化学组卷一.选择题(共1小题)1.(2023•林州市模拟)某同学想探究实验室制取二氧化碳反应后溶液的成分,他取适量反应后的滤液,向其中逐滴滴加碳酸钠溶液,并用pH传感器监测得到如图所示曲线。
下列有关说法不正确的是()A.p点的溶液呈碱性B.m点的溶质为HCl、NaCl、CaCl2、Na2CO3C.o~n段发生的反应为:CaCl2+Na2CO3=2NaCl+CaCO3↓D.滴加碳酸钠过程中观察到的现象是先有气泡,后有白色沉淀二.实验题(共15小题)2.(2021•呼和浩特)中和反应是一类重要的化学反应,化学兴趣小组做了如图实验。
观察到试管①③中共同的明显现象是,试管②中没有明显现象。
【提出问题】试管②中没有明显现象,是否发生了反应?【实验探究】(1)化学兴趣小组取少量实验后试管②中的溶液,分别放入a、b两支试管中,向a试管中滴入酚酞溶液,观察到了(填写现象),证明了稀盐酸和氢氧化钠溶液一定发生了化学反应,为进一步探究试管②反应后溶液中溶质成分,还可以向试管b 中加入下列物质中的(填字母)。
A.ZnB.Fe(OH)3C.FeCl3D.AgNO3(2)化学兴趣小组又利用pH传感器探究稀盐酸和氢氧化钠溶液的反应过程。
实验操作和测定结果如图所示:①该实验中,乙溶液是;②加入甲溶液6mL时,烧瓶中的溶液溶质成分(填化学式);③根据该实验测定结果,判断发生化学反应的依据是。
3.(2016•金昌)某班同学用氢氧化钠溶液和稀盐酸进行中和反应实验。
(1)甲同学在烧杯中加入约15mL氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈色。
接着用滴管滴入一定量的稀盐酸,再用玻璃棒搅拌,发现溶液变为无色,反应的化学方程式为。
(2)甲、乙、丙同学对反应后溶液中的溶质成分进行探究。
【猜想与假设】反应后溶液中的溶质是什么?猜想一:只有NaCl猜想二:猜想三:有NaCl和NaOH上猜想中,直接可以排除的是,理由。
