高考化学专项攻关高分秘籍 专题03 氧化还原反应学案
备战2019年高考化学专项攻关高分秘籍 专题03 氧化还原反应学案

专题03 氧化还原反应【考纲要求】1.了解氧化还原反应的本质。
2.了解常见的氧化还原反应。
3.掌握常见氧化还原反应的配平和相关计算【考情分析】(1)氧化还原反应是全国卷每年的必考内容,但单独命题的概率较低,常分散在选择题的某个选项或非选择题的某些设问中,选择题往往与阿伏加德罗常数或化学计算相结合命题,非选择题则可能与基本理论、元素化合物、化学实验及工艺流程相结合命题,分值一般为4~6分。
(2)从考查的内容上来看,物质氧化性、还原性强弱的比较在元素周期律题目中是命题热点;氧化还原反应中电子转移数目的计算在N A题目中是命题热点;氧化还原反应方程式的书写与计算是必考内容,尤其是陌生反应方程式的书写,近年来“常考不衰”。
有关氧化还原概念的题目,考查考生对氧化还原模型的认知能力。
电子转移数目的计算题目,其实质是考查考生的化合价分析能力、依据化学方程式计算的能力,能较好地考查考生“宏观辨识与微观探析”素养。
考点1 氧化还原反应中的基本概念1.氧化还原反应的本质和特征本质:电子的转移(得失或偏移)特征:化合价变化2.氧化还原反应中基本概念之间的联系3.氧化还原反应与四种基本反应类型的关系注意:1.有单质参加或生成的化学反应,不一定是氧化还原反应。
如3O2 =2O3。
2.氧化性和还原性的强、弱不取决于得失电子的多少,如还原性强弱:Na>Mg>Al;失电子数:Na<Mg<Al。
4.氧化还原反应中电子转移的方向和数目的表示方法(1)双线桥法双线桥法表示同一种元素原子在反应前后电子变化的情况,双线桥法的基本表示形式如下:其中n表示得失电子的数目。
(2)单线桥法单线桥法表示反应物中同种元素原子或不同种元素原子之间的电子转移情况,这种方法表示出了电子转移的方向和数目。
其基本表示形式如下:考点2 常见的氧化剂与还原剂1.常见的氧化剂22.常见的还原剂【高考链接】全国卷对本专题的考查主要集中在以下几个方面:1.氧化还原反应的概念、电子转移数目的计算等;2.氧3化还原反应方程式的配平、书写;3.陌生物质参与的氧化还原反应方程式的书写和配平。
高三化学专题复习《氧化还原反应》教案

氧化—还原反应专题教案
【教学目标】
知识与技能
1.理解氧化和还原、氧化性和还原性、氧化剂和还原剂、氧化产物和还原产物等概念。
能判断氧化还原反应中物质的氧化性、还原性的强弱和电子转移方向和数目。
能应用氧化还原反应中电子得失规律解决一些化学问题。
2.能配平常见的氧化还原反应方程式(包括常规配平、缺项配平、离子方程式配平、简
单的有机反应配平等)。
3.掌握化合、分解、置换、复分解等四种基本化学反应类型,并能进行判断分析。
氧化还原反应是高考每年必考的内容,从考查试题类型来说可以是氧化还原概念的应用、
氧化还原方程式的配平和书写或有关氧化还原的化学计算等等。
近几年有深化加难的趋势。
过程与方法:
通过氧化还原方程式配平的学习,提高知识的综合迁移能力;
情感态度与价值观:
(1)通过一般氧化还原反应方程式、特殊的氧化还原反应方程式的配平,理解事物的一
般性和特殊性,加深具体情况具体分析的思想观念。
(2)通过一些配平技巧、配平的规律的学习,培养学生创造和发现化学学科的科学美、
规律美,从中提高学习化学的兴趣。
【重点和难点】
重点:使学生掌握用化合价升降法配平氧化还原反应方程式的原则和步骤。
难点:氧化还原反应方程式配平的技巧,熟练掌握氧化还原反应方程式配平。
教学中主要通过学生的练习来发现问题、让学生自己总结发现配平的规律,提高氧化还
原反应方程式配平的能力。
教学方法和过程
一、氧化—还原反应概念。
氧化还原反应专题复习学案

氧化还原反应专题复习学案一、认识氧化还原反应1.从化合价变化的角度认识氧化还原反应(1)氧化反应:物质所含元素化合价________的反应。
(2)还原反应:物质所含元素化合价________的反应。
(3)氧化还原反应:物质所含元素的化合价有________的反应。
2.从电子转移的角度认识氧化还原反应(1)氧化反应:物质________(或偏离)电子的反应。
(2)还原反应:物质________(或偏向)电子的反应。
(3)氧化还原反应:有电子________(得失或偏移)的反应。
3.氧化还原反应的特征和实质(1)氧化还原反应的特征:元素的__________的升降。
也是判断一个反应是不是氧化还原反应的依据。
(2)氧化还原反应的实质:____________(电子得失或共用电子对偏移)。
典型例题:下列反应中属于氧化还原反应的是()①2KMnO4错误!K2MnO4+MnO2+O2↑②H2SO4+BaCl2===BaSO4↓+2HCl③Zn+2HCl===ZnCl2+H2↑④Cu2(OH)2CO3错误!2CuO+CO2↑+H2O A.①②B.②④C.①③③④练习:下列反应属于非氧化还原反应的是()A.Fe2O3+3CO错误!2Fe+3CO2B.NH4NO3错误!N2O↑+2H2OC.2NaHCO3错误!Na2CO3+CO2↑+H2OD.CuO+CO===Cu+CO2二、氧化还原反应的相关概念1.反应类型氧化反应:物质所含元素化合价________的反应还原反应:物质所含元素化合价________的反应2.反应物氧化剂:在反应中________电子(或电子对________)的物质还原剂:在反应中________电子(或电子对________)的物质3.生成物氧化产物:________反应得到的产物还原产物:________反应得到的产物4.物质性质氧化性:氧化剂所表现出的________电子(或电子对________)的性质还原性:还原剂所表现出的________电子(或电子对________)的性质典型例题:分析下列氧化还原反应,指出氧化剂和还原剂、氧化产物和还原产物。
氧化还原导学案3

高一化学HX—14—01—012《氧化还原反应3》导学案编写:审核:编写时间:【学习目标】1.进一步理解氧化还原反应的本质,能运用化合价升降关系对氧化还原反应进行配平,掌握基本的配平技巧和方法。
2.能确定氧化剂与还原剂、氧化产物和还原产物、被氧化和被还原的物质的量之比或质量比,确定反应中电子转移数。
【学法指导】教师通过讲解实例,揭示配平的原则和步骤,总结关键技巧。
【学习过程】一、课堂导入1. 氧化还原反应中氧化剂得电子总数=还原剂失电子总数2. 氧化还原反应中,转移的电子数=失电子总数=得电子总数二、拓展学习(一)氧化还原反应的配平及相关计算1. 氧化还原反应的配平1)依据:原子守恒化合价升、降总数相等氧化剂中得电子总数=还原剂失电子总数2)配平步骤:标变价——标出变价元素的化合价。
列变化——用线桥指明化合价的变化情况。
求总数——判断化合价升高数、降低数的最小公倍数。
配系数——对变价元素配相应的系数,使化合价升降总数相等,并用观察法配平其他原子的系数,使原子守恒。
例题解析:CuO + NH3------N2+ Cu + H2O(二)合作探究1.配平下列化学方程式NH3 + O2——NO + H2O Fe2O3 + CO ——Fe+ CO2Al+ HCl ——AlCl3 + H2 KClO3——KCl + O2C + HNO3(浓)——NO2 + CO2 + H2O Cu+ HNO3(浓)-- Cu(NO3)2 + NO 2+ H2OCl2 + KOH——KCl + KClO + H2O S +KOH ——K2S + K2SO3 +H2ONH3 + NO --- N2 + H2O Na2S+ Na2SO3+ HCl——S+ Na Cl + H2OKClO3 + HCl——KCl+ Cl2+ H2O CuO + NH3——Cu+ N2+ H2O2.有关氧化还原反应的计算以上反应中氧化剂与还原剂的物质的量之比进行提问。
(整理)高考化学氧化还原反应专题教案
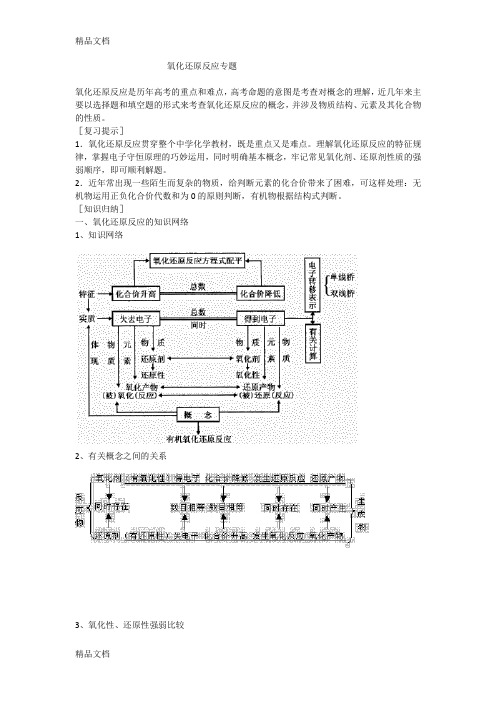
氧化还原反应专题氧化还原反应是历年高考的重点和难点,高考命题的意图是考查对概念的理解,近几年来主要以选择题和填空题的形式来考查氧化还原反应的概念,并涉及物质结构、元素及其化合物的性质。
[复习提示]1.氧化还原反应贯穿整个中学化学教材,既是重点又是难点。
理解氧化还原反应的特征规律,掌握电子守恒原理的巧妙运用,同时明确基本概念,牢记常见氧化剂、还原剂性质的强弱顺序,即可顺利解题。
2.近年常出现一些陌生而复杂的物质,给判断元素的化合价带来了困难,可这样处理:无机物运用正负化合价代数和为0的原则判断,有机物根据结构式判断。
[知识归纳]一、氧化还原反应的知识网络1、知识网络2、有关概念之间的关系3、氧化性、还原性强弱比较4、常见的氧化剂和还原剂强氧化剂:KMnO4,K2Cr2O7,浓H2SO4,HNO3,Ca(ClO)2,H2O2,Na2O2,Cl2,Br2,O2等。
强还原剂:活泼金属如Na,Mg,Al等,H2S,S2—,SO2,SO32—,H2SO3,I—,HI,Fe2+等。
二、氧化还原反应方程式的配平及计算1.氧化还原方程式的配平原则(1)电子得失守恒:反应中还原剂失去电子总数(化合价升高总值)与氧化剂得到的电子总数(化合价降低总值)相等。
(2)质量守恒:反应前后元素的种类相同,各元素的原子个数相等。
2.氧化还原方程式的配平步骤一标:标明反应前后化合价有变化的元素前后化合价。
二等:通过求最小公倍数使化合阶升与降总值相等。
三定:确定氧化剂与还原剂的化学计量数。
方法是:氧化剂(还原剂)化学计量数=四平:用观察法配平其他物质的化学计量数。
五查:检查质量与电荷是否分别守恒。
3.氧化还原反应的有关计算其原理是:氧化剂得到的电子总数等于还原剂失去的电子总数。
[例题分析]一、判断概念[例1] 已知化学方程式CaCO3十2HCN=CaCN2十CO↑十H2↑十CO2↑,在反应中()A.氢元素被氧化,碳元素被还原B.HCN既是氧化剂又是还原剂C.CaCN2是氧化产物.H2为还原产物D.CO为氧化产物,H为还原产物解析:本题考查氧化还原反应的有关概念。
高考化学氧化还原反应专题教案

高考化学氧化还原反应专题教案第一章:氧化还原反应基本概念1.1 氧化还原反应的定义1.2 氧化还原反应的特征1.3 氧化还原反应的实质1.4 氧化还原反应的分类第二章:氧化还原反应的电子转移2.1 电子转移的类型2.2 电子转移的表示方法2.3 电子转移的规律2.4 电子转移与化合价变化的关系第三章:氧化还原反应的计算3.1 氧化还原反应计算的基本方法3.2 氧化还原反应计算的步骤3.3 氧化还原反应计算的注意事项3.4 氧化还原反应计算的实例分析第四章:氧化还原反应与四种基本反应类型的关系4.1 氧化还原反应与化合反应的关系4.2 氧化还原反应与分解反应的关系4.3 氧化还原反应与置换反应的关系4.4 氧化还原反应与复分解反应的关系第五章:氧化还原反应的应用5.1 氧化还原反应在工业上的应用5.2 氧化还原反应在生活中的应用5.3 氧化还原反应在农业生产中的应用5.4 氧化还原反应在其他领域的应用第六章:氧化还原反应的配平6.1 配平氧化还原反应的概念6.2 配平氧化还原反应的方法6.3 配平氧化还原反应的步骤6.4 配平氧化还原反应的实例分析第七章:氧化还原反应中的还原剂和氧化剂7.1 还原剂和氧化剂的定义7.2 还原剂和氧化剂的性质7.3 还原剂和氧化剂的判断7.4 还原剂和氧化剂在氧化还原反应中的作用第八章:氧化还原反应中的氧化数变化8.1 氧化数的概念8.2 氧化数的判断与计算8.3 氧化数变化的规律8.4 氧化数变化在氧化还原反应中的应用第九章:氧化还原反应的实验操作与观察9.1 氧化还原反应实验的基本操作9.2 氧化还原反应实验中常见的问题及解决方法9.3 氧化还原反应实验的现象观察与分析9.4 氧化还原反应实验的实例操作第十章:氧化还原反应在高考化学题中的应用10.1 高考化学中氧化还原反应题型的特点10.2 高考化学中氧化还原反应题型的解题策略10.3 高考化学中氧化还原反应题型的练习方法10.4 高考化学中氧化还原反应题型的实例分析重点和难点解析一、氧化还原反应基本概念:理解氧化还原反应的定义、特征、实质和分类是理解整个专题的基础,需要重点关注。
氧化还原反应专题学案

判断:有单质参加的反应一定是氧化还原反应()有单质生成的反应一定是氧化还原反应( )专题一 氧化还原反应一、基本知识点实质:________________________特征:________________________组成:氧化反应:元素化合价________的反应(元素_____氧化的反应)还原反应:元素化合价________的反应(元素_____还原的反应)氧化反应 + 还原反应 = 氧化还原反应反应的结构:1.双线桥:2.单线桥二、氧化还原反应的规律及其应用1.性质强弱的规律氧化性强弱:氧化剂>氧化产物 在“氧化剂+还原剂 → 还原产物+氧化产物”中, 还原性强弱:还原剂>还原产物+ne —2.守恒规律化合价有升必有降,电子有得必有失。
对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数(或共用电子对偏离)与得电子总数(或共用电子对偏向)相等。
3.价态表现性质的规律元素处于最高价,只有_________; ___________ 元素处于最低价,只有_________; ___________ 元素处于中间价态,既有氧化性又有还原性,(但主要呈现一种性质,e.g.___________)。
物质若含有多种元素,其性质是这些元素性质的综合体现。
4.同种元素反应化合价转化规律氧化还原反应中,以元素相邻价态间的转化最容易;同种元素相邻价态间不发生氧化还原反应。
e.g.________________歧化反应:____________________________;归中反应:同种元素不同价态反应时,化合价向中间靠拢。
同种元素不同价态之间的反应,化合价的变化遵循“只靠拢,不交叉”(即_________);5. 反应先后的一般规律在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中还原性最______的还原剂作用。
反之同理。
说明:越易失电子的物质,失后就越难得电子;越易得电子的物质,得后就越难失电子。
高考化学复习 氧化还原反应学案1

高考化学复习氧化还原反应学案1【考纲要求】1、理解氧化还原反应,会从氧化还原反应的角度分析反应类型;2、能判断氧化还原反应中的氧化剂和还原剂、氧化产物和还原产物;3、应用化合价变化和电子转移的观点分析判断电子转移的方向和数目;4、掌握重要的氧化剂、还原剂之间的常见反应,比较物质氧化性或还原性的强弱。
【知识梳理】一、氧化还原反应的概念1、氧化剂和还原剂概念:氧化剂在氧化还原反应中,所含的某种元素的化合价()的反应物还原剂在氧化还原反应中,所含的某种元素的化合价()的反应物如:在H2 +Cl22HCl反应中,是氧化剂,具有氧化性性,氯元素被还原;是还原剂,具有还原性性,氢元素被氧化电子转移的表示方法双线桥法:得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。
整理归纳单线桥法:只在反应物中标注,从失电子的元素指向得电子的元素,并注明转移的电子数。
注意:(1)某元素得到(或失去)一个电子,化合价就降低(或升高)一个单位。
(2)失电子数=得电子数=转移的电子数例1、亚氨基锂(Li2NH)是一种储氢容量高的安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。
下列有关说法正确的是()A、Li2NH中N的化合价是-1B、该反应中H2既是氧化剂又是还原剂C、Li+和H+的离子半径相等D、此法储氢和钢瓶储氢的原理相同例2、氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。
在一定条件下,AlN可通过反应Al2O3+N2+3C2AlN+3CO合成。
下列叙述正确的是()A、上述反应中,N2是还原剂,Al2O3是氧化剂B、上述反应中,每生成1molAlN需转移3mol电子C、AlN中氮元素的化合价为+3D、AlN的摩尔质量为41g【针对训练】(1)氯化碘(ICl)的性质类似卤素,有很强的化学活动性。
ICl跟Zn、H2O的反应如下:①2ICl+2Zn=ZnCl2+ZnI2②ICl+H2O=HCl+HIO 下列叙述中正确的是()A、在反应①中,ZnI2只是氧化产物B、在反应①中,ZnCl2既是氧化产物又是还原产物C、在反应②中,ICl既是氧化剂又是还原剂D、在反应②中,ICl既不是氧化剂,又不是还原剂(2)重铬酸铵[(NH4)2Cr2O7]受热分解的反应为氧化还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题03 氧化还原反应【考纲要求】1.了解氧化还原反应的本质。
2.了解常见的氧化还原反应。
3.掌握常见氧化还原反应的配平和相关计算【考情分析】(1)氧化还原反应是全国卷每年的必考内容,但单独命题的概率较低,常分散在选择题的某个选项或非选择题的某些设问中,选择题往往与阿伏加德罗常数或化学计算相结合命题,非选择题则可能与基本理论、元素化合物、化学实验及工艺流程相结合命题,分值一般为4~6分。
(2)从考查的内容上来看,物质氧化性、还原性强弱的比较在元素周期律题目中是命题热点;氧化还原反应中电子转移数目的计算在N A题目中是命题热点;氧化还原反应方程式的书写与计算是必考内容,尤其是陌生反应方程式的书写,近年来“常考不衰”。
有关氧化还原概念的题目,考查考生对氧化还原模型的认知能力。
电子转移数目的计算题目,其实质是考查考生的化合价分析能力、依据化学方程式计算的能力,能较好地考查考生“宏观辨识与微观探析”素养。
考点1 氧化还原反应中的基本概念1.氧化还原反应的本质和特征本质:电子的转移(得失或偏移)特征:化合价变化2.氧化还原反应中基本概念之间的联系3.氧化还原反应与四种基本反应类型的关系注意:1.有单质参加或生成的化学反应,不一定是氧化还原反应。
如3O2 =2O3。
2.氧化性和还原性的强、弱不取决于得失电子的多少,如还原性强弱:Na>Mg>Al;失电子数:Na<Mg<Al。
4.氧化还原反应中电子转移的方向和数目的表示方法(1)双线桥法双线桥法表示同一种元素原子在反应前后电子变化的情况,双线桥法的基本表示形式如下:其中n表示得失电子的数目。
(2)单线桥法单线桥法表示反应物中同种元素原子或不同种元素原子之间的电子转移情况,这种方法表示出了电子转移的方向和数目。
其基本表示形式如下:考点2 常见的氧化剂与还原剂1.常见的氧化剂物质类别常见的氧化剂对应的还原产物活泼非金属单质Cl2、Br2Cl-、Br-O2、O3变价元素处于高价态的化合物或离子某些氧化物MnO2Mn2+ H+稀硫酸、盐酸、醋酸H2氧化性酸HNO3NO或NO2浓硫酸SO2HClO Cl-盐Fe3+Fe2+KMnO4Mn2+过氧化物H2O2、Na2O2高考关注的氧化剂PbO2、高铁酸盐(如K2FeO4)、重铬酸钾(K2Cr2O7)、LiCoO2、NO22.常见的还原剂物质类别常见的还原剂对应的氧化产物活泼金属单质Na、Al、Zn、Fe Na+、Al3+、Zn2+、Fe2+或Fe3+某些非金属单质H2、C、S H+、CO或CO2、SO2变价元素处于较低价态的化合物或离子氧化物CO CO2SO2SO3或SO42-氢化物NH3NOH2S S离子SO32- SO42-Fe2+Fe3+I-、Br-I2、Br2过氧化物H2O2、Na2O2O2高考关注的还原剂Mg、Sn、HI、Na2S、N2、S【高考链接】全国卷对本专题的考查主要集中在以下几个方面:1.氧化还原反应的概念、电子转移数目的计算等;2.氧化还原反应方程式的配平、书写;3.陌生物质参与的氧化还原反应方程式的书写和配平。
例1:[高考组合题]根据要求回答下列问题:(1)[2016全国卷Ⅲ,28(2),2分]“氧化”中欲使3 mol的VO2+变成VO2+,则需要氧化剂KClO3至少为mol。
(2)[2015新课标全国卷Ⅰ,28(1),2分]大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2。
该反应的还原产物为。
(3)[2015新课标全国卷Ⅱ,28(1),1分]工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为。
【答案】(1)0.5 (2)MnSO4(或Mn2+) (3)2∶1例2:(1)[2017全国卷Ⅲ,27(1)节选,2分]FeO·Cr2O3+Na2CO3+NaNO3 =Na2CrO4+Fe2O3+CO2+NaNO2,反应配平后FeO·Cr2O3与NaNO3的系数比为:。
(2)[2017全国卷Ⅰ,27(6)改编]写出高温煅烧中由FePO4、Li2CO3、H2C2O4制备LiFePO4的化学方程式。
(3)[2014新课标全国卷Ⅱ,27(2)(3)节选,3分]①PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为。
②PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为。
【答案】(1)2∶7 (2)2FePO4+Li2CO3+H2C2O4=2LiFePO4+3CO2↑+H2O↑(3)①PbO2+4HCl(浓) =PbCl2+Cl2↑+2H2O②PbO+ClO- =PbO2+Cl-【解析】(1)1 mol FeO·Cr2O3参与反应共失去7 mol电子,而1 mol NaNO3参与反应得到2 mol电子,根据得失电子守恒,二者的系数比为2∶7。
(2)H2C2O4中碳元素为+3价,高温煅烧过程中铁元素的化合价降低,碳元素的化合价升高,有CO2生成,则反应方程式为2FePO4+Li2CO3+H2C2O4=2LiFePO4+3CO2↑+H2O↑。
(3)①由题意知,生成的黄绿色气体应为氯气,氯元素化合价升高,则铅元素化合价降低,所以反应的化学方程式为PbO2+4HCl(浓) =PbCl2+Cl2↑+2H2O。
②由题意知,PbO作还原剂,NaClO作氧化剂,反应的离子方程式为PbO+ClO- =PbO2+Cl-。
氧化还原反应的“三大”基本规律1、守恒规律电子守恒、质量守恒、电荷守恒2、转化规律(1)价态归中规律含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价中间价”,而不会出现交叉现象,简记为“两相靠,不相交”。
(2)歧化反应规律具有多种价态的元素(如氯、硫、氮和磷元素等)组成的物质可发生歧化反应,即“中间价高价+低价”3.强者优先规律(1)同时含有几种还原剂时,加入氧化剂将按照还原性由强到弱的顺序依次反应。
如:在FeBr2溶液中通入少量Cl2时,因为还原性Fe2+>Br-,所以Fe2+先与Cl2反应。
(2)同时含有几种氧化剂时,加入还原将按照氧化性由强到弱的顺序依次反应。
如在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后依次与Cu2+、H+反应。
例3:已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH- =2RO4n-+3Cl-+5H2O,则RO4n-中R的化合价是()A.+3B.+4C.+5D.+6【答案】D例4:今有下列三个氧化还原反应:2FeCl3+2KI =2FeCl2+2KCl+I22FeCl2+Cl2 =2FeCl32KMnO4+16HCl =2KCl+2MnCl2+5Cl2↑+8H2O若某溶液中含有Fe2+、Cl-和I-,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是A.Cl2B.KMnO4C.FeCl3D.HCl【答案】C【解析】由题给三个氧化还原反应可推知,氧化性:KMnO4>Cl2>FeCl3>I2,还原性:I->Fe2+>Cl->Mn2+。
加入氧化剂反应,反应过程分别为Cl2氧化I-生成I2 ,Cl2过量将氧化Fe2+;KMnO4氧化I-生成I2 ,KMnO4过量将氧化Fe2+、Cl-;Fe3+氧化I-生成I2 ,Fe3+只氧化I-不能氧化Fe2+。
【综合检测】新型纳米材料MFe2O x(3<x<4)中,M表示+2价的金属元素,在反应中化合价不发生变化。
常温下,MFe2O x 能使工业废气中的SO2转化为S,转化过程表示如下:则下列判断正确的是A.MFe2O x是还原剂B.氧化性:MFe2O x> SO2C.x>yD.SO2是该反应的催化剂【答案】A2.工业上生产MnO2和Zn的主要反应有:①MnO 2+ZnS+2H2SO4MnSO4+ZnSO4+S+2H2O②MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4下列说法不正确的是A.①中MnO2和H2SO4都是氧化剂B.①中析出16 g S时转移1 mol电子C.②中MnSO4发生氧化反应D.硫酸在该生产中可循环利用【答案】A【解析】反应①中MnO2→MnSO4,Mn元素化合价降低,MnSO4为氧化剂,②中MnSO4→MnO2,Mn 元素化合价升高,为氧化剂,A项错误;①中析出16gS即0.5mol,转移2×0.5mol=1mol电子,B项正确;②中MnSO4→MnO2,Mn元素化合价升高,被氧化,发生氧化反应,C项正确;反应①消耗硫酸,反应②生成硫酸,硫酸可循环利用,D项正确。
3.一定条件下硝酸铵受热分解的化学方程式为:5NH 4NO3 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为A.5∶3B.5∶4C.1∶1D.3∶5【答案】A4.下列化工生产过程中,未涉及氧化还原反应的是A.侯式制碱法制纯碱B.海带提碘C.电解饱和食盐水制烧碱D.工业上合成氨【答案】A【解析】侯氏制碱法没有化合价变化,未涉及氧化还原反应,A项正确;海带提碘时,碘元素从化合态变为游离态,涉及氧化还原反应,B项错误;电解饱和食盐水制备烧碱时,有氢气和氯气两种单质生成,有化合价变化,C项错误;工业上合成氨是氢气与氮气单质反应生成化合物氨气,有化合价变化,D项错误。
5.工业上可通过反应2Al2O3+3C+6Cl24AlCl3+3CO2制取无水氯化铝,下列有关该反应的说法正确的是A.Cl2是氧化剂B.Al2O3还原剂C.发生还原反应D.氧原子得到电子【答案】A【解析】Al2O3+3C+6Cl24AlCl3+3CO2反应中C元素的化合价从0价升高为+4价,Cl元素的化合价从0价降低为-1价;反应中Cl元素的化合价降低,被还原,则氯气为氧化剂,A项正确;Al2O3中铝元素和O元素的化合价都没有变,所以氧化铝既不是氧化剂又不是还原剂,B项错误;Al2O3+3C+6Cl24AlCl3+3CO2反应中C元素的化合价从0价升高为+4价,Cl元素的化合价从0价降低为-1价,所以既发生了氧化,又发生了还原,C项错误;在该反应中O元素的化合价没有变,氧原子既没有到电子也没有失去电子,D项错误。
6.已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气.测得产物中NO2与O2的体积比为5:1(同温同压下测得),试分析该硝酸盐分解时金属化合价的变化情况是A.升高B.降低C.不变D.不能确定【答案】A7.氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。
