重要的酸碱盐 (2)
高三化学酸碱盐的知识点

高三化学酸碱盐的知识点酸碱盐是高中化学中非常重要的知识点之一,它是化学反应中常见的物质。
在本文中,我们将重点讨论高三化学中酸碱盐的基本概念、性质以及其在生活中的应用。
1. 酸的定义和特性酸是指在水溶液中能够产生氢离子(H+)的化合物。
酸具有以下几个特性:(1)酸味:许多酸都有酸味,如柠檬汁和醋。
(2)蓝色石蕊试纸变红:将蓝色的石蕊试纸浸入酸溶液中,试纸会变红。
(3)与碱中和生成盐和水:酸和碱反应会生成盐和水,这个过程称为酸碱中和反应。
2. 碱的定义和特性碱是指能够在水溶液中产生氢氧化物离子(OH-)的化合物。
碱具有以下几个特性:(1)苦味:许多碱都有苦味,如苦苣碱。
(2)红色石蕊试纸变蓝:将红色的石蕊试纸浸入碱溶液中,试纸会变蓝。
(3)与酸中和生成盐和水:碱和酸反应会生成盐和水。
3. 酸碱盐的性质和常用实验室指示剂(1)酸的性质:酸具有酸味、蓝色石蕊试纸变红等。
(2)碱的性质:碱具有苦味、红色石蕊试纸变蓝等。
(3)盐的性质:盐是酸和碱中和反应的产物,具有晶体结构、无味、不导电等性质。
(4)常用实验室指示剂:- 蓝石蕊试纸:用于检验溶液是否呈酸性。
- 红石蕊试纸:用于检验溶液是否呈碱性。
- 酚酞指示剂:用于酸碱中和反应的滴定实验,由红色变为无色。
- 甲基橙指示剂:用于酸碱中和反应的滴定实验,由红色变为黄色。
4. 酸碱中和反应及其应用酸碱中和反应是酸和碱反应生成盐和水的过程。
酸碱中和反应在生活中有很多应用,如:(1)草酸与氢氧化钠的中和反应:草酸与氢氧化钠反应生成草酸钠和水,草酸钠可用作草酸清洗剂。
(2)盐酸与氢氧化钠的中和反应:盐酸与氢氧化钠反应生成氯化钠和水,氯化钠是食盐的主要成分。
5. 盐的分类和应用盐可以根据酸和碱的种类进行分类,常见的盐有以下几类:(1)氯盐:由盐酸与金属氢氧化物反应得到,如氯化钠、氯化钙。
(2)硫酸盐:由硫酸与金属氢氧化物反应得到,如硫酸铜、硫酸钙。
(3)亚硝酸盐:由硝酸与金属氢氧化物反应得到,如亚硝酸铜、亚硝酸钠。
酸碱盐的性质及其在生活中的应用

酸碱盐的性质及其在生活中的应用酸碱盐是化学中非常重要的物质,它们具有特定的性质和在各个领域的广泛应用。
本文将介绍酸碱盐的性质以及它们在生活中的应用。
一、酸碱盐的性质酸碱盐是由酸和碱反应生成的化合物,它们具有以下几个重要的性质。
1. 酸碱性:酸碱盐中的阳离子或阴离子具有酸性或碱性。
当阳离子为氢离子(H+)时,该盐为酸性盐;当阴离子为氢氧根离子(OH-)时,该盐为碱性盐;当阳离子和阴离子均不是氢离子或氢氧根离子时,该盐为中性盐。
2. 溶解性:酸碱盐的溶解性与其阳离子和阴离子的大小和电荷有关。
一般来说,阳离子或阴离子的电荷越大,其溶解性越差。
此外,一些酸碱盐在不同温度下的溶解性也会有所变化。
3. 颜色和气味:酸碱盐的颜色和气味可以因其成分的不同而有所差异。
例如,镁盐呈白色晶体,铁盐可以呈现不同的颜色,氯化铵有特殊的氨气味。
二、酸碱盐在生活中的应用酸碱盐广泛应用于生活的各个方面,下面将介绍一些常见的应用。
1. 食品加工:酸碱盐在食品加工中起到酸化、调味、脱水、防腐等作用。
例如,柠檬酸和醋酸常用于调味和腌制食品,磷酸盐可以作为食品添加剂用于调整酸碱度。
2. 清洁用品:酸碱盐在清洁用品中有着重要的应用。
例如,氯化钠和磷酸盐可用于制作洗衣粉、洗洁精、洗手液等,用以去除衣物或物体表面的污垢和油脂。
3. 医药制剂:酸碱盐在医药领域被广泛使用。
例如,酸性盐如柠檬酸和草酸钙可作为药物的酸性成分,碱性盐如氢氧化钠可用于中和酸性药物,中性盐如硫酸镁则可用于治疗便秘。
4. 农业领域:酸碱盐在农业中的应用主要涉及土壤调理和肥料。
例如,磷酸盐肥料可以提供植物所需的磷元素,硫酸铵肥料则可以提供植物所需的氮和硫元素。
5. 环境保护:酸碱盐在环境保护中具有重要作用。
例如,氢氧化钠被用于调节废水的酸碱度,能够中和酸性废水;磷酸盐可用于去除水体中的磷污染物等。
总结:本文介绍了酸碱盐的性质及其在生活中的应用。
酸碱盐具有酸碱性、溶解性、颜色和气味等特性,广泛应用于食品加工、清洁用品、医药制剂、农业和环境保护等领域。
初三化学酸碱盐归纳总结
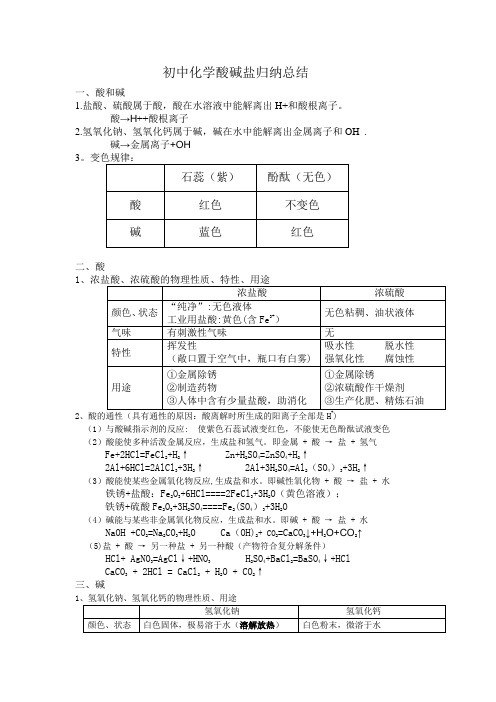
初中化学酸碱盐归纳总结一、酸和碱1.盐酸、硫酸属于酸,酸在水溶液中能解离出H+和酸根离子。
酸→H ++酸根离子2.氢氧化钠、氢氧化钙属于碱,碱在水中能解离出金属离子和OH¯. 碱→金属离子+OH ¯ 3二、酸12(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色 (2)酸能使多种活泼金属反应,生成盐和氢气。
即金属 + 酸 → 盐 + 氢气Fe+2HCl=FeCl 2+H 2↑ Zn+H 2SO 4=ZnSO 4+H 2↑2Al+6HCl=2AlCl 3+3H 2↑ 2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑(3)酸能使某些金属氧化物反应,生成盐和水。
即碱性氧化物 + 酸 → 盐 + 水 铁锈+盐酸:Fe 2O 3+6HCl====2FeCl 3+3H 2O (黄色溶液); 铁锈+硫酸Fe 2O 3+3H 2SO 4====Fe 2(SO 4)3+3H 2O(4)碱能与某些非金属氧化物反应,生成盐和水。
即碱 + 酸 → 盐 + 水 NaOH +CO 2=Na 2CO 3+H 2O Ca (OH)2+ CO 2=CaCO 3↓+H 2O+CO 2↑ (5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件) HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HClCaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 三、碱12、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH )(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 (2)酸性氧化物+碱 → 盐+水 2NaOH+CO 2=Na 2CO 3+H 2O (3)酸+碱 → 盐+水NaOH + HCl = NaCl + H 2O(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HCl CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 注:①难溶性碱受热易分解(不属于碱的通性) 如Cu(OH )2 ΔCuO +H 2O 2Fe(OH)3 ΔFe 2O 3+3H 2O②常见沉淀:AgCl ↓ BaSO 4↓ Cu(OH)2↓ F e (OH)3↓ Mg (OH)2↓ BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
初中常见酸碱盐的用途

初中常见酸碱盐的用途引言酸碱盐是化学中的重要概念,它们在日常生活和工业生产中都有广泛的应用。
在初中化学课程中,我们学习了一些常见的酸碱盐,它们具有不同的性质和用途。
本文将详细介绍初中常见酸碱盐的用途。
酸的应用1.食品加工:柠檬汁、醋等酸性物质常被用于食品加工,调味品和腌制食品。
2.清洁剂:许多清洁剂中含有酸性物质,如盐酸、硫酸等,可以去除污渍和清洁表面。
3.化妆品:某些化妆品中含有一定浓度的果酸或乳酸,可以去除皮肤上的死皮细胞,使皮肤更加光滑。
4.医药领域:某些药物中含有酸性成分,如维生素C、柠檬酸等,具有抗氧化和保健作用。
碱的应用1.清洁剂:碱性物质常被用于清洁剂中,如氢氧化钠、氢氧化钾等,可以去除油脂和杀菌。
2.化学实验:在化学实验中,碱性物质常被用作中和试剂,可以中和酸性溶液。
3.草坪维护:碱性物质如石灰可以用于调节土壤酸碱度,改善草坪生长环境。
盐的应用1.食品加工:食盐是最常见的盐类,它被广泛应用于食品加工和烹饪中,调味、腌制等。
2.农业领域:硝酸盐、磷酸盐等盐类是植物生长所需的营养元素,它们被广泛用于肥料制备。
3.化学实验:许多化学实验需要使用盐类试剂进行反应或分析。
4.医药领域:某些盐类如氯化钠、硝酸银等在医药领域有着重要的应用。
酸碱中和反应1.酸碱中和反应是指酸和碱反应生成盐和水的化学反应。
2.酸碱中和反应在许多方面都有着重要的应用,如药物中和、环境调节等。
总结初中常见的酸碱盐在日常生活和工业生产中都有广泛的应用。
酸性物质常被用于食品加工、清洁剂、化妆品和医药领域;碱性物质常被用于清洁剂、化学实验和草坪维护;盐类则广泛应用于食品加工、农业领域、化学实验和医药领域。
酸碱中和反应也是一种重要的化学反应,它在许多方面都有着重要的应用。
了解酸碱盐的性质和用途对我们深入理解化学知识以及日常生活都非常有帮助。
以上就是初中常见酸碱盐的用途的详细介绍。
希望本文对读者有所启发,增进对酸碱盐的理解。
酸碱盐重要知识点总结

酸碱盐重要知识点总结一、酸碱的定义和性质1.1 酸的定义和性质酸是一类具有酸性的化合物,它们通常能够与碱反应并产生盐和水。
酸的特性包括:酸味、酸性、导电性、和金属反应产氢气等。
1.2 碱的定义和性质碱是一类具有碱性的化合物,它们通常能够与酸反应并产生盐和水。
碱的特性包括:苦味、碱性、导电性、和酸反应生成盐和水等。
1.3 酸碱中和反应酸与碱之间的化学反应称为酸碱中和反应。
在中和反应中,酸和碱的质子和氢氧根离子结合形成水和盐。
二、常见的酸碱盐2.1 酸常见的酸包括硫酸、盐酸、硝酸等。
它们在工业和生活中有着广泛的应用,例如硫酸用于电池制造,盐酸用于化学实验室等。
2.2 碱常见的碱包括氢氧化钠、氢氧化钙、氨水等。
它们在日常生活中用作清洁剂、化肥等。
2.3 盐常见的盐包括氯化钠、硫酸铵、硫酸钠等。
它们在食品加工、化工、医药等领域有着广泛的应用。
三、酸碱盐的应用3.1 酸碱盐在化工中的应用酸碱盐在化工中有着广泛的应用,例如硫酸用于制造电池,盐酸用于金属清洗等。
3.2 酸碱盐在食品加工中的应用酸碱盐在食品加工中有着重要的作用,例如氯化钠用作调味剂、食品防腐剂等。
3.3 酸碱盐在医药中的应用酸碱盐在医药中有着重要的应用,例如氢氧化钠用于药品的生产,氯化钠用作生理盐水等。
3.4 酸碱盐在生活中的应用酸碱盐在生活中有着广泛的应用,例如氨水用作清洗剂,氢氧化钙用于制作肥料等。
以上就是对酸碱盐这一重要知识点的总结,酸碱盐是化学中的基础知识,它们在生活中有着广泛的应用。
希望本文能够对学习者有所帮助。
常见酸碱盐的性质和用途

常见酸碱盐的性质和用途酸碱盐是化学中常见的三种类型化合物之一,它是由酸和碱反应生成的。
酸碱盐在生活中有着广泛的应用,下面我们将介绍常见酸碱盐的性质和用途。
1.硫酸盐硫酸盐是由硫酸和金属离子或阳离子组成的盐类。
它具有很强的酸性和腐蚀性。
硫酸盐广泛用作肥料、溶剂和工业原料。
例如,硫酸铁常用于水处理、纸浆漂白和媒染剂。
硫酸铜可用于制备农药和木材防腐剂。
硫酸铅用于制备电池的正极材料。
2.硝酸盐硝酸盐是由硝酸和金属离子或阳离子组成的盐类。
它的溶液具有强氧化性,易于与其它物质发生反应。
硝酸盐广泛用作肥料、火药和爆炸物的成分。
硝酸铵和硝酸钾是常见的肥料,它们富含氮元素,有利于植物生长。
硝酸甘油是一种重要的爆炸物。
3.氯化物氯化物是由盐酸和金属离子或阳离子组成的盐类。
氯化物具有广泛的应用。
氯化钠是常见的食盐,用于调味和防腐。
氯化铁广泛用于水处理和去重金属物质。
氯化钙是除冰剂和融雪剂的重要成分。
氯化铵是一种常见的氮肥。
4.碳酸盐碳酸盐是由碳酸和金属离子或阳离子组成的盐类。
碳酸盐具有一定的酸碱性,能够与酸和强碱反应生成盐和水。
碳酸钠是一种重要的化工原料,在玻璃工业、造纸工业和洗涤剂生产中得到广泛应用。
碳酸钙是石灰石的主要成分,广泛用于建筑材料、化妆品、食品和医药工业。
5.亚硫酸盐亚硫酸盐是由亚硫酸和金属离子或阳离子组成的盐类。
亚硫酸盐具有还原性和抗氧化性。
亚硫酸钠是常见的还原剂,可用于染料工业、食品工业和药品工业。
亚硫酸氢钠是饮料和食品的抗氧化剂。
6.磷酸盐磷酸盐是由磷酸和金属离子或阳离子组成的盐类。
磷酸盐具有很强的潮解性和溶解性。
磷酸盐广泛用作肥料、洗涤剂和食品添加剂。
磷酸二氢钾和磷酸二氢铵是常见的食品酸度调节剂,用于调味品、碳酸饮料和面包等食品中。
磷酸三钠是一种常用的洗涤剂成分。
总的来说,酸碱盐具有广泛的应用。
它们被广泛用于农业、化工、食品、医药、环保等各个领域。
了解酸碱盐的性质和用途,有助于我们更好地理解和利用这些化合物。
初三化学酸碱盐(二)——化学肥料、酸碱盐之间的重要反应

初三化学酸碱盐(二)——化学肥料、酸碱盐之间的重要反应【本讲主要内容】酸碱盐(二)——化学肥料、酸碱盐之间的重要反应化学肥料、酸碱盐之间的重要反应、复分解反应及其发生条件【知识掌握】【知识点精析】一、化学肥料:(一)常见化肥的种类及作用:1. 钾肥:作用——促进植物生长,抗病虫害和抗倒伏能力。
种类:硫酸钾(K2SO4)、氯化钾(KCl)2. 氮肥:作用——使植物枝繁叶茂,果实硕大,营养丰富。
种类:尿素(CO(NH2)2)、碳酸氢铵(NH4HCO3)、硝酸铵(NH4NO3)等3. 磷肥:作用——促进植物生长,增强作物抗寒、抗旱能力。
种类:过磷酸钙(Ca(H2PO4)2,CaSO4),重过磷酸钙(Ca(H2PO4)2)4. 复合肥:含N、P、K三种营养元素中的两种或两种以上,具有多重功效。
种类:硝酸钾(KNO3),磷酸钾(K3PO4)(二)使用化肥与环境的关系化肥污染大气(如污染)污染水体(、使水体富营养化)破坏土壤(使土壤酸化、板结)不合理施用−→−−−−⎧⎨⎪⎩⎪NHN P3(三)化肥的简易鉴别:二、单质、氧化物、酸、碱、盐之间的重要反应(一)置换反应:1. 金属+酸→H2↑+盐条件金属:金属活动性顺序前金属酸:盐酸或稀硫酸H⎧⎨⎩例:Zn HCl ZnCl H +=+↑222Fe H SO FeSO H +=+↑24422. 金属+盐→新金属+新盐条件:金属:“前”置“后”,不用、、盐:盐溶液∙∙∙∙⎧⎨⎪⎩⎪K Ca Na例:Fe CuSO Cu FeSO +=+44Cu AgNO Ag Cu NO +=+22332()(二)复分解反应:两种化合物交换成分生成两种新化合物的反应。
AB CD AD CB +→+ 发生条件——复分解反应要发生,溶液里面才进行; 交换成分价不变,生成H 2O 、气或沉淀 1. 酸+碱→盐+H 2O (中和反应) 例:2224242NaOH H SO Na SO H O +=+Ca OH HCl CaCl H O ()22222+=+2. 酸+盐→新酸+新盐 例:HCl AgNO AgCl HNO +=↓+33 H SO BaCl BaSO HCl 24242+=↓+Na CO H SO Na SO H O CO 23242422+=++↑CaCO HCl CaCl H O CO 32222+=++↑3. 碱+盐→新碱+新盐 条件:反应物均可溶 例:24242NaOH CuSO Na SO Cu OH +=+↓()Ca OH Na CO CaCO NaOH ()22332+=↓+4. 盐1+盐2→盐3+盐4 条件:反应物均可溶 例:Na CO CaCl CaCO NaCl 23232+=↓+ CuSO BaCl BaSO CuCl 4242+=↓+FeCl AgNO Fe NO AgCl 333333+=+↓()【解题方法指导】例1. 熊健同学到舅父家作客,看到一个化肥袋上印有所示标签,还嗅到一股臭味,他向舅父解释说: (1)这包化肥是___________肥,能促使作物茎叶生长茂盛,叶色浓绿;每袋化肥中含该元素的质量至少___________kg 。
化学酸碱盐知识点

化学酸碱盐知识点化学是一门研究物质的变化及其性质的学科。
在化学中,酸碱盐是重要的研究对象。
本文将深入探讨酸碱盐的性质及应用。
一、酸的性质及应用酸是一类能够释放氢离子(H+)的物质。
酸可以分为有机酸和无机酸。
有机酸常见于日常生活中,例如柠檬汁中的柠檬酸和苹果中的苹果酸。
无机酸则包括硫酸、盐酸等。
酸的性质有酸味、腐蚀性和酸性反应。
酸有许多重要的应用。
例如,我们可以利用酸来清洁厕所和清除水垢。
酸还可以用于工业生产中的化学反应,如酸催化的酯化反应和酸催化的聚合反应。
二、碱的性质及应用碱是一类能够接受氢离子的物质。
碱可以分为强碱和弱碱。
强碱如氢氧化钠(NaOH)和氢氧化钾(KOH),在溶液中能完全离解得到氢氧根离子(OH-)。
弱碱则只部分离解。
碱的性质包括苦味、腐蚀性和碱性反应。
我们可以利用碱来中和酸性物质,并且用碱调节溶液的酸碱度。
碱还广泛应用于清洁剂和肥料的生产。
三、盐的性质及应用盐是酸和碱反应产生的化合物,具有稳定的离子化合物特性。
盐可以是酸的盐和碱的盐。
例如,氯化钠(NaCl)是酸氯化氢(HCl)和碱氢氧化钠(NaOH)反应产生的酸盐,硫酸钠(Na2SO4)是硫酸(H2SO4)和氢氧化钠(NaOH)反应产生的碱盐。
盐的性质常见于日常生活中。
例如,氯化钠是我们食盐的主要成分。
盐还可以用于工业应用,如制备可溶性肥料和草地的除草剂。
四、酸碱中和反应酸碱中和反应是指酸和碱按化学计量比例反应得到水和盐的反应。
该反应是酸碱中和成分的准确方法,并且可以调节溶液的酸碱度。
在酸碱中和反应中,酸和碱的摩尔数相等,并且产生的盐是由酸和碱的阳离子和阴离子组成。
例如,硫酸钠的酸碱中和反应是硫酸和氢氧化钠反应产生的,生成的盐是由钠离子(Na+)和硫酸根离子(SO42-)组成的。
总结:酸碱盐是化学中一组重要的物质,具有各自独特的性质和应用。
酸具有腐蚀性和酸性反应性,碱具有碱性反应性和中和酸的能力,而盐是酸和碱反应产生的产物。
理解和应用这些酸碱盐的知识对于我们更好地理解化学反应和日常生活中的化学物质有着重要的意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、学习重点、难点:
重点:碱的化学通性
难点:有关化学方程式的书写
三、学习方法:
自主学习、实验探究、对比、分析讨论、归纳总结相结合的方法
四、学习过程:
一、复习回忆上节课学习的常见的酸及酸有哪些化学通性?
接着问学生在日常生活中我们经常用到哪些碱,让大家说一说所知道的碱的名称,导入新课。
俗名
水溶性
二):对比酸的化学通性,学习碱的化学通性
1:[观察活动]:【实验8—9】让学生根据实验桌上的用品,自己设计实验验证。以小组为单位讨论,交流。报告实验结果。由学生代表归纳、总结:
碱的通性1:碱与指示剂的作用:
碱能使、
___________________________________。
2、学生回忆【实验8--4】写出有关化学方程式:
1、常见的碱NaOH、Ca(OH)2的特性、用途;
2、碱的化学通性:四点
3、碱溶液具有化学通性的原因。
六、板书设计:
常见的碱
一、常见碱NaOH、Ca(OH)2的特性、用途
二、碱的化学通性:
1、碱能使无色酚酞溶液变红、紫色石蕊溶液变蓝;
2、碱+酸→盐+水
NaOH + HCl = NaCl + H2O
Ca(OH)2+ H2SO4= CaSO4↓+ 2H2O
1、氢氧化钠与盐酸反应
________________________________________;
2、氢氧化钙与硫酸反应
________________________________________;
总结得出碱的通性2:碱与酸发生中和反应生成盐和水:
通式为:_________________________________。
3、[观察活动]:【实验8—10】,学生在实验5—7做过二氧化碳和石灰水反应。引导学生做好这两个对比实验,根据反应前后液面的变化让学生讨论、分析原因。由学生代表回答。仿照石灰水与二氧化碳反应写出氢氧化钠与二氧化碳反应的方程式:
_________________________________。
从而归纳、总结出通性3:碱能和某些非金属氧化物反应生成盐和水:
补充栏
主备栏
反思栏
了解熟石灰、烧碱的制取方法,会书写有关化学方程式。
学生讨论交流互相补充回答
指出Ca(OH)2还可以制农药波尔多液。
强调CaO作干燥剂及CaO+H2O反应放热属易考点,要灵活应用,指出熟石灰的制取方法。
固体NaOH易吸收水分而潮解,通常作某些气体的干燥剂,强调NaOH溶液具有强烈腐蚀性,使用时需注意。
二、自学参考提纲:
1、氢氧化钙的俗称、物理性质如何?
2、氢氧化钙是如何制取的?用途如何?
3、氢氧化钠的俗称、物理性质如何?
4、碱的化学通性有哪些?有关反应现象及化学方程式如何?
5、碱具有化学通性的原因是什么?
三、疑难解析:
一):1、让学生阅读课本232页。以小组为单位讨论分析,归纳总结出常见碱的用途。
A、HNO3B、SO2C、KOH D、FeCl3
2、熟石灰是松散的粉末,将它调成石灰浆,粉刷墙壁,一段时间后,墙面变得洁白而坚固,原因如何?
3、下列气体能用NaOH固体干燥的是()
A、HCl B、SO2C、CO2D、O2
4、如何区分NaOH和Ca(OH)2两瓶无色液体?
五、课堂小结:
回顾本节内容,分组讨论总结,学生代表发言。
____________________,____________________。
书写有关方程式:_________________________________________
_________________________________________
归纳总结通性4:碱与盐反应生成另一种碱和另一种盐:
教师巡回观察指导,并强调只有碱溶液才能使指示剂变色,难溶性碱不能。
酸和碱反应是中和反应,属于复分解反应,会写常见酸与碱的反应方程式。
强调指出碱与非金属氧化物反应不属于复分解反应,同时
提出固体NaOH为什么要密封保存?
强调生成物为亚硫酸钠(Na2SO3)
必须注重有关实验现象,强调:蓝色沉淀Cu(OH)2、红褐色沉淀Fe(OH)3。
通式为:____________________________。
试写出氢氧化钠与二氧化硫反应的方程式:
____________________________。
4、[观察活动]:【实验8—11】
回顾质量守恒定律中的探究活动,提出碱与盐也会发生复分解反应,让学生分组做石灰水与硫酸铜溶液,氢氧化钠溶液与氯化铁溶液反应的实验,各小组讨论、分析,由学生代表总结实验现象:
2、阅读课本233页。教师引导学生注意“石灰石、石灰水、生石灰、熟石灰”之间的区别,讨论合作完成下表:
物质
石ቤተ መጻሕፍቲ ባይዱ石
石灰水
物质
氧化钙
氢氧化钙
主要
成分
名称
化学式
化学式
俗名
用途
用途
3、[观察活动]:学生分组做【实验8—8】,
讨论、交流。报告实验结果。以小组为单位完成下表。
物质名称
氢氧化钠
氢氧化钙
颜色状态
化学式
指出:碱和盐必须都可溶,生成物中必须有沉淀或气体生成。
提示:
3、即不与NaOH反应的气体
4、鉴别物质必须有不同的现象
第八章生活中的酸碱盐
第二节常见的碱(1课时)
一、学习目标:
1、了解常见碱在生产生活中的主要用途,知道熟石灰、烧碱的物理性质;
2、初步学会用科学实验的方法认识碱的化学通性,并理解碱具有化学通性的原因;
七、作业布置:
3、碱+非金属氧化物→盐+水
Ca(OH)2+ CO2= CaCO3↓+ H2O
2NaOH + CO2= Na2CO3+ H2O
4、碱+盐→新碱+新盐
Ca(OH)2+ CuSO4= Cu(OH)2↓+ CaSO4↓
3NaOH + FeCl3= Fe(OH)3↓+ 3NaCl
2NaOH + CuSO4= Cu(OH)2↓+ Na2SO4
通式为:_________________________________________
三)、学生阅读课本235页,讨论与交流。
分析、总结,由学生代表回答碱在水溶液中表现为共同化学性质的原因:
_________________________________________。
四)、课堂练习:
1、不能与氢氧化钠反应的物质是()
