单质氧化物酸碱盐之间的相互关系.ppt
酸碱盐的反应规律

酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
①金属+ 氧气?金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,由酸转化成盐有四个途径:某些金属+ 某些酸?盐+ 氢气酸+ 碱性氧化物?盐+ 水酸+ 碱?盐+ 水酸+ 某些盐?另一种酸+ 另一种盐⑧酸?酸性氧化物+ 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+ 非金属?无氧酸盐此处的非金属H2、O2除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
⑩酸性氧化物+ 碱性氧化物?含氧酸盐(非初三知识)强酸(H2SO4、HNO3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
碱性氧化物+ 酸?盐+ 水强酸(H2SO4、HNO3、HCl)可与所有碱性氧化物反应,弱酸(H2CO3、H2S等)只能和活碱、4参加反应的两种盐必须都能溶于水,若生成物中有一种是难溶性的盐时,则反应可以进行。
金属+ 盐?另一种金属+ 另一种盐在金属活动性顺序里,排在前面的金属(K、Ca、Na除外)能把排在后面的金属从它的盐溶液里置换出来。
金属+ 酸?盐+ 氢气在金属活动性顺序里,排在氢前的金属能从酸溶液中把氢置换出来。
这里的酸主要是指盐酸和稀硫酸。
浓硫酸和硝酸因有强氧化性,跟金属反应时不会生成氢气,而是生成盐、水和其它气体。
除杂1、CO2(CO):把气体通过灼热的氧化铜,2、CO(CO2):通过足量的氢氧化钠溶液3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体3除去Cu中的Fe,可将混合固体加入CuSO4溶液中,(Fe+CuSO4=Cu+FeSO4),然后过滤后取滤渣。
4除去Na2SO4溶液中的NaOH,可向溶液中加入适量的稀H2SO4溶液(2NaOH+H2SO4=Na2SO4+2H2O)5除去KCl溶液中的K2SO4,可向溶液中加入适量的BaCl2溶液(K2SO4+BaCl2=2KCl+BaSO4),然后过滤后取滤液。
酸碱盐的反应规律

.酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
①金属+ 氧气?金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,反应就越剧烈。
金属氧化物大多数是碱性氧化物。
②碱性氧化物+ 水?可溶性碱可溶性碱对应的碱性氧化物能与水反应生成对应的碱,KO、NaO、BaO都能跟水反应。
22Ca(OH)微溶于水,它对应的CaO也能与水反应。
其余的碱性氧化物一般与水不反应或2不易反应。
③碱?盐由碱转化成盐的三个途径:碱+ 酸性氧化物?盐+ 水碱+ 酸?盐+ 水碱+ 某些盐?另一种碱+ 另一种盐④碱?碱性氧化物+ 水不溶性的碱在加热的条件下,一般可分解为对应的碱性氧化物和水。
碱中的金属越不活泼,则该碱越容易分解。
...⑤非金属+ 氧气?非金属氧化物除F、Cl、Br、I外的非金属,一般都可直接与O反应生成非金属氧化物。
非金属氧22222化物大多数是酸性氧化物。
⑥酸性氧化物+ 水?含氧酸除不溶性的SiO外,常见的酸性氧化物都可与水反应生成对应的含氧酸。
2⑦酸?盐由酸转化成盐有四个途径:某些金属+ 某些酸?盐+ 氢气酸+ 碱性氧化物?盐+ 水酸+ 碱?盐+ 水酸+ 某些盐?另一种酸+ 另一种盐⑧酸?酸性氧化物+ 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+ 非金属?无氧酸盐此处的非金属H、O除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
22⑩酸性氧化物+ 碱性氧化物?含氧酸盐(非初三知识)强酸(HSO、HNO)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加324热或高温条件下才能发生反应。
碱性氧化物+ 酸?盐+ 水强酸(HSO、HNO、HCl)可与所有碱性氧化物反应,弱酸(HCO、HS等)只能233224和活泼金属的氧化物反应。
酸性氧化物+ 碱?盐+ 水酸性氧化物在一般条件下都可与强碱溶液反应,但SiO与NaOH固体(或KOH固体)2需在强热条件下才发反应。
中考化学专题一 酸、碱、盐、单质、氧化物的相互反应
专题一酸、碱、盐、单质、氧化物的相互反应单质、氧化物、酸、碱、盐之间的相互关系,内容比较多,范围比较广,涉及的中考知识考点也比较多,一般以选择、推断等结合酸碱盐的性质进行考查。
利用物质的典型特性和化学性质进行鉴别和推断训练,培养学生的解题思路和解题方法,提高学生的素质是解答此类问题的最好途径。
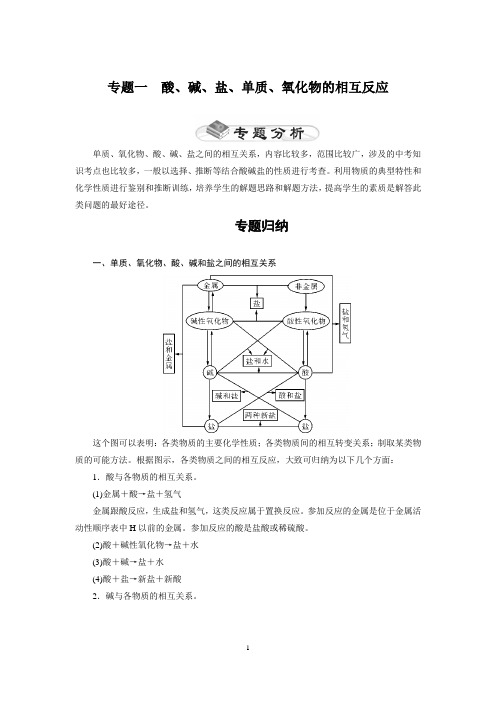
专题归纳一、单质、氧化物、酸、碱和盐之间的相互关系这个图可以表明:各类物质的主要化学性质;各类物质间的相互转变关系;制取某类物质的可能方法。
根据图示,各类物质之间的相互反应,大致可归纳为以下几个方面:1.酸与各物质的相互关系。
(1)金属+酸→盐+氢气金属跟酸反应,生成盐和氢气,这类反应属于置换反应。
参加反应的金属是位于金属活动性顺序表中H以前的金属。
参加反应的酸是盐酸或稀硫酸。
(2)酸+碱性氧化物→盐+水(3)酸+碱→盐+水(4)酸+盐→新盐+新酸2.碱与各物质的相互关系。
⎭⎪⎬⎪⎫(1)碱+酸→盐+水(2)碱+盐→新盐+新碱(3)碱+酸性氧化物→盐+水(碱要可溶)生成沉淀、气体或水 3.盐与各物质的相互关系。
(1)金属+盐→新盐+新金属条件:反应物中金属单质必须排在盐中金属前面 ⎭⎪⎬⎪⎫(2)碱+盐→新盐+新碱(3)酸+盐→新盐+新酸(4)盐+盐→另两种盐生成沉淀、气体或水 注意:金属+盐、碱+盐、盐+盐反应除满足复分解反应条件外,反应物的盐和碱还必须可溶。
二、考点分析及解题思路1. 中考常考查内容。
(1)根据相互关系写化学方程式。
(2)根据相互关系推断名称及化学式。
(3)根据相互关系鉴别、分离、提纯物质。
2.解题思路:明类型→知规律→想条件→写反应→得结论。
典例突破题型1 根据相互关系写化学方程式[例1](1)“比较归纳法”是学习化学的一种重要方法(“﹣”表示相连的两种物质能发生反应,“→”表示某种物质可通过反应转化为另一种物质),请以下表中序号Ⅰ为示例,填写序号Ⅱ、Ⅲ中的空格.序号/项目举例 物质类别间的相互反应 物质类别间的转化 Ⅰ CaCl 2+Na 2CO 3=CaCO 3↓+2NaCl盐1﹣盐2 盐新盐 Ⅱ写出硫酸与氯化钡反应的化学方程式酸﹣盐 酸→Ⅲ 写出氢氧化钠变成另一种碱的化学方程式 碱﹣ 碱新碱(2)“组成相同的物质会具有一些相同的性质”已知:Cl2+H2O=HCl+HClO,HCl和HClO 在水溶液中都能解离出H+,请写出Cl2和NaOH溶液发生反应的化学方程式:.解析:(1)氯化钡和稀硫酸反应的化学方程式为:BaCl2+H2SO4═BaSO4↓+2HCl.酸与盐反应生成新酸和新盐;氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;碱与盐反应生成新碱和新盐;(2)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯气与氢氧化钠溶液反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,答案:(1) BaCl2+H2SO4═BaSO4↓+2HCl;新酸;2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;盐.(2) Cl2+2NaOH=NaCl+NaClO+H2O.[变式训练]1.A~H是初中化学常见的物质,已知A为黑色固体单质,B为红色粉末,C和E常温下为气体且均属氧化物,F的浓溶液能挥发出刺激性气味的气体,G→H发生的是化合反应。
单质氧化物酸碱盐的相互转化关系

单质、氧化物、酸、碱、盐的相互转化关系一、金属1、金属+氧气→金属氧化物:例如:2Mg + O2===2MgO 2Cu + O2===2CuO2、金属+酸→盐+H2 :酸一般指盐酸、稀硫酸,金属指金属活动顺序中H以前的金属例:Fe + H2SO4 == Fe SO4 + H2 Zn + 2HCl ===ZnCl2 + H23、金属+盐→另一种金属+另一种盐盐必须是可溶于水的,金属要求①不能是K、Ca、Na ②反应的金属比生成金属活泼例如:Fe + Cu SO4 ==== Cu + Fe SO4Cu + 2AgNO3 ==== 2Ag + Cu二、非金属1、非金属单质+O2→非金属氧化物例如:2H2 + O2 ===2H2O2、非金属单质+金属氧化物→金属+非金属氧化物非金属单质指:碳和氢气,金属氧化物一般指CuO 、Fe2O3例如C + 2CuO===2Cu + CO2三、金属氧化物1、金属氧化物+水→碱金属氧化物指Na2O、K2O、CaO、BaO例如:CaO + H2O===Ca( OH)2 Na2O+ H2O==2NaOH2、金属氧化物+酸→盐+水例如:Fe2O3 + 6HCl===2FeCl3 + 3 H2O3、金属氧化物(Fe2O3、CuO)和CO、H2、C的反应例如:3CO + Fe2O3===2Fe + 3CO2四、非金属氧化物:1、非金属氧化物+水→酸非金属氧化物指CO2、SO2、SO3例:CO2+ H2O == H2 CO3SO2 + H2O=== H2 SO32、非金属氧化物+可溶性碱→盐+水非金属氧化物指CO2、SO2、SO3例如:CO2 + Ca( OH)2 ===CaCO3 + H2O SO2 +2NaOH=== Na2SO3 + H2O五、酸1、酸+金属→盐+H2酸一般指盐酸、稀硫酸,金属指金属活动性顺序中H以前的金属例如:Mg + H2SO4 == MgSO4 + H22Al + 6HCl===2AlCl3 + 3 H22、酸+金属氧化物→盐+水例如:CuO + H2SO4 == CuSO4 + H2O 3、酸+碱→盐+水例如:NaOH + HCl ===NaCl + H2O4、酸+盐→另一种酸+另一种盐生成物中要有沉淀或气体和水例如:CaCO3 + 2HCl===CaCl2 +H2O + CO2HCl+AgNO3====AgCl + HNO3 H2SO4 + BaCl2 ===BaSO4 + 2HCl六、碱可溶性碱有NaOH、KOH、Ca(OH)2 、Ba(OH)2、不溶性碱Cu(OH)2蓝色固体Fe(OH)3红褐色固体1、可溶性碱+非金属氧化物→盐+水非金属氧化物指CO2、SO2、SO3例如:CO2 + 2NaOH====Na2CO3 + H2O2、碱+酸→盐+水例如:Cu(OH)2 + H2SO4 == CuSO4 + 2H2O3、可溶性碱+可溶性盐→另一种碱+另一种盐要求:反应的碱和盐都须溶于水,生成物中至少一种是沉淀例如:Ca(OH)2 + Na2CO3 == CaCO3 + 2 Na OH七、盐1、盐+金属→另一种盐+另一种金属盐须是可溶于水,金属要求①不能是K、Ca、Na ②反应的金属比生成金属活泼2Al + 3CuSO4 ==3Cu + Al2 (SO4)32、盐+酸→另一种盐+另一种酸生成物中要有沉淀或气体和水例如:Na2CO3 + 2HCl===2NaCl + CO2 + H2O3、可溶性碱+可溶性盐→另一种碱+另一种盐要求:反应的碱和盐都须溶于水,生成物中至少一种是沉淀例如:CuSO4 +2 Na OH==== Na2 SO4 + Cu(OH)24、盐+盐→新盐1+新盐2、要求:反应的盐都必须溶于水,生成物中至少一种是沉淀例如:Na2CO3 + CaCl2 ==== CaCO3 + 2NaCl练习:用六种不同的方法制取MgCl2Mg + HCl===MgO + HCl===Mg(OH)2 + HCl===Mg CO3+ HCl===MgSO4 + BaCl2===Mg + CuCl2===。
单质氧化物酸碱盐

酸碱盐在新能源领域的应用研究
酸碱盐在电池中的研究
01
利用酸碱盐的电化学性质,可以开发出高效、环保的电池材料
和体系,如锂离子电池、钠离子电池等。
酸碱盐在燃料电池中的应用
02
酸碱盐可以作为燃料电池的电解质和催化剂,提高燃料电池的
效率和稳定性。
酸碱盐在太阳能转化中的应用
03
利用酸碱盐的吸收和转化能力,可以开发出高效、低成本的太
历史
随着化学科学的发展,人们对酸碱盐的认识逐渐深入,对其性质和用途也有了更全面的 了解。在历史上,许多科学家都对酸碱盐的研究做出了重要贡献,推动了化学科学的发
展。
PART 02
单质氧化物
定义与性质
定义
单质氧化物是由一种元素与氧元素形成的化合物。
性质
单质氧化物通常具有特定的颜色、状态和化学性质,如酸性氧化物、碱性氧化物和两性氧化物等。
盐(主要是氯化钠)也是农业中不可或缺的,它不仅是植物生长所需的营养元素 之一,还可用于防治病虫害。
在日常生活中的应用
酸碱盐在日常生活中也有很多应用,如用小苏打(碳酸氢钠 )或白醋(乙酸)清洁家居,用食盐(氯化钠)保存食物等 。
酸碱盐还用于制备各种日用品,如肥皂、洗涤剂、化妆品等 。
PART 06
酸碱盐的未来发展
新材料的研发与应用
新型酸碱盐材料的合成
随着化学合成技术的发展,未来将会有更多新型酸碱盐材料被合 成出来,以满足各种特殊需求。
材料性能优化
通过改进合成方法和条件,可以进一步优化酸碱盐材料的性能,如 提高稳定性、降低毒性等。
新应用领域的探索
酸碱盐材料在能源、环保、生物医学等领域有广泛的应用前景,未 来将会有更多新的应用领域被探索和开发出来。
单质氧化物酸碱盐之间的反应关系
4. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
5. 盐酸和氢氧化铁反应: 3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
6. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
7. 硫酸和烧碱反应:
变红色”,前者说法正确,后者说法错误。
(二)、酸与某些活泼金属反应,生成H2和盐。
金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
【 注意 】
(1)浓硫酸和硝酸与活泼金属反应,不生成H2,而生 成H2O。
(2) 活泼金属指金属活动顺序表中,氢前面的金属。 (3) Fe参加置换反应,生成物中铁显+2价(亚铁离
3
CaCl2
Na2SO4
BaCl2
NaCl
CaO
Ca(OH)2
Ca(OH)2+CO2= CaCO3↓+H2O
CaCl2→CaCO
3
与Na2CO3、 K2CO3反应
CaCl2
CaCO3
CaCO3+2HCl= CaCl2+H2O+CO2↑
Ca(OH)2+2HCl= CaCl2+H2O
NaOH
CO2
Ca(OH)2
Na2CO3
NaNO Ba(OH)2 Cu(OH)2
一、氧化物
有两种元素组成,其中一种元素为氧元
素的化合物叫氧化物。
氧化物按组成分为
非金属氧化物 金属氧化物
非金属氧化物:CO、CO2、SO2、NO、
NO2、P2O5、H2O等
化学 酸碱盐氧化物关系图(整理简洁版)ppt课件

(4)碱+酸==盐+H2O
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O23
酸(不稳定)
H2CO3
非金属氧化物+水
CO2↑+H2O
24
ቤተ መጻሕፍቲ ባይዱ温
2CuO+C 2Cu+CO2↑
古代炼铜的△方法之一
CuO+H2 Cu+H2O
非复分解反应,没有交换成分
13
碱+酸==盐+H2O NaOH+HCl=NaCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O Cu(OH)2+2HCl=CuCl2+2H2O 2Fe(OH)3+3H2SO4=Fe2(SO4)3+
2H2O
复分解反应,生成物有水 14
酸 +盐=盐+酸
H2SO4+BaCl2=2HCl +BaSO4 ↓
Al(OH)3+FeCl3≠
解释:因为反应物有沉 淀存在,不能进行
18
盐 + 盐 = 新盐 + 新盐
AgNO3+NaCl=AgCl↓ +NaNO3
CaCl2+Na2CO3=CaCO3↓+2NaCl
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO
BaCl2+Na2SO4=BaSO4↓+2NaCl
HNO3+NaOH=NaNO3+H2O
H2SO4+2KOH=K2SO4+2H2O
化学 酸碱盐氧化物关系图(整理简洁版)ppt课件

(4)碱+酸==盐+H2O
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O23
酸(不稳定)
H2CO3
非金属氧化物+水
CO2↑+H2O
24
高温
2CuO+C 2Cu+CO2↑
古代炼铜的△方法之一
CuO+H2 Cu+H2O
HNO3+NaOH=NaNO3+H2O
H2SO4+2KOH=K2SO4+2H2O
H2SO4+BaCl2=BaSO4 ↓ +2HCl
HCl+AgNO3=AgCl↓ +2HNO3
9
碱+盐= 盐+ 碱
3 NaOH + FeCl3 = 3NaCl+Fe(OH)3↓
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
金属+氧气 或△ 金属氧化物
点燃
2Mg+O2 2MgO
4Al +3O2 点燃 2Al2O3
3Fe+2O2 点燃 Fe3O4
2Cu +O2 △ 2CuO 5
金属氧化物+水
CaO+H2O Na2O+H2O
碱(可溶)
Ca(OH)2 2NaOH
6
碱 +酸 盐 碱 +盐 盐
NaOH+HCl=NaCl+H2O
复分解反应,生成物有水 11
非金属氧化物+水
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
② Fe+CuSO4=FeSO4+Cu
③ C+2CuO
2Cu+CO2↑
复分解反应及复分解反应发生的条件
(1)复分解反应是具备一定前提条件的化 学反应。这些前提条件是:①反应物是两种 化合物;②生成物是两种化合物;③生成的 两种化合物是参加反应的两种化合物相互交 换成分的结果。
判断下列反应能否发生置换反应, 不能反应的请说明理由,能的请写出 化学方程式。
①Cu+HCl= 不能反应,因为铜排在H的后面
② Fe+HCl= 能反应,Fe+2HCl=FeCl2+H2↑
③Al+H2SO4= 能反应,2Al+3H2SO4=Al2(SO4)3+3H2↑ ④ Cu+AgNO3= 能反应,Cu+2AgNO3=Cu(NO3)2+2Ag ⑤Fe+CuSO4= 能反应,Fe+CuSO4=FeSO4+Cu ⑥ Cu+ZnSO4=不能反应,因为铜排在锌的后面
置换反应规律小结:
1、这类反应以金属活动性顺序表为依 据去判断能否进行。
在金属活动性顺序中,位于氢前面的金属能置 换出盐酸、稀硫酸中的氢;
在金属活动性顺序中,位于前面的金属能把位 于后面的金属从它们化合物的溶液(盐溶液)里 置换出来。
2、有铁参加的置换反应均生成亚铁盐。
已知:化合物甲+单质乙 化合物丙+单质丁。试回答:写出三个符 合此表达式的化学方程式(要求:甲在不 同的化学方程式中所属类别不能相同)
单质、氧化物、酸、碱、 盐之间的相互关系
单质、氧化物、酸、碱、盐之间的相互关系
金属氧化物
复 分
酸
+碱 +盐
+酸 +酸 活泼 置
金属 换
解 反
碱
+盐
应 盐 +盐
盐
反
金属
+盐溶液
应
+碱
非金属氧化物
应用1:可反映各类物质的主要化学性质
应用2:主要涉及两类基本反应类型
活泼金属+酸→盐+氢气 置换反应
金属+盐溶液→新金属+新盐
(6)理解复分解反应要透过现象看本质。 例如: CaCO3+2HCl=CaCl2+H2O+CO2↑,若 仅从外表来看,往往会将其拒之于复分解反应
门外,如果从实质上分析,则会得出不同结论。
虽然此反应的生成物是三种化合物,但CO2和 H2O是因H2CO3分解产生的, H2CO3、CaCl2
是CaCO3和HCl相互交换成分的产物,因此, 该反应属于复分解反应。
(2012.贵阳市)某化学兴趣活动小组在准备实验时,甲 同学配制了Na2SO4、K2CO3、BaCl2、稀盐酸四种溶液, 但没有及时贴标签。乙同学在使用时为区分四种无色溶液,
将溶液分别编号为①、②、③、④并进行如下表所示实验, 由此推断①、②、③、④依次是( )
A.稀盐酸、Na2SO4溶液、K2CO3溶液、BaCl2溶液 B.K2CO3溶液、BaCl2溶液、稀盐酸、Na2SO4溶液 C.BaCl2溶液、K2CO3溶液、Na2SO4溶液、稀盐酸 D.Na2SO4溶液、BaCl2溶液、K2CO3溶液、稀盐酸
A.硝酸铜 B.稀盐酸
C.稀硫酸 D.二氧化碳
(2011.咸宁市)现有氧化铁、稀硫酸、氢 氧化钠溶液、氯化钡溶液和碳酸钾溶液五 种物质,在常温下它们两两相互发生的化 学反应有 ( )
A.4个 B.5个 C.6个 D.7个
(2012·德阳)下列各组物质在溶液中能 大量共存且形成无色溶液的是 ( ) A.NaCl 、 BaCl2 、 Na2CO3 B.KNO3 、 HCl 、 CaCl2 C.H2SO4 、 FeCl3 、 NaNO3 D.NaOH 、 HNO3、 NH4NO3
③ Ca(OH)2+H2SO4= CaSO4+2H2O
④Na2CO3 +Ca(OH)2= CaCO3 ↓ +2NaOH
⑤K2SO4
+NaCl=
不反应,生成物中无沉淀、 气体和水
⑥CuSO4+BaCl2= BaSO4 ↓ +CuCl2
熟记:(1)复分解反应发生的条件
(2)酸碱盐的溶解性表
应用三:可实现单质、氧化物、酸、 碱、盐间的相互转化
(2)复分解反应中的“换”与置换反应 中的“换”含义不同。前者是两种化合物 成分的互换(AB+CD=AD+CB),后者 是单质的元素“取代”化合物中的某一元 素(A+BC=B+AC)。
(3)复分解反应通常发生在:酸+金属氧 化物;酸+碱;酸+盐;碱+盐;盐+盐反应 中。中和反应是酸和碱作用生成盐和水的反应, 显然,中和反应属于复分解反应。
实验内容
实验现象
①+②
有白色沉淀生成
②+④
有白色沉淀生成
①+③
(7)酸、碱、盐之间并不是都 能发生复分解反应。只有当两种 化合物互相交换成分,生成物中 有水或有气体或有沉淀生成时, 复分解反应才能发生。
判断下列能否发生复分解反应,能的
写出化学方程式 ,不能的请说明理由:
①Ba(NO3)2+H2SO4= BaSO4↓+2HNO3
②K2CO3 +2ቤተ መጻሕፍቲ ባይዱHCl=2KCl+H2O+CO2↑
(2009临沂)下列两种物质的溶液混合 后,能发生反应,且溶液的总质量不会 发改变的是( )
A.氢氧化钠溶液和稀盐酸 B.碳酸钠溶液和稀盐酸 C.氯化钠溶液和稀硫酸 D.碳酸钠溶液和氯化钙溶液
(2009·陕西)在一定条件下,与NaOH溶 液、BaCl2溶液、Fe2O3、Zn、Na2CO3五种 物质均能发生反应的是 ( )
(2009.河南)滴有酚酞溶液的Ca(OH)2,溶液 分别与下列各物质恰好完全反应后,溶液仍显
红色的是( )
A.CO2 C.稀盐酸
B.H2SO4溶液 D.K2CO3溶液
(2009·宿迁)铁、氯化铜、石灰水、稀盐酸、
石灰石之间的反应关系如右图所示,图中两圆相 交部分(a、b、c、d)表示物质间反应的类型 或主要实验现象。下列说法中错误的是( ) A.a处产生白色物质 B.b处生成蓝色沉淀 C.c处发生复分解反应 D.d处产生气泡
(4)复分解反应中各元素的化合价 反应前后均不变。
(5)理解复分解反应考虑问题要全面。即 从反应物、生成物、反应发生的途径三个方面 去判断。如:2NaOH+CO2=Na2CO3+H2O,此 反应尽管反应物、生成物都是两种化合物,但 生成的两种化合物并不是反应物相互交换成分 的结果,所以该反应不是复分解反应。
