金属原子簇化合物
第9章 过渡金属原子簇化学
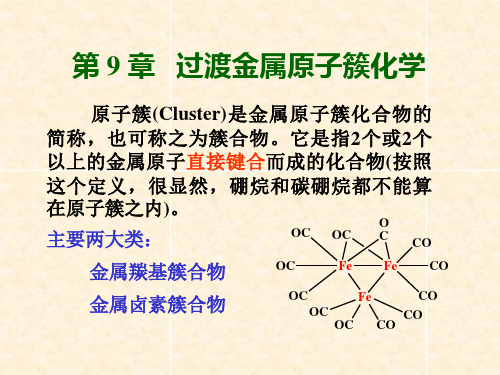
合起来; • 一般重金属元素形成原子簇的倾向更大一些。 • 一个配位体常常能和两个或两个以上金属原子成键,对金属原 子起桥连作用。
若干化合物中的 M—M 化学键 键 级 4.0 3.5 3.0 2.5 1.0 电 子 组 态 σ2π4δ2 σ2π4δ2 δ*1 σ2π4δ2 δ*2 σ2π4δ2δ*2 π*1 σ2π4δ2 δ*2 π*1 实 例
以Re2C182-为例: 2 Re3+=2×(7-3)=8,8 C1-=16,4 M-M=8, 总电子数=32, 平均每个Re为16e。 然而,对于Mo6C184+, Mo612+=6×6-12=24,8C1-=16, 总数=40, 每个Mo为40/6, 这很难用18或16电子规则描述。 其结构见右下。 其中六个钼原子构成一个八面 体,在八面体的每个面上方有一个 氯原子。因此, Cl-离子应为面桥基 配位, Mo6C184+应写作Mo6(3-C1)84+。 如果把8个Cl-取掉,则剩下Mo612+, 其价电子数为6×6-12=24,共12 对,而八面体共12条边,正好足够 沿着八面体的每个边形成一条Mo- Mo键,这一点可能是很有意义的。
③ 在羰基簇中,金属的 d 轨道大多参与形成 d→反 馈键,因而羰基簇的金属与金属间大都为单键,很少有多 重键。而在卤素簇中,金属的 d 轨道多用来参与形成金属 之间的多重键,只有少数用来参与同配体形成键。如 Re2C182-; ④ 中心原子的氧化态一般比羰基化合物高, d 轨道紧 缩(如果氧化数低, 卤素负离子的配位将使负电荷累积, 相 反,如果氧化数高, 则可中和这些负电荷), 不易参与生成d →反馈键; ⑤ 由于卤素不能易用*轨道从金属移走负电荷,所以 中心金属的负电荷累积造成大多数卤素簇合物不遵守18电 子规则。
第8章 金属原子簇合物

一个 σ键,两个 键, 和一个 δ键的形成造成 键 两个π键 键的形成造成 铼原子的4个电子俩俩成键, 铼原子的4个电子俩俩成键,在铼原子间形成 四重建。因此配合物是抗磁性的, 四重建。因此配合物是抗磁性的,键的强度 高至480~540 kj/mol, Re-Re 键距很短 高至 , (224 pm) ,氯原子呈重叠构象 (见下页图) 见下页图)
及 Te62+(三角棱柱体 三角棱柱体); 三角棱柱体
4. 金属簇合物: 金属簇合物: 金属间通过两个或两个以上金属-金属键形成 金属间通过两个或两个以上金属- 多面体结构的化合物, 多面体结构的化合物, 例如 Re2Cl82-, Re3Cl123-, Nb6Cl122+, Mo6Cl84+ and H2Ru6(CO)18
两个不寻常的特性:
a) 极短的 Re-Re 核间距,224 pm (比金属铼中 核间距, Re-Re 核间距 275 pm 还短). 还短). b) 在Re2Cl82-立方体结构中,8个氯原子呈重叠构 立方体结构中, 个氯原子呈重叠构 象。 ⅲ) 化学成键 将 Re-Re 键取作 z 轴 a) 每个铼原子使用它的 d x 2 − y 2 ,s,px, py 原子轨道 杂化轨道, 形成4 形成4个近似的 形成 个近似的 dsp2 杂化轨道,与 4 Cl- 形成 配键。 个正常的 σ 配键。
第八章 过渡金属簇合物
§8-1 概论 - 定义与分类 原子簇指原子间互相成键形成笼形或多面体 结构的一类化合物。 结构的一类化合物。广义地讲既包括非金属 原子簇也包括金属原子簇。 原子簇也包括金属原子簇。金属原子簇的特 征是金属间形成金属-金属键。 征是金属间形成金属-金属键。原子簇主要 包括以下四类: 包括以下四类: 1. P4, P4O6, P4O10 (Td); 2. 硼烷及硼烷阴离子 B4H10, B12H122-, B11SH12, B9C2H11; 3. 无配体原子簇 Bi95+ (三帽三棱柱体 Pb52-(三角双锥体 三帽三棱柱体), 三角双锥体) 三帽三棱柱体 三角双锥体
金属原子簇化合物

金属原子簇化合物金属原子簇化合物是由金属原子组成的微小团簇,具有特殊的物理和化学性质。
在这篇文章中,我们将探讨金属原子簇化合物的形成、结构和应用。
一、形成金属原子簇化合物的方法金属原子簇化合物可以通过多种方法合成,其中最常见的是气相聚集方法和溶液相方法。
1. 气相聚集方法气相聚集方法是通过在真空条件下,利用高温或激光等手段将金属原子蒸发并聚集起来形成团簇。
这种方法可以控制金属原子的大小和组成,从而得到不同性质的簇化合物。
2. 溶液相方法溶液相方法是将金属原子溶解在有机溶剂或水溶液中,通过控制溶液的浓度和温度等条件,使金属原子形成团簇。
这种方法可以得到较大数量的金属原子簇,并且可以对其进行表面修饰,改变其性质。
金属原子簇化合物的结构取决于金属原子的种类、数量和排列方式。
常见的结构包括金属球形簇、链状簇和层状簇等。
1. 金属球形簇金属球形簇是由金属原子构成的球形团簇,其中金属原子呈紧密堆积的结构。
这种簇化合物通常具有良好的稳定性和高度的对称性。
2. 链状簇链状簇是由金属原子按一定的顺序排列形成的线性结构。
这种簇化合物具有特殊的电子结构和导电性,常用于纳米电子器件的制备。
3. 层状簇层状簇是由金属原子按层次排列形成的二维结构。
这种簇化合物具有较大的表面积和丰富的表面活性位点,可以用作催化剂、吸附剂等。
三、金属原子簇化合物的应用金属原子簇化合物由于其特殊的物理和化学性质,在多个领域具有广泛的应用。
1. 催化剂金属原子簇化合物作为催化剂具有高效、高选择性的特点,广泛应用于化学反应中。
例如,铂簇可以用作氧还原反应的催化剂,铜簇可以用作CO2还原的催化剂。
2. 电子器件金属原子簇化合物可以用于制备纳米电子器件,如纳米传感器、纳米电子芯片等。
其特殊的电子结构和导电性使其在微电子技术中具有巨大的潜力。
3. 材料科学金属原子簇化合物可以用于制备新型材料,如金属纳米颗粒、金属纳米线等。
这些材料具有特殊的光学、磁学和力学性质,可应用于光催化、磁性材料和生物传感器等领域。
高等无机化学第四章 金属原子簇

金属原子簇化合物分三类:
1.多核金属羰基,亚硝酰配合物
2.低价卤化物和羧酸配合物 3.无配体原子簇 Hg2Cl2可看作最简单的金属原子簇化合物. 1907,法,美分别报道Ta6Cl14· 2O. 7H 上世纪20年代Linder(Ger.)合成了[Mo6Cl8]Cl4. 1935,Brosset(Swed.)报道了K3W3Cl4···. ···
可被其它配体取代,这类簇化合物及其衍生物是数量最大, 发展最快,又是最重要的一类金属簇化合物: Fe: [Fe3(CO)11]-1, Fe3(CO)12, [Fe6(CO)16C]2-··· ·· Co: Co3(CO)9CR (R=H.Cl.Me.Ph等), Co4(CO)12
[Co6(CO15C]12, [Co13(CO24C2H]4-·· ·,
第四章 金属原子簇
目前,金属原子簇化学已成为无机化学前沿领域
之一. 因其电子结构特殊,成键方式新颖,成为结构化
学新课题,也是对化学键理论的新挑战.
金属原子间形成以多面体骨架为特征的金属原子
簇(metal cluster),最基本的共同点是含金属-金属 键,超越了经典Werner型配和物的范畴(仅考虑金属 与配体间化学键).
210o C 12 h
研究结果表明:随温度升高,原子簇增大,极端情况 下可形成金属Os.由于很大的金属羰基簇合物可以看
作是金属表面吸附了CO,因此金属多核羰基化合物反
应性能可能与Os表面吸附了一氧化碳分子有关,这对
多相催化研究提供了一个模型.
此外还有光化学缩合等方法. 3.金属-羰基原子簇反应
此类反应具有其自身的特殊性和复杂性.
25 C,CO, KPa 100 THF
o
[Rh5(CO)15]+CO
第七章 金属原子簇化学

金属原子簇
• 在铁硫蛋白中,铁硫原子簇的主要生理功能是传递电 子,因此,在研究铁硫原子族的性质时,往往对它们 的氧化还原性给予特殊的注意.
• 实验表明,中性的Fe4S4(NO)4可被还原到Fe4S4(NO)4-阴 离子
– [(η5-C5H5)Co][Fe4S4(NO)4]
– [AsPh4][Fe4S4(NO)4]
金属原子簇的类型
• 主要类型
– 金属—羰基原子簇化合物
– 金属—卤素原子簇化合物 – 其它类型
金属—羰基原子簇化合物及其衍生物
• 金属—羰基原子簇化合 物及其衍生物 • 金属—碳基能形成大量 的二元原子簇化合物,
– 一部分碳基还可被共 它配体如烯烃、炔烃 及芳香基等碳氢基团, 以及大量含氮、磷、 砷、氧、硫等非碳配 位原子的基团所取 代.
金属羰基原子簇化合物的合成和反应
• [Pt3(CO)6]n 2- (n=6、2或1)不易直接由PtCl62-的还原得 到,它们可由[Pt3(CO)6]n 2- (n=5、4、3)开始来制备
金属羰基原子簇化合物的合成和反应
• 锇的三核羰基族合物Os3(CO)12,是制备其它锇的二元 羰基簇合物及其衍生物的重要中间产物.
金属原子簇
• 例:Fe4S4(NO)4 • 制备: Hg[Fe(CO)3(NO)]2与 硫在甲苯溶液中迴流得到, Hg[Fe(CO)3(NO)]2则可由 Fe(CO)5、 KNO2和Hg(CN)2 反应而来. • 性能:黑色晶体, 稳定. • 结构:Fe4构成四面体, 硫 原子占据面桥基的位置.从 另一个角度来看,Fe4S4形 成一个畸变立方体的骨架, 其中Fe—Fe平均距离 265.1pm,12个Fe—S键长 的变化范围很小,仅从 220.85pm到222.4pm,平均 221.7pm(图).
第六章 簇状化合物(中级无机化学)

4+
可以无配体 一些无配体原子簇 也称团簇
P4,As4,S6等
C60
硼原子簇
B4H10
B12H122-
B9C2H11
金属原子簇
簇合物的结构特点
五种正多面体(柏拉图多面体)
簇合物的结构特点
骨架(笼) 形状: 多为三角面多面体(可欠完整) 笼的中心:大多数空心! 笼的边 :除双核簇外,不代表一条单键, 仅代表多面体的一条棱 键合: 骨架原子之间一般以离域的多中心键 结合
二、金属簇状化合物的特征
1、金属-金属键的形成条件
[Mo6Cl8]4+ Ir4(CO)12
与金属和配体都有关!
(1) 金属
本质:静电作用、轨道重叠
① 低氧化态金属易形成金属—金属键(羰 基簇多) ② 同氧化态的重过渡元素比轻过渡元素易成簇 例:[V6X12]2+ × [Nb6X12]2+ √ [Ta6X12]2+ √ ③ d电子过多不利于成簇 例:VIII、IB 解释:(1)M-M键靠d轨道重叠,高氧化态, ④ 原子化焓较大的过渡金属易成簇 d轨道收缩,不利于重叠;(2) M-M键靠d M(–M–M–)(s) → M(g) ΔH 轨道重叠,4d、5d空间伸展比3d大,有利于重 叠;(3)金属价层电子太多,导致电子占据 对应 M–M 键强度 反键轨道,妨碍M-M键的形成。
特点 缺电子化合物 价电子数 < 价轨道数
命名:
硼原子数 ≤ 10:甲乙丙丁
B2H6:乙硼烷
硼原子数 > 10:11、12
中文数字
氢原子数用阿拉伯数字标在括号内 B4H10:丁硼烷(10) 用前缀表示立体结构类型 B10H14:巢式-癸硼烷(14) 闭式网式硼烷阴离子括号内标出电荷数,不标氢原子数 B12H122-:闭式-十二硼烷(2-)
第四章 原子簇化合物part2
“低价卤化物”型原子簇Mo2Cl83- 。
5.2.3 多核羰基配合物原子簇
1、合成
(1)氧化还原
6[RhC16]3-+23OH-+26 CO+CHC13 0.1MPa, 298K CH3OH [Rh6(CO)15C]2-+11CO2+3PC1-+12H2O
1123K
14NbC15+16 Nb+20 NaC1
2、影响形成M-M键的因素
(1) 第二、第三系列过渡金属比第一系列过渡金属更易形 成金属-金属键。 由于 3d 轨道在空间的伸展范围小于 4d和 5d ,因而 只有第二、三过渡系列的元素才更易形成原子簇化合物。
(2) 处于低氧化态的金属易于形成金属-金属键。 M-M键的形成主要依靠 d轨道的重叠,当金属处于高 氧化态时, d轨道收缩,不利于 d轨道的互相重叠;相反, 当金属呈现低氧化态时,其价层轨道得以扩张,有利于金属 之间价层轨道的充分重叠。因此M-M键常出现在金属原子 处于低氧化态的化合物中。 在羰基化合物中 表现零价或负价态 低价卤化物中 金属离子价态小于+3价
是 因为形成M-M键后,电子配对的结果。 Co(CO)4末成对电子数1 而Co2(CO)8末成对电子 数0,说明分子中可能存在Co -Co键。
(3) 键能:M-M键能>80KJ/mol才是簇状化合物(同族中
原子簇的M-M键能从上到下增大)
Mn2(CO)10 Te2(CO)10 Re2(CO)10 Fe3(CO)12 Ru3(CO)12 Os3(CO)12 (KJ/mol) 104 180 187 82 117 130
合成: KReO4 + NaH2PO2 +HCl
K2Re2Cl8 + NaH2PO4 + 4H2O KReO4 + H2 +HCl(浓) K2Re2Cl8 + 8H2O
金属簇合物
3.其它方法。如配体取代、骨架转换、加成反应等。
(1)配体取代反应:如: Rh6(CO)16+MX Os3(CO)12 +x PPh3 (x=1,2,3) M[Rh6(CO)15X]+CO Os3(CO)12-x(PPh3)x
在取代反应中,簇合物的骨架不发生变化。
(2)配体插入反应,如:
Re3C19+3Py
Nb
Nb 2e Nb
Mo6C184+,
Mo612+=6×6-12=24,8C1-=16, 总数=40,每个Mo为40/6,这很难用18或16e规则描述。 其结构见右下。 其中六个钼原子构成一个八面 体,在八面体的每个面上方有一个 氯原子。因此,Cl-离子应为面桥基 配位,Mo6C184+应写作Mo6(3-C1)84+。 如果把8个Cl-取掉,则剩下Mo612+, 其价电子数为6×6-12=24,共12 对,而八面体共12条边,正好足够 沿着八面体的每个边形成一条Mo- Mo键。
含有直接而明显键合的两个或两个以上金属原子的化合物。
1982年徐光宪提出:
原子簇合物为若干有限原子(三个或三个以上)直接键合组成 多面体或缺顶多面体骨架为特征的分子或离子。
第一个金属簇合物(亦即第一个原子簇合物):
Roussin黑盐:Cs[Fe4S3(NO)7]•H2O 1858年,Roussin合成得到 。 1958年,经X-ray分析确定其结构 。 1970年,经IR光谱和Mö ssbauer谱进一步证实 。
三、M-M键存在的判据
金属原子簇是具有M-M键的化合物,但要判断M-M键的存在却是一个十分复杂 的问题。通常是根据下列几方面的实验事实进行判断的。
1.键长:
若金属原子间的核间距离比金属晶体中的差不多或更小,
高等无机化学第四章-金属原子簇
1993,x-ray测定其结构,证实铁钼辅因子含 MFe3S3(M=Fe or Mo),为不完整类立方烷的二聚体, p原子簇含Fe4S4原子簇二聚体.同时还有一单个 Fe4S4原子簇和另一组铁蛋白结合在一起.
多面体骨架电子对理论 PSEPT or Wade Rule or Wade-Mingos Rule
硼烷,碳硼烷原子簇骨架主要由BH or CH结构单元共同组 成, BH→2个价电子,3个价轨道
Os: Os3(CO)12, [Os10(CO)24C]2-···· Ir: Ir(CO) 12, [Ir(CO)22]2-··· Pt: [Pt3(CO)6]2-, [Pt12(CO)24]2-, [Pt38(CO)44H2]2-···
簇化合物中均含有金属原子直接键合组成的多面体骨架 . 最低三核原子簇均具有三角型骨架. 四核有几种不同骨架:
4.5 金属原子簇的结构规则
关于金属原子簇的结构规则已提出多种,有经验的、半 经验的和纯理论计算的。主要着眼于原子簇骨架的电子数与 几何构型之间的内在关系。
Wade and Mingos 从其提出的硼烷结构规则推广应用 到金属原子簇中——多面体骨架电子理论(PSEPT)
(Polyhedral Skeletal Electron Pair Theory). Lauher的过渡金属原子簇成键能力规则(The Bonding Capabilities of Transition Metal Clusters): 主要是通过半 经验的分子轨道法计算出簇价分子轨道数来说明原子簇的成 键能力,同时预示其骨架的几何构型。
第9章_过渡金属原子簇化学
(a)
(b )
HFe4(CO)12(CO)-的结构(a)和铁催化剂上的N2 (b)
9.6 过渡金属羰基簇合物
配体为CO的过渡金属簇合物称为过渡金属羰基簇合物。 由于CO是一个较强的 电子给予体和 电子接受体,所以 羰基簇合物比较稳定,数量也较多。 CO在羰基簇合物中可以发挥不同的功能: 羰基簇合物 功能 单核羰基簇合物 端基配位 双核羰基簇合物 端基+边桥基+半桥基 多核羰基簇合物 端基+边桥基+半桥基+面桥基
Os3(CO)10(2-H)2:
配体提供价电子数=10×2+2×1=22 金属 Os3 = 3×8=24 总电子数=46 M-M键数=(18×3-46) / 2=4
三个金属4条金属键,可以有两种如下 Os=Os=Os 和 Os Os=Os
的排布,结构分析表明配合物 具有环丙烯的结构,所以其结 构如右图所示: 显然,后者电荷分布比较 合理。
a a a b e b c c d c
f d fd
Os6(CO)18
9.7 过渡金属卤素簇合物 (了解)
卤素簇在数量上远不如羰基族多,由 卤素簇的
特点可以理解这一点:
① 卤素的电负性较大, 不是一个好的电子给予
体,且配体相互间排斥力大, 导致骨架不稳定;
② 卤素的反键 *轨道能级太高 , 不易同金属生 成 d→反馈键,即分散中心金属离子的负电荷累 积能力不强;
O C
CO CO CO CO
Fe
金属卤素簇合物
CO
9.1 金属-金属键
按照簇合物定义, 金属-金属键是簇合物的重要标志,金属 原子之间可以形成单键、双键、三键或四重键。 1 Mn2(CO)10 按照 18 电子规则 , Mn2(CO)10 有 2×7 + 10×2 = 34 个电子, 平均每个Mn有17个电子,可以预料在它们的分子中必定存在有 一条Mn-Mn金属键。 事实上,在成键时锰进行了 d2sp3杂化,有六条杂化轨道。 其中5条用以接受来自五个羰基配体的孤对电子,其中还有一条 已充填有一个单电子的d2sp3杂化轨道与另一个锰原子的同样的 轨道重叠形成 Mn-Mn键。因此,每一个锰都是八面体型的, 而且OC-Mn-Mn-CO处于一条直线上。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
§4-5 钯 铂原子簇 -
指导老师: 学 生:
金属原子簇化合物的定义: 1 、金属原子簇化合物的定义:
1966年F.A.Cotton提出,原子簇是“含有直接而 明显键合的两个或以上的金属原子的化合物”。 美国化学文摘CA的索引中提出, “原子簇化合 物是含有三个或三个以上互相键合或极大部分互相键 合的金属原子的配位化合物”。 1982年我国徐光宪提出,“原子簇为若干有限 原子(三个或三个以上)直接键合组成多面体或缺顶 多面体骨架为特征的分子或原子”。(包括了硼烷及 杂硼烷)
5、钯、铂原子簇 由于钯铂原子簇在仿声系统、新型 材料、均相催化剂等方面具有潜在的应 用前景,因此,近二十年来一直是原子 簇化合物领域的研究热点之一。人们合 成了一系列蔟核结构,如下图,并对其 光学,电化学以及催化性质进行了研究。
钯、铂原子簇核结构
Pd(dppm)3(CO)2+为例介绍其 性质
关于核数超过十的多核钯蔟的研究室 目前的另一个热点。最近,具有纳米尺度 的[Pd30(CO)26(PEt3)10],[Pd54(CO)40(PEt3)14]等 多核钯原子簇已见报道。值得关注的是在 这些研究中发现多核蔟结构表现出类似主客复合物的结构。如[Pd69(CO)3(PEt3)18]蔟 核中具有由33个Pd原子构成的线形分子上。 多核的异钯铂原子簇同样引起人们的研究 兴趣。关于PdTI蔟以及PdNi蔟的合成与结 构的研究已有人涉足。预计今后这方面的 研究会更加活跃。
4、分类: 、分类:
含有金属-金属键的化合物通称为金属原子簇 合物 . 它们可分为 3 类: ⅰ). 多核的金属羰基化合物 Mn2(CO)10, Fe3(CO)12, Fe2(CO)9; ⅱ). 低氧化态的卤化物和氧化物 [Re3Cl12]3-, [Re2Cl8]2-; ⅲ). 无配体金属原子簇, Bi4+(AlCl4), Bi53+ (AlCl4)3, K4Sn94-, NaPb4( 在液氨中).
当使用铜作为工作电极时,通过单电 子氧化,可将Pd3(dppm)3(CO)Cl+还原为 Pd3(dppm)3(CO)2+,如此就提供了一个催 化循环,见下图
在该催化过程中可由酰氯生成相应 的酰基阳离子。这个酰基阳离子与醇或 F-反应,可在温和的条件下合成不对称 酯和酰氟,该反应与常用方法相比,反 应条件更加温和,反应产率很大的提高。
该原子簇在光照射下可以与氯代烷 发生氧化加成-分解反应,反应过程是 通过一个原子在激发态时转移进行的, 而未发现在反应中有电子转移现象。当 有机底物分子较大时。它与原子簇之间 的主-客体相互作用确定了其反应活性。
Pd3(dppm)3(CO)2+还可以与酰氯反应,生成 Pd3(dppm)3(CO)Cl+和相应的酰基阳离子:
2、特点: 、特点:
(1)存在M-M金属键 (2)分子的立体结构一般都是三角多面体或欠完整的 三角多面体,骨架成键电子以离域多中心键形式存在。 (具有M-M键的两个核配合物并不算原子簇)
3、金属-金属键的形成条件 、金属-
(1)金属原子处于低氧化态(羰基配合物中,金属 1 原子常呈0或-1价,低价过渡金属 卤化物 的簇状化 0 1 合物中,金属原子呈+2,+3价。) (2)形成金属簇状化合物是第二、三过渡系元素的 特点 。如ⅤB: Nb Ta形成M6X122+,而V不能;ⅥB : Mo W形成M2(CH3COO)4,而Cr不能;ⅦB :Tc Re形成M2X82-, 而Mn不能. (3)适宜配体。低价卤化物,硫、硒、碲化物只有 前面几族形成。
谢谢Leabharlann 由于不同的金属之间存在协同作用, 可以预计双金属原子簇或多金属原子簇 的催化活性和选择性加成反应将大大优 于但金属原子簇。例如,立方体 PdMo 3S 4蔟对于醇或羧酸与炔烃的立体 选择性加成反应具有良好的催化活性, 其催化活性及立体选择性优于单核的钯 配合物。因此,钯铂异核原子簇受到了 广泛关注,其催化活性及立体选择性均 优于单核的钯铂配合物。因此,钯铂异 核原子簇受到广泛关注。
