半导体材料硅的基本性质
硅知识点总结框架

硅知识点总结框架全文共四篇示例,供读者参考第一篇示例:硅是一种常见的半导体材料,广泛应用于电子工业中。
在学习硅的知识点时,我们可以按照以下框架进行总结:硅的基本性质、硅的制备方法、硅的应用领域以及硅的未来发展方向。
我们来看硅的基本性质。
硅是周期表中第14元素,化学符号为Si。
它是一种灰白色的固体,具有金属和非金属的特性。
硅是地壳中含量最丰富的元素之一,其化学性质稳定,不容易与其他元素发生化学反应。
硅具有良好的导电性和热导性,是一种优良的半导体材料。
硅的制备方法主要包括自然硅的提取和人工合成两种。
自然硅主要存在于硅酸盐矿物中,通过矿石的精炼和提纯可以得到高纯度的硅。
人工合成硅主要是指通过化学反应将硅源物质转化为硅材料。
目前,工业上主要采用的制备方法是化学气相沉积法和晶体生长法。
硅的应用领域非常广泛,主要包括电子工业、光伏产业、半导体材料等方面。
在电子工业中,硅被广泛应用于集成电路、太阳能电池、电子器件等领域,是现代电子产品的重要组成部分。
硅还可以用于制备硅钢、硅铁合金等工业原材料,广泛应用于冶金、化工等领域。
未来,硅材料在电子工业中的应用前景非常广阔。
随着5G、人工智能等新兴技术的发展,对集成电路和光伏材料的要求越来越高,硅作为优良的半导体材料将在未来得到更广泛的应用。
人们也在不断研究硅材料的改性方法,以提高其性能和应用范围。
第二篇示例:硅知识点总结框架硅是一种非金属元素,化学符号为Si,原子序数为14。
硅在地壳中含量很高,是地壳中第二多的元素。
硅是一种广泛应用的材料,被广泛用于电子工业、建筑领域、制造业等多个领域。
以下是硅知识点的总结框架:一、硅的性质1. 物理性质:硅是一种灰色的晶体,熔点为1414°C,沸点为3265°C。
硅是半导体材料,其导电性介于导体和绝缘体之间。
2. 化学性质:硅是惰性元素,不容易与其他元素反应。
硅可以与氧形成氧化硅,与氢形成硅氢化合物。
二、硅的结构1. 晶体结构:硅以晶体形式存在,常见的晶体结构包括钻石结构、闪锌矿结构等。
高一硅及硅的化合物知识点

高一硅及硅的化合物知识点硅(Si)是元素周期表中的第14号元素,属于非金属元素。
硅及其化合物在日常生活和工业生产中具有重要的应用价值。
本文将介绍关于硅及其化合物的知识点。
一、硅的基本性质硅是一种无色、硬度较高、脆性较大的固体物质。
它具有较高的熔点和沸点,不溶于水和大多数常见的溶剂,但能溶于热的氢氟酸和碱性溶液。
硅是一种良好的导热材料,同时具有半导体特性,因此在电子行业中有广泛应用。
二、硅的化合物及应用1. 硅石(SiO2):也称为二氧化硅,是硅最常见的氧化物。
硅石在自然界中广泛存在,常见于石英、石英砂等形式。
它是制备硅金属的重要原料,也用于制备玻璃、陶瓷等材料。
2. 硅酸盐:是一类以硅酸根离子(SiO4^4-)为主的化合物。
硅酸盐在岩石、矿石和土壤中普遍存在,如长石、石英等。
它们具有重要的地质作用,也用于制备建筑材料、陶瓷等。
3. 二氧化硅凝胶:是一种由硅酸盐制备得到的多孔固体材料,具有很高的比表面积和孔隙度。
它被广泛应用于催化剂、吸附剂、保温材料等领域。
4. 硅油:是一种由聚硅氧烷链构成的有机硅化合物,具有良好的润滑性、绝缘性和耐热性。
硅油常用于机械设备的润滑、电子元器件的封装等。
5. 硅树脂:是一类由有机硅聚合物构成的高分子材料,常用于制备塑料、胶黏剂等。
硅树脂具有良好的耐高温性能和化学稳定性,广泛应用于航空航天、电子、汽车等领域。
6. 硅橡胶:是一种由聚硅氧烷和填充剂组成的弹性材料,具有优异的耐高温、耐候性和绝缘性。
硅橡胶常用于制备密封件、隔振垫等。
7. 硅材料在半导体工业中的应用:由于硅具有半导体特性,因此在半导体工业中,硅被广泛应用于制备集成电路、太阳能电池等。
三、硅及其化合物的重要性硅及其化合物在现代工业和科技领域具有重要的地位和应用价值。
硅材料的独特性能使其成为电子行业中不可或缺的材料,半导体工业的发展离不开硅材料。
此外,硅化合物在建筑材料、化工原料、橡胶和塑料等领域也起着重要作用。
硅材料知识

硅材料的基本特性1、硅材料的基本特性;2、硅单晶材料的重要参数定义:晶向;导电类型;电阻率;杂质分布均匀性;微缺陷;晶片几何尺寸及公差;厚度;弯曲度;翘曲度;平行度;抛光片的平坦度;3、硅单晶中杂质的缺陷对器件的影响。
硅结晶型的硅是暗黑蓝色的,很脆,是典型的半导体。
化学性质非常稳定。
在常温下,除氟化氢以外,很难与其他物质发生反应。
硅的用途:①高纯的单晶硅是重要的半导体材料。
在单晶硅中掺入微量的第IIIA族元素,形成p型硅半导体;掺入微量的第VA族元素,形成n型和p型半导体结合在一起,就可做成太阳能电池,将辐射能转变为电能。
在开发能源方面是一种很有前途的材料。
②金属陶瓷、宇宙航行的重要材料。
将陶瓷和金属混合烧结,制成金属陶瓷复合材料,它耐高温,富韧性,可以切割,既继承了金属和陶瓷的各自的优点,又弥补了两者的先天缺陷。
可应用于军事武器的制造。
第一架航天飞机“哥伦比亚号”能抵挡住高速穿行稠密大气时磨擦产生的高温,全靠它那三万一千块硅瓦拼砌成的外壳。
③光导纤维通信,最新的现代通信手段。
用纯二氧化硅拉制出高透明度的玻璃纤维,激光在玻璃纤维的通路里,无数次的全反射向前传输,代替了笨重的电缆。
光纤通信容量高,一根头发丝那么细的玻璃纤维,可以同时传输256路电话,它还不受电、磁干扰,不怕窃听,具有高度的保密性。
光纤通信将会使21世纪人类的生活发生革命性巨变。
④性能优异的硅有机化合物。
例如有机硅塑料是极好的防水涂布材料。
在地下铁道四壁喷涂有机硅,可以一劳永逸地解决渗水问题。
在古文物、雕塑的外表,涂一层薄薄的有机硅塑料,可以防止青苔滋生,抵挡风吹雨淋和风化。
天安门广场上的人民英雄纪念碑,便是经过有机硅塑料处理表面的,因此永远洁白、清新。
发现1822年,瑞典化学家白则里用金属钾还原四氟化硅,得到了单质硅。
名称由来源自英文silica,意为“硅石”。
分布硅主要以化合物的形式,作为仅次于氧的最丰富的元素存在于地壳中,约占地表岩石的四分之一,广泛存在于硅酸盐和硅石中。
关于硅的知识点总结

关于硅的知识点总结硅的物理性质硅是一种灰色金属,具有良好的导电性、导热性和化学稳定性。
它的熔点高达1414摄氏度,沸点为3265摄氏度,具有较高的融化温度和热稳定性。
硅的密度约为2.33克/立方厘米,硬度较高,能耐高温,属于典型的半金属材料。
硅的化学性质硅是一种化学惰性较高的元素,它在常温下不易与氧气、水或其它物质发生反应。
但是,在一定条件下,硅可以与氧气、氯气等元素发生化学反应,生成二氧化硅、硅氢化合物等化合物。
此外,硅还能够形成多种配位化合物,如四氯化硅、硅烷等。
硅的应用硅在工业生产和科研领域有着广泛的应用。
首先,硅是集成电路和半导体材料的主要原料,它的导电性和稳定性使得它成为现代电子设备中不可或缺的材料。
此外,硅也是太阳能电池板的制备材料,它在光伏产业中有着重要的作用。
另外,硅还被用作制备耐高温耐腐蚀材料、电解铝、合金等。
硅的生产硅是从硅石中提取的。
硅石是一种富含二氧化硅的矿石,其主要成分为二氧化硅和少量的杂质。
硅的生产过程主要包括硅石的选矿、熔炼、精炼等步骤。
首先,硅石要经过选矿处理,去除其中的杂质;然后,将硅石加热至高温,将其中的二氧化硅还原成硅金属;最后,通过精炼等多道工序,将硅金属纯化,获得高纯度的硅产品。
硅的结构特性硅的原子结构特殊,它的原子结构为Si: 1s² 2s² 2p⁶ 3s² 3p⁴。
这种原子结构决定了硅的物理和化学性质。
硅元素存在多种同素异形体,其中最重要的是α晶形和β晶形。
α型硅是传统的非晶硅,具有较高的电阻率,用于传统集成电路中;而β型硅具有较高的导电性和导热性,用于现代半导体材料制备中。
硅的环境影响硅是地球上丰富的元素之一,但是大规模的硅矿开采和利用对环境造成了一定的影响。
在硅石的开采过程中,常常伴随着土地破坏、水源污染等环境问题,在硅石的加工过程中,也会产生大量的尾矿渣和工业废水等污染物。
因此,在硅石的开采和加工过程中,应该注意减少对环境的不利影响,加强环保设施建设,达到可持续发展的目标。
半导体材料硅的基本性质-推荐下载
1.3 硅的化学性质
硅在自然界中多以氧化物为主的化合物状态存在。
硅晶体在常温下化学性质十分稳定,但在高温下,硅几乎与所有物质发生化学反应。
1. 硅的热氧化反应
~1100℃
Si + O2 → SiO2
~1000℃
Si + 2H2O → SiO2 + H2 在硅表面生成氧化层,其反应程度与温度有相当大的关系,随温度的升高,氧化速度加
1.3 半导体根据其是否掺杂又可以分为本征半导体和非本征半导体,它们的定义分别为: 本征半导体:当半导体中无杂质掺入时,此种半导体称为本征半导体。 非本征半导体:当半导体被掺入杂质时,本征半导体就成为非本征半导体。
1.4 掺入本征半导体中的杂质,按释放载流子的类型分为施主与受主,它们的定义分别为: 施主:当杂质掺入半导体中时,若能释放一个电子,这种杂质被称为施主。如磷、砷就
是硅的施主。 受主:当杂质掺入半导体中时,若能接受一个电子,就会相应地产生一个空穴,这种杂
质称为受主。如硼、铝就是硅的受主。
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术通关,1系电过,力管根保线据护敷生高设产中技工资术艺料0不高试仅中卷可资配以料置解试技决卷术吊要是顶求指层,机配对组置电在不气进规设行范备继高进电中行保资空护料载高试与中卷带资问负料题荷试2下卷2,高总而中体且资配可料置保试时障卷,各调需类控要管试在路验最习;大题对限到设度位备内。进来在行确管调保路整机敷使组设其高过在中程正资1常料中工试,况卷要下安加与全强过,看度并22工且22作尽22下可22都能22可地护以缩1关正小于常故管工障路作高高;中中对资资于料料继试试电卷卷保破连护坏接进范管行围口整,处核或理对者高定对中值某资,些料审异试核常卷与高弯校中扁对资度图料固纸试定,卷盒编工位写况置复进.杂行保设自护备动层与处防装理腐置,跨高尤接中其地资要线料避弯试免曲卷错半调误径试高标方中高案资等,料,编试要5写、卷求重电保技要气护术设设装交备备置底4高调、动。中试电作管资高气,线料中课并敷3试资件且、设卷料中拒管技试试调绝路术验卷试动敷中方技作设包案术,技含以来术线及避槽系免、统不管启必架动要等方高多案中项;资方对料式整试,套卷为启突解动然决过停高程机中中。语高因文中此电资,气料电课试力件卷高中电中管气资壁设料薄备试、进卷接行保口调护不试装严工置等作调问并试题且技,进术合行,理过要利关求用运电管行力线高保敷中护设资装技料置术试做。卷到线技准缆术确敷指灵设导活原。。则对对:于于在调差分试动线过保盒程护处中装,高置当中高不资中同料资电试料压卷试回技卷路术调交问试叉题技时,术,作是应为指采调发用试电金人机属员一隔,变板需压进要器行在组隔事在开前发处掌生理握内;图部同纸故一资障线料时槽、,内设需,备要强制进电造行回厂外路家部须出电同具源时高高切中中断资资习料料题试试电卷卷源试切,验除线报从缆告而敷与采设相用完关高毕技中,术资要资料进料试行,卷检并主查且要和了保检解护测现装处场置理设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
硅(si)材料特点

硅(Si)是一种非金属元素,具有以下特点:
1. 高熔点和高热稳定性:硅具有较高的熔点(约为1414°C),因此在高温环境下能够保持稳定性。
这使得硅在高温应用中表现出色,例如在半导体制造中的炉管、炉膛等设备。
2. 半导体性质:硅是一种重要的半导体材料,其电导率介于金属和非金属之间。
通过控制硅的杂质浓度和结构,可以将硅制成p型或n型半导体,用于制造电子器件如集成电路(IC)、太阳能电池等。
3. 良好的机械性能:硅具有较高的硬度,且具有较好的抗拉强度和耐磨性。
这使得硅在一些应用领域中作为结构材料使用,例如制造光学窗口、传感器封装等。
4. 化学惰性:硅在常温下对大多数酸和碱都具有较好的耐腐蚀性。
这使得硅在化学实验室、化学工业中常被用作反应容器、仪器设备的制造材料。
5. 高纯度和可控性:硅可以通过精细的提纯工艺制备高纯度的晶体硅,用于半导体材料的制备。
此外,硅的物理和电学性质可以通过控制晶体结构和取向进行调控,以满足具体应
用需求。
6. 可广泛应用:硅材料广泛应用于电子、光电、光学、化工等领域。
在电子行业中,硅是制造集成电路和其他电子器件的基本材料。
在太阳能产业中,硅是制造太阳能电池的关键材料。
总体而言,硅作为一种重要的材料,在半导体、光电和化工等领域发挥着重要作用,其特点包括高热稳定性、半导体性质、机械性能和化学惰性等。
半导体材料硅基本性质
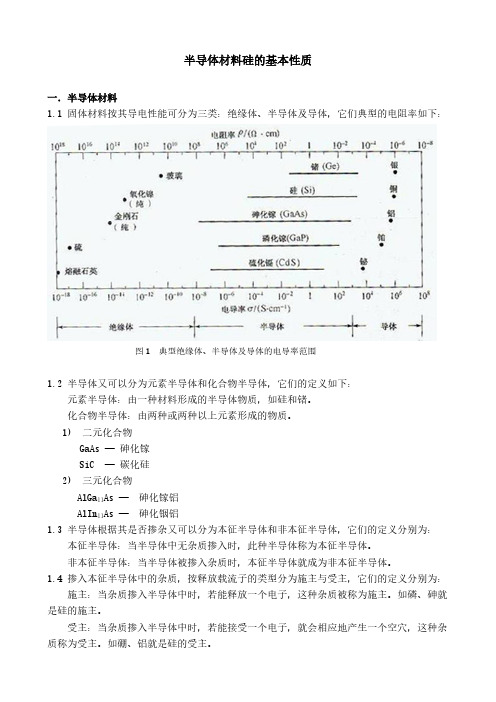
半导体材料硅的基本性质一.半导体材料固体材料按其导电性能可分为三类:绝缘体、半导体及导体,它们典型的电阻率如下:图1 典型绝缘体、半导体及导体的电导率范围半导体又可以分为元素半导体和化合物半导体,它们的定义如下:元素半导体:由一种材料形成的半导体物质,如硅和锗。
化合物半导体:由两种或两种以上元素形成的物质。
1)二元化合物GaAs —砷化镓SiC —碳化硅2)三元化合物As —砷化镓铝AlGa11AlInAs —砷化铟铝11半导体根据其是否掺杂又可以分为本征半导体和非本征半导体,它们的定义分别为:本征半导体:当半导体中无杂质掺入时,此种半导体称为本征半导体。
非本征半导体:当半导体被掺入杂质时,本征半导体就成为非本征半导体。
掺入本征半导体中的杂质,按释放载流子的类型分为施主与受主,它们的定义分别为:施主:当杂质掺入半导体中时,若能释放一个电子,这种杂质被称为施主。
如磷、砷就是硅的施主。
受主:当杂质掺入半导体中时,若能接受一个电子,就会相应地产生一个空穴,这种杂质称为受主。
如硼、铝就是硅的受主。
图(a)带有施主(砷)的n型硅 (b)带有受主(硼)的型硅掺入施主的半导体称为N型半导体,如掺磷的硅。
由于施主释放电子,因此在这样的半导体中电子为多数导电载流子(简称多子),而空穴为少数导电载流子(简称少子)。
如图所示。
掺入受主的半导体称为P型半导体,如掺硼的硅。
由于受主接受电子,因此在这样的半导体中空穴为多数导电载流子(简称多子),而电子为少数导电载流子(简称少子)。
如图所示。
二.硅的基本性质硅的基本物理化学性质硅是最重要的元素半导体,是电子工业的基础材料,其物理化学性质(300K)如表1所示。
性质符号单位硅(Si)原子序数Z 14原子量M原子密度个/cm3 ×1022晶体结构金刚石型晶格常数 a Å熔点Tm ℃1420 密度(固/液) ρg/ cm3介电常数ε0个/ cm3×1010本征载流子浓度ni本征电阻率ρi Ω·cm ×105电子迁移率μn cm2/(V·S) 1350空穴迁移率μp cm2/(V·S) 480电子扩散系数Dncm2/S空穴扩散系数Dp cm2/S禁带宽度(25℃)Eg eV导带有效态密度Nc cm-3×1019价带有效态密度Nvcm-3×1019器件最高工作温度℃250表1 硅的物理化学性质(300K)硅的电学性质硅的电学性质有两大特点:一、导电性介于半导体和绝缘体之间,其电阻率约在10-4~1010Ω·cm二、导电率和导电类型对杂质和外界因素(光热,磁等)高度敏感。
硅的性质及有关半导体基础理论
硅是典型的具有半导体性质的元素,是很重要的半导体 材料。据统计,目前半导体器件的95﹪以上用硅材料制作,集 成电路99﹪以上是用硅材料制作。
这个比例还在增大。尤其大规模集成电路(LSI)、超大 规模集成电路(VLSI)、甚大规模集成电路(ULSI)都是制作 在高纯优质的硅单晶抛光片或外延片上。
*对于绝缘体而言,价电子紧密地局限在其原子轨道,无法导电。 *对于具有金刚石结构的硅,每个原子与邻近四个原子构成键合。
Z +4
X 金刚石晶格中四面体结构
+4
+4
+4
Y
+4
在金刚石二维空间 结构的键合情况
上面已讲述硅原子的最外层轨道具有四个价电子。它可以与四个临近原子分享其价电子,所以这样的一对分享价电 子即成为共价键。
• 由于半导体的Eg比较小,所以在一定温度下具有能量较大的电子就越过禁带进入导带。使原来空着的导带 有了电子,而且在价带中也出现了一些电子的空位,这样导带中的电子和价带中的电子,在外电场的作用 下,都可作定向运动。因此,半导体在一定的温度下具有导电性。
1、半导体的导电机构—电子和空穴。
电子自价带激发到导带,不仅使导带有了导电的功能,而且原来价带由于有一些状态空了出来,也获得了一 定的导电性能。这一事实在半导体的导电机购具有十分重要的意义。
• 。
绝缘体和半导体,它的电子大多数都处于价带,不能自由移动。但在热、光等外界因素的作用下,可以使少量 价带中的电子越过禁带,跃迁到导带上去成为载流子。
绝缘体和半导体的区别主要是禁带的宽度不同。半导体的禁带很窄,(一般低于3eV),绝缘体的禁带宽一 些,电子的跃迁困难得多。因此,绝缘体的载流子的浓度很小,导电性能很弱。实际绝缘体里,导带里的电子 不是没有,并且总有一些电子会从价带跃迁到导带,但数量极少。所以,在一般情况下,可以忽略在外场作用 下它们移动所形成的电流。但是,如果外场很强,束缚电荷挣脱束缚而成为自由电荷,则绝缘体就会被“击穿” 而成为导体。
硅的基本性质
硅的基本性质硅属元素周期表第三周期ⅣA族,原子序数l4,原子量28.085。
硅原子的电子排布为1s22s22p63s23p2,原子价主要为4价,其次为2价,因而硅的化合物有二价化合物和四价化合物,四价化合物比较稳定。
地球上硅的丰度为25.8%。
硅在自然界的同位素及其所占的比例分别为:28Si为92.23%,29Si为4.67%,30Si为3.10%。
硅晶体中原子以共价键结合,并具有正四面体晶体学特征。
在常压下,硅晶体具有金刚石型结构,晶格常数a=0.5430nm,加压至l5GPa,则变为面心立方型,a=0.6636nm。
硅是最重要的元素半导体,是电子工业的基础材料,它的许多重要的物理化学性质,如表1.1 所示。
表1.1 硅的物理化学性质(300K)[4,6]①本书中关于分子、原子、离子密度、浓度的单位简写为cm-3或cm-2。
续表性质符号单位硅(Si)磁化率德拜温度介电常数本征载流子浓度本征电阻率电子迁移率空穴迁移率电子有效质量空穴有效质量电子扩散系数空穴扩散系数禁带宽度(25℃) 导带有效态密度价带有效态密度器件最高工作温度χθDε0n iρiμnμpm n﹡m p﹡D nD pE g(△W e)N cN v厘米-克-秒电磁制K个/cm3Ω·cmcm2/(V·s)cm2/(V·s)ggcm2/scm2/seVcm-3cm-3℃-0.13×10-665011.91.5×10102.3×l051350480m n﹡‖= 0.92m0m n﹡⊥= 0.19m0(1.26K)m h﹡p= 0.59m0m l﹡p =0.16m0(4K)34.612.31.112.8×10191.04×1019250硅的基本物理和化学性质硅的电学性质半导体材料的电学性质有两个十分突出的特点,一是导电性介于导体和绝缘体之间,其电阻率约在10-4~1010Ω·cm范围内;二是电导率和导电型号对杂质和外界因素(光、热、磁等)高度敏感。
硅的基本特性和用途
硅的基本特性和用途硅是一种非金属元素,化学符号是Si,原子序数14,相对原子质量28.09。
我国曾称它为矽,因矽和锡同音,难以分辨,故于1953年将矽改称为硅。
硅有无定型和晶体两种同素异形体,晶体硅具有金属光泽和某些金属特性,因此常被称为准金属元素。
晶体硅为钢灰色,无定形硅为黑色,密度2.4g/cm3,熔点1420℃,沸点2355℃,晶体硅属于原子晶体,硬而有光泽,有半导体性质。
硅的化学性质比较活泼,在高温下能与氧气等多种元素化合,不溶于水、硝酸和盐酸,溶于氢氟酸和碱液,用于制造合金如硅铁、硅钢等。
硅是地球上储藏最丰富的材料之一,在自然界分布极广,它是构成矿物与岩石的主要元素。
在自然界硅无游离状态,都存在于化合物中。
硅的化合物主要是二氧化硅(硅石)和硅酸盐。
硅约占地壳总质量的27.72%,仅次于氧。
造房子用的砖、瓦、砂石、水泥、玻璃、吃饭、喝水用的瓷碗、水杯,洗脸间用的洁具,它们看上去截然不同,其实主要成分都是硅的化合物。
虽然人们早在远古时代便使用硅的化合物黏土制造陶器。
但直到1923年,瑞典化学家贝采利乌斯才首次分离出硅元素,并将硅在氧气中燃烧生成二氧化硅,确定硅为一种化学元素。
硅是一种重要的半导体材料,掺微量杂质的硅单晶可用来制造大功率晶体管、整流器和太阳能电池等。
二氧化硅(硅石)是最普通的化合物,在自然界中分布极广,构成各种矿物和岩石。
最重要的晶体硅石是石英。
大而透明的石英晶体称为水晶,黑色几乎不透明的石英晶体叫墨晶。
石英的硬度为7。
石英玻璃能透过紫外线,可以用来制造贡蒸汽紫外光灯和光学仪器。
自然界中还有无定形的硅,称为硅藻土,常用作甘油炸药(硝化甘油)的吸附体,也可作绝热、隔音材料。
普通的砂子是制造玻璃、陶瓷、水泥和耐火材料等的原料。
硅酸干燥脱水后的产物为硅胶,它有很强的吸附能力,能吸收各种气体,因此常用来作吸附剂,干燥剂和部分催化剂的载体。
多晶硅和石英玻璃的联合制备法的原料就是硅。
但这种硅不是天然形成的,是经过工业方法制取的,而且有用于工业生产中,因此被称为工业硅。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
半导体材料硅的基本性质一.半导体材料1.1 固体材料按其导电性能可分为三类:绝缘体、半导体及导体,它们典型的电阻率如下:图1 典型绝缘体、半导体及导体的电导率范围1.2 半导体又可以分为元素半导体和化合物半导体,它们的定义如下:元素半导体:由一种材料形成的半导体物质,如硅和锗。
化合物半导体:由两种或两种以上元素形成的物质。
1)二元化合物GaAs —砷化镓SiC —碳化硅2)三元化合物As —砷化镓铝AlGa11AlInAs —砷化铟铝111.3 半导体根据其是否掺杂又可以分为本征半导体和非本征半导体,它们的定义分别为:本征半导体:当半导体中无杂质掺入时,此种半导体称为本征半导体。
非本征半导体:当半导体被掺入杂质时,本征半导体就成为非本征半导体。
1.4 掺入本征半导体中的杂质,按释放载流子的类型分为施主与受主,它们的定义分别为:施主:当杂质掺入半导体中时,若能释放一个电子,这种杂质被称为施主。
如磷、砷就是硅的施主。
受主:当杂质掺入半导体中时,若能接受一个电子,就会相应地产生一个空穴,这种杂质称为受主。
如硼、铝就是硅的受主。
图1.1 (a)带有施主(砷)的n型硅 (b)带有受主(硼)的型硅1.5 掺入施主的半导体称为N型半导体,如掺磷的硅。
由于施主释放电子,因此在这样的半导体中电子为多数导电载流子(简称多子),而空穴为少数导电载流子(简称少子)。
如图1.1所示。
掺入受主的半导体称为P型半导体,如掺硼的硅。
由于受主接受电子,因此在这样的半导体中空穴为多数导电载流子(简称多子),而电子为少数导电载流子(简称少子)。
如图1.1所示。
二.硅的基本性质1.1 硅的基本物理化学性质硅是最重要的元素半导体,是电子工业的基础材料,其物理化学性质(300K)如表1所示。
性质符号单位硅(Si)原子序数Z 14原子量M 28.085原子密度个/cm3 5.00×1022晶体结构金刚石型晶格常数 a Å 5.43熔点Tm ℃1420 密度(固/液) ρg/ cm3 2.329/2.533介电常数ε0 11.9 本征载流子浓度n个/ cm3 1.5×1010i本征电阻率ρi Ω·cm 2.3×105电子迁移率μn cm2/(V·S) 1350表1 硅的物理化学性质(300K)1.2 硅的电学性质硅的电学性质有两大特点:一、导电性介于半导体和绝缘体之间,其电阻率约在10-4~1010Ω·cm二、导电率和导电类型对杂质和外界因素(光热,磁等)高度敏感。
无缺陷的、无掺杂的硅导电性极差,称为本征半导体。
当掺入极微量的电活性杂质,其电导率将会显著增加,称为非本征半导体。
例如,向硅中掺入亿份之一的硼,其电阻率就降为原来的千分之一。
掺入不同的杂质,可以改变其导电类型。
当硅中掺杂以施主杂质(ⅴ族元素:磷、砷、锑等)为主时,以电子导电为主,成为N型硅;当硅中掺杂以受主杂质(Ⅲ族元素:硼、铝、镓等)为主时,以空穴导电为主,成为P型硅。
硅中P型和N型之间的界面形成PN结,它是半导体器件的基本机构和工作基础。
如图所示电阻率随杂质浓度的变化1.3 硅的化学性质硅在自然界中多以氧化物为主的化合物状态存在。
硅晶体在常温下化学性质十分稳定,但在高温下,硅几乎与所有物质发生化学反应。
1.硅的热氧化反应~1100℃Si + O2 → SiO2 ~1000℃Si + 2H2O → SiO2+ H2在硅表面生成氧化层,其反应程度与温度有相当大的关系,随温度的升高,氧化速度加快。
2.硅与氯气(Cl2)或氯化物(HCl)的化学反应~300℃Si + 2Cl2 → SiCl4~280℃Si + 3HCl→ SiHCl3 + H2上面两个反应常用来制造高纯硅的基本材料—SiCl4和SiHCl3。
3.硅与酸的化学反应硅对多数酸是稳定的,硅不能被HCl、H2SO4、HNO3、HF及王水所腐蚀,但可以被其混合液所腐蚀。
(1)硅与HF—HNO3混合液的化学反应Si + 4HNO3 + 6HF → H2SiF6+ 4NO2+ 4H2OHNO3在反应中起氧化作用,没有氧化剂存在,H就不易与硅发生反应。
此反应在硅的缺陷部位腐蚀快,对晶向没有选择性。
(2)硅与HF—CrO3混合液有化学反应Si + CrO3 + 8HF → H2SiF6+ CrF2+ 3H2O此混合液是硅单晶缺陷的择优腐蚀显示剂,缺陷部位腐蚀快。
(3)硅与金属的作用硅与金属作用可生成多种硅化物,如TiSi2,W Si2,MoSi等硅化物具有良好的导电性、耐高温、抗电迁移等特性,可以用来制备集成电路内部的引线、电阻等元件。
(4)硅与SiO2的化学反应1400℃Si + SiO2→ 2SiO在直拉法(CZ)制备硅单晶时,因为使用超纯石英坩埚(SiO2),石英坩埚与硅熔体会发生上述反应。
反应生成物SiO一部分从硅熔体中蒸发出来,另外一部分溶解在熔硅中,从而增加了熔硅中氧的含量,成为硅中氧的主要来源。
在拉制单晶时,单晶炉内须采用真空环境或充以低压高纯惰性气体,这种工艺可以有效防止外界沾污,并且随着SiO蒸发量的增大而降低熔硅中的氧含量,同时,在炉腔壁上减缓SiO沉积,以避免SiO粉末影响无位错单晶生长。
1.4 硅的晶体结构和化学键1.硅的晶体结构硅晶体为金刚石结构,四个最近邻原子构成共价四面体。
如图2.1和图2.2所示。
图2.1 共价四面体图2.2 硅的晶体结构2.硅晶体的化学键硅晶体中的化学键为典型的共价键,共价键是通过价电子的共有化形成的。
具体说来,共价键是由两原子间一对自旋相反的共有电子形成的。
电子的配对是形成共价键的必要条件。
硅晶体中的每个原子都与4个最近邻原子形成四对自旋相反的共有电子,构成4个共价键。
硅原子的最外层价电子分布为3s23p2,3s能级最多能容纳2个自旋相反的电子,现已有2个自旋相反的电子配成对了。
3p能级最多可容纳6个电子,现只有2个电子。
根据洪特规则,即共价轨道上配布的电子将尽可能分占不同的轨道,且自旋平行。
那么,两个p电子将分别占据两个p轨道,而空出一个p轨道。
如此,硅原子的价电子配布为:3s 3p按照这种配布,s轨道的两个电子已配成对了,不能再配对。
只有p 轨道上的2个电子尚未配对,可以和最近邻原子的价电子配成两对。
这样每个原子只能和最近邻原子形成2个共价键,而实际上却是4个共价键。
这个矛盾靠轨道的杂化来解决。
硅原子的3s上的电子可以激发到3p上去,形成新的sp3杂化轨道:3s 3psp3杂化轨道有4个未配对的电子,故可以形成4个共价键。
虽然3s能级上的电子激发到3p能级上去需要一定的能量,但形成2个共价键所放出的能量更多,结果体系更趋稳定。
共价键有两个重要特性:饱和性和方向性。
所谓饱和性是1个电子和1个电子配对以后,就不能再与第3个电子配对了。
硅原子轨道杂化以后,有4个未配对的价电子。
这4个电子分别与最近邻原子中的1个价电子配成自旋相反的电子对,形成4个共价键。
因此,硅晶体中的任一原子能够形成的共价键数目最多为4。
这个特性就是共价键的饱和性。
所谓共价键的方向性是指原子只在特定的方向上形成共价键。
硅原子的四个sp3杂化轨道是等同的,各含有1/4s和3/4p成分,它们两两之间的夹角为109°28′。
所以,它们的对称轴必须指向正四面体的四角。
而且,共价键的强弱取决于形成共价键的两个电子轨道相互交叠的程度,交叠愈多,共价键愈强。
因此,硅原子结合时的4个共价键取四面体顶角方向,因为2个最近邻原子的sp3杂化轨道在四面体顶角方向重叠最大,故共价键取这些方向,这就决定了硅晶体为金刚石结构。
1.5 硅的半导体性质1. 硅原子能级图图2.3 一孤立硅原子能级图2. 硅晶体的能带结构图2.4 硅晶体的能带结构图晶体的能带代表的物理意义:反应了晶体中电子的运动状态具有介于孤立原子中电子与自由电子之间这样一种特性。
设想,固体中各个原子之间没有相互作用,相距较远,彼此孤立,那么,许多电子都处在相同的能级上。
实际上,原子通过电子,特别是外层电子的相互作用,改变了独立原子中电子的能量,N 个孤立原子的一个能级扩层或分裂成N个间隔很近的能级,组成一个能带。
如图2.5所示。
图2.5 原子能级和能带3. 导体、半导体及绝缘体的能带模型能带理论可以说明导体、半导体和绝缘体的区别,如图2.6所示。
金属导体有被电子部分占据的能带,称为导带。
在导带中,空态的能量与被占态的能量相连接。
能带填充情况很容易被外电场作用所改变,表现出良好的导电性。
半导体和绝缘体在T=0K时电子恰好填满较低的一系列能带,其余能带全空着。
最高被填充的能带与其上的空带之间隔着禁带(带隙)。
外电场很难改变其能带填充状况,因而不产生电流。
在T≠0K时,由于半导体的禁带宽度较窄,一般在1~2eV左右,会有少量电子从最高的满带(即价带)跃迁到空带(即导带),成为导电电子,同时价带中出现少量空穴,自由的电子和空穴在外电场作用下漂移运动,因此,半导体具有一定的导电性。
绝缘体的禁带较宽,这种热激发很少,所以导电性很差。
4. 硅晶体的禁带宽度Eg禁带宽度Eg是半导体材料的一个重要参数。
Eg的大小大体上和光吸收的阀值能量及光发射的光波长限相对应,即和光电应用的波长范围密切联系着。
较大的Eg有利于提高半导体器件的热稳定性。
Eg的大小还与温度有直接的关系,在一定的温度范围内Eg随T线性变化,但当T→0K 时,Eg趋于一个常数,如图2.7所示。
图2.7 Si的禁带宽度Eg随温度的变化5. 硅中杂质的能级和缺陷能级理想的硅晶体,即无缺陷无掺杂的半导体硅,禁带中没有其它能级存在,具有本征电导特性,称为本征半导体。
当掺入杂质或有缺陷时,禁带中将有杂质或缺陷能及存在,将明显影响半导体性能,对电导起主要作用。
实际半导体都会有一定的杂质,所形成有电导超过本征电导,称为杂质半导体或非本征半导体。
硅中的杂质能级如图2.8所示。
图2.8 硅中杂质能级a. 浅能级杂质在硅中的Ⅲ,Ⅴ族元素,杂质能级非常靠近价带或导带,对硅的电学性能起着关键性影响,如受主杂质硼和施主杂质磷。
b.深能级杂质在硅中,有些杂质的能级位于禁带中部,例如:金,银,铜,铁等重金属杂质。
电子和空穴可以通过这些复合中心使少数载流子寿命降低。
c.缺陷(原生缺陷和工艺诱生缺陷)半导体材料中各种缺陷也可以在禁带中产生能级,增加少子复合机率,降低少子寿命。
6. 载流子浓度载流子浓度随温度的变化如图2.9所示。
图2.9 以温度为函数且施主浓度为1015cm-3的硅样品的电子浓度7. PN结a. PN结的光生伏特效应光生伏特效应就是半导体二极管吸收光能后在PN结两端产生电动势的效应。
b. 光电转换的物理过程①吸收光能激发出非平衡电子一空穴对②非平衡电子和空穴从产生处向非均匀势场区运动③非平衡电子和空穴在内建电场作用下向相反方向运动而分离,在PN结两端产生电势④将PN结用导线连接,形成电流⑤在太阳电池两端连接负载,实现了将光能向电能的转换。
