氧化还原反应的概念与实质
氧化还原反应介绍

氧化还原反应介绍一、氧化还原反应的概念氧化还原反应是化学反应中的一种重要类型哦。
在一个反应里呢,有元素的化合价发生变化,这就是氧化还原反应啦。
比如说,在铜和氧气反应生成氧化铜这个反应中,铜元素的化合价从0价升高到了 +2价,氧元素的化合价从0价降低到了 -2价呢。
这其中化合价升高的过程就叫做氧化反应,化合价降低的过程就叫做还原反应。
而且啊,氧化反应和还原反应是同时发生的,不能单独存在呀。
二、氧化还原反应的实质氧化还原反应的实质是电子的转移呢。
电子转移包括电子的得失和电子对的偏移哦。
就像钠和氯气反应生成氯化钠的时候,钠原子最外层有1个电子,它容易失去这个电子,变成带1个正电荷的钠离子,而氯原子最外层有7个电子,它容易得到1个电子,变成带1个负电荷的氯离子。
这个过程中就有电子的得失。
再比如说在氯化氢分子中,氢原子和氯原子形成共价键的时候,电子对偏向氯原子一方,这就是电子对的偏移,这也是氧化还原反应中电子转移的一种形式呢。
三、氧化还原反应中的氧化剂和还原剂1. 氧化剂氧化剂在氧化还原反应中是得到电子(或者电子对偏向)的物质呢。
它具有氧化性,在反应中使其他物质氧化,自身被还原。
常见的氧化剂有氧气、氯气、硝酸、浓硫酸等。
例如在碳和氧气反应中,氧气就是氧化剂,它得到电子,碳被氧化。
2. 还原剂还原剂在氧化还原反应中是失去电子(或者电子对偏离)的物质。
它具有还原性,在反应中使其他物质还原,自身被氧化。
常见的还原剂有金属单质(如铁、铝等)、氢气、一氧化碳等。
比如在氢气还原氧化铜的反应中,氢气就是还原剂,它失去电子,氧化铜被还原。
四、氧化还原反应的表示方法1. 双线桥法双线桥法是一种用来表示氧化还原反应中电子转移情况的方法哦。
它的步骤是这样的:首先,找出反应前后化合价发生变化的元素,然后从反应物中化合价升高的元素指向生成物中对应的元素,标上失去电子的数目;再从反应物中化合价降低的元素指向生成物中对应的元素,标上得到电子的数目。
氧化还原反应的实质与特质是什么

氧化还原反应的实质与特质是什么
氧化-还原反应是化学反应前后,元素的氧化数有变化的一类反应。
氧化还原反应的实质是电子的得失或共用电子对的偏移。
氧化还原反应是化学反应中的三大基本反应之一。
1 什幺是氧化还原反应氧化还原反应的实质:电子的得失或偏移。
氧化还原反应是在反应前后,某种元素的化合价有变化的化学反应。
这种反应可以理解成由两个半反应构成,即氧化反应和还原反应。
反应的本质是化合价有变化,即电子有转移和偏移。
化和价升高,即失电子的半反应是氧化反应;氧化数降低,得电子的反应是还原反应。
化合价升高的物质还原对方,自身被氧化,因此叫还原剂,其产物叫氧化产物;化合价降低的物质氧化对方,自身被还原,因此叫氧化剂,其产物叫还原产物。
即:
还原剂+ 氧化剂---> 氧化产物+ 还原产物
一般来说,同一反应中还原产物的还原性比还原剂弱,氧化产物的氧化性比氧化剂弱,这就是所谓“强还原剂制弱还原剂,强氧化剂制弱氧化剂”。
总结:氧化剂发生还原反应,得电子,化合价降低,有氧化性,被还原,生成还原产物。
还原剂发生氧化反应,失电子,化合价升高,有还原性,被氧化,生成氧化产物。
记法:氧化还原不可分,得失电子是根本。
失电子者被氧化,得电子者被还原。
氧化还原反应及相关概念

氧化还原反应及相关概念【知识框架】【基础回顾】一、氧化还原反应的概念(1)特征及判断依据:特征是反应前后元素化合价的升降;判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征。
(2)实质:在化学反应中有电子的转移(得失或偏移)(3)概念二、氧化还原反应中电子转移的表示方法(1)单线桥法表示氧化剂与还原剂之间电子转移的方向和总数。
注意事项:①箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素②箭头方向表示电子转移的方向③在“桥”上标明转移的是电子总数。
(2)双线桥法表示氧化剂及其还原产物、还原剂及其氧化产物之间电子转移情况。
注意事项:①箭头必须由反应物指向生成物,且两端对准同种元素。
②箭头方向不代表电子转移方向,仅表示电子转移前后的变化。
③在“桥”上标明电子的“得”与“失”,且得失电子总数应相等。
【技能方法】氧化还原反应概念分析氧化还原反应及相关概念,通过整体,关注发生过程的方法进行掌握。
在一个氧化还原反应中有:解决此类问题的关键是对分析化合价,在化合价的分析过程中注意:①先标出熟悉元素的化合价,再根据化合物中正负化合价的代数和为零的原则求解其他元素的化合价。
②个别非金属元素的化合物中元素的价态是正还是负,取决于非金属性的相对强弱。
如:Si3N4中Si显+4价,N显-3价。
【基础达标】1.下列变化属于氧化还原反应的是()A.馒头在咀嚼过程中产生甜味B.三氯化铁溶液长期放置产生红褐色固体C.蛋白质溶液中加入饱和硫酸铵溶液,析出沉淀D.植物油长期放置发生“酸败产生刺激性气味”【答案】D【解析】试题分析:有化合价升降的反应是氧化还原反应,则A、馒头在咀嚼过程中产生甜味属于水解反应,A错误;B、三氯化铁溶液长期放置产生红褐色固体。
属于复分解反应,B错误;C、蛋白质溶液中加入饱和硫酸铵溶液,析出沉淀属于蛋白质的盐析,不是氧化还原反应,C错误;D、植物油长期放置发生“酸败产生刺激性气味”属于油脂被氧化而变质,D正确,答案选D。
新教材高中化学必修一难点:氧化还原反应

新教材高中化学必修一难点:氧化还原反应一、氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
2.实质:反应过程中有电子的得失或共用电子对的偏移。
3.特征:化合价有升降。
4.氧化还原反应概念的发展二、氧化还原反应与四种基本反应类型1.四种基本类型的反应2.氧化还原反应与四种基本类型反应的关系①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2=2O3。
三、氧化还原反应的四对概念四、1.氧化剂与还原剂氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。
氧化剂具有氧化性,还原剂具有还原性。
2.氧化反应与还原反应氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
3.氧化产物与还原产物氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
4.氧化性与还原性氧化剂具有的得电子的性质称为氧化性;还原剂具有的失电子的性质称为还原性。
总之记住六字口诀:升失氧,降得还!解释:四、氧化还原反应电子转移表示方法双线桥法:(1)两条桥线从反应物指向生成物,且对准同种元素;(2)要标明“得”“失”电子,且数目要相等;(3)箭头不代表电子转移的方向。
单线桥法:(1)一条桥线表示不同元素原子得失电子的情况;(2)不需标明“得”“失”电子,只标明电子转移的数目;(3)箭头表示电子转移的方向;(4)单线桥箭头从还原剂指向氧化剂。
五、常见的氧化剂、还原剂常见的氧化剂(处于高价态的元素的单质或化合物):(1)活泼的非金属单质(F2、O2、Cl2、Br2、I2、O3等)(2)元素处于高价时的含氧酸(硝酸、浓硫酸)(3)元素处于高价时的盐:(KClO3、KMnO4、FeCl3)(4)过氧化物(H2O2、Na2O2)(5)其它(HClO)常见的还原剂(处于低价态的元素的单质或化合物):(1)活泼的金属单质:K、Na、Mg等;(2)非金属单质:H2、C、Si等;(3)低价态的化合物:CO、H2S、HI、Fe2+、NH3等。
氧化还原反应的概念

氧化还原反应的概念教学目标1.氧化还原反应的本质及特征。
2.了解常见的氧化还原反应,知道常见的氧化剂和还原剂。
3.了解氧化还原反应的一般规律。
教学重点1.理解氧化还原反应的本质和特征2.熟悉常见的氧化还原反应和氧化剂、还原剂3.基本能应用氧化还原反应的一般规律教学难点理解并能应用氧化还原反应的一般规律课时安排3课时教学方法归纳法、讲练结合法教学要点一、氧化还原反应的本质及特征1.氧化还原反应的定义在反应过程中有元素化合价变化的化学反应叫做氧化还原反应。
在氧化还原反应中,反应物所含元素化合价升高的反应称为氧化反应;反应物所含元素化合价降低的反应称为还原反应。
氧化反应和还原反应对立统一于一个氧化还原反应之中。
2.氧化还原反应的实质元素化合价的变化是电子转移的外观表现,电子转移是氧化还原反应的实质。
3. 氧化还原反应的特征(判断依据)反应前后某些元素的化合价发生了变化。
例1.氯化碘(ICl)的性质类似卤素,有很强的化学活动性。
ICl跟Zn、H2O的反应如下:①2ICl+2Zn=ZnCl2+ZnI2②ICl+H2O=HCl+HIO下列叙述中正确的是()A.反应①不是氧化还原反应B.反应②不是氧化还原反应C.二者都是氧化还原反应D.在反应①中,Zn发生的是氧化反应二、氧化剂和还原剂1.氧化剂和还原剂的相关概念氧化剂:得到电子(所含某元素化合价降低)的反应物;还原剂:失去电子(所含某元素化合价升高)的反应物。
氧化反应:失去电子(或元素化合价升高)的反应;还原反应:得到电子(或元素化合价降低)的反应。
氧化性:物质得到电子的能力或性质;还原性:物质失去电子的能力或性质。
氧化产物:氧化产物是发生氧化反应的物质的生成物;还原产物:还原产物是发生还原反应的物质的生成物。
说明:①氧化剂和还原剂均是指反应物,是一种化学物质,而不是指某一种元素;②氧化剂具有氧化性,氧化剂本身被还原,即发生还原反应,转化为还原产物;还原剂具有还原性,还原剂本身被氧化,即发生氧化反应,转化为氧化产物(图示如下):例2.在3Cu + 8HNO3(稀)= 3Cu(NO3) 2 + 2NO↑+ 4H2O的反应中,还原剂是__________,氧化剂是__________,还原产物是__________,氧化产物是__________,4molHNO3参加反应,其中被还原的是______mol。
氧化还原反应知识结构

氧化还原反应知识结构氧化还原反应是化学中一类重要的化学反应,也是化学中的一个基本概念。
其实质是电子的转移过程,即一个物质不仅失去电子,还必然有另外一种或几种物质吸收了这些电子。
这个过程就是由氧化和还原两个互为逆反的过程组成的。
下面我将从氧化还原反应的基本概念、氧化和还原的定义、氧化剂和还原剂、常见的氧化还原反应类型以及工业应用等方面进行探讨。
一、氧化还原反应的基本概念二、氧化和还原的定义氧化是指物质失去电子的过程,即负电荷变大,原子价亚稳态消失。
在化学方程中,一般以“增加氧含量、减少氢含量或增加氧化态”来表示。
还原是指物质获得电子的过程,即负电荷变小,原子价亚稳态增大。
在化学方程中,一般以“减少氧含量、增加氢含量或减少氧化态”来表示。
三、氧化剂和还原剂氧化剂是指能使其他物质发生氧化反应的物质,因为氧化剂自身会被还原。
常见的氧化剂有氧气、过氧化氢、高锰酸钾等。
还原剂是指能使其他物质发生还原反应的物质,因为还原剂自身会被氧化。
常见的还原剂有金属、非金属元素、还原性较强的化合物等。
四、常见的氧化还原反应类型1.金属与非金属离子的氧化还原反应:如铁和铜离子反应产生铁离子和铜。
2.金属与非金属原子的氧化还原反应:如锌与硫反应产生二氧化硫和锌离子。
3.单质氧化还原反应:如硫与氧反应产生二氧化硫。
4.酸与金属的氧化还原反应:如盐酸和锌反应产生氯化锌和氢气。
5.半反应的配平:在氧化还原反应中,经常需要对氧化半反应和还原半反应进行配平,以保证反应整体电荷平衡。
五、工业应用1.腐蚀防护:腐蚀是指物质表面被破坏或失去原有功能,氧化还原反应是常见的腐蚀形式之一、为了防止腐蚀,可以通过涂层、阳极保护、合金等方式来保护金属表面。
2.锂离子电池:锂离子电池是一种典型的氧化还原反应应用,通过锂离子在正极和负极之间的转移,实现电池的充放电过程。
3.化肥生产:氧化还原反应在化肥生产中起着重要作用。
例如,氨氧化反应是制造硝酸和尿素等氮肥的重要过程。
高一化学必修一知识点:氧化还原反应(人教版)

高一化学必修一知识点:氧化还原反应(人教版)【导语】以下是作者为大家推荐的有关高一化学必修一知识点:氧化还原反应(人教版),如果觉得很不错,欢迎分享~感谢你的浏览与支持!一、概念判定:1、氧化还原反应的实质:有电子的转移(得失)2、氧化还原反应的特点:有化合价的升降(判定是否氧化还原反应)3、氧化剂具有氧化性(得电子的能力),在氧化还原反应中得电子,产生还原反应,被还原,生成还原产物。
4、还原剂具有还原性(失电子的能力),在氧化还原反应中失电子,产生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化(由阳离子变单质),也可能被还原(由阴离子变单质)。
8、元素价态有氧化性,但不一定有强氧化性;元素态有还原性,但不一定有强还原性;阳离子不一定只有氧化性(不一定是价态,,如:Fe2+),阴离子不一定只有还原性(不一定是态,如:SO32-)。
9、常见的氧化剂和还原剂:10、氧化还原反应与四大反应类型的关系:【同步练习题】1.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。
S2O32-和Cl2反应的产物之一为SO42-。
下列说法不正确的是()A.该反应中还原剂是S2O32-B.H2O参与该反应,且作氧化剂C.根据该反应可判定氧化性:Cl2>SO42-D.上述反应中,每生成lmolSO42-,可脱去2molCl2答案:B点拨:该反应方程式为:S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+,该反应中氧化剂是Cl2,还原剂是S2O32-,H2O参与反应,但既不是氧化剂也不是还原剂,故选B。
2.(2011•河南开封高三一模)分析以下残缺的反应:RO3-+________+6H+===3R2↑+3H2O。
下列叙述正确的是()A.R一定是周期表中的第ⅤA族元素B.R的原子半径在同周期元素原子中最小C.上式中缺项所填物质在反应中作氧化剂D.RO3-中的R元素在所有的反应中只能被还原答案:B点拨:RO3-中R为+5价,周期表中ⅤA、ⅦA元素均可形成RO3-离子,A毛病;据元素守恒,反应中只有R、H、O三种元素,则缺项一定为R-,且配平方程式为RO3-+5R-+6H+===3R2↑+3H2O,据此可得R为ⅦA元素,B正确;R-中R处于态,只能作还原剂,C毛病;RO3-中R元素处于中间价态,在反应中既可被氧化又可被还原,D项错。
氧化还原反应知识点总结
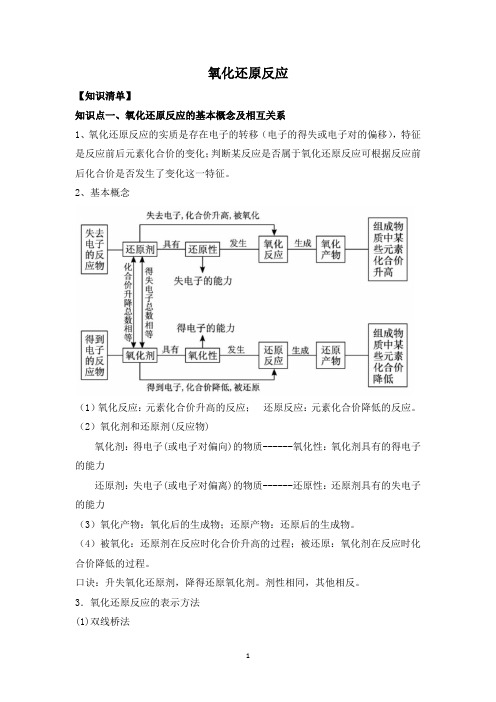
氧化还原反应【知识清单】知识点一、氧化还原反应的基本概念及相互关系1、氧化还原反应的实质是存在电子的转移(电子的得失或电子对的偏移),特征是反应前后元素化合价的变化;判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征。
2、基本概念(1)氧化反应:元素化合价升高的反应;还原反应:元素化合价降低的反应。
(2)氧化剂和还原剂(反应物)氧化剂:得电子(或电子对偏向)的物质------氧化性:氧化剂具有的得电子的能力还原剂:失电子(或电子对偏离)的物质------还原性:还原剂具有的失电子的能力(3)氧化产物:氧化后的生成物;还原产物:还原后的生成物。
(4)被氧化:还原剂在反应时化合价升高的过程;被还原:氧化剂在反应时化合价降低的过程。
口诀:升失氧化还原剂,降得还原氧化剂。
剂性相同,其他相反。
3.氧化还原反应的表示方法(1)双线桥法箭头必须由反应物指向生成物,且两端对准同种元素。
箭头方向不代表电子转移方向,仅表示电子转移前后的变化。
在“桥”上标明电子的“得到”与“失去”,且得失电子总数应相等。
如:(2)单线桥法箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示电子转移的方向。
在“桥”上标明转移的电子总数。
4.氧化还原反应与四种基本反应类型的关系(1)有单质参加的化合反应一定是氧化还原反应;(2)有单质生成的分解反应一定是氧化还原反应;(3)置换反应一定是氧化还原反应;(4)复分解反应一定不是氧化还原反应。
知识点二、常见的氧化剂和还原剂(1)常见的氧化剂:①活泼的非金属单质:F2、O2、O3、Cl2等;②含有高价态元素的化合物:HNO3、KMnO4、K2Cr2O7、浓H2SO4等;③某些金属元素的高价态离子:Fe3+、Cu2+等;④其它:H2O2、Na2O2、HClO等。
(2)常见的还原剂:①活泼的金属单质:K、Na、Fe、Mg等;②含有低价态元素的化合物:H2S、HI、CO2、SO2、H2SO3等;③某些非金属单质:H2、C等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原反应的概念与实质1.对于反应2P +4H 2O 2+2NaOH===Na 2H 2P 2O 6+4H 2O ,下列有关该反应的说法正确的是( ) A .P 是氧化剂B .氧化性:H 2O 2>Na 2H 2P 2O 6C .1 mol H 2O 2反应,转移电子1 molD .Na 2H 2P 2O 6中磷元素的化合价为+32.(2018·哈尔滨六中高三月考)新型纳米材料MFe 2O x (3<x <4)中M 表示+2价的金属元素,在反应中化合价不发生变化。
常温下,MFe 2O x 能使工业废气中的SO 2转化为S ,流程如下,则下列判断正确的是( )MFe 2O x ――→常温下SO2MFe 2O y A .MFe 2O x 是氧化剂 B .SO 2是该反应的催化剂 C .x <yD .MFe 2O y 是还原产物3.(2017·温州中学10月高考模拟)已知NH 4CuSO 3与足量的1 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。
据此判断下列说法合理的是( )A .NH 4CuSO 3中硫元素被氧化了B .该反应中NH 4CuSO 3既是氧化剂又是还原剂C .刺激性气味的气体是二氧化硫或氨气D .该反应中硫酸既表现酸性又表现氧化性4.(2017·山东师大附中高三模拟)Na 2FeO 4是一种高效多功能水处理剂,应用前景十分看好。
一种制备Na 2FeO 4的方法可用化学方程式表示如下:2FeSO 4+6Na 2O 2 ===2Na 2FeO 4 +2Na 2O +2Na 2SO 4 +O 2↑,对此反应下列说法中正确的是( ) A .Na 2O 2只作氧化剂B .2 mol FeSO 4发生反应时,反应中共有8 mol 电子转移C .每生成16 g 氧气就有1 mol Fe 2+被还原D .Na 2FeO 4既是还原产物又是氧化产物5.(2018·安徽江南十校联考)水热法制备纳米颗粒Y(化合物)的反应为3Fe 2++2S 2O 2-3+O 2+a OH -===Y +S 4O 2-6+2H 2O ,下列有关说法不正确的是( )A .a =4B .Y 的化学式为Fe 2O 3C .S 2O 2-3是还原剂D .每32 g O 2参加反应,转移电子的物质的量为4 mol6.下列反应中,氧化剂与还原剂的物质的量之比为1∶2的是( ) ①O 3+2KI +H 2O===2KOH +I 2+O 2 ②SiO 2+2C=====高温Si +2CO ↑ ③SiO 2+3C=====高温SiC +2CO ↑④4HCl(浓)+MnO 2=====△MnCl 2+Cl 2↑+2H 2O A .仅有② B .仅有②④ C .仅有②③④D .①②③④7.(2017·湖南百强六校联考)多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制品的主要原料。
已知多晶硅第三代工业制取流程如图所示:下列说法错误的是( ) A .Y 、Z 分别为H 2、Cl 2B .制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1∶1C .SiHCl 3极易水解,其完全水解的产物为H 2SiO 3、H 2、HCl ,据此推测SiHCl 3中硅元素的化合价为+2价D .Y 与SiHCl 3制备多晶硅的反应属于置换反应8.(2018·本溪市高级中学诊断)CsICl 2是一种铯的化合物,该物质在化学反应中既可表现氧化性又可表现还原性,并且受热易分解,有关该物质的说法错误的是( ) A .该物质中Cs 显+1价B .CsICl 2受热分解的方程式为CsICl 2=====△CsI +Cl 2↑ C .在CsICl 2溶液中通入SO 2能生成SO 2-4D .CsICl 2溶液能使KI-淀粉溶液变蓝9.(2017·海南中学高三模拟)铜的冶炼大致可分为①富集,将硫化物矿进行浮选;②焙烧,主要反应为2CuFeS 2+4O 2===Cu 2S +3SO 2+2FeO(炉渣);③制粗铜,在1 200 ℃发生的主要反应为2Cu 2S +3O 2===2Cu 2O +2SO 2,2Cu 2O +Cu 2S===6Cu +SO 2↑;④电解精炼铜。
按要求填写下列问题:(1)上述灼烧过程的尾气回收后可用来制_______________________________________。
(2)上述过程中,由6 mol CuFeS 2制取6 mol Cu 时共消耗O 2的物质的量为_________。
(3)在反应2Cu 2O +Cu 2S===6Cu +SO 2↑中,氧化产物与还原产物的物质的量之比为__________。
(4)在反应2Cu2O+Cu2S===6Cu+SO2↑中,氧化剂为_________________。
10.(2017·山东青岛一模)用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的工业流程如图。
已知:①草酸钴晶体难溶于水;②RH为有机物(难电离)。
(1)H2O2是一种绿色氧化剂,写出加入H2O2后发生反应的离子方程式________________。
(2)加入氧化钴的目的是_______________________________。
(3)草酸钴晶体分解后可以得到多种钴的氧化物(其中Co的化合价为+2、+3),取一定量钴的氧化物,用280 mL 5 mol·L-1盐酸恰好完全溶解,并得到CoCl2溶液和2.24 L(标准状况)黄绿色气体,由此可确定该钴氧化物中Co、O的物质的量之比为________。
(4)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O2-4),测定溶液中C2O2-4的浓度,写出此反应的离子方程式_____________________________;KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果________(填“偏高”“偏低”或“无影响”)。
答案精析1.B [P 由0价→+4价,化合价升高,属于还原剂,故A 错误;根据氧化还原反应的规律,氧化剂的氧化性强于氧化产物的氧化性,H 2O 2是氧化剂,Na 2H 2P 2O 6是氧化产物,故B 正确;1 mol H 2O 2反应,转移电子的物质的量为1 mol×2×(2-1)=2 mol ,故C 错误;Na 、H 的化合价均为+1价,O 为-2价,根据化合物中各元素正、负化合价的代数和为0,则P 的化合价为+4价,故D 错误。
]2.C [SO 2转化为S ,S 元素化合价降低,说明SO 2在反应中作氧化剂,则MFe 2O x 为还原剂,故A 错误;SO 2在反应中为氧化剂,不是催化剂,B 错误;C 项,MFe 2O x 为还原剂生成MFe 2O y ,反应后Fe 元素的化合价升高,根据化合价代数和为0,则有(2y -2)>(2x -2),即x <y ,C 正确;SO 2在反应中作氧化剂,则MFe 2O x 为还原剂,所以MFe 2O y 是氧化产物,D 错误。
] 3.B4.D [2FeSO 4+6Na 2O 2===2Na 2FeO 4+2Na 2O +2Na 2SO 4+O 2↑反应中,Fe 元素的化合价升高,由+2价升高到+6价,Na 2O 2中O 元素的化合价既升高又降低,反应中既是氧化剂又是还原剂,A 错误;反应中化合价升高的元素有Fe ,由+2价→+6价,化合价升高的元素还有O 元素,由-1价→0价,2 mol FeSO 4发生反应时,共有2 mol×4+1 mol×2=10 mol 电子转移,B 错误;16 g 氧气的物质的量为0.5 mol ,生成0.5 mol O 2,有1 mol Fe 2+被氧化,C错误;FeSO 4→Na 2FeO 4,Fe 的化合价升高,Na 2FeO 4是氧化产物,Na 2O 2→Na 2FeO 4,O 元素化合价降低,Na 2FeO 4是还原产物,D 正确。
] 5.B 6.C7.B [A 项,电解饱和食盐水的产物有氢氧化钠、氢气、氯气,由于Y 参与了SiHCl 3的还原反应,故为H 2,Y 、Z 点燃后的产物与硅反应生成SiHCl 3,故Z 为Cl 2,正确;B 项,焦炭与石英反应生成碳化硅的化学方程式为SiO 2+3C=====高温SiC +2CO ↑,氧化剂与还原剂的物质的量之比为1∶2,错误;C 项,SiHCl 3中由H 、Cl 两元素的化合价可推知硅元素的化合价为+2,正确;D 项,H 2与SiHCl 3反应的化学方程式为H 2+SiHCl 3=====高温Si +3HCl ,属于置换反应,正确。
]8.B [经分析知CsICl 2中各元素的化合价分别为Cs +1I +1Cl -12,故有强氧化性,可氧化SO 2、I -。
]9.(1)硫酸 (2)15 mol (3) 1∶6 (4)Cu 2O 、Cu 2S解析 (1)在铜的冶炼过程中,②焙烧、③制粗铜过程中都有二氧化硫生成,二氧化硫被氧化生成三氧化硫,三氧化硫和水反应生成硫酸,故冶炼过程中的尾气可用来制硫酸。
(2)总反应方程式为6CuFeS 2+15O 2===6Cu +12SO 2+6FeO ,根据方程式知由6 mol CuFeS 2制取6 mol Cu 时共消耗15 mol O 2。
(3)在反应2Cu 2O +Cu 2S===6Cu +SO 2↑中,Cu 元素化合价由+1价变为0价、S 元素化合价由-2价变为+4价,则氧化剂是Cu 2O 、Cu 2S ,还原剂是Cu 2S ,氧化产物是二氧化硫、还原产物是Cu ,则氧化产物和还原产物的物质的量之比为1∶6。
10.(1)2Fe 2++2H ++H 2O 2===2Fe 3++2H 2O(2)调节溶液pH (3)6∶7(4)2MnO -4+5C 2O 2-4+16H +===2Mn 2++10CO 2↑+8H 2O 偏高解析 (2)加入氧化钴,与溶液中的H +反应,从而调节溶液的pH ,使Fe 3+、Al 3+沉淀而Co 2+不沉淀,达到除去Fe 、Al 两种杂质元素的目的。
(3)n (HCl)=0.28×5 mol =1.4 mol ,n (Cl 2)=2.24 L22.4 L·mol -1=0.1 mol 。
由n (Cl 2)=0.1 mol 可推知+3价Co 的物质的量为0.2 mol 。
