氧化还原反应的基本概念和关系
氧化还原反应的基本概念和规律

氧化还原反应的基本概念和规律 最新考纲1.了解氧化还原反应的本质是电子的转移。
2.了解常见的氧化还原反应。
考点一 氧化还原反应的相关概念及其相互间的联系1.本质和特征2.有关概念及其相互关系氧化剂(氧化性)+ 还原剂(还原性)===还原产得电子,化合价降低,被还原物+氧化失电子,化合价升高,被氧化产物例如:反应4HCl(浓)+MnO 2=====△MnCl 2+Cl 2↑+2H 2O 中,氧化剂是MnO 2,氧化产物是Cl 2,还原剂是HCl ,还原产物是MnCl 2;生成1 mol Cl 2时转移电子的物质的量为2__mol ,被氧化的HCl 的物质的量是2__mol 。
3.氧化还原反应中电子转移的表示方法(1)双线桥法氧化剂+还原剂===还原得到n e -产物+氧化失去n e -产物请标出Cu 与稀硝酸反应中电子转移的方向和数目: 3Cu + 8HNO 3(稀)===3C u(NO 3)2+2N O ↑+4H 2O失去3×2e - 得到2×3e -(2)单线桥法氧化剂+还原n e -剂===还原产物+氧化产物请标出Cu 与稀硝酸反应中电子转移的方向和数目: 3Cu + 8HNO 3(稀)===3Cu(NO 3)2+2NO ↑+4H 2O失去3×2e - 得到2×3e -4.常见的氧化剂和还原剂(1)常见氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。
如:(2)常见还原剂常见还原剂包括活泼的金属单质、非金属离子及低价态化合物、低价金属阳离子、非金属单质及其氢化物等。
如:(3)具有中间价态的物质既有氧化性,又有还原性其中:Fe 2+、SO 32-主要表现还原性,H 2O 2主要表现氧化性。
【例1】 (2012·上海,20改编)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS 2+O 2===Cu 2S +2FeS +SO 2下列说法正确的是( )。
高中化学知识点大全:氧化还原反应

高中化学知识点大全:氧化还原反应七、氧化还原反应与四种基本反应类型的关系:(1)氧化还原反应定义:有电子发生转移的化学反应。
(2)实质:电子发生转移物质所含元素化合价升高的反应是氧化反应;物质所含元素化合价降低的反应是还原反应。
(3)判断依据:元素化合价发生变化(4)氧化还原反应中概念及其相互关系如下:还原剂(有还原性)——失去电子——化合价升高——被氧化(发生氧化反应)——氧化产物。
记做:升失氧氧化剂(有氧化性)——得到电子——化合价降低——被还原(发生还原反应)——还原产物。
记做:降得还(5)氧化还原反应中电子转移的表示方法:双线桥法表示电子转移的方向和数目注意:a.“e-”表示电子。
b.双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素,应标出“得”与“失”及得失电子的总数。
c.失去电子的反应物是还原剂,得到电子的反应物是氧化剂d.失去电子的物质被氧化,被氧化得到的产物是氧化产物,具有氧化性。
e.得到电子的物质被还原,被还原得到的产物是还原产物,具有还原性。
单线桥法表示电子转移的方向和数目2e-2Na+Cl2=点燃=== 2NaCl注意:a.“e-”表示电子。
b.用一条带箭头的曲线从失去电子的元素指向得到电子的元素,并在“桥”上标出转移的电子数。
(2)氧化性、还原性强弱的判断氧化性反映的是得电子能力的强弱;还原性反映的是失电子能力的强弱。
1)通过氧化还原反应比较:氧化剂 + 还原剂→ 氧化产物+还原产物氧化性:氧化剂 > 氧化产物还原性:还原剂 > 还原产物2)从元素化合价考虑:3+、H2SO4、KMnO4 等;最高价态——只有氧化性,如 Fe2+、S、Cl2 等;中间价态——既具有氧化性又有还原性,如 Fe2-等。
最低价态——只有还原性,如金属单质、Cl-、S3)根据其活泼性判断:①根据金属活泼性:②根据非金属活泼性:4)根据元素周期律进行比较:一般地,氧化性:上>下,右>左;还原性:下>上,左>右.5)根据反应条件进行判断:不同氧化剂氧化同一还原剂,所需反应条件越低,表明氧化剂的氧化剂越强;不同还原剂还原同一氧化剂,所需反应条件越低,表明还原剂的还原性越强。
(完整版)氧化还原反应知识点总结

i r氧化还原反应氧化还原反应与四大基本反应类型的关系①置换反应都是氧化还原反应;②复分解反应都不是氧化还原反应;③有单质生成的分解反应是氧化还原反应;④有单质参加的化合反应也是氧化还原反应。
从数学集合角度考虑:氧化还原反应的概念1.基本概念.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物还原产物通过发生还原反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS 2+11O 2=2Fe 2O 3+8SO 2中,Fe 2O 3和SO 2均既为氧化产物,又为还原产物。
氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X 2)、O 2、S 等(2)高价金属阳离子;如Fe 3+、Cu 2+等(3)高价或较高价含氧化合物;如MnO 2、浓H 2SO 4、HNO 3、KMnO 4等(4)过氧化物;如Na 2O 2、H 2O 2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K 、Na 、Z n 、Fe 等②一些非金属单质;如H 2、C 、Si 等③较低态的化合物;CO 、SO 2、H 2S 、Na 2SO 3、FeSO 4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力2.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物[例1]金属钛(Ti )性能优越,被称为继铁、铝制后的“第三金属”。
氧化还原反应高考复习

一、氧化还原反应的基本概念及相互关系
1.氧化还原反应的实质是电子的得失或电子 对的偏移,特征是反应前后元素化合价的升降; 判断某反应是否属于氧化还原反应可根据反应 前后化合价是否发生了变化这一特征。
2.基本概念
(1)氧化反应: 失去 电子(化合价 升高 )的反应。 (2)还原反应: 得到 电子(化合价 降低 )的反应。 (3)氧化剂(被还原): 得到 电子的物质(所含元素化 合价降低的物质)。 (4)还原剂(被氧化): 失去 电子的物质(所含元素化 合价升高的物质)。 (5)氧化产物: 还原剂 失电子后对应的产物(包含化 合价升高的元素的产物)。 (6)还原产物: 氧化剂 得电子后对应的产物(包含化 合价降低的元素的产物)。
2.氧化还原反应方程式的配平 (1)配平原则:电子守恒、原子守恒、电荷守恒 (2)配平步骤(以高锰酸钾和浓盐酸反应制氯气为例): ①标出化合价变化了的元素的化合价。如:
②根据元素存在的实际形式调整发生了氧化还原 反应的物质的系数,使之成1︰1的关系。如:
③调整系数,使化合价升降总数相等。
④根据化合价升降总数相等确定发生氧化还原反应 的物质的化学计量数。如: 2KMnO4+10HCl KCl+2MnCl2+5Cl2↑+H2O
2.优先规律 在同一溶液里存在几种不同的还原剂且浓度相差
不大时,当加入氧化剂时,还原性 强 的还原剂优 先被 氧化 ;同时存在几种不同的氧化剂且其浓度 相差不大时,当加入还原剂时,氧化性 强 的氧化 剂优先被 还原 。如:把少量Cl2通入FeBr2溶液中, Fe2+先失电子;把少量Cl2通入FeI2溶液中,I-先失电 子。
氧化性还原性强弱的比较是考试的一个难 点,基本考查方式一是比较氧化性还原性的 强弱,二是根据氧化性还原性强弱,判断反 应能否进行。总的解题依据是一个氧化还原 反应能进行,一般是氧化剂的氧化性强于氧 化产物的氧化性,还原剂的还原性强于还原 产物的还原性。但要考虑到某些特殊情况如 符合特定的平衡原理而进行的某些反应。
氧化还原反应要点概括

氧化还原反应要点概括一、五对概念在氧化还原反应中,有五对既相对立又相联系的概念。
它们的名称和相互关系如下:二、四条规律1.表现性质规律同种元素具有多种价态时,一般处于最高价态时只具有氧化性,处于最低价态时只具有还原性,处于中间可变价时既具有氧化性又具有还原性。
2.反应先后规律在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原剂,则首先与溶液中最强的氧化剂作用。
例如,向含有FeBr2溶液中通入Cl2,首先被氧化的是Fe2+。
3.价态归中规律含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。
4.电子守恒规律在任何氧化还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
三、物质氧化性或还原性强弱的比较(1)由元素的金属性或非金属性进行比较①金属阳离子的氧化性随其单质还原性的增强而减弱,如②非金属阴离子的还原性随其单质的氧化性增强而减弱,如(2)由反应条件的难易进行比较不同的氧化剂与同一还原剂反应时,反应条件越容易,其氧化剂的氧化性越强。
例如,前者比后者容易发生反应,可判断出氧化性:。
同理,不同的还原剂与同一氧化剂反应时,反应条件越容易,其还原剂的还原性越强。
(3)根据被氧化或被还原的程度不同进行比较当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。
同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。
(4)根据化学方程式进行比较在“氧化剂+还原剂===还原产物+氧化产物”中:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(5)某些氧化剂的氧化性或还原剂的还原性与温度、浓度、酸碱性有关温度:如热的浓硫酸的氧化性比冷的浓硫酸的强。
浓度:如浓硝酸的氧化性比稀硝酸的强。
氧化还原反应的基本概念与基本关系
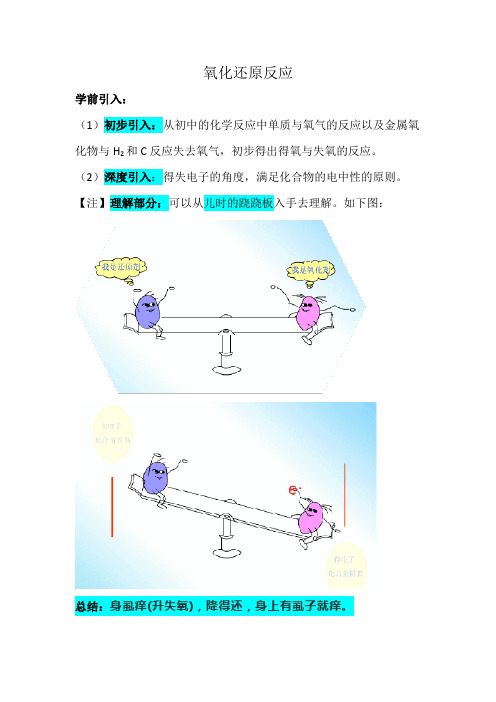
氧化还原反应学前引入:(1)初步引入:从初中的化学反应中单质与氧气的反应以及金属氧化物与H2和C反应失去氧气,初步得出得氧与失氧的反应。
(2)深度引入:得失电子的角度,满足化合物的电中性的原则。
【注】理解部分:可以从儿时的跷跷板入手去理解。
如下图:总结:身虱痒(升失氧),降得还,身上有虱子就痒。
一、基本概念1、定义:凡有元素化合价升降的化学反应就是氧化还原反应。
2、特征:化合价的升降3、本质:电子的得失4、初中基本四种基本反应与氧化还原的关系:【注】根据化合价的升降去判断,但这里有必要去回顾下初中学过的化合价,一些常见的化合价情况。
如; 碳;+2、+4。
氮:-3、+2、+4、+5等总结:(1)置换反应全都是氧化还原反应。
(2)有单质参加的化合反应是氧化还原反应。
(3)有单质生成的分解反应是氧化还原反应。
(4)复分解反应都不属于氧化还原反应。
例题:主要考察四种基本反应类型与氧化还原反应的关系,如何判断例1,P91、例1和变式1例2、下列反应一定属于氧化还原反应的是()A、化合反应B、分解反应C、置换反应D、复分解反应例3、判断正误(正确的划“√”,错误的划“×”)。
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应。
( )(2)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。
( )(3)某元素从游离态变为化合态,该元素可能被氧化也可能被还原。
( )(4)置换反应都是氧化还原反应,化合反应不都是氧化还原反应。
( )例4、P101,T5(教师版)例5、下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A .Fe +CuSO 4===FeSO 4+CuB .AgNO 3+NaCl===AgCl ↓+NaNO 3C .Fe 2O 3+3CO=====△ 2Fe +3CO 2D .2KMnO 4=====△ K 2MnO 4+MnO 2+O 2↑。
氧化还原反应知识点总结

氧化还原反应氧化还原反应与四大基本反应类型的关系①置换反应都是氧化还原反应;②复分解反应都不是氧化还原反应;③有单质生成的分解反应是氧化还原反应;④有单质参加的化合反应也是氧化还原反应。
从数学集合角度考虑:氧化还原反应的概念1.基本概念.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物2.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物[例1]金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。
工业上以xx为原料制取Ti的反应为:aTiO2+bCl2+cCaTiCl4+cCO ……反应①TiCl4+2MgTi+2MgCl2……反应②关于反应①、②的分析不正确的是()①TiCl4在反应①中是还原产物,在反应②中是氧化剂;②C、Mg在反应中均为还原剂,被还原;③在反应①、②xxMg的还原性大于C,C的还原性大于TiCl4;④a=1,b=c=2;⑤每生成19.2gTi,反应①、②中共转移4.8mol e-。
A.①②④B.②③④C.③④D.②⑤标电子转移的方向和数目(双线桥法、单线桥法)①单线桥法。
从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。
例:2e-MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O②双线桥法。
得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。
例:得2e-——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O失2e-——两类特殊的化学反应①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。
例:得5×e3Cl2+6KOHKClO3+5KCl+3H2O失5e②归中反应。
不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。
氧化还原反应中的概念与规律

氧化还原反应中的概念与规律: 一、 五对概念在氧化还原反应中,有五对既相对立又相联系的概念。
它们的名称和相互关系是:二、 五条规律1、表现性质规律:同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。
2、性质强弱规律3、反应先后规律同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;反之则首先与溶液中最强的氧化剂作用。
例如,向含有FeBr 2溶液中通入Cl 2,首先被氧化的是Fe 2+4、价态归中规律:含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。
5、电子守恒规律:在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
三.物质氧化性或还原性强弱的比较: (1)由元素的金属性或非金属性比较(2)由反应条件的难易比较不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。
前者比后者容易发生反应,可判断氧化性: 。
同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
(3)根据被氧化或被还原的程度不同进行比较当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。
如,根据铁被氧化程度的不同 ,可判断氧化性:。
同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。
(4)根据反应方程式进行比较:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物 (5)根据元素周期律进行比较:一般地,氧化性:上>下,右>左;还原性:下>上,左>右。
离子反应规律和离子方程式书写 1 基本概念 1.1 离子反应在溶液(或熔化态)中有离子参与或有离子生成的化学反应统称离子反应。
1.2 强电解质和弱电解质在溶液中(或熔化状态)本身能发生电离的化合物叫电解质,不能发生电离的化合物叫非电解质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原反应的基本概念和关系教学过程一、复习预习1.2.初中化学中常见的带电原子团:碳酸根离子CO32-、碳酸氢根离子HCO3-、硫酸根离子SO42-、亚硫酸根离子SO32-、高锰酸根离子MnO4-、硝酸根离子NO3-、磷酸根离子PO43-、氢氧根离子OH-、铵根离子NH4+3.氧化反应和还原反应:CuO+H2Cu+H2O二、知识讲解考点1:氧化还原反应的概念1.从得失氧的角度认识氧化还原反应结论:根据得失氧的情况,得到氧的反应是氧化反应;失去氧的反应是还原反应。
一种物质被氧化,另一种物质被还原的反应叫氧化还原反应。
2.从元素化合价升降的角度认识氧化还原反应结论:根据化合价升降情况,所含元素的化合价升高的物质发生氧化反应;所含元素化合价降低的物质发生还原反应。
反应前后有元素化合价升降的反应叫氧化还原反应。
3.从电子转移的角度认识氧化还原反应结论:根据元素的化合价变化与电子得失或电子对偏移的关系,从电子得失的角度分析失去电子的反应为氧化反应,得到电子的反应为还原反应。
凡有电子转移(得失或偏移)的化学反应叫氧化还原反应。
4.小结氧化还原反应的本质是电子转移(得失或偏移);特征是反应前后元素的化合价发生变化。
判断方法为标明元素的化合价,分析元素的化合价是否变化。
考点2:氧化还原反应与四种基本反应类型的关系(1).置换反应一定是氧化还原反应;(2).分解反应一定不是氧化还原反应;(3).单质参加的化合反应和有单质生成的分解反应是氧化还原反应。
关系如图所示:考点3:氧化还原反应的基本概念1.氧化剂和还原剂氧化剂:得到电子或电子对偏向的物质--------所含元素化合价降低的物质还原剂:失去电子或电子对偏离的物质———所含元素化合价升高的物质2.氧化产物和还原产物氧化产物:氧化反应得到的产物还原产物:还原反应得到的产物3.氧化性和还原性(1)氧化性:氧化剂得电子的能力。
(2)还原性:还原剂失电子的能力。
4. 氧化反应和还原反应氧化反应(被氧化):指反应物中的某元素失电子、化合价升高的反应过程。
(1)氧化反应的对象是反应物中的某元素;(2)氧化反应的本质是元素的原子失去电子;(3)氧化反应的特征是元素化合价升高;(4)氧化反应对反应过程而言。
还原反应(被还原):指反应物中某元素得电子、化合价降低的反应过程。
(1)还原反应的对象是反应物中的某元素;(2)还原反应的本质是元素的原子得到电子;(3)还原反应的特征是元素化合价降低;(4)还原反应对反应过程而言考点4:氧化还原反应概念之间的关系三、例题精析【例题1】以元素化合价升降的观点分析下列各化学反应,其中不属于氧化还原反应的是( )A .Mg +2HCl===MgCl 2+H 2↑B .H 2+Cl 2=====点燃2HCl C .CuO +H 2=====△Cu +H 2OD .CaCl 2+Na 2CO 3===CaCO 3↓+2NaCl【答案】D【解析】只要是反应前后存在元素化合价升降的化学反应,都属于氧化还原反应。
【例题2】“四种基本反应类型与氧化还原反应的关系”可用如图表达。
其中Ⅰ为化合反应,则Ⅱ为__________反应。
写出有关水生成的符合反应类型Ⅲ的一个化学方程式:______________________。
写出有水参加的符合反应类型Ⅳ的一个化学方程式__________________________,其中水为________剂。
【答案】分解NaOH+HCl===NaCl+H2O(其他合理答案也可)2Na+2H2O===2NaOH+H2↑氧化(合理即可)【解析】因为化合反应和分解反应,都是部分属于氧化还原反应,部分属于非氧化还原反应,故若Ⅰ为化合反应,则Ⅱ为分解反应。
进而判断出Ⅲ为复分解反应,Ⅳ为置换反应,可分别举以下两个例子:NaOH+HCl===NaCl+H2O,2Na+2H2O===2NaOH+H2↑(其中H2O为氧化剂)。
【例题3】已知下列四个反应:①2Na +2H 2O===2NaOH +H 2↑ ②2F 2+2H 2O===4HF +O 2 ③Cl 2+H 2O===HCl +H ClO ④C +H 2O(g)=====高温CO +H 2试从氧化还原的角度,回答下列问题: (1)水只作氧化剂的是________; (2)水只作还原剂的是________;(3)水既不作氧化剂又不作还原剂的是________。
【答案】(1)①④ (2)② (3)③【解析】 H 2O 中H 元素为+1价,当生成H 2时,氢元素化合价降低,此时H 2O 作氧化剂;H 2O 中O 元素为-2价,当生成O 2时,氧元素化合价升高,此时H 2O 作还原剂。
因此,结合①、②、③、④四个反应方程式的特点可知①、④中H 2O 只作氧化剂,②中H 2O 只作还原剂,③中H 2O 既不作氧剂又不作还原剂。
【例题4】下列反应既是离子反应,又是氧化还原反应的是()A.BaCl2溶液中滴加稀H2SO4B.盐酸和氧化铁反应C.铁片放入CuSO4溶液中D.氢气还原CuO【答案】C【解析】A、B、C项对应的反应为离子反应,但A、B中的反应为复分解反应,C中的反应为置换反应,Fe+CuSO4===FeSO4+Cu,Fe+Cu2+===Fe2++Cu。
【例题5】制备氰氨基化钙的化学方程式为CaCO3+2HCN===CaCN2+CO↑+H2↑+CO2↑,在反应中()A.氢元素被氧化,碳元素被还原B.HCN是氧化剂,CaCO3是还原剂C.CaCN2是氧化产物,H2为还原产物D.CO为氧化产物,H2为还原产物【答案】 C【解析】该题的最关键的一点是分析各元素的化合价变化,难点是碳元素在HCN和CaCN2中的化合价,从反应物CaCO3到生成物CO2,碳的化合价均为+4价,没有改变,再从生成物H2分析发现氢的化合价降低,显然HCN中H得电子,HCN是氧化剂,而CaCO3中的各元素化合价均无变化,则还原剂也必是HCN,其中的碳元素一定被氧化,在HCN中碳为+2价,CO中的碳也为+2价,则CaCN2中的碳为+4价,故CaCN2为氧化产物。
四、课堂运用【基础】1. 某元素在化学反应中,由化合态变为游离态,则该元素()A.一定被氧化B.一定被还原C.可能被氧化,也可能被还原D.化合价降低为02. 有下列几组反应:A .Zn +2HCl===ZnCl 2+H 2↑B .CO 2+H 2O===H 2CO 3C .S +O 2=====点燃SO 2D .Ba(OH)2+H 2SO 4===BaSO 4↓+2H 2OE .Na 2CO 3+2HCl===2NaCl +H 2O +CO 2↑F .CaCO 3=====△CaO +CO 2↑G .CH 4+2O 2=====点燃CO 2+H 2OH .2KClO 3=====△2KCl +3O 2↑以上反应中,属置换反应的是________,属化合反应的是________,属分解反应的是________,属复分解反应的是______,属氧化还原反应的是________。
答案及解析:1.C 解析:元素以单质形态(游离态)存在时,化合价为0,元素以化合物形态(化合态)存在时,化合价有正价或负价之分。
当元素由游离态变为化合态时,元素的化合价升高和降低都有可能,所以可能被氧化,也可能被还原。
2. A BC FH DE ACGH解析:根据化学反应的基本类型进行分类,只有A是置换反应,B、C属化合反应,F、H 属分解反应,D、E属复分解反应,G不属基本类型的反应,ACGH中都有元素化合价的变化,所以都属氧化还原反应。
可以发现,置换反应、部分化合反应、部分分解反应属氧化还原反应,复分解反应一定不属氧化还原反应。
【巩固】1.在Fe+CuSO4===FeSO4+Cu反应中,________是还原剂,________是氧化剂,________被氧化,________被还原,Cu是________产物,FeSO4是________产物。
2. 有关氧化还原反应的下列叙述正确的是()A.氧化剂发生还原反应,还原剂发生氧化反应B.氧化剂被氧化,还原剂被还原C.一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质D.氧化还原反应中,金属单质只作还原剂,非金属单质只作氧化剂答案及解析:1. Fe CuSO 4 Fe CuSO 4 还原 氧化。
解析:根据化合价变化情况分析:Fe 0+Cu +2SO 4===Fe +2SO 4+Cu 0,Fe 的化合价由0价升为+2价,所以Fe 是还原剂,被氧化,生成氧化产物FeSO 4;Cu 的化合价由+2价降为0价,所以CuSO 4是氧化剂,被还原,生成还原产物Cu 。
2. A 解析:在氧化还原反应中,氧化剂被还原;发生还原反应,还原剂被氧化,发生氧化反应,A 正确,B 错误;氧化剂与还原剂可能是不同的物质,也可能是同一物质,C 错误,金属无负价,故反应中化合价只能升高,所以金属单质只作还原剂,但非金属既有正价,也有负价,故非金属单质既可作氧化剂,也可作还原剂,D 错误。
【拔高】1. 下列关于氧化还原反应的叙述正确的是( )A .H 2还原CuO 的反应只属于还原反应B .置换反应都是氧化还原反应,所以,3CO +Fe 2O 3=====高温2Fe +3CO 2既是置换反应又是氧化还原反应C .3O 2=====电火花2O 3是氧化还原反应D .复分解反应一定不是氧化还原反应2.阅读下列材料后回答问题。
一个体重50 kg的健康人,体内约含有2 g铁,这2 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。
正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。
服用维生素C,可使食物中的Fe3+转化成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+——Fe3+的转化时,①反应中的Fe2+发生________反应,②反应中的Fe3+被________。
(2)“服用维生素C,可使食物中的Fe3+转化成Fe2+”这句话说明,维生素C在这一反应中被____________。
(3)市场上出售的某种麦片中含有微量的颗粒细小的还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。
此反应的化学方程式为______________________ ___________________离子方程式为________________________________。
答案及解析:1. D 解析:氧化还原反应是一个整体,氧化反应和还原反应必然同时发生在同一个反应中,在H 2+CuO=====△Cu +H 2O 过程中,对CuO 而言是失去氧被还原,发生了还原反应,对H 2而言,则是得到氧被氧化,发生了氧化反应。
