第3章 晶体结构题解
高中化学选修二第三章《晶体结构与性质》测试(答案解析)(18)

一、选择题1.(0分)[ID :139821]下列叙述中,不正确的是( ) A .微粒半径由小到大顺序是H +<Li +<H -B .杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子C .[Cu(NH 3)4]2+中H 提供接受孤对电子的空轨道D .分子中中心原子通过sp 3杂化轨道成键时,该分子不一定为四面体结构 2.(0分)[ID :139809]下列关于C 、Si 及其化合物结构与性质的论述错误的是 A .键能 C-C >Si-Si 、C-H >Si-H ,因此C 2H 6稳定性大于Si 2H 6B .立方型SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度和熔点 C .常温下C 、Si 的最高价氧化物晶体类型相同,性质相同。
D .Si 原子间难形成双键而C 原子间可以,是因为Si 的原子半径大于C ,难形成p p π— 键 3.(0分)[ID :139876]下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是 A .Cl 2+H 2O=HClO+HCl B .2Na 2O 2+2H 2O=4NaOH+O 2↑C .NH 4Cl+NaOH Δ−−→NaCl+NH 3↑+H 2OD .2FeCl 2+H 2O 2+2HCl=2FeCl 3+2H 2O 4.(0分)[ID :139867]下列说法正确的是A .Fe 、Co 、Ni 在元素周期表中位于同一周期同一族B .离子晶体的熔点:NaCl<KCl<RbCl<CsClC .CO 2为极性分子,含有σ键与π键D .金刚石和C 60互称为同素异形体,两者具有相同的晶体类型5.(0分)[ID :139865]甲、乙、丙三种离子晶体的晶胞如图所示,下列说法正确的是A .甲的化学式(X 为阳离子)为XYB .乙中A 、B 、C 三种微粒的个数比是1:3:1 C .丙是CsCl 晶体的晶胞D .乙中与A 距离最近且相等的B 有8个 6.(0分)[ID :139848]下列描述正确的是 A .2CS 为V 形的极性分子 B .3NO -与23SO -的中心原子均为3sp 杂化C .3NF 的键角大于3NCl 的键角D .金属键无方向性和饱和性7.(0分)[ID :139847]有关晶体的结构如下图所示,下列说法中错误的是A .钛酸钙的化学式为CaTiO 3B .在金刚石晶体中,碳原子与碳碳键(C —C)数目之比为1:2 C .硒化锌晶体中与一个Se 2-距离最近且相等的Se 2-有8个D .CaF 2中F -与距离最近的Ca 2+所形成的键的夹角为109.5° 8.(0分)[ID :139842]下列物质形成的晶体中,属于分子晶体的是 A .CO 2B .NaOHC .金刚石D .NaCl9.(0分)[ID :139841]下列物质的性质比较,结论错误的是 A .稳定性:H 2O>H 2Te>H 2Se>H 2S B .微粒半径:r(S 2-)>r(Cl -)>r(Al 3+) C .晶格能:MgO>CaO>NaF>NaClD .熔点:金刚石>碳化硅>晶体硅10.(0分)[ID :139839]通常状况下,3NCl 是一种油状液体,可用于漂白,其分子空间构型与氨分子的相似。
材料科学基础第三章典型晶体结构.答案

类似于NaCl型晶体结构的晶体较多,只是晶胞 参数不同而已。
常见的NaCl型晶体都是碱土金属氧化物和过渡 金属的二价氧化物。化学式可写为MO,其中M2+ 是二价金属离子,结构中M2+和O2-分别占据了 NaCl中钠离子和氯离子的位置。这些氧化物有很 高的熔点,尤其是MgO(矿物名称方镁石),其 熔点高达2800℃左右,是碱性耐火材料镁砖中的 主要晶相。
反萤石型结构 :在萤石型结构中正、负离子位置全部互换,并没 有改变结构形式,只是正、负离子位置对调。如Na2O
结构-性能关系:CaF2熔点较低,用作助熔剂/作晶核剂。 质点间 键力较NaCl强 硬度稍高(莫氏4级),熔点1410C,在水中 溶解度小。
表示方法:球体堆积法;坐标法;投影图;配位多面体
连接方式
0,100
50
0,100
75 50
25 0,100
25 0,100
50
75
50
0,100
与金刚石晶胞的对比 ,有什么不同?
同型结构的晶体β-SiC,GaAs,AlP 等
5、-ZnS(纤锌矿)型结构 (AB type)
六方晶系,简单六方格子
C
50
0,100
晶胞在(001)面的投影图
晶胞中由几套等同点?
在坐标为000和坐标为1/4 1/4 3/4 的 原 子 的 环 境 是 不 同 的 , 它们不能独立抽象为一类等同 点,这是两类等同点。最后, 它的布拉维格子仍为面心立方 格子。
这种结构可以看成是由2个面 心立方布拉维格子穿插而成: 这2个面心立方格子(图中的 灰色和红色点)沿体对角线相 对位移动a/4<111>。
2021年高中化学选修二第三章《晶体结构与性质》测试(答案解析)(1)

一、选择题1.某种硫的氧化物冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示。
下列有关该物质的说法中正确的是A.固态物质中S原子的杂化轨道类型是SP2杂化B.该物质的化学式为SO3C.从该结构片段分析可知所有的O原子和S原子在同一平面上D.该结构片段中S-O键之间的夹角约为120º答案:B解析:A.由题给结构片段可知,每个硫原子的周围有4个氧原子,则固态物质中S原子的杂化轨道类型是SP3杂化,故A错误;B.由题给结构片段可知,每个硫原子的周围有4个氧原子,其中2个氧原子为该硫原子单独占有,还有2个氧原子为两个硫原子共有,则每个硫原子单独占有的氧原子数为3,氧化物的化学式为SO3,故B错误;C.由题给结构片段可知,每个硫原子的周围有4个氧原子,空间构型为四面体形,则所有的O原子和S原子不可能在同一平面上,故C错误;D.由题给结构片段可知,每个硫原子的周围有4个氧原子,空间构型为四面体形,不是平面三角形,则S-O键之间的夹角不可能约为120º,故D错误;故选B。
2.由一种阳离子与两种酸根离子组成的盐称为混盐。
向混盐CaOCl2中加入足量浓硫酸,可发生反应:CaOCl2 + H2SO4(浓)→CaSO4 + Cl2↑+ H2O。
下列说法错误的是(N A表示阿佛加德罗常数)A.浓硫酸体现氧化性与酸性B.1 mol混盐CaOCl2中含有3N A个离子C.混盐CaOCl2中既含离子键又含共价键D.每产生1mol氯气,转移电子数为N A答案:A【分析】由混盐CaOCl2在酸性条件下可产生氯气,可知混盐为CaCl2和Ca(ClO)2的混合物,在酸性条件下发生Cl-+ ClO-+2H+= Cl2↑+ 2H2O,以此来解答题。
解析:A.CaOCl2 + H2SO4(浓)→CaSO4 + Cl2↑+H 2O ,硫酸中没有元素化合价变化,故浓硫酸只体现酸性,故A 错误;B.CaOCl 2中含有1个Ca 2+、1个Cl -、1个ClO -,故1mol 混盐CaOCl 2中含有3N A 个离子,故B 正确;C.Ca 2+和阴离子之间是离子键,Cl-O 是共价键, 故C 正确;D.Cl -+ ClO -+2H += Cl 2↑+ 2H 2O ,每产生1mol 氯气,转移电子数为N A ,故D 正确。
高中化学新教材同步选择性必修第二册第3章微专题6:晶体结构的分析与计算
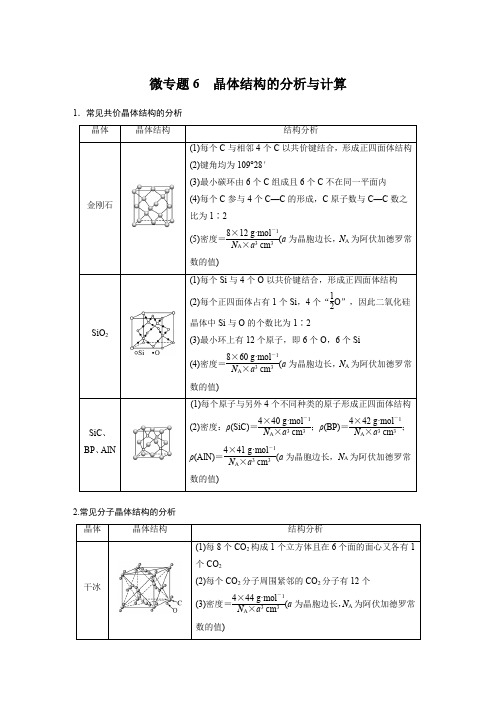
微专题6晶体结构的分析与计算1.常见共价晶体结构的分析晶体晶体结构结构分析金刚石(1)每个C与相邻4个C以共价键结合,形成正四面体结构(2)键角均为109°28′(3)最小碳环由6个C组成且6个C不在同一平面内(4)每个C参与4个C—C的形成,C原子数与C—C数之比为1∶2(5)密度=8×12 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)SiO2(1)每个Si与4个O以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,因此二氧化硅晶体中Si与O的个数比为1∶2(3)最小环上有12个原子,即6个O,6个Si(4)密度=8×60 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)SiC、BP、AlN (1)每个原子与另外4个不同种类的原子形成正四面体结构(2)密度:ρ(SiC)=4×40 g·mol-1N A×a3 cm3;ρ(BP)=4×42 g·mol-1N A×a3 cm3;ρ(AlN)=4×41 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)2.常见分子晶体结构的分析晶体晶体结构结构分析干冰(1)每8个CO2构成1个立方体且在6个面的面心又各有1个CO2(2)每个CO2分子周围紧邻的CO2分子有12个(3)密度=4×44 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)白磷密度=4×124 g·mol-1N A×a 3 cm 3(a为晶胞边长,N A为阿伏加德罗常数的值)3.常见离子晶体结构的分析NaCl型CsCl型ZnS型CaF2型晶胞配位数684F-:8;Ca2+:4密度的计算(a为晶胞边长,N A为阿伏加德罗常数的值)4×58.5 g·mol-1N A×a3 cm3168.5 g·mol-1N A×a3 cm34×97 g·mol-1N A×a3 cm34×78 g·mol-1N A×a3 cm31.AB型化合物形成的晶体结构多种多样。
(必考题)初中高中化学选修二第三章《晶体结构与性质》知识点(答案解析)

一、选择题1.下列物质中,既含有离子键,又含有非极性共价键的是()A.H2O B.CaCl2C.NH4Cl D.Na2O2答案:DH O是共价化合物,只含极性共价键,A不符合题意;解析:A.2CaCl是离子化合物,只含离子键,B不符合题意;B. 2NH Cl是离子化合物,其中铵根离子中含有极性共价键,铵根离子和氯离子之间存在C. 4离子键,C不符合题意;D. Na2O2是离子化合物,钠离子和过氧根离子之间存在离子键,两个氧原子之间存在非极性共价键,D符合题意。
综上所述,既含离子键,又含非极性共价键的是选项D。
答案选D。
2.BN(氮化硼)和CO2中的化学键均为共价键,BN的晶体熔点高且硬度大,而CO2的晶体(干冰)却松软而且极易升华,由此判断,BN的晶体类型是A.分子晶体B.原子晶体C.离子晶体D.金属晶体答案:B解析:干冰松软而且极易升华、则晶体内二氧化碳分子间作用力小,干冰是分子晶体,氮化硼晶体熔点高且硬度大,则晶体内粒子间作用力强,因为化学键是共价键,因此判断为原子晶体,B正确;答案选B。
3.下列物质中,含有共价键的离子化合物是A.NH3B.HCl C.NaOH D.NaCl答案:C【分析】解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,含有离子键的化合物是离子化合物,全部由共价键形成的化合物是共价化合物,则氨气、氯化氢是共价化合物。
氢氧化钠是含有离子键和共价键的离子化合物,氯化钠是含有离子键的离子化合物,答案选C。
4.下列有关化合物的说法不正确的是A.[Cu(NH3)4]SO4中H-N-H键的键角大于NH3中H-N-H键的键角Co(NO )4]2-中各元素第一电离能由小到大的顺序为Co<O<NB.配离子[3C.八面体配合物CoCl3•3NH3结构有4种,其中极性分子有2种D.邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点低答案:C解析:A.[Cu(NH3)4]SO4中N含有4个键,没有孤电子对,属于采取sp3杂化,氨气分子中氮原子上有一对孤对电子,[Cu(NH3)4]SO4中氮原子上没有孤对电子,排斥力小,故[Cu(NH3)4]SO4中H-N-H键角比NH3中H-N-H键角大,选项A正确;B.金属元素的第一电离能一般比非金属的小,同一周期中,元素的第一电离能随着原子序数的增大而增大,但N元素的最外层电子处于半满状态,是一种稳定结构,所以它的第一电离能高于同周期相邻的元素,所以Co、N、O的第一电离能由小到大的顺序为Co<O<N,选项B正确;C.正八面体六个顶点的位置是对称等同的,八面体配合物CoCl3•3NH3结构有3种,其中极性分子有1种,选项C不正确;D.同类物质相比,分子内形成氢键的物质的熔沸点要低于分子间形成氢键的物质的熔沸点。
结晶化学第3章习题答案

结晶化学•第三章习题与思考题1. 简述晶体结构要素和空间格子要素的异同。
2. 相当点是一种什么点?有什么用?为什么它不一定非要选在质点上?3. 举例说明确定平行六面体的三个基本原则。
★答:自行画一个平面空间格子(类似图 3.3)。
原则一:所选平行六面体应与空间格子整体的对称性一致。
原则二:所选平行六面体中棱与棱之间的夹角尽可能为直角。
原则三:所选平行六面体体积最小。
4. 试证明:晶体结构中只存在一种空间格子规律。
★ 答:举例:可自行画出一个平面晶体结构,在其中不同的部位分别安置至少3 个原始点,然后,利用相当点方法提取至少3 套平面空间格子(事实上,你提出的若干套空间格子一定相同的)。
依次列出你抽象出来的、若干套相同的空间格子,你就证明了:每种晶体结构中只有一种空间格子规律。
5. 简述如何确定晶体结构的空间格子。
6. 简述晶胞和平行六面体的关系。
★答:A、晶胞是晶体结构的最小重复单位,是物质实体。
B、平行六面体是空间格子的最小重复单位,是从晶体结构中抽象出来、表现晶体结构中质点排列规律的纯几何点阵图像。
C、平行六面体与晶胞的几何形态和尺寸相同。
D、实际工作中,晶胞是通过平行六面体确定的(即:先有平行六面体,后有晶胞)。
7. 论述空间格子。
(提示:论述要全面,但须扼要,即有关空间格子的方方面面都要考虑到,但行文不要啰嗦)★答题要点:A、空间格子是一种从晶体结构中抽象出来的三维立体纯几何点阵图像,它用来表现晶体结构中质点排列的规律。
B、空间格子要素:结点、行列、面网、平行六面体,其中平行六面体是空间格子的最小重复单位。
C、平行六面体的形态和尺寸由晶格常数决定;但根据结点分布的不同,平行六面体有四种格子类型:P、C、I、F格子。
D、七个晶系中一共14种平行六面体或布拉维格子。
8. 为什么只有14种布拉维格子?它们分别都是哪些?9. 晶体对称定律的表述是“晶体没有五次和六次以上的对称轴”。
试利用晶体结构的长程平移有序特征和布拉维格子的概念证明晶体对称定律。
高中化学选择性必修二 第3章第3节 离子晶体 过渡晶体与混合型晶体练习下学期(解析版)

第三章晶体结构与性质第二节金属晶体与离子晶体第二课时离子晶体过渡晶体与混合型晶体一.选择题1.下列叙述正确的是A. 任何晶体中,若含有阳离子,就一定含有阴离子B. 金属晶体的形成是因为晶体中存在金属阳离子间的相互作用C. 价电子数越多的金属原子的金属性越强D. 含有金属元素的离子不一定是阳离子【答案】D【解析】金属晶体由金属离子和自由电子构成,含有阳离子,但不含阴离子,故A错误;B.金属晶体是由金属阳离子和自由电子的组成,粒子间的结合力为金属键,所以金属晶体的形成是因为晶体中存在金属离子、自由电子,故B错误;C.金属性与价电子多少无关,与失去电子的难易程度有关,如Al与钠,价电子Al比Na多,金属性Na比Al强,故C错误;D.含有金属元素的离子,可能为阴离子,如,也可能为阳离子,故D正确;故选:D。
2.下列说法正确的是A. 、、的分子间作用力依次增大B. 和晶体硅都是共价化合物,都是原子晶体C. NaOH和的化学键类型和晶体类型相同D. 加热熔化时破坏了该物质中的离子键和共价键【答案】C【解析】A.水分子间存在氢键,因此分子间作用力,故A错误;B.和晶体硅都是原子晶体,但晶体硅是单质,不是共价化合物,故B错误;C.NaOH和均由离子键、极性键构成,均属于离子晶体,故C正确;D.加热熔化电离得到钠离子和硫酸氢根离子,破坏了离子键,故D错误;故选:C。
3.下列物质性质的变化规律,与化学键的强弱无关的是A. 、、、的熔点、沸点逐渐升高B. HF、HCl、HBr、HI的热稳定性依次减弱C. 金刚石的硬度、熔点、沸点都高于晶体硅D. NaF、NaCl、NaBr、NaI的熔点依次降低【答案】A【解析】、、、的相对分子质量逐渐增大,相对分子质量越大,范德华力越大,熔点、沸点越高,与键能无关,故A正确;B.非金属性,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,与键能有关,故B错误;C.金刚石、晶体硅都属于原子晶体,金刚石中碳碳键的键长小于晶体硅中硅硅键的键长,所以金刚石的硬度、熔点、沸点都高于晶体硅,与键能有关,故C错误;D.NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,键能越小,熔沸点越低,与化学键的键能有关,故D错误;故选:A。
固体物理参考答案(前七章)

固体物理习题参考答案(部分)第一章 晶体结构1.氯化钠:复式格子,基元为Na +,Cl -金刚石:复式格子,基元为两个不等价的碳原子 氯化钠与金刚石的原胞基矢与晶胞基矢如下:原胞基矢)ˆˆ()ˆˆ()ˆˆ(213212211j i a a i k a a k j a a +=+=+= , 晶胞基矢 ka a j a a ia a ˆˆˆ321===2. 解:31A A O ':h:k;l;m==-11:211:11:111:1:-2:1 所以(1 1 2 1) 同样可得1331B B A A :(1 1 2 0); 5522A B B A :(1 1 0 0);654321A A A A A A :(0 0 0 1)3.简立方: 2r=a ,Z=1,()63434r 2r a r 3333πππ===F体心立方:()πππ833r4r 342a r 3422a 3r 4a r 4a 33333=⨯=⨯=∴===F Z ,,则面心立方:()πππ622r 4r 34434442r 4a r 4a 233ar 33=⨯=⨯=∴===F Z ,,则 六角密集:2r=a, 60sin 2c a V C = a c 362=,πππ622336234260sin 34223232=⨯⨯⨯=⨯=⎪⎭⎫ ⎝⎛a a c a r F a金刚石:()πππ163r 38r 348a r 3488Z r 8a 33333=⨯=⨯===F ,, 4. 解:'28109)31arccos(312323)ˆˆˆ()ˆˆˆ(cos )ˆˆˆ()ˆˆˆ(021*******12211=-=-=++-⋅+-=⋅=++-=+-=θθa a k j i a k j i a a a a a kj i a a kj i a a 5.解:对于(110)面:2a 2a a 2S =⋅=所包含的原子个数为2,所以面密度为22a2a22=对于(111)面:2a 2323a 22a 2S =⨯⨯= 所包含的原子个数为2,所以面密度为223a34a 232=8.证明:ABCD 是六角密堆积结构初基晶胞的菱形底面,AD=AB=a 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②将容器Ⅱ的CO2全部压缩到容器Ⅰ中, 总体积是
原来的2/5。
p '总 V '总 p总V总
V总 p '总 p总 V '总
V总 5 p '总 p总 p总 2 2 V总 5
5 132 330kPa 2
XCO2 和 XO2不变。
2.试推测下列物质中何者熔点高?何者熔点低?
①NaCl
答: 2+离子半径是:65pm Mn2+离子半径是:80pm Mg 按说, 离子间距离应该是: MnSe>MgSe 但是, Mn2+离子属于9-17电子构型的离子,极化 作用和变形性都比Mg2+大.Se2-的变形性也很大. Mn2+对Se2-的极化作用,以及Se2-对Mn2+的反极化作 用,导致Mn2+和Se2-之间距离缩短到与MgSe相同.
72kPa
p总 pCO2 pO2 60 72 132kPa
n总 nCO2 nO2
X CO2 nCO2 n总
360 300 660 RT RT
360 RT 6 =0.546 660 11 RT
X O2
nO2 n总
300 RT 5 =0.454 660 11 RT
CaO半径比为:0.707,应为NaCl型.
5.试推测下列物质分别属于哪一种类型的晶体?
物质:
熔点/oC:
B
2300
LiCl
605
BCl 3
-107.3
答:
原子晶体
离子晶体
分子晶体
8. MgSe和MnSe的离子间距离均为0.273nm,但Mg2+ 和Mn2+的离子半径又不相同,如何解释此实验事实?
范德华力, 氢 键 范德华力, 氢 键 离子键
分子晶体 低
分子晶体 低 离子晶体 高
4.已知各离子的半径如下:
离子
离子半径/pm
Na+
95
Rb+
148
Ag+
126
Ca+
99
Cl181
I216
O2140
根据半径比的推测,试推算RbCl、AgCl 、 NaI 、 CaO的 晶体类型。
答: RbCl半径比为:0.818,应为CsCl型,实际NaCl型 AgCl半径比为:0.696,应为NaCl型、 NaI半径比为:0.440,应为NaCl型、
nCO2 PCO2VCO2 RT 120 103 3 103 360 RT RT
nO2
PO2VO2 RT
150 103 2 103 300 RT RT
pO2
nO2 RT V总
300 RT RT (2+3) 103
60kPa
pCO2
360 RT nCO2 RT RT (2+3) 103 V总
②N2 Si
KBr
NH3
KCl
MgO
答: 从高向低的顺序排列为:
①
②
MgO > NaCl > KCl > KBr
Si > NH3 > N2
10. 试用离子极化的观点解释:
①KCl,CaCl2的熔点、沸点高于GeCl4;
②ZnCl2的熔点、沸点低于CaCl2;
③FeCl3的熔点、沸点低于FeCl2。
答: ① Ge4+的氧化态高达+4,比Ca2+和K+高出许多, 其离子极化作用比它们强很多。强的极化作用导 致GeCl4过渡成共价化合物.所以,GeCl4的熔、沸 点比KCl和CaCl2低。
P11 4.在等温下,计算下列情况混合气体的总压 力和各组分的摩尔分数。
Ⅰ 容积2L p(O2)= 150kPa Ⅱ 容积3L p(CO2)= 120kPa
①把中间开关打开,让其自动混合。 ②把中间开关打开,将容器Ⅱ的CO2全部压缩到容 器Ⅰ中。
பைடு நூலகம்
解:①自动混合后,每一种气体体积变为5L, 物质的量n不变,分压将被改变:
第3章 晶体结构题解
作业
P.83.
1.
4. 5. 8.
1.
物质 晶格结点上 的质点 氧分子 Si, C原子 质点间的作用 晶格类型 预言熔 力 点高低
MgCl2 Mg2+, ClO2 SiC
离子键
范德华力 共价键
离子晶体 高
分子晶体 很低 原子晶体 很高
HF
H2O MgO
HF分子
水分子 Mg2+, O2-
②Zn2+离子半径是:74pm
Ca2+离子半径是:99pm
Zn2+离子半径比Ca2+离子小,而且属于18电子构型 的离子,其极化作用和变形性都比Ca2+大.使ZnCl2 带有很强的共价化合物的特征,而CaCl2还是典型 的离子化合物。因此,ZnCl2的熔、沸点低于 CaCl2的。
③ Fe3+的氧化态Fe2+的高,其离子极化作用比Fe2+ 的强,导致FeCl3过渡成共价化合物.所以,FeCl3 的熔、沸点比FeCl2低。
