03分子结构
第九章分子结构
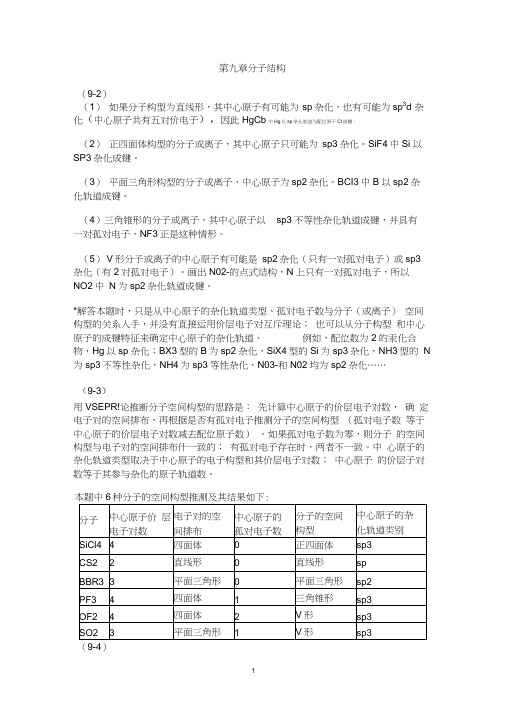
第九章分子结构(9-2)(1)如果分子构型为直线形,其中心原子有可能为sp杂化,也有可能为sp3d 杂化(中心原子共有五对价电子),因此HgCb中Hg以sp杂化轨道与配位原子Cl成键。
(2)正四面体构型的分子或离子,其中心原子只可能为sp3杂化。
SiF4中Si 以SP3杂化成键。
(3)平面三角形构型的分子或离子,中心原子为sp2杂化。
BCI3中B以sp2杂化轨道成键。
sp3不等性杂化轨道成键,并具有(4)三角锥形的分子或离子,其中心原子以一对孤对电子,NF3正是这种情形。
(5)V形分子或离子的中心原子有可能是sp2杂化(只有一对孤对电子)或sp3 杂化(有2对孤对电子)。
画出N02-的点式结构,N上只有一对孤对电子,所以NO2中N为sp2杂化轨道成键。
*解答本题时,只是从中心原子的杂化轨道类型、孤对电子数与分子(或离子)空间构型的关系入手,并没有直接运用价层电子对互斥理论;也可以从分子构型和中心原子的成键特征来确定中心原子的杂化轨道。
例如,配位数为2的汞化合物,Hg以sp杂化;BX3型的B为sp2杂化,SiX4型的Si为sp3杂化,NH3型的N 为sp3不等性杂化,NH4为sp3等性杂化,N03-和N02均为sp2杂化……(9-3)用VSEPR!论推断分子空间构型的思路是:先计算中心原子的价层电子对数,确定电子对的空间排布,再根据是否有孤对电子推测分子的空间构型(孤对电子数等于中心原子的价层电子对数减去配位原子数)。
如果孤对电子数为零,则分子的空间构型与电子对的空间排布什一致的;有孤对电子存在时,两者不一致。
中心原子的杂化轨道类型取决于中心原子的电子构型和其价层电子对数;中心原子的价层子对数等于其参与杂化的原子轨道数。
本题中6种分子的空间构型推测及其结果如下:本题的解题思路与上题相同。
不同之处在于如何计算离子的中心原子的价层电子对数,请见内容要点部分。
这里再补充d轨道参与的杂化。
7种离子的空间构型的推测用及其结果如下:自行完成(9-5 )和(9-6 )两个习题,应用VSEPR!论推测分子或离子构型时1几何构型为T形的分子或离子,其中心原子的价层电子对数应为5,配位原子数应为3。
环己烷

安全信息
安全术语
风险术语
S9:Keep container in a well-ventilated place. 保持容器在通风良好的场所。 S16:Keep away from sources of ignition - No smoking. 远离火源,禁止吸烟。 S25:Avoid contact with eyes. 避免眼睛接触。 S33:Take precautionary measures against static discharges. 对静电采取预防措施。 S60:This material and/or its container must be disposed of as hazardous waste. 该物质及其容器必须作为危险废物处置。 S61:Avoid release to the environment. Refer to special instructions/Safety data sheets.
谢谢观看
操作处置与储存
操作注意事项:密闭操作,全面通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴 自吸过滤式防毒面具(半面罩),戴安全防护眼镜,穿防静电工作服,戴橡胶耐油手套。远离火种、热源,工作 场所严禁吸烟。使用防爆型的通风系统和设备。防止蒸气泄漏到工作场所空气中。避免与氧化剂接触。灌装时应 控制流速,且有接地装置,防止静电积聚。搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种和数量的消 防器材及泄漏应急处理设备。倒空的容器可能残留有害物。
03-蛋白质的三维结构

目录
2.酰胺平面与二面角
肽键具有部分双键的性质, 不能自由转动。因此,每个肽 单位的六个原子都被酰胺键固 定在同一个平面上,这一平面 称为酰胺平面,也叫肽平面。 它是一个刚性平面,参与肽键 的6个原子C1、C、O、N、H、 C2的相对位臵都是固定不变的。 位于同一平面,C1和C2在平 面上所处的位臵为反式构型。
第三章 蛋白质的高级结构
一、蛋白质的一级结构 二、蛋白质的二级结构 三、蛋白质的三级结构 四、蛋白质的四级结构 五、稳定蛋白质三维结构的作用力 P207,掌握
目录
引言
蛋白质的多肽链并不是线形伸展的,而是 按一定方式折叠盘绕成特有的空间结构。 蛋白质的三维构象,也称空间结构或高级 结构,是指蛋白质分子中原子和基团在三 维空间上的排列、分布及肽链的走向。高 级结构是蛋白质表现其生物功能或活性所 必须的,包括二级、三级和四级结构。
首 N端
末C 端
其中的氨基酸称 氨基酸残基
目录
一级结构
1969年,国际纯化学和应用化学协会经过讨论规定一级 结构只指蛋白质分子中氨基酸残基的排列顺序,又称共 价结构、主链结构。其内容包括:肽键、氨基酸的种类 和数目,氨基酸的排列顺序、肽链数目、二硫键及酰胺 基的位置等。
一级结构要点:
1.蛋白质通过肽键-CO-NH-这一基本方式连接而成。
β转角
目录
β转角
作用力——同样 是肽键衍生来的 氢键 但由于只有这一 个氢键,只形成 β —转角结构。
O ……( 氢 键 )………H —C—(NH—CH—CO)2—N— R
目录
Ϋ-转角是球状蛋白质分子中出现的180°回折,有人称 之为发夹结构。 Ϋ转角的特征: ①由多肽链上4个连续的氨基酸残基组成。 ②主链骨架以180°返回折叠。 ③第一个a.a残基的C=O与第四个a.a残基的N-H生成氢键 ④C1Ϊ与C4Ϊ之间距离小于0.7nm ⑤多数由亲水氨基酸残基组成。 在Ϋ转角中第一个残基地C=O与第四个残基地N-H氢键键 合,形成一个紧密地环,使Ϋ转角成为比较稳定地结构。 由于甘氨酸缺少侧链(只有一个H),在Ϋ转角中能很 好地调整其他残基地空间阻碍,因此是立体化学上最合 适地氨基酸,而脯氨酸具有环状结构和固定的φ角,因 此在一定程度上迫使Ϋ转角形成,促进多肽链自身回折。
《高分子的结构》课件

高分子的应用
塑料
利用高分子材料制成的塑料具有 质轻、绝缘、耐腐蚀等优点,广 泛应用于包装、建筑、汽车等领
域。
纤维
高分子纤维具有强度高、耐磨、 耐高温等特点,用于纺织、航空
航天、体育器材等领域。
橡胶
橡胶是高分子材料的重要应用之 一,具有弹性好、耐磨、耐油等 特点,用于轮胎、减震器、密封
件等领域。
05
02 03
无规共聚、交替共聚、嵌段共聚
无规共聚是指两种单体随机结合生成的高分子;交替共聚是指两种单体 按照一定的顺序交替结合生成的高分子;嵌段共聚是指将一种高分子链 段嵌入另一种高分子链中生成的高分子。
合成橡胶
合成橡胶是通过共聚合反应合成的,可以调节单体的配比和聚合条件, 生成具有不同性能的高分子,广泛应用于汽车、建筑、电子等领域。
高分子的聚集态结构包括晶 态、非晶态、液晶态等,这 些结构决定了高分子的机械
性能、热性能等。
02
晶态高分子具有较高的机械 强度和热稳定性,而非晶态 高分子则具有较好的弹性和
塑性。
03
高分子的结晶度越高,其机 械性能和热稳定性越好,但 结晶过程会影响高分子的加
工性能。
高分子的化学结构
高分子的化学结构包括单体单元、重复单元、侧基等,这些结构决定了高分子的化 学性质。
化学稳定性
合成高分子通常具有良好的化学稳定性 ,不易受酸、碱、氧化剂等物质的影响 。
力学性能
高分子具有优良的力学性能,如强度、 弹性、耐磨性等,使其在工程、建筑、 汽车等领域得到广泛应用。
电学性能
一些高分子具有特殊的电学性能,如导 电、绝缘、介电等,可用于制造电子元 件和绝缘材料等。
02
高分子的结构
第3章双原子分子的结构-资料

(a
b )
E1
H aa H ab 1 Sab
E2
H aa H ab 1 Sab
库仑积分()
H aa
EH
1 R
a2 d
rb
后项意指处在 a 轨道中的电子,受到核 b的库仑吸引能
一般来说:第二项与第三项数值相近而抵消, ≈ EH ﹤0
交换积分( )
第三章 双原子分子结构
1. H2+ 结构 2. 简单分子轨道理论 (MO法) 3. 同核双原子分子 4. 异核双原子分子 5. 价键理论 (VB法) 6. 分子光谱
双原子分子的解离能 (kJ/mol)
H 2 L i2 N a 2 F e 2C l2 H FH C lC lFL iH N a H 4 3 21 0 57 21 3 02 4 05 6 54 3 03 6 42 4 12 1 8
3 同核双原子分子
3.1 分子轨道的构造及能级次序 同核双原子分子,可取两原子相同的 AO 进行加或减组合 得到的MO用作为基函数的AO来标记
如, 1 s 一定是由两个原子的1s AO ( 1 s ) 组合到的MO
分子轨道的能量,显然同参与组合的AO的能量相关 (1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s )
是稳定分子(闭壳层结构), 又具化学活性( g * 为反键轨道 )
3.3 O2 分子
仅当其对应的系数行列式为0, 方有非零解。
Haa E Hab ESab 0 Hab ESab Haa E
久期行列式
(H aa E)2 (H ab ESab )2 0
2024年度医用化学基础(中职)PPT完整全套教学课件(1)

目录•课程介绍与学习目标•原子结构与元素周期律•分子结构与化学键理论•溶液与胶体性质及应用•酸碱平衡与沉淀溶解平衡•有机化合物结构与性质•生物体内重要元素及其化合物•医用高分子材料简介与应用课程介绍与学习目标0102 03医用化学的定义医用化学是医学领域中的一门重要学科,主要研究生物体内的化学过程以及与医学相关的化学知识。
医用化学的研究内容包括生物分子的结构与功能、生物体内的化学反应、药物设计与合成等。
医用化学在医学领域的应用医用化学为医学提供了重要的理论基础和实践指导,对于理解疾病的发病机理、药物设计与合成以及医学诊断和治疗等方面具有重要意义。
医用化学基础概述能力目标能够运用医用化学知识分析生物体内的化学过程,具备基本的实验技能和药物设计与合成能力。
知识目标掌握医用化学的基本概念和原理,了解生物分子的结构与功能,熟悉生物体内的化学反应及药物设计与合成等相关知识。
情感目标培养学生对医用化学的兴趣和热情,树立科学的世界观和方法论,提高创新意识和实践能力。
中职医用化学课程目标ABDC系统学习按照课程大纲和教学计划,系统学习医用化学的知识体系,掌握基本概念和原理。
理论联系实际将所学的理论知识与实际应用相结合,通过实验、案例分析等方式加深对理论知识的理解。
多维度学习除了课堂学习外,还可以通过阅读相关文献、参加学术讲座、与同学讨论等方式拓宽学习视野。
及时复习与总结课后及时复习所学内容,总结重点和难点,形成自己的知识体系。
学习方法与技巧原子结构与元素周期律提出原子是化学变化中的最小粒子,具有不可分割性。
道尔顿的原子学说认为原子是一个均匀分布的带正电荷的球体,电子像葡萄干一样镶嵌在其中。
汤姆生的葡萄干面包模型通过实验发现原子中心有一个带正电荷的原子核,电子在核外绕核运动。
卢瑟福的核式结构模型引入量子化概念,解释了氢原子光谱的不连续性。
波尔的氢原子模型原子结构模型1 2 3根据元素的性质随原子序数的递增而呈现周期性变化的特点,将元素按照原子序数大小排列成表。
分子的空间结构(第2课时价层电子对互斥模型)高二化学同步课件精讲及习题精练

(1)BeCl2 直线形
;
(2)SCl2
V形
;
(3) SO32- 三角锥形 ;
(4)PF3 三角锥形
。
Thank you!
感谢观看!
中心原子上的孤电子对数
例:CO2:
C原子的孤电子对为( 4 - 2×2 )÷ 2 = 0 个; 分子中一个C原子与2个O原子形成了2个σ键电子对; 则价层电子对为2。这2对价层电子对之间彼此排斥,便得到了 直线型的VSEPR模型,也就是二氧化碳分子的空间构型。
【课堂练习】
1、(1)计算下列分子中红色字体对应原子的价层电子对数: ①C· Cl4________;②B· eCl2________; ③B· Cl3________;④P· Cl3________。
随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,键 角减小。
得到VSEPR模型以后,若分子的中心原子有孤电子对,中心原子上的孤对电 子也要占据中心原子周围的空间,并与成键电子对互相排斥。再讨论空间构 型时应略去孤电子对,才是该分子的实际空间构型。
【思考与讨论】
H2O、NH3的键角分别是105°、107°,请解释原因。
)
×
(4)SO2分子与CO2分子的组成相似,故它们都是直线形分子。( )
【课堂练习】
B 2、下列分子中,空间结构不是直线形的是( )
A.CO B.H2O C.CO2
D.C2H2
3、下列分子或离子的中心原子上未用于成键的价电
A 子对最多的是( ) A.H2O B.HCl
C.NH4+ D.PCl3
【课堂练习】
【思考与讨论】
写出分子的电子式, 再对照其球棍模型, 运用分类、对比的方
Gaussian03技术讲座 分子坐标、基组选择和常见出错处理

例4:பைடு நூலகம்O2的内坐标
三原子共线,一定需要虚原子定位. C X 1 1.0 O 1 r 2 90.0 O 1 r 2 90.0 3 180.
r=1.25
建议:一般键角大于175.度,应该加虚原子调节,否则容易造成优化中超过 180.度而出错; 或者用直角坐标优化。
混合坐标写法 从:优化的1,3-丁二烯标准方向坐标开始
例3:CH4 分子的两种写法 (Td对称性)
A: B:
C1 H2 1 r H3 1 r 2 a H4 1 r 2 a 3 b H5 1 r 2 a 3 –b
r=1.09 a=109.47122 b=120.
•原子顺序可以改变,同一结构有多种写法
1 61r 12r1a 12r1a3 b 12r1a4 b r=1.09 a=109.47122 b=120.
19.4800000 -0.470282000E-01 2.38900000 0.624884100 0.779500000 0.472254200 P 1 1.00 0.740000000E-01 1.00000000 P 1 1.00 0.220000000E-01 1.00000000 D 4 1.00 37.0800000 0.329000000E-01 10.1000000 0.178741800 3.22000000 0.448765700 0.962800000 0.587636100 D 1 1.00 0.226200000 1.00000000 ****
因此,它和体系的总电子自旋S有关: 自旋多重度=2S+1
1个和2个单电子时自旋多重度的确定
容易知道,闭壳层体系的自旋多重度为1。具有一个单电子的体系自旋多重 度为2。余下类推。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
检偏镜
目镜
3.2.2 手性与结构 连有四个完全不相同的基团的碳原子的叫手性化 合物,但是含不含手性碳不一定表征了手性是否 存在。手性的产生与对称因素相关联
1,CN轴:N=360度/旋转角 如果分子中有一条直线,以此直线为轴旋转 360度/N(N=2,3,4……)后,得到的图形与原 分子完全重合,此直线就是该分子的N重对称轴。 2,平面对称因素σ 如果某分子能被一平面分为互为实物和镜像两 部分,该平面就是该分子的对称面。 3,中心对称因素i 如果分子中有一个P点,任何一个原子或者基 团向P点引连线并且延长,在等距离处都遇到相同 的原子 或者基团,P点为该分子的对称中心。 如:含一个碳的化合物来说
1号碳是S型的,3号碳是R型的。 所以2号碳是假手性的。
3.4.5 手性轴和手性平面 有的分子没有手性碳,但是有手性轴和手性平面, 因而也是手性分子,如图:
H H C C C H
sp2
H
sp2
sp
如果a不等于b,则该 分子具有手性轴,该 分子是手性分子。 中间那个4元环立于α平面 之上,如果四元环上无a基, 则α平面是该分子的对称面, 分子无手性。如果4元环上 有a基,则该分子无对称面。
b b a C d c a d c
在Fisher投影式中,任意两个集团互换,构型改变, 任意三个集团轮换,构型不变。 如果最不优集团在竖直键上,则其表观的R,S型结 构就是其真实结构,如果最不优集团在横键上,则 其表观结构为其 对映异构体。 例,给下列化合物命名
1
2 5 6
3 4
3号和5号的碳都是S型的,所以2号和6号碳都是相 同的,所以1号碳不是手性碳。 3.3.3 D,L命名 以乳糖为例,将手性碳放在中心,将氧化数最高的C 放在最上面,如果—OH在右边,为D型,如果--OH 在左边,为L 型。 COOH 如图: D型乳糖
a c b
3.4.3 含n个不同C*,有2n个对映异构体,2n-1对 对映异构体。 3.4.4 假手性碳和假手性化合物 有一个碳虽然连了四个不相同的集团,但是其中2个 碳分别是互为对映异构的CR和CS,因而这个分子 仍然是非手性分子,存在对称面,这个碳称为假手 性碳(如下图的2号C原子)
CH3 H H3C H CH3 Cl CH2CH3 Cl
Cl Cl
Cl
Cl Cl
revolve90
o
Cl
Cl Cl
Cl
σ
S4
Cl Cl
Cl
具有S4对称因素的分子
5,手性与结构的关系 如果同时没有平面对称因素(σ)和中心对称因素 (i)的化合物,就是手性化合物。但是当分子不 具有σ和i时,却具有S4轴时,分子仍是非手性的。 3.3 手性化合物的命名方式
3.2 手性与旋光性 3.2.1 光学异构体的检测 旋光仪是一种测量旋光性化合物旋光性能的仪器, 它检测的物理量是旋光度,旋光度是旋光性物质使 偏振光的偏振方向改变的角度,用α表示。物质的旋 光性能一般用比旋光来表示[α],两者关系如下:
[α]D
T
α CxL
旋光度检测流程:由单色光源出发
起偏器
旋光管
3.3.1 R,S构型 对一个化合物,如图:
C d
a b c
设d为最不优集团,将d置于竖直向里的位置 如果a>b>c(按集团的优势与不优势) 则化合物是R型的(a,b,c,从最优到最不优是 时针旋转的) 如果a>c>b, 则化合物是S型的(a,c,b ,从最优到最不优是 逆时针旋转
a C d c b a
a
Caaaa:6个σ 4个C3轴 3个C2轴
a a
Caaab:3个σ 1个C3轴 Caabb:2个σ 1个C2轴 Cabcd:0个σ 0个Cn轴
C a
4,更叠旋转轴对称因素(Sn) 如果一个分子能围绕一根轴旋转360°/n(n=1, 2,…),用一个垂直于该轴的镜面将分子反射, 得到的镜像若能与原来的分子完全重叠,则该 轴称为该分子的n重更叠(旋转)
H CH3 OH
其他化合物,把编号最大的手性碳与乳糖作类比, 如果较优势集团在右边,则是D型;如果较优势集 团在左边,则是L型。 3.4. 常见手性化合物类型 3.4.1 含一个手性碳C* 有一对对映异构体,即CR和CS 3.4.2 含两个手性碳 有两对对映异构体,4个对映异构体,如果这2 个手性碳所连的集团都相同,而且一个是R型,一 c 个是S型 即CRA—CSA 如图: a b 该化合物有对称面,是非 手性的,没有对映异构。
3.5 构象与手性 1,含手性构象的分子未必是手性的 2,在非手性环境中,一对对映异构体的能量是相 同的。 3,手性分子不存在非手性构象 4,如果一个分子出现了非手性构象,则该分子是 非手性分子 5,一般可以从分子对称性最好的构象推测判断分 子是否具有手性,如果对称性最好的构象都是手性 构象,则一般来说,分子是手性分子。 环状:平面 链状:全交叉或全重叠
注:手性只考虑原子的对称关系,如果分子是 手性的,则存在对映异构,如果分子是非手性 的,则没有对映异构(如CRA—CSA是内消旋 化合物),但是可能有非对映异构体(如 CRA—CSA和CRA—CRA之间)
R type
c
d
b
a C d c b
a
S type
b
d
c
3.3.2 Fisher投影式 Fischer投影式(简称Fischer式)是在纸平面 上表示碳原子四面体结构的一种方法。具体规定是, 将碳链竖直,编号小的碳原子朝上,C∗放在纸平面上, 与C∗所连的竖直方向上的两个基团指向纸平面下方, 水平方向上的两个基团指向纸平面的上方,然后向纸 平面投影,得到“+”的图形,其交点表示C∗,横线和 竖线表示四价键,写出相应的四个基团,即得 Fischer式。如图:
第三章 分子结构
3.1 立体化学与立体异构现象 分子异构可以分为构造异构和立体异构,构造异构是 指原子在空间的连接顺序不同而造成的同分异构现象, 包括碳架异构,官能异构等。 立体异构是指原子在空间的连接顺序相同,但是连接 方式不同造成的同分异构现象,它可以分为构型异构 和构象上的异构。 其中构型上的异构又可以分为顺反异构和光学异构 (又叫对映异构或者异构)
