给水处理中二氧化氯与臭氧的应用比较
二氧化氯及紫外线及氯液与臭氧比较

液氯、臭氧、二氧化氯、紫外线比较
项目液氯二氧化氯紫外线臭氧
需要处理时间10~30 分钟比液氯稍快最小5~10 分钟对细菌的有效性有有有有
对病毒的有效性有一些有一些有一些有
设备投资最低比液氯高,比其
它方法低许多
比臭氧高液氯的 5 倍
运行费用最低比液氯高,比其
他方法稍低
与臭氧类似比液氯高
优点1、价廉
2、技术成熟
3、有保护性余
氯
4、有持续杀菌
的能力1、价廉
2、可现场制造,
技术成熟
3、有持续杀菌
能力
杀菌效应快1、除色臭味快
2、广谱杀菌消
毒,消毒效率是
氯消毒的15 倍
3、无二次污染
缺点1、对病毒无效
2、其氧化性对
人体有害
3、有刺激性气
味并损害人体皮
肤1、对病毒无效
2、气态的二氧
化氯是剧毒的化
合物,对人体有
害,且与液氯一
样会有致癌的二
次污染物的产生
1 、价格贵
2 、无持续杀菌
能力
3 、对水的前处
理要求高
4 、穿透力弱
1、价格贵
2、无持续杀菌
能力
3、安全要求高
适合类型所有类型的污水
处理或给水处理1 、所有类型的
污水处理
2 、所有类型的
给水处理
简单空气杀菌、
医院废水、饮料
生产用水、污水
处理排放
1、适合所有场
合水处理的杀菌
和消毒
2、空气消毒
3、器械表面消毒。
水处理中二氧化氯与臭氧的应用比较(二)

水处理中二氧化氯与臭氧的应用比较(二)2. 臭氧(O3)2.1 臭氧的应用1840年瑞士化学家Schōnbein证实了臭氧的存在。
1886年法国人Meritenus发现臭氧具有杀菌作用。
1893年荷兰首先将臭氧应用于水的消毒处理。
1906年法国的Nice城将臭氧用于大规模净水厂的水处理,至今已有近百年历史。
臭氧氧化能力强,用于消毒杀菌杀伤力大,速度快;臭氧可氧化溶解性铁、锰,形成高价沉淀物,使之易于去除;可将氰化物、酚等有毒有害物质氧化为无害物质;可氧化致嗅和致色物质,从而减少嗅味,降低色度;可将生物难分解的大分子有机物氧化分解为中小分子量有机物,使之易于生物降解;使用臭氧预处理,还可以起到微絮凝作用,提高出水水质;应用臭氧,不会在处理过程中产生有害的三致物质。
目前,世界上有上千家水厂使用臭氧进行处理、消毒。
在欧洲主要城市已把臭氧作为去除水中污染的一种主要手段用于饮用水的深度净化。
20世纪70年代初以来,许多国家还对臭氧应用于城市污水、工业废水、循环冷却水处理进行了研究并有很多成功的例子。
70年代中期开始,我国也开始了利用臭氧氧化工艺处理受污染饮用水水源的试验研究工作。
现在国内已有数十家水厂应用于实际生产。
2.2 臭氧的物理性质O3是一种具有特殊的刺激性气味的不稳定气体,常温下为浅蓝色,液态呈深蓝色。
O3是常用氧化剂中氧化能力最强的,在水中的氧化还原电位为2.07V,而氯为1.36V,二氧化氯为1.50V.另外,O3具有较强腐蚀性。
O3在空气中会慢慢自行分解为O2,同时放出大量的热量,当其浓度超过25%时,很容易爆炸。
但一般臭氧化空气中O3的浓度不超过10%,不会发生爆炸。
在标准压力和温度下,纯臭氧的溶解度比氧大10倍,比空气大25倍。
0℃时,纯臭氧在水中的溶解度可达1.371g/L.O3在水中不稳定,在含杂质的水溶液中迅速分解为O2,并产生氧化能力极强的单原子氧(O)和羟基(OH)等具有极强灭菌作用的物质。
水处理过程中几种消毒剂的对比

消毒剂次氯酸钠
就运行成本而言,采用次氯酸钠消毒的运行成本费用是很低的,稍比氯气高一些。 根据英国所统计的一组数据表明,次氯酸钠同氯气成本相比大约为1.05 :1 作为一种真正高效、广谱、安全的強力灭菌、杀病毒药剂,次氯酸钠同水的亲 和性很好,能与水任意比互溶,它不存在液氯、二氧化氯等药剂的安全隐患, 且其消毒效果被公认为和氯气相当。也正是因为这一特点,所以它消毒效果好, 投加准确,操作安全,使用方便,易于储存,对环境无毒害,不存在跑气泄漏, 可以任意环境工作状况下投加。
小结
不管是氯气、臭氧还是二氧化氯气体,不仅存在扩散和跑泄漏问题,而且它们的溶解性 能都是比较差的,在药物投加方面要做到像次氯酸钠等液体消毒剂那样方便准确是比较 困难的。一般来讲,它们通过发生器所形成的气体气压大抵为常压,不会高出大气压力 多少,更不可能有近似液氯的压力,也没有真空加氯机这样的投加设备,这是它投加困 难达不到所要求水质标准的主要因素。
消毒剂臭氧
臭氧的消毒原理 臭氧在水中分解时直接放出单原子氧[O],因而具有强大的氧化消毒功效。臭氧由 于分子小,能迅速扩散和渗透到水中的细菌、芽孢、病毒中,强力有效地氧化分 解细菌、病毒、藻类物质的各种组织物质。 臭氧的优缺点 它不生成任何带有特殊气味的物质,在味觉、气味、颜色方面可以很好地起到 改善水质的作用。它的这一特点决定其在食品工业方面应用是很有前途的。 另外臭氧的灭菌速度快。
水处理过程中几种消毒剂的对比
水处理过程中几种消毒剂的对比
水处理过程中几种消毒剂的对比
水处理过程中常用的消毒剂 几种消毒剂的对比
小结 绘图
水处理过程中常用的消毒剂
目前,从水体消毒的种类来说,有氯气、次氯酸钠、 漂白粉、三氯异氰尿酸、二氧化氯、双氧水、臭氧 等药剂和方式,此外还有紫外线消毒等一些手段。
紫外线消毒、臭氧、二氧化氯技术比较
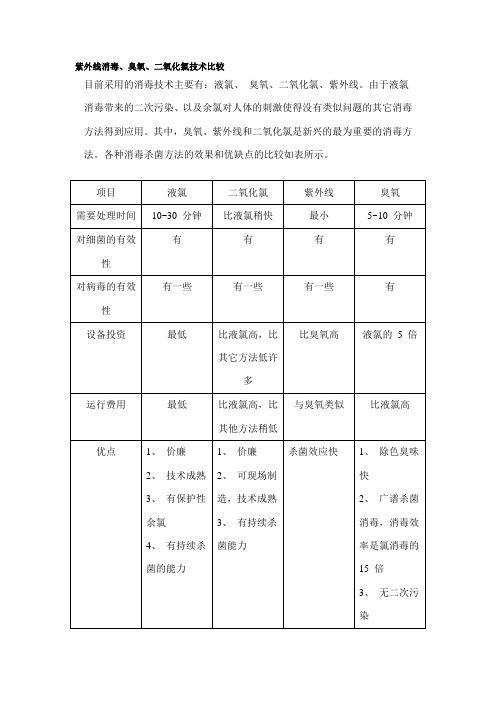
紫外线消毒、臭氧、二氧化氯技术比较
目前采用的消毒技术主要有:液氯、臭氧、二氧化氯、紫外线。
由于液氯消毒带来的二次污染、以及余氯对人体的刺激使得没有类似问题的其它消毒方法得到应用。
其中,臭氧、紫外线和二氧化氯是新兴的最为重要的消毒方法。
各种消毒杀菌方法的效果和优缺点的比较如表所示。
通过上表可以看出,在消毒杀菌的有效性方面,臭氧与紫外线差不多,但臭氧的应用范围要比紫外线广泛。
在设备投资和运行费用方面,臭氧≈紫外线>二氧化氯>液氯。
但根据对各种消毒方法的总体评价,臭氧是一种非常好杀菌消毒的方法。
次氯酸钠二氧化氯和臭氧杀菌消毒的比较.

次氯酸钠二氧化氯和臭氧消毒效果的比较目前,从水体消毒的种类来说,有氯气、次氯酸钠、漂白粉、三氯异氰尿酸、二氧化氯、双氧水、臭氧等药剂和方式,此外还有紫外线消毒等一些手段。
由于氯气运输、管储方面的不安全;在投加方面,气体同水体的溶解性较低,容易散失,水中留存余量难以达到标准;氯气瓶气压不断变化,存在投加计量不够准确的问题;加之,氯气等气体的极强扩散性对环境存在毒害作用,游离氯的高活性容易形成许多象四氯化碳一类的致癌物质,故而,取消液氯的主张越来越多,也日益受到人们的关注。
就拿氯气的安全性来说,就始终是一个让人时时警觉的问题。
在我国,几乎每一年都有氯气罐泄漏的安全事故发生。
氯气作为危险品受到各国安全机关的严格管制。
前些年,发生在福建三明火车站氯气瓶运输中的跑氯事件造成几千人的紧急疏散;在北京有些游泳场由于操作人员不谨慎,三分钟跑氯就有37名孩子住进医院。
我国的天津地区就明确规定公共娱乐场所禁用氯气进行消毒。
在国外许多发达国家,像美国、德国、日本等就相当限制氯气的使用,氯气主要用于污水处理。
尤其是公用场所和中小型自来水厂一般不再使用液氯,而多以使用次氯酸钠液体进行消毒。
当然,也有根据用水要求,如像小量饮用水就采用诸如紫外线、臭氧、双氧水等手段进行灭菌杀毒。
氯气、次氯酸钠、、氯酸钠氯酸钠和用臭氧发生器设备,一般都必须采取者压缩空气进行发二氧化氯和臭氧[1]都是工农业生产和日常生活中比较容易见到的几种强氧化剂,除臭氧以外,它们均为非天然存在的化学物质。
一般都可以用作水体杀生剂。
它们不仅具有灭杀细菌和病毒的功能,还能够漂白纸张、纤维以及用作化学合成等。
广泛用于自来水消毒、游泳池水灭菌、污水处理、循环水除藻、造纸工业、化学合成业、以及医药卫生和防疫等各个领域。
但是,不同的药剂具有不同的性能和特点,就如同不同厂家的产品具有并不相同的质量一样。
氯气、次氯酸钠、二氧化氯和臭氧在物理化学性能上,以及实际使用中都有很大的区别。
次氯酸钠、二氧化氯和臭氧的比较

次氯酸钠、二氧化氯和臭氧的比较目前,从水体消毒的种类来说,有氯气、次氯酸钠、漂白粉、三氯异氰尿酸(二氯异氰尿酸钠)、二氧化氯、双氧水、臭氧等药剂和方式,此外还有紫外线消毒等一些手段。
氯气、次氯酸钠、二氧化氯和臭氧都是工农业生产和日常生活中比较容易见到的几种强氧化剂,除臭氧以外,它们均为非天然存在的化学物质。
一般都可以用作水体杀生剂。
它们不仅具有灭杀细菌和病毒的功能,还能够漂白纸张、纤维以及用作化学合成等。
广泛用于自来水消毒、游泳池水消毒、污水处理、循环水除藻、造纸工业、化学合成业、以及医药卫生和防疫等各个领域。
但是,不同的药剂具有不同的性能和特点,就如同不同厂家的产品具有并不相同的质量一样。
氯气、次氯酸钠、二氧化氯和臭氧在物理化学性能上,以及实际使用中都有很大的区别。
就这几种消毒剂的应用来讲,次氯酸钠最为安全有效,易于储存,使用最为方便。
在国外许多发达国家,如美国、德国、日本等对氯气的使用有严格的限制,氯气主要用于污水处理。
而公用场所和中小型自来水厂一般不再使用液氯,而多使用次氯酸钠液体进行消毒。
当然,也可根据用水量的情况,采用其它消毒方法。
如小量饮用水的消毒就可以采用诸如紫外线、臭氧、双氧水等手段进行灭菌杀毒。
有关氯气的性能和使用情况,我们已很熟悉了。
液氯的杀菌效果很好,且容易获得,经济廉价,而且投加方便,占用地方很小,但其安全性比较低,管理上容易疏忽。
在这里,不再对液氯的情况进行详细分析,具体探讨和比较一下次氯酸钠、二氧化氯和臭氧三种消毒剂的性能以及相关设备的使用特点。
次氯酸钠次氯酸钠的分子式是N aOC ,l属于强碱弱酸盐,它清澈透明,是一种能完全溶解于水的液体。
但由于次氯酸钠液不易久存,次氯酸钠多以电解低浓度食盐水现场制备。
次氯酸钠液体可通过电解食盐水制备,这种设备称为次氯酸钠发生器。
次氯酸钠的生成过程可以通过化学方程式表达如下: 其总反应表达如下:N aC l+ H2 O N aO C l+ H2电极反应:阳极:2Cl-- 2eCl2阴极:2H++ 2e H2溶液反应: 2N aOH + C l2N aC l+ N aOC l+ H2O当然,次氯酸钠消毒液体以次氯酸钠发生器生产为最佳。
消毒剂次氯酸钠二氧化氯和臭氧的比较

消毒剂次氯酸钠二氧化氯和臭氧的比较目前,从水体消毒的种类来说,有氯气、次氯酸钠、漂白粉、三氯异氰尿酸、二氧化氯、双氧水、臭氧等药剂和方式,此外还有紫外线消毒等一些手段。
由于氯气运输、管储方面的不安全;在投加方面,气体同水体的溶解性较低,容易散失,水中留存余量难以达到标准;氯气瓶气压不断变化,存在投加计量不够准确的问题;加之,氯气等气体的极强扩散性对环境存在毒害作用,游离氯的高活性容易形成许多象四氯化碳一类的致癌物质,故而,取消液氯的主张越来越多,也日益受到人们的关注。
就拿氯气的安全性来说,就始终是一个让人时时警觉的问题。
在我国,几乎每一年都有氯气罐泄漏的安全事故发生。
氯气作为危险品受到各国安全机关的严格管制。
前些年,发生在福建三明火车站氯气瓶运输中的跑氯事件造成几千人的紧急疏散,又如2004年重庆市一家储存有十多吨的液氯发生泄漏迫使三十多万人疏散;在北京有些游泳场由于操作人员不谨慎,三分钟跑氯就有37名孩子住进医院。
我国的天津地区就明确规定公共娱乐场所禁用氯气进行消毒。
在国外许多发达国家,像美国、德国、日本等就相当限制氯气的使用,氯气主要用于污水处理。
尤其是公用场所和中小型自来水厂一般不再使用液氯,而多以使用次氯酸钠液体进行消毒。
当然,也有根据用水要求,如像小量饮用水就采用诸如紫外线、臭氧、双氧水等手段进行灭菌杀毒。
氯气、次氯酸钠、、氯酸钠氯酸钠和用臭氧发生器设备,一般都必须采取者压缩空气进行发二氧化氯和臭氧[1]都是工农业生产和日常生活中比较容易见到的几种强氧化剂,除臭氧以外,它们均为非天然存在的化学物质。
一般都可以用作水体杀生剂。
它们不仅具有灭杀细菌和病毒的功能,还能够漂白纸张、纤维以及用作化学合成等。
广泛用于自来水消毒、游泳池水灭菌、污水处理、循环水除藻、造纸工业、化学合成业、以及医药卫生和防疫等各个领域。
但是,不同的药剂具有不同的性能和特点,就如同不同厂家的产品具有并不相同的质量一样。
氯气、次氯酸钠、二氧化氯和臭氧在物理化学性能上,以及实际使用中都有很大的区别。
臭氧、次氯酸钠、二氧化氯消毒剂的比较

臭氧、次氯酸钠、二氧化氯消毒剂的比较作者:佚名文章来源:本站原创点击数:240 更新时间:2006-9-16次氯酸钠、二氧化氯和臭氧的比较目前,从水体消毒的种类来说,有氯气、次氯酸钠、漂白粉、三氯异氰尿酸(二氯异氰尿酸钠)、二氧化氯、双氧水、臭氧等药剂和方式,此外还有紫外线消毒等一些手段。
由于氯气在运输、存储方面存在安全隐患;在定量投加方面,因氯气在水中的溶解度较低,氯气容易散失,使得水中留存余量难以达到标准;同时,氯气瓶气压不断变化,存在投加计量不够准确的问题;氯气具有极强的扩散性,对环境存在毒害作用;游离氯的高活性容易形成许多象四氯化碳一类的致癌物质,故而,在常规消毒领域,取消液氯的主张越来越多,也日益受到人们的关注。
就拿氯气的安全性来说,就始终是一个让人时时警觉的问题。
在我国,几乎每年都有氯气罐泄漏的安全事故发生。
氯气作为危险品受到各国安全机关的严格管制。
前些年,发生在福建三明火车站氯气瓶运输中的跑氯事件,造成几千人的紧急疏散;在北京有些游泳场由于操作人员不谨慎,三分钟的跑氯,就有37名孩子住进医院。
2005年3月29日18时50分,江苏省淮安市境内,一辆山东鲁H-00099装有液氯危险品的运输车,行至京沪高速公路上行线103KM+300M处,与一辆鲁QA0938货车相撞,导致鲁H-00099侧翻液氯泄漏。
截止3月31日8时,此事故已造成28人中毒死亡,285人被送往医院救治。
事故发生后,有关部门立即组织疏散村民群众近1万人,造成京沪高速公路宿迁至宝应段关闭20个小时。
我国的天津地区就明确规定公共娱乐场所禁用氯气进行消毒。
在国外许多发达国家,如美国、德国、日本等对氯气的使用有严格的限制,氯气主要用于污水处理。
而公用场所和中小型自来水厂一般不再使用液氯,而多使用次氯酸钠液体进行消毒。
当然,也可根据用水量的情况,采用其它消毒方法。
如小量饮用水的消毒就可以采用诸如紫外线、臭氧、双氧水等手段进行灭菌杀毒。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目前,我国给水中应用的氧化消毒剂以液氯为主。
但随着源水污染的变化,废水中各种有机物的含量有所增加,运用液氯消毒会产生氯代有机物,其中有的产物具有致突变作用。
为满足人们对水质要求的不断提高,寻求能替代氯的更安全而经济的新型氧化消毒剂,成为今后给水处理的一个发展方向。
其中,较有前途的是二氧化氯(ClO2)和臭氧(O3)。
1.二氧化氯(ClO2)1.1 二氧化氯的应用十九世纪初,美国科学家Dary H.发现了ClO2气体。
二十世纪40年代,二氧化氯开始应用于食品加工的杀菌消毒,造纸的漂白和水的净化处理等。
由于二氧化氯不会与有机物反应而生成THMs,所以在饮用水处理中应用越来越广泛。
1983年,美国国家环保局(EPA)提出饮用水中三氯甲烷含量必需低于0.1mg/L,并推荐使用ClO2消毒。
二氧化氯消毒的安全性被世界卫生组织(WHO)列为A1级,被认定为氯系消毒剂最理想的更新换代产品。
目前,美国和欧洲已有上千家水厂采用ClO2消毒;我国则多用于造纸、纺织等行业,并逐步应用于自来水厂。
在给水处理中,ClO2不仅可以作为高效的消毒剂,还可考虑投加在原水、沉淀池前或滤池前,进行预氧化或中间氧化,以控制嗅味(尤其是氯酚或藻类副产物嗅味等),防止微生物滋长,加强混凝过滤;也可用于去除水中的铁、锰和色度。
另外,欧洲一些国家将ClO2、O3即Cl2结合起来用于饮用水处理,取得了较好的效果。
1.2 二氧化氯的物理性质二氧化氯(ClO2)常温(20℃)下是一种黄绿色的气体,具有与氯气、臭氧类似的刺激性气味,分子量67.45,比空气重,熔点-59℃,沸点11℃。
ClO2极易溶于水而不与水反应,22℃时溶解度约为氯的5倍,达2.9g/L。
ClO2在水中的溶解度随温度升高而降低。
同时二氧化氯分子的电子结构虽是不饱和状态,在水中却不以聚合状态存在,这对ClO2在水中迅速扩散十分有利。
但ClO2水溶液易挥发,在较高温度与光照下会生成ClO2-与ClO3-,应避光低温保存。
据介绍,ClO2在常温下可压缩成深红色液体,极易挥发,极不稳定,光照、机械碰撞或接触有机物都会发生爆炸;在空气中的体积浓度超过10%或在水中浓度超过30%时也会发生爆炸。
不过ClO2溶液浓度在10g/L以下时基本没有爆炸的危险。
由于ClO2对压力、温度和光线敏感,不能压缩进行液化储存和运输,只能在使用时现场临时制备。
1.3 二氧化氯的氧化消毒机理作为强氧化剂,ClO2在酸性条件下具有很强的氧化性:ClO2 + 4H+ + 5e = Cl- + 2H2O在水厂pH≈7的中性条件下,ClO2 + e = ClO2-ClO2- + 2H2O + 4e = Cl-- + 4OH-ClO2能将水中少量的S2-、SO32-、NO2-等还原性酸根氧化去除,还可去除水中的Fe2+、Mn2+及重金属离子等。
另外,对水中有机物的氧化,Cl2以亲电取代为主,而ClO2以氧化还原为主,能将腐殖酸、富里酸等降解,且降解产物不以三氯甲烷形式存在。
ClO2是一种光谱、高效的杀菌消毒剂,实验证实,它对细菌、芽孢、藻类、真菌、病毒等均有良好的杀灭效果。
关于ClO2的消毒机理,由多种解释,一般认为ClO2对微生物细胞壁有较好的吸附和穿透作用,能渗透到细胞内部与含巯基(-SH)的酶反应,使之迅速失活,抑制细胞内蛋白质的合成,从而达到将微生物灭活的目的。
由于细菌、病毒、真菌都是单细胞的低级微生物,其酶系分布于细胞膜表面,易于受到ClO2攻击而失活。
而人和动物细胞中,酶系位于细胞质之中受到系统的保护,ClO2难以和酶直接接触,故其对人和动物的危害较小。
1.4 二氧化氯的氧化消毒特性ClO2时较强的氧化剂,氧化水中有机物具有选择性。
(1)ClO2氧化能力强,其氧化能力是氯的2.5倍,能迅速杀灭水中的病原菌、病毒和藻类(包括芽孢、病毒和蠕虫等)。
(2)与氯不同,ClO2消毒性能不受pH值影响。
这主要是因为氯消毒靠次氯酸杀菌而二氧化氯则靠自身杀菌。
(3)ClO2不与氨或氯胺反应,在含氨高的水中也可以发挥很好的杀菌作用,而使用氯消毒则会受到很大影响。
(4)ClO2随水温升高灭活能力加大,从而弥补了因水温升高ClO2在水中溶解度的下降。
(5)ClO2的残余量能在管网中持续很长时间,故对病毒、细菌的灭活效果比臭氧和氯更有效。
(6)ClO2具有较强的脱色、去味及除铁、锰效果。
(7)ClO2消毒只是有选择的与某些有机物进行氧化反应将起降解为含氧基团为主的产物,不产生氯化有机物,所需投加量小,约为氯投加量的40%,且不受水中氨氮的影响。
因此,采用ClO2代替氯消毒,可使水中三氯甲烷生成量减少90%。
1.5 二氧化氯的制备及经济性比较ClO2的制备方法有化学反应法、电解食盐法、离子交换法等。
其中化学法和电解法在生产上应用较多。
1.5.1 化学法化学反应制取ClO2的方法有:(1)盐酸与亚氯酸钠反应5NaClO2 + 4HCl = 5NaCl + 4HCl + 2H2O(2)盐酸与氯酸钠反应2NaClO3 + 4HCl = 2NaCl + 2ClO2 + 2H2O(3)液气混合反应2NaClO2 + Cl2 = 2NaCl + 2ClO2根据方法(3)研制的ClO2发生器,使用时固体亚氯酸钠至于反应器中,以空气稀释的氯气通过反应器,这样可在反应过程中一直保持过量的亚氯酸钠,使全部氯气都参与反应从而避免产物中混入氯气。
但由于NaClO2价格昂贵,这种方法的成本与运行费用较高,难以在饮用水处理中推广。
目前,一般谈到的化学法制取ClO2指方法(1)。
这种方法生产规模较小,设备简单,便于实现自动化操作,适于水处理中生产应用;但碰到的问题同样是NaClO2价格昂贵,且该法ClO2的理论产率只有80%。
为此,有公司研制出使用NaClO3和H2SO4反应制取ClO2的二氧化氯发生器,其反应原理是:2NaClO3 + 2NaCl + 2H2SO4 = 2ClO2 + Cl2 + 2H2O + 2Na2SO4反应中会产生氯气,用户再根据需要将气体纯化,2NaClO2 + Cl2 = 2NaCl + 2ClO2据称该种发生器产生的混合气体中ClO2占70%,其余30%为Cl2。
使用纯化器后ClO2的含量可达95%。
该发生器价格不到相同规格电解法发生器的1/2,比使用NaClO2的发生器价格还低。
设备可以连续运转,也可以间歇使用,发生器可调范围大。
同时,NaClO3价格低廉,只有NaClO2价格的十分之一,运行费用较低,有一定的竞争力。
1.5.2 电解法电解NaCl溶液生产ClO2以食盐为原料,采用隔膜电解工艺,在阳极室注入饱和食盐水,阴极室加入自来水,接通电源后使离子定向迁移,从而在阳极室及中性电极周围产生ClO2、O3、H2O2、Cl2等混合气体。
生产中可以通过降低电解温度,控制盐水流量,增加阳极室ClO3-含量等方法提高ClO2产率。
产生的混合气体ClO2仅占10%左右,除了O3、H2O2外,大部分是氯气。
这就无法避免液氯消毒的缺点。
同时ClO2含量也难以精确计算,设备复杂,易损坏部件价格昂贵,运行维护困难。
但目前国内仍多用此法。
也有报道称电解法可生产一种以ClO2为主的复合消毒剂,其成分ClO2占37%,Cl2占27%,O3占15%,H2O2占10%,其它占11%。
由于氧化作用速度O3> ClO2> Cl2,所以O3和ClO2首先降水中的有机物氧化分解,并进行消毒,而27%的Cl2可保证水中足够的余氯。
这对快速氧化和杀灭水中微生物及稳定水质都有很好的效果。
另外,曾有液体稳定性ClO2、固体稳定性ClO2的研究报道。
根据有关资料,投加10mg/L的液氯进行消毒,药剂成本约0.022元/吨水;利用HCl和NaClO2制取的ClO2按0.5mg/L投加,吨水消毒成本约0.02元。
而采用液体稳定性二氧化氯和固体稳定性二氧化氯消毒,药剂成本分别为每吨水0.35元和0.12元(投加量0.5mg/L),显然经济性较差。
1.6 使用二氧化氯存在的问题ClO2加入水中后,会有50%~70%转变为ClO2-与ClO3-。
很多实验表明ClO2-、ClO3-对血红细胞有损害,对碘的吸收代谢有干扰,还会使血液中胆固醇升高。
美国EPA建议二氧化氯消毒时残余氧化剂总量(ClO2+ClO2-+ClO3-)<1.0mg/L,使对正常人群健康不致有影响。
而实际应用中ClO2的剂量都控制在0.5mg/L以下。
ClO2氧化分解有机物具有较强的选择性。
它能氧化去除水中的Fe2+、Mn2+、氰化物、酚等;能氧化硫醇、仲胺和叔胺,消除水中的不愉快气味,却不易氧化醇、醛、酮、伯胺等有机物,导致去除不彻底。
二氧化氯性质比较活泼,易爆炸,且其本身也有毒性。
因此在使用ClO2时要十分注意安全。
一般在ClO2制备系统中应严格控制原料稀释浓度,防止误操作并应建立相应安全措施。
ClO2储存要低温避光;ClO2车间禁用火种,设良好的通风换气设备。
2. 臭氧(O3)2.1 臭氧的应用1840年瑞士化学家Schōnbein证实了臭氧的存在。
1886年法国人Meritenus发现臭氧具有杀菌作用。
1893年荷兰首先将臭氧应用于水的消毒处理。
1906年法国的Nice城将臭氧用于大规模净水厂的水处理,至今已有近百年历史。
臭氧氧化能力强,用于消毒杀菌杀伤力大,速度快;臭氧可氧化溶解性铁、锰,形成高价沉淀物,使之易于去除;可将氰化物、酚等有毒有害物质氧化为无害物质;可氧化致嗅和致色物质,从而减少嗅味,降低色度;可将生物难分解的大分子有机物氧化分解为中小分子量有机物,使之易于生物降解;使用臭氧预处理,还可以起到微絮凝作用,提高出水水质;应用臭氧,不会在处理过程中产生有害的三致物质。
目前,世界上有上千家水厂使用臭氧进行处理、消毒。
在欧洲主要城市已把臭氧作为去除水中污染的一种主要手段用于饮用水的深度净化。
20世纪70年代初以来,许多国家还对臭氧应用于城市污水、工业废水、循环冷却水处理进行了研究并有很多成功的例子。
70年代中期开始,我国也开始了利用臭氧氧化工艺处理受污染饮用水水源的试验研究工作。
现在国内已有数十家水厂应用于实际生产。
2.2 臭氧的物理性质O3是一种具有特殊的刺激性气味的不稳定气体,常温下为浅蓝色,液态呈深蓝色。
O3是常用氧化剂中氧化能力最强的,在水中的氧化还原电位为2.07V,而氯为1.36V,二氧化氯为1.50V。
另外,O3具有较强腐蚀性。
O3在空气中会慢慢自行分解为O2,同时放出大量的热量,当其浓度超过25%时,很容易爆炸。
但一般臭氧化空气中O3的浓度不超过10%,不会发生爆炸。
在标准压力和温度下,纯臭氧的溶解度比氧大10倍,比空气大25倍。
