6 锌族元素
锌族元素概述

、最简易的检测化妆品中是否含有重金属汞的方法,如下: 1、将化妆品涂在皮肤表面,取1分2分或者5分硬币(或用银质饰品)
擦拭,擦拭部位变黑者,即含有重金属汞,颜色越黑含有汞越多。
原理:化学法 — 汞与硬币中的镍、铬等金属生成合金“汞齐”。
2、用一个不锈钢汤勺盛一些化妆品,在煤气灶的火源上加热,
如果出现沉淀的杂质,即含有汞等重金属化合物。
1000℃
2 ZnO
第十四章 过渡元素(二)
14.2.1锌族元素概述
单质 化学性质
Zn与Cd相似,Hg化学活泼性较差
在干燥空气中稳定 Zn: 1.在潮湿空气中表面生成致密碱式碳酸盐薄膜, 保护Zn不被继续氧化 2Zn+O2+H2O+CO2 → Zn(OH)2· ZnCO3 2. 加热下可与绝大多数非金属反应 1000℃ 2 Zn + O2 2 ZnO 3.两性 Zn + 2 H+ → Zn2+ + H2 Zn + 2 OH- + 2 H2O → [Zn(OH)4]2- + H2 4.溶于氨水 Zn + 4NH3+ 2H2O→ [Zn(NH3)4]2++H2 +2OH-
第十四章 过渡元素(二)
14.2.1锌族元素概述ຫໍສະໝຸດ 美白化妆品中的汞(氨基氯化汞)
色斑形成的根本原因:皮肤色素细胞产生的黑色素过多 汞是一种有毒重金属,能够损害色素细胞,减少黑色素生成。氨基
氯化汞作为汞的衍生物,不仅起效快,价格低廉,而且因为是白色
、无味,即便添加过多也不会对产品的卖相起到什么变化,所以,
14.2.1锌族元素概述
单质 物理性质
均为银白色金属,锌略带蓝白色。 熔、沸点较低,并按Zn-Cd-Hg顺序降低,常温下Hg 为液态。
锌族元素化学性质

HgCl2(升汞 升汞) 升汞
Hg2Cl2(甘汞 甘汞) 甘汞
硝酸汞和硝酸亚汞 Hg(NO3)2 Hg2(NO3)2 HgO; 过量Hg + HNO [HgI制取 2Hg2+ + 2I-4+ HgI2 (橘红色 3 ; ]2-可用于检验NH → 过量 橘红色 可用于检验 橘红色) 适量 4 Hg+HNO3 Hg(NO3)2+Hg 2[HgI4]2-+4OH-+NH4+→-OHg2NH2I +7I-+3H2O 易溶(Hg 溶解性 + 2HNO+→ Hg(NO )I 易溶 O 22+) 易溶 2I 2+) 2+ HgO 2Hg2易溶(Hg →Hg32 22+ H浅绿色 (浅绿色 浅绿色) 3 (奈斯勒试剂 HgOHg(NO红棕色 2(OH)NO3 奈斯勒试剂) (红棕色 2 红棕色) 奈斯勒试剂 Hg 易水解 3)2 Hg+4HNO3+过量 → HgOHg(NOg)2I 2 (浅绿色 过量) HgI 橘红色 橘红色) 浅绿色) 浅绿色 与KI反应 3适量H2O → (橘红色3)2+2NO2 +2HNO3 反应 2Hg(NO )2 (过量 2 Hg(NO H 3 2 + 2H2O
配合物 Hg(Ⅰ)形成配合物的倾向较小 Ⅰ 形成配合物的倾向较小 Hg(Ⅱ)可形成稳定配合物,如 可形成稳定配合物, Ⅱ 可形成稳定配合物
配位数 ClISCNCN配离子 [HgCl4]2[HgI4]2[Hg(SCN)4]2[Hg(CN)4]2Kf 1.17×1015 × 6.76×1029 × 1.698×1021 × 2.51×1041 × 稳 定 性 增 强
巧记元素周期表

巧记元素周期表其实初中化学不会很难,内容也不是很多,关键是上课效率要高,不是记笔记的效率,而是听讲的效率,课后恶补一小时,也不一定有上课十分钟有用。
做作业时可以多翻翻书翻翻笔记,翻几遍就记住了,但不能形成依赖,每次一不记得就翻也不行,先想一下,通常第一次想到了,就不会忘了。
题目最好靠自己做,实在想不出了再问问别人,不用做太多,但做一条就要有一条的效率,不能太马虎。
要注意找规律,一些常遇到的关键点要牢记于心,要形成一种思想。
元素周期表初中只要记前20个就够了,五个五个记,没事多念念,念快一点,当顺口溜记(氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,硫氯氩钾钙),至于字吗,看着元素周期表记,周期表是有自己的周期的,仔细看看就会发现一些规律,初中就够用了。
气体是气字头的,金属是金字旁的,其他都是石字旁的。
现在化学刚起步,补还来得及,等以后再补就难了,因为其中要记的很多,初中打个好基础,以后就不会哪么累。
老师说的话虽然常常很废,但有的还是要听的,虽然我的化学老师叫我做错题集很烦很无聊,还不准上课做作业,但看在听他话后我的化学还不赖的份上,我还是乖乖听话的,与君共勉。
巧记元素周期表自编的小故事口诀,10分钟全背(2分钟看故事+6分钟浓缩故事+2分钟对照)侵害(氢氦)从前,有一个富裕人家,用鲤鱼皮捧着碳(锂铍硼碳),煮熟鸡蛋供养着有福气的奶妈(氮氧氟氖)。
那儿有个很美丽的女儿(钠镁铝),叫桂林(硅磷),不过她留有两颗绿色的大门牙(硫氯氩)(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命(钾钙钪钛钒铬锰)。
新婚的那天,号称“铁姑”的小姑子狠狠地捏痛了新嫁者(铁钴镍铜锌镓锗),新娘子的母亲一生气(砷硒),当时就休克(溴氪)了。
如此一来(铷锶钇),娘家就上告(锆),说:“你(铌)看这小姑(子真是不得了(钼锝钌)!”铁姑的老爸与她的哥哥(铑钯银镉)连夜跑进县太爷府,把官印(铟)偷走了,一直往西(锡),提(锑)在手里拼命逃跑,跑到一个仙人住的地方。
1到12族元素-概述说明以及解释

1到12族元素-概述说明以及解释1.引言1.1 概述概述:元素是构成物质的基本组成单位,根据元素在周期表中的位置不同,可以分为不同的族。
本文将重点介绍1到12族元素,这些元素在化学性质上具有一定的相似性。
1到12族元素分别是氢、碱金属、碱土金属、硼族、碳族、氮族、氧族、氟族、稀有气体、过渡金属、镧系元素和锕系元素。
通过对这些族元素的了解,可以帮助我们更深入地理解元素之间的关系,预测它们的化学性质,以及应用它们在各种领域中的重要性。
本文将对1到12族元素的性质、用途以及未来研究方向进行综述,为读者提供更全面的知识。
1.2 文章结构文章结构部分的内容如下:文章结构部分将重点介绍本文的组织结构和内容安排。
本文将分为引言、正文和结论三个部分。
在引言部分,将对1到12族元素进行概述,并介绍本文的目的和结构。
接着,在正文部分将详细探讨1到4族元素、5到8族元素和9到12族元素的特点和性质。
最后,在结论部分将总结1到12族元素的特点,并提出未来可能的研究方向和结论。
通过以上结构安排,读者将能够系统全面地了解1到12族元素的相关信息,同时也能为今后的研究和探讨提供一定的参考依据。
1.3 目的:本文旨在系统地介绍1到12族元素的特点和性质,帮助读者全面了解这些元素在化学和物理方面的表现。
通过对这些元素进行分类和比较,我们可以更好地理解它们在元素周期表中的位置以及它们之间的关系。
同时,通过对不同族元素的性质和行为进行探讨,我们还可以更深入地探讨元素周期表的规律性和周期性。
最终,我们希望读者能够通过本文对1到12族元素有一个清晰的认识,为进一步研究和应用这些元素打下基础。
2.正文2.1 1到4族元素1到4族元素是元素周期表中的第一至第四主族元素,它们包括氢(H)、锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)、铍(Be)、镓(Ga)、铟(In)、铊(Tl)、硼(B)、铝(Al)、镧(La)等元素。
元素周期表背诵口诀

精品文档化学元素周期表背诵口诀对于大多数爱好化学者来说,在刚接触到化学的那一刻,就对那一张神秘莫测的表充满了背诵的欲望。
可惜,元素周期表有规律,背诵元素周期表却没有规律可循,于是我们跟着老师的节奏,初中毕业,背下了前二十号元素,高中毕业,充其量加了一些主族元素以及常用金属元素,而那张美丽神奇的表我们依旧只能是望洋兴叹……不否认这个世界上有黄蓉和黄蓉她妈这样的天才或者变态,他们不需要任何的口诀或者技巧就能过目不忘的背诵下来,或者即便他们的背诵技巧和方法公布出来,大多数人还是学不会。
因为天才的方法只适用于他们自己,其他人无法学习模仿,所以我们需要寻找大多数、绝大多数人都能轻松学会和掌握的方法。
一:常见的背诵方法化学元素周期表的背诵方法之前也在网上看到过许多,大体分为两种:1.编故事法“从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈……”这套取自大学英语四六级乃至雅思托福GRE的单词背诵方法,在背诵英语单词的时候帮了大家很大的忙,例如charisma (China rise Mao,中国升起了毛泽东,伟人气质,领袖风范油然而生,俞敏洪最得意之作),用这套方法背诵元素周期表却效果大打折扣,首先,元素周期表全表有近120号元素,本来记忆量就大,这么一来记得更多;其次,很难对应还原;再次,破坏了周期表的规整和严谨,得不偿失。
2.谐音法第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙(那美女鬼流露绿牙)对于元素周期表来说,谐音还不如死背,因为周期表中有大量的形声字,很多人连字本身的发音都记不住,更不用说去记谐音了,死背好歹记住的是正确的元素,谐音最后背的是什么自己都不知道了。
对于大多数人来说,元素周期表里很多汉字都分不清怎么读,用谐音法记忆,还原就是个大问题,只会错上加错,而且这些谐音法没有一个顺畅的,读着非常拗口,口诀本身就很难记,还原就更难。
锌族元素

锌族元素(锌镉汞)一、总的结构特征:(n-10d10ns2电子构型,最外层有两个电子且容易失去,d层电子的电离能较大,故不易失去。
这是造成锌族元素各种性质的根本原因。
1、从锌到汞,锌最活泼,只有+2价,而镉和汞拥有+1价和+2价,Hg的正一价是采取共用电子对形成离子形式稳定存在的(详见p719)2、锌族的化合物一般不显色因为锌族元素一般形成+2价化合物。
在+2价化合物中,锌族元素的(n-1)d轨道是全满的。
因此不能发生d-d跃迁,故一般为无色,固体为白色。
汞能形成稳定的+1价化合物。
但Hg+的5d轨道也是全满的,所以Hg+化合物一般也无色。
但要注意并不是所有锌族元素化合物都是无色,某些锌族元素化合物,由于离子极化,是有颜色的。
例如硫化汞有红色和黑色两种;氧化镉为棕色;氧化锌在室温下为白色;在高温(>300℃)下,由于离子极化加强而显黄色。
二、存在和冶炼锌族元素均为亲硫元素,因此主要是以硫化物存在:闪锌矿ZnS,菱锌矿ZnCO3。
镉有CdS,而汞的唯一矿源为朱砂(又名辰砂)HgS。
处理硫化矿物的方法需要记住,一般是先用氧气,得到金属氧化物和S02气体,之后再用一氧化碳还原金属氧化物即可。
三、锌Zn1、它与铝类似,是两性金属。
但也有不同,即是锌可以溶于氨水,因为可以形成四氨合锌阳离子,而铝不可以。
锌是生命必备的痕量金属元素之一。
2、ZnO,俗名锌白,可用作白色颜料,相比传统的颜料铅白(碱式碳酸铅,是输送自来水的材料之一,是一种保护膜,可以阻止水和氧气继续和Pb反应)而言,优点在于无毒,且与H2S气体相遇不会变色,而碱式碳酸铅与H2S反应会生成黑色的PbS。
ZnO是一种两性氧化物,可以溶于强碱形成配位阳离子。
3、ZnCl2,无水ZnCl2为白色固体,极易溶于水,也极易吸水,故可以用它作为去水剂来浸泡木材(固体盐中溶解度最大的),也易溶于许多有机溶剂。
ZnCl2溶解度高的原因是因为在水中形成了配酸(一羟基二氯合锌酸),这种配酸有显著的酸性。
元素周期表(全面版)
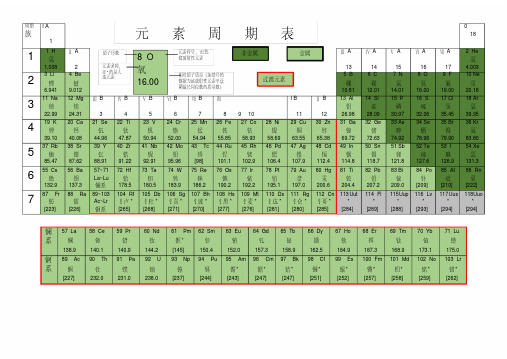
周期族I A1 0181 1 H 氢1.008 Ⅱ A2Ⅲ A13Ⅳ A14Ⅴ A15Ⅵ A16Ⅶ A172 He氦4.0032 3 Li 锂6.941 4 Be铍9.0125 B硼10.816 C碳12.017 N氮14.018 O氧16.009 F氟19.0010 Ne氖20.183 11 Na 钠22.99 12 Mg镁24.31Ⅲ B3Ⅳ B4Ⅴ B5Ⅵ B6Ⅶ B7Ⅷ8 9 10I B11Ⅱ B1213 Al铝26.9814 Si硅28.0915 P磷30.9716 S硫32.0617 Cl氯35.4518 Ar氩39.954 19 K钾39.10 20 Ca钙40.0821 Se钪44.9622 Ti钛47.8723 V钒50.9424 Cr铬52.0025 Mn锰54.9426 Fe铁55.8527 Co钴58.9328 Ni镍58.6929 Cu铜63.5530 Zn锌65.3831 Ga镓69.7232 Ge锗72.6333 As砷74.9234 Se硒78.9635 Br溴79.9036 Kr氪83.805 37 Rb 铷85.47 38 Sr锶87.6239 Y钇88.9140 Zr锆91.2241 Nb铌92.9142 Mo钼95.9643 Tc锝[98]44 Ru钌101.145 Rh铑102.946 Pd钯106.447 Ag银107.948 Cd镉112.449 In铟114.850 Sn锡118.751 Sb锑121.852 Te碲127.653 I碘126.954 Xe氙131.36 55 Cs 铯132.9 56 Ba钡137.357~71La~Lu镧系72 Hf铪178.573 Ta钽180.574 W钨183.975 Re铼186.276 Os锇190.277 Ir铱192.278 Pt铂195.179 Au金197.080 Hg汞200.681 Ti铊204.482 Pb铅207.283 Bi铋209.084 Po钋[209]85 At砹[210]86 Rn氡[222]7 87 Fr钫[223] 88 Ra镭[226]89~103Ac~Lr锕系104 Rf钅卢*[265]105 Db钅杜*[268]106 Sg钅喜*[271]107 Bh钅波*[270]108 Hs钅黑*[277]109 Mt钅麦*[276]110 Ds钅达*[281]111 Rg钅仑*[280]112 Cn钅哥*[285]113Uut*[284]114 Fl*[289]115Uup*[288]116 Lv*[293]117Uus*[294]118Uuo*[294]镧系57 La镧138.958 Ce铈140.159 Pr镨140.960 Nd钕144.261 Pm钷*[145]62 Sm钐150.463 Eu铕152.064 Gd钆157.365 Tb铋158.966 Dy镝162.567 Ho钬164.968 Er铒167.369 Tm铥168.970 Yb镱173.171 Lu镥175.0锕系89 Ac锕[227]90 Th钍232.091 Pa镤231.092 U铀238.093 Np镎[237]94 Pu钚[244]95 Am镅*[243]96 Cm锯*[247]97 Bk锫*[247]98 Cf锎*[251]99 Es锿*[252]100 Fm镄*[257]101 Md钔*[258]102 No锘*[259]103 Lr铹*[262]金属非金属过渡元素8 O氧16.00原子序数元素符号,红色指放射性元素元素名称,注*的是人造元素相对原子质量(加括号的数据为该放射性元素半衰期最长同位数的质量数)元素周期表元素周期表有关知识一、部分酸、碱和盐的溶解性表(室温)说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇水就分解了。
元素周期表

元素周期表元素周期表主族元素类金属▪硼 ( 5 ) ▪硅 ( 14 ) ▪锗 ( 32 ) ▪砷 ( 33 ) ▪锑 ( 51 )▪碲 ( 52 ) ▪钋 ( 84 )金属元素碱金属▪锂 ( 3 ) ▪钠 ( 11 ) ▪钾 ( 19 ) ▪铷 ( 37 ) ▪铯 ( 55 )▪钫 ( 87 )碱土金属▪铍 ( 4 ) ▪镁 ( 12 ) ▪钙 ( 20 ) ▪锶 ( 38 ) ▪钡 ( 56 )▪镭 ( 88 )其他金属▪铝 ( 13 ) ▪铟 ( 49 ) ▪镓 ( 31 ) ▪锡 ( 50 ) ▪铊 ( 81 )▪铅 ( 82 ) ▪铋 ( 83 )▪ Uut( 113 )▪ Uuq( 114 )▪ Uup( 115 )▪ Uuh( 116 )▪ Uus( 117 )非金属元素稀有气体▪氦 ( 2 ) ▪氖 ( 10 ) ▪氩 ( 18 ) ▪氪 ( 36 ) ▪氙 ( 54 )▪氡 ( 86 )▪ Uuo( 118 )卤族元素▪氟 ( 9 ) ▪氯 ( 17 ) ▪溴 ( 35 ) ▪碘 ( 53 ) ▪砹 ( 85 )其他元素▪氢 ( 1 ) ▪碳 ( 6 ) ▪氮 ( 7 ) ▪氧 ( 8 ) ▪磷 ( 15 )▪硫 ( 16 ) ▪硒 ( 34 )副族元素金属元素镧系▪镧 ( 57 ) ▪铈 ( 58 ) ▪镨 ( 59 ) ▪钕 ( 60 ) ▪钷 ( 61 )▪钐 ( 62 ) ▪铕 ( 63 ) ▪钆 ( 64 ) ▪铽 ( 65 ) ▪镝 ( 66 )▪钬 ( 67 ) ▪铒 ( 68 ) ▪铥 ( 69 ) ▪镱 ( 70 ) ▪镥 ( 71 )锕系▪锕 ( 89 ) ▪钍 ( 90 ) ▪镤 ( 91 ) ▪铀 ( 92 ) ▪镎 ( 93 ) ▪钚 ( 94 ) ▪镅 ( 95 ) ▪锔 ( 96 ) ▪锫 ( 97 ) ▪锎 ( 98 ) ▪锿 ( 99 ) ▪镄 ( 100 ) ▪钔 ( 101 ) ▪锘 ( 102 ) ▪铹 ( 103 )过渡金属▪钪 ( 21 ) ▪钛 ( 22 ) ▪钒 ( 23 ) ▪铬 ( 24 ) ▪锰 ( 25 ) ▪铁 ( 26 ) ▪钴 ( 27 ) ▪镍 ( 28 ) ▪铜 ( 29 ) ▪锌 ( 30 ) ▪钇 ( 39 ) ▪锆 ( 40 ) ▪铌 ( 41 ) ▪钼 ( 42 ) ▪锝 ( 43 ) ▪钌 ( 44 ) ▪铑 ( 45 ) ▪钯 ( 46 ) ▪银 ( 47 ) ▪镉 ( 48 ) ▪铪 ( 72 ) ▪钽 ( 73 ) ▪钨 ( 74 ) ▪铼 ( 75 ) ▪锇 ( 76 ) ▪铱 ( 77 ) ▪铂 ( 78 ) ▪金 ( 79 ) ▪钅卢( 104 )▪钅杜( 105 )▪钅喜( 106 )▪钅波( 107 )▪钅黑( 108 )▪钅麦( 109 )▪鐽 ( 110 ) ▪錀 ( 111 ) ▪鎶 ( 112 ) ▪汞 ( 80 )目录发展史概述发明者生平简介大学期间的探索攀登科学高峰正式发现元素周期表119号元素元素周期表简介IUPAC元素系统命名法元素的位置碱金属性质发展史概述发明者生平简介大学期间的探索攀登科学高峰正式发现元素周期表119号元素元素周期表简介IUPAC元素系统命名法元素的位置碱金属性质展开编辑本段发展史◆诞生:1869年,俄国化学家门捷列夫编制出第一张元素周期表◆依据:按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行◆意义:揭示了化学元素之间的内在联系,成为化学发展史上的重要里程碑之一◆发展:随着科学的发展,元素周期表中未知元素留下的空位先后被填满。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. Hg Hg(NO3)2 + Hg → Hg2(NO3)2
HgCl2 + Hg → Hg2Cl2 2. 强还原剂与过量Hg(Ⅱ)化合物反应
Hg(Ⅱ)与Hg(Ⅰ)的相互转化 Hg(Ⅰ) → Hg(Ⅱ) Hg2+ + Hg Hg22+ 降低c (Hg2+) 即可 Hg22+ + 2OH- → HgO + Hg + H2O Hg22+ + S2- → HgS + Hg
化学性质
单质
Zn与Cd相似,Hg化学活泼性较差 在干燥空气中稳定 Zn:1.在潮湿空气中表面生成致密碱式碳 酸盐薄膜,保护Zn不被继续氧化 2.加热下可与绝大多数非金属反应 3.两性 Zn + 2H+ → Zn2+ + H2 -+2H O → [Zn(OH) ]2- + H Zn +2OH 4.溶于氨水2 4 2 Zn+4NH3+2H2O→[Zn(NH3)4]2++H2 +2OH-
无机化学多媒体电子教案
过渡元素
第七节锌族元素
锌族元素
ห้องสมุดไป่ตู้
1锌族元素概述 1锌族元素概述
ds 区
通性
Hg 汞
5d106s2
、
Zn
ⅡB族
Cd 铬
4d105s2
、
锌
104s2 3d 价层电子构型
、
+2 金属活泼性减弱 +1 +2 +1 +2 +1 主要氧化数 离子极化力、变形性增强, EA 其化合物溶解度减小。 2+ (M /M)/V -0.7626 -0.403 0.8535
氯化汞和氯化亚汞
HgCl2(升汞)
Hg2Cl2(甘汞)
稳定性 较稳定 见光分解 与稀氨水 HgNH2Cl (白色) HgNH2Cl↓(白色) + Hg↓(黑色) 反应★ (氨基氯化汞) Hg↓(黑色) 与SnCl2 适量 Hg2Cl2↓(白色) 反应★ 过量 Hg↓(黑色) [HgCl4]2—— 与KCl反应 - → [HgCl ]2光 HgCl + 2Cl 2HgCl + SnCl → Hg Cl + SnCl 2 3 → 4+ HgCl Hg(NH )Cl NH Cl Hg Cl HgCl + Hg 22NH 2 2 2 4 2+ 2 4 2 2 2 配制HgCl2溶液时, 可加入KCl , Hg Cl +3 SnCl → 2Hg + Hg SnCl Hg +2NH → Hg ( NH ) Cl + +NH Cl 2 2 2 4 2Cl 2 2 4 ∴Hg2Cl2应保存在棕色瓶中 以增加HgCl2的溶解度
Kf 1.17×1015 6.76×1029 1.698×1021 2.51×1041
稳 定 性 增 强
Hg(Ⅱ)与Hg(Ⅰ)的相互转化 Hg(Ⅱ) → Hg(Ⅰ) Hg2+
0.991 Hg 2+ 0.7960 Hg 2 Hg2+ + Hg Hg22+ c (Hg22+) K = ≈ 88 2+ c (Hg )
与氨水反应 与O2反应 热稳定性 HgO· NH2NO3 HgO· NH2NO3 +Hg Hg(NO3)2 \\\\\\\\ HgO + NO2+ O2 HgO + NO2
2
配合物 Hg(Ⅰ)形成配合物的倾向较小 Hg(Ⅱ)可形成稳定配合物,如
配位数
ClISCNCN-
4
配离子 [HgCl4]2[HgI4]2[Hg(SCN)4]2[Hg(CN)4]2-
适量 2Hg2++Sn2++6Cl-→Hg2Cl2 + SnCl4 (白色) 过量 Hg2Cl2+Sn2+ + 2Cl- → 2Hg + SnCl4 (黑色)
本节内容讲授完毕
本节内容 讲授完毕!
2锌的重要化合物
氧化物和氢氧化物
2锌的重要化合物
+ → Zn2+ +Zn(OH) ZnO ZnO + 2H H2O 2 + → Zn2+ + 2H O Zn(OH) + 2H 2 白色 2 颜色 白色 - + H O → [Zn(OH) ]2ZnO + 2OH 2 4 溶解性 微溶于水 难溶于水 Zn(OH)2 + 2OH- → [Zn(OH)4]2稳定 较稳定 热稳定性 酸碱性 两性 877 C —— 加入氨水 溶解 Zn(OH)2 ZnO + H2O Zn(OH)2 + 4NH3 → [Zn(NH3)4]2++2OH-
通性
E /V
A
Zn2+ Cd2+
-0.7626
Zn
2+
> -0.6 0.911
Cd2
< -0.2 0.7960
Cd
Hg2+
Hg2
2+
Hg
易发生: Hg2+ + Hg → Hg22+
化学性质
单质
Zn与Cd相似,Hg化学活泼性较差 在干燥空气中稳定 Zn:1.在潮湿空气中表面生成致密碱式碳 酸盐薄膜,保护Zn不被继续氧化 2.加热下可与绝大多数非金属反应 2Zn+O2+H2O+CO2 → Zn(OH)2· ZnCO3 1000 C 2Zn + O2 2ZnO
硫化锌(ZnS)
盐类
在锌盐溶液中通入H2S,可得到ZnS Zn2+ + H2S → ZnS(白色) +2H+ 白色颜料,混合晶体ZnS· BaSO4称为锌 钡白(即立德粉),是优良的白色颜料。
在晶体ZnS中掺入微量Cu、Mn、Ag做活 化剂,光照时可发出不同颜色的荧光,此 材料可作荧光粉。
配合物
硝酸汞和硝酸亚汞 Hg(NO3)2 Hg2(NO3)2 2-可用于检验 + HgO; 过量Hg + HNO3 ; 制取 2+ [HgI ] NH 适量 2Hg Hg+HNO + 2I 4→ HgIHg(NO ) 4 2 (橘红色 3 3)2+Hg 2-+4OH-+NH +→ OHg NH I +7I-+3H O 2[HgI ] 2+) 2 4 4 (Hg 2 易溶(Hg22+2 溶解性 易溶 ) 2+ HgO + 2HNO → Hg(NO ) + H O 2Hg + I ( 浅绿色 ) 3 2I →Hg 3 22 2 2 2 (奈斯勒试剂 )HgO· (红棕色 ) Hg(NO ) Hg 易水解 3 2 2(OH)NO3 Hg+4HNO (过量 )→ → Hg(NO + 2H2O ) HgI 橘红色 ))2+2NO Hg I ( 浅绿色 3 2 与 KI反应 3适量 2Hg(NO )23+ H2 O HgO · Hg(NO ) +2HNO 2 ( 2 2 3 2 3
常见配位数
Kf 2.88×109
4
5.01×1016 用于电镀
主要配合物 [Zn(NH3)4]2+ [Zn(CN)4]2-
[Zn(CN)4]2-/Zn: -1.26V [Cu(CN)4]2-/Cu: -1.27V
3汞的重要化合物
氧化汞
3汞的重要化合物
红色HgO 黄色HgO
变体
制取
Hg(NO3)2分解 汞盐中加碱
氯化锌(ZnCl2)
盐类
性质: 无水ZnCl2为白色固体 吸水性强,易溶于水,水溶液显酸性 Zn2+ + H2O Zn(OH)+ + H+ 浓溶液具有显著酸性, 能溶解金属氧化物 ZnCl H2O → H[ZnCl (OH)] 2+ 2 蒸干 ZnCl 水溶液,得不到 ZnCl 2 2, Fe2O3+6H[ZnCl2(OH)]得到的是 →Fe[ZnCl ( OH )] +3H O 2 3 2 Zn(OH)Cl。 常用于锡焊前清除金属表面氧化物
Hg2Cl2+ 2NH3 → Hg(NH2)Cl +Hg +NH4Cl
Hg22+ + 2CN- → Hg(CN)2 + Hg Hg22+ + 4I- → [HgI4]2- + Hg
Hg22+、Hg2+的鉴定 Hg22+—— SnCl2 Hg22+ + Sn2+ + Cl- → Hg + SnCl4 (黑色) Hg2+—— SnCl2
硝酸汞和硝酸亚汞 Hg(NO3)2 Hg2(NO3)2 HgO; 过量Hg + HNO3 ; 制取 2Hg(NO ) +4NH +H O 3 2 3 2 2Hg2(NO3)2+O2+4HNO ) +2H O 3→4Hg(NO 3 2 2 Hg+HNO Hg(NO3)2+Hg 3 → HgO · NH NO ( 白色 )+3NH NO 2 3 4 2+) 2+) 3 慢加热 溶解性 易溶 (Hg 易溶 (Hg 2 为防止 Hg2(NO ) 被空气氧化, 2Hg(NO ) 2HgO + 4NO + O (碱式氨基硝酸汞) 3 2 3 2 2 2 HgO· Hg(NO3)2 Hg2(OH)NO 易水解 3 2Hg (NO3 )2+4NH 可在其溶液中加入少量金属 Hg) HgI ) Hg2I2 (浅绿色 适量 3+H 2O 与 KI2 反应 2 (橘红色 Δ 22-+ NO → HgO·NH NO +Hg +NH Hg2(NO ) 2HgO + 2NO [HgI ] [HgI ] 2+ 2+ 过量 2 3 4 Hg 3 3 2 + Hg → 2 4 Hg 4 Hg
