关于化学电池的练习
化学基础知识点练习(原电池部分)

雄县中学高三化学组基础知识点电化学、电子式、热化学(4-1)制作者:李伟每天进步只需一点点高三化学电化学、电子式、热化学 班级姓名
原电池:1)自发的氧化还原2)负极发生氧化反应3)电子从负极经导线流向正极4)溶液中阴离子移向负极5)正极+负极=总离子方程式=负极+电解质6)碱性条件下O2+2H2O+4e-=4OH-
1、原电池(常见电池)
1)Zn-Cu/C-H2SO4负极正极总离子
2)Zn-Cu/C-CuSO4负极正极总离子
3)Fe-Cu/C-FeCl3负极正极总离子
4)Cu-Pt/C-FeCl3负极正极总离子
5)Mg-Al-H2SO4负极正极总离子
6)Mg-Al-NaOH 负极正极总离子
2、原电池(燃料电池)
1)H2(Pt/C)-O2(Pt/C)-KOH
负极正极总化学
2)H2(Pt/C)-O2(Pt/C)- H2SO4
负极正极总化学
3)CH4(Pt/C)-O2(Pt/C)- NaOH
负极正极总化学
4)CH4(Pt/C)-O2(Pt/C)- H2SO4
负极正极总化学
3、原电池(提高类)
1)Pb+PbO2+2H2SO4=2PbSO4+2H2O 注意:PbSO4是难溶物
负极正极
2)钢铁在潮湿的空气中发生吸氧腐蚀
负极(Fe)正极(C)总
3)铝-空气-海水电池
负极(Al)正极(C)总。
完整版)电化学练习题带答案

完整版)电化学练习题带答案1.铁镍蓄电池是一种常见的电池,其放电反应为Fe +NiO3 + 3H2O → Fe(OH)2 + 2Ni(OH)2.下列说法中,错误的是:A。
电池的电解液为碱性溶液,正极为NiO3,负极为Fe。
B。
电池放电时,负极反应为Fe + 2OH- → Fe(OH)2 + 2e。
C。
电池充电过程中,阴极附近溶液的pH降低。
D。
电池充电时,阳极反应为2Ni(OH)2 + 2OH- + 2e → NiO3 + 3H2O。
2.当镀锌铁发生析氢腐蚀时,有0.2mol电子发生转移。
正确的说法是:④在标准状况下有1.12L气体放出。
3.某固体酸燃料电池以CsHSO4固体为电解质传递H,其基本结构如图,电池总反应可表示为:2H2 + O2 → 2H2O。
以下说法正确的是:A。
电子通过外电路从b极流向a极。
B。
b极上的电极反应式为:O2 + 2H2O + 4e → 4OH-。
C。
每转移0.1mol电子,消耗1.12L的H2.D。
H由a极通过固体酸电解质传递到b极。
4.如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。
甲醇在催化剂作用下提供质子(H)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH + 3O2 → 2CO2 + 4H2O。
以下说法中,错误的是:A。
右边的电极为电池的负极,b处通入的是空气。
B。
左边的电极为电池的正极,a处通入的是甲醇。
C。
电池负极的反应式为:2CH3OH + 2H2O - 12e → 2CO2↑ + 12H+。
D。
电池正极的反应式为:3O2 + 12H+ + 12e → 6H2O。
5.铅蓄电池的工作原理为:Pb + PbO2 + 2H2SO4 →2PbSO4 + 2H2O。
以下判断不正确的是:A。
K闭合时,d电极反应式:PbSO4 + 2H2O - 2e → PbO2 + 4H+。
B。
当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.2mol。
高中化学原电池练习题

高中化学原电池练习题原电池,是指由两种不同金属电极和相应电解质组成的电池。
原电池是化学反应生成电流的简单装置,其工作原理基于金属的离子间的电子传递。
在高中化学中,对原电池的理解是十分重要的知识点。
下面将给出几道高中化学原电池练习题,帮助同学们巩固对原电池的理解。
1. 下列反应中,哪一个能够组成原电池?A. 2H₂ + O₂ → 2H₂OB. Zn + Cu²⁺ → Zn²⁺ + CuC. Fe + 2H⁺ → Fe²⁺ + H₂D. Mg + 2Cl → MgCl₂2. 以下哪一个金属能够用于制作原电池中的阴极?A. 铝B. 锌C. 铜D. 锡3. 如果想要构建一个氢气电极,应该选择下列哪一种金属?A. 铜B. 银C. 铝D. 镍4. 在一个铜原电池中,下列哪一种粉末的溶液可以作为电解质?A. 氢氧化铁(III)溶液B. 铝氧化物溶液C. 硫酸铜溶液D. 碳酸镁溶液5. 当镍棒浸泡在硫酸镍的溶液中,同时有一个金片浸泡在硫酸铁的溶液中,连接两者后形成的电池是什么电池?A. 镍电池B. 铁电池C. 镍铁电池D. 锌铜电池6. 在铅板浸泡的硝酸铅溶液中,铁片浸泡在硫酸铁的溶液中,下列哪一种连接方式可以构成最简单的原电池?A. 铅板与铁片直接连接B. 铅板与铁片通过电解液连接C. 铅板通过导线连接铁片D. 铅板与铁片间没有联系7. 如果我们想要增加原电池的电动势,下列哪一种操作是可行的?A. 增加电解质浓度B. 更换阳极和阴极的金属C. 减小电解质浓度D. 加热电池中的电解液8. 下列哪一项不是原电池的特点?A. 金属电极必须有差异B. 电解液是电解质C. 电池产生电流的原理是化学反应D. 电解质中必须含有阴离子9. 原电池中,金属电极上的反应为氧化还是还原?A. 氧化B. 还原10. 在原电池中,正极电极对应于哪一个位置?A. 当电池放电时,正极为阳极B. 当电池放电时,正极为阴极C. 当电池充电时,正极为阳极D. 当电池充电时,正极为阴极通过这些练习题的答题学习,相信同学们对于高中化学中的原电池知识有了更深入的了解。
高二化学电池练习题

高二化学电池练习题电池是一种将化学能转变为电能的装置。
在高中化学学习中,电池是一个重要的话题。
为了帮助高二化学学生更好地理解和掌握电池的知识,下面将提供一些电池相关的练习题,供同学们练习。
1. 下面是一些关于电池的基础知识的选择题,请选择正确答案:a) 反应性最强的金属是:1. 银2. 铜3. 铁4. 钾b) 下面哪个物质通常用作电池中的电解质:1. 银片2. 金片3. 锂离子4. 盐溶液c) 一个原电池的电势增加的最简单方法是:1. 增加阳极面积2. 增加阴极体积3. 增加电解质浓度4. 增加电池温度d) 能将化学能转化为电能的是:1. 太阳能电池2. 汽车蓄电池3. 闹钟电池4. 家庭插座2. 下面是一些关于电池的计算题,请计算出正确答案:a) 一个锌-银原电池的电势差是1.5V,如果将这个原电池放入电解质浓度为0.5mol/L的溶液中,预测电池的电势差。
b) 一个锌-银原电池在连续工作了48小时后,电池金属极板的质量变化是5g,计算出电池每小时的平均电流。
c) 如果一个化学电池的电势差为3V,电流为0.5A,求出电池内部电阻的大小。
d) 一个镍-铅蓄电池可以提供12V的电压,在放电过程中,电池的电动势逐渐降低到10V,计算电池的放电效率。
3. 下面是一些关于电池工作原理的简答题,请用简洁明了的语言回答:a) 请解释一下电池的工作原理是什么。
b) 为什么铅酸电池中的电解质通常是酸性溶液?c) 请简要描述一下原电池的结构和工作原理。
d) 为什么电池会产生放电反应?以上是一些关于高二化学中电池的练习题,希望能帮助同学们巩固并深化对电池知识的理解。
做完题目后,可以将答案与同学们互相讨论,相互学习成长。
原电池习题_化学原电池题目及解析题
问题解决
铜银原电池(盐桥)
电极反应:
Cu 盐桥 Ag
负极: Cu - 2e- = Cu2+
正极:
2Ag + +2e- =2Ag CuSO4溶液
总反应:
铜半电池
Cu + 2Ag + = Cu2+ + 2Ag
AgNO3溶液
银半电池
练习反馈
(高考真题)依据氧化还原反应: 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)
锌半电池
铜半电池 总反应: Zn + Cu2+= Zn2+ + Cu
知识小结
一. 盐桥的作用:
1.沟通内电路 2.平衡电荷,使溶液呈电中性
二.加入盐桥后由两个半电池组成的原电池工作原理:
半电池中:活泼金属(还原性强)作负极,失电子被氧化 另半电池:电解质溶液中氧化性强的离子在正极得电子被还原 外电路中:电子由负极经导线流向正极 内电路中:两极之间通过盐桥构成闭合回路。
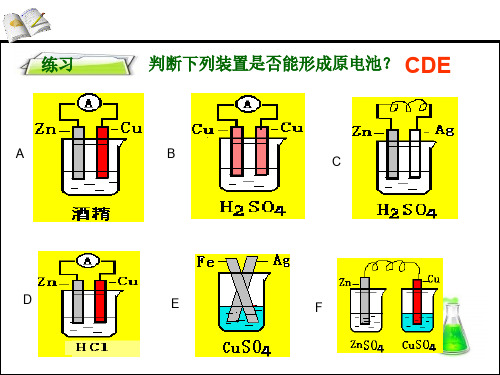
练习
判断下列装置是否能形成原电池? CDE
A
B
C
D
E
F
Zn
Cu
ee-
Zn2+
Cu2+ Cu2+
CuSO4
1、铜锌原电池的工作原理
• (1)锌失去电子变成锌离子进入溶液中 • (2)失去的电子通过导线流向铜 • (3)铜离子在铜表面得到电子生成铜 • (4)导线中电子是由锌极流向铜极,溶液
中铜离子向铜移动,硫酸根离子向锌极移 动,电子和离子的移动形成一个闭合的回 路。
Cl- K+
K+ Cl-
5原电池原理练习题及参考答案

原电池原理例1.某化学兴趣小组组装的原电池装置如下图所示:下列有关说法正确的是A .X 极上发生的是还原反应B .外电路电流方向为:Y −−→外电路−−→XC .电子流动方向为:Y −−→电解质溶液−−→XD .烧杯中一定是稀硫酸例2.银锌电池是一种常见化学电源,其反应原理:222Zn Ag O H O=Zn(OH)2Ag +++。
其工作示意图如图所示,下列说法不正确的是A .Zn 电极是负极B .Ag 2O 电极发生还原反应C .放电前后电解质溶液中c (OH -)保持不变D .Zn 电极的电极反应式:Zn-2e -+2OH -=Zn(OH)21.下列化学反应可设计成原电池的是 A .HCl+NaOH=NaCl+H 2O B .2FeCl 3+Cu=2FeCl 2+CuCl 2C .Ba(OH)2·8H 2O+2NH 4Cl=BaCl 2+2NH 3↑+10H 2OD .CO 2+Na 2CO 3+H 2O=2NaHCO 32.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气体的是A .B .C .D .3.下列有关装置的说法正确的是A .装置I 中Mg 为原电池的负极B .装置II 为一次电池C .装置III 中a 极发生反应:2H 2e 2H -+-=D .装置IV 工作时,电子由锌通过导线流向碳棒4.将铜棒和铝棒用导线连接后插入浓硝酸溶液中,下列叙述中正确的是 A .该装置能形成原电池,其中铝是负极 B .该装置能形成原电池,其中铜是负极 C .该装置不能形成原电池 D .以上说法均不正确5.某同学设计的原电池装置如图,下列说法错误的是A .该电池的总反应为32Fe 2Fe e =3F +++B .C 极为电池的正极C .电流从C 极经导线流向Fe 极D .3Fe +在C 极表面被氧化6.M 、N 、P 、E 四种金属:①M+N 2+=N+M 2+;②M 、P 用导线连接放入硫酸氢钠溶液中,M 表示有大量气泡;③N 、E 用导线连接放入E 的硫酸溶液中,电极反应为E 2++2e -=E ,N-2e -=N 2+。
高中化学原电池练习题(有答案)

原电池练习题一、单选题1.放热的氧化还原反应能设计成原电池下列反应中能设计成原电池的是A.与反应B. 酸碱中和反应C. 灼热的炭与反应D.与的燃烧反应2.研究小组分别用锌片、铝片、Cu和稀硫酸进行原电池的相关的探究,所得部分实验数琚如下,下列说法正确的是实验电极甲电极乙I Zn CuⅡAl CuA. 两组实验溶液的pH均增大B. 实验Ⅱ中,向Al定向迁移C. 实验I中,甲电极反应为:D. 实验Ⅱ中,电子由铜转移到锌3.人造地球卫星用到的一种高能电池--银锌蓄电池,其电极分别是和Zn,电解液是KOH溶液放电时,该电池的电极反应式为:,下列说法中正确的是锌为负极,为正极;放电时,正极附近溶液浓度增大;工作时电流由极经外电路流向Zn极;溶液中阴离子向正极方向移动,阳离子向负极方向移动.A. B. C. D.4.下图是原电池的装置示意图,下列叙述正确的是( )A. Zn片是正极B. 电池工作时,在铜片上得电子C. 电池工作时,电能转变为化学能,且锌片逐渐被消耗D. 电池工作时,电子从锌片通过硫酸溶液流向铜片5.干电池原理示意图如图,电池总反应为:,下列说法正确的是A. 碳为电池的负极B. Zn极上发生氧化反应C. 电流由锌极流向碳极D.在Zn片上生成6.有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:实验次数电极材料水果品种电极间距电压1锌铜菠萝3900 2锌铜苹果3650 3锌铜柑橘3850 4锌铜西红柿3750 5锌铝菠萝3650 6锌铝苹果3450甲同学提出的问题,乙同学解释不正确的是甲同学乙同学A实验6中的负极电极反应如何写?铝为负极:B实验1,5电流方向为什么相反?1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝C水果电池的电压与哪些因素有关?只跟水果的类型有关D实验中发光二极管不太亮,如何使它更明亮起来?可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来A. AB. BC. CD. D7.我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流。
高一化学下原电池电解池难点练习题(附答案)

2020年06月01日xx学校高中化学试卷学校: ___________姓名: ___________班级: ___________考号: ___________一、单选题1.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-Li2S+Fe,有关该电池的下列说法中正确的是( )A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价B.该电池的总反应式为2Li+FeS Li2S+FeC.负极的电极反应式为Al-3e-Al3+D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-2Li++FeS2.近年来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O2→2CO 2+ 3H2O.下列说法不正确的是( )A.1mol乙醇被氧化转移6mol电子B.C2H5OH在电池的负极上参加反应C.在外电路中电子由负极沿导线流向正极D.电池正极的电极反应式为4H++O2+4e-=2H2O3.有A.B.C.D四种金属。
将A与B用导线连接起来,浸入电解质溶液中,B为正极。
将A.D分别投入等浓度盐酸中,D比A反应剧烈。
将铜浸入B的盐溶液里,无明显变化。
如果把铜浸入C的盐溶液里,有金属C析出。
据此判断它们的活动性由强到弱的顺序是( )A.DCABB.DABCC.DBACD.BADC4.锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为:2Zn+O2+4OH-+2H2O=2()2-4Zn OH。
下列说法正确的是( )A.充电时,电解质溶液中K+向阳极移动.B.充电时,电解质溶液中c(OH-)逐渐减小C.放电时,负极反应为:Zn+4OH--2e-=()2-4Zn OHD.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)5.某模拟"人工树叶”电化学实验装置如右图所示, 该装置能将H2O和CO2转化为O2和燃料(C3H8O)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
关于化学电池的练习
唐荣德
(一)选择题
1.干电池使用时,其中发生的是( B )
A. 中和反应
B. 氧化还原反应
C. 分解反应
D. 电解反应
2.蓄电池在放电时起原电池作用,在充电时起电解池作用,下面是爱迪生蓄电池分别在充电和放电时发生的反应:
Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2
下面有关对爱迪生蓄电池的推断错误的是( D )
A. 放电时,Fe是负极,NiO2是正极
B. 充电时,阴极上的电极反应为:Fe(OH)2 + 2e =Fe2+ + 2OH-
C. 放电时,正极电极反应为:NiO2 + 2e + 2H2O =Ni(OH)2 + 2OH-
D. 蓄电池的电极可以浸入某种酸性电解质溶液中
3.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是( D )
A. Ag
B. Zn(OH)2
C. Ag2O
D. Zn
4.氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。
氢
镍电池的总反应式是。
根据此反应式判断,下列叙述中正确的是(MCE99.14)( CD )
A. 电池放电时,电池负极周围溶液的pH不断增大
B. 电池放电时,镍元素被氧化
C. 电池充电时,氢元素被还原
D. 电池放电时,H2是负极
5.电子表和电子计算器的电源常用微型银─锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应分别为:
Zn+2OH--2e =ZnO+H2O
Ag2O+H2O+2e =2Ag+2OH-
总反应式:Ag2O+Zn =2Ag+ZnO
根据上述变化,下列判断正确的是( BD )
A. Zn为正极,Ag2O为负极
B. 工作时电池负极区溶液的pH值减少
C. 工作时电子由Ag 2O 极经外电路流向Zn 极
D. Zn 为负极,Ag 2O 为正极
6.国外新近研制的溴—锌蓄电池的基本构造是用碳棒作两极,溴化锌溶液作电解液,现有四个电极反应:
① Zn -2e =Zn 2+ ② Zn 2++2e =Zn
③ Br 2+2e =2Br - ④ 2Br --2e =Br 2
那么充电时的阳极和放电时的负极的反应分别是 ( A )
A . ④①
B . ②③
C . ③①
D . ②④
解析:电解池的阳极和原电池的负极都是氧化极,即发生失电子的氧化反应,故应选A 。
7.扣式银—锌电池的电极反应如下:
锌极:Zn +2OH --2e - =Zn (OH )2 氧化银极:Ag 2O +HO 2+2e - =2Ag +2OH -
据此判断,锌极是 ( B )
A . 正极并被氧化
B . 负极并被氧化
C . 正极并被还原
D . 负极并被还原
9.镍镉(Ni —Cd )可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
由此可知,该电池放电时的负极材料是(广东河南20012) ( C )
A .Cd(OH)2
B .Ni(OH)2
C .Cd
D .NiO(OH)
10.日常所用的干电池的电极分别为碳棒的锌皮。
以糊状NH 4Cl 、ZnCl 2作电解液(其中加入MnO 2氧化吸收H 2),电极反应可简化为:
Zn —2e -=Zn 2+ 2NH 4++2e - →2NH 3+H 2(NH 3可用于结合Zn 2+
),根据上述判断下列说法正确的是( C ) A. 干电池中锌为正极,碳为负极
B. 干电池工作时,电子由碳极经外电路流向锌极
C. 干电池长时间连续工作时,内装糊状物可能外流出腐蚀电池
D. 该干电池可以实现化学能向电能的转化和电能向化学能的转化
(二)填空题
1.铅蓄电池放电时发生下列反应:
负极:Pb +SO 42-=PbSO 4↓+2e -
正极:PbO 2+4H ++SO 42-+2e -
=PbSO 4↓+2H 2O 现使用此蓄电池来电解硫酸铜溶液(两个电池都为惰性电极)。
(1) 电解时的电极反应为
阳极:________________________________________;
阴极:________________________________________。
(2) 电解一段时间后溶液的pH 值变________。
(3) 若要得到1.6 g铜,这时蓄电池内消耗硫酸_________ mol。
1. (1) 4OH -4e-=2H2O+O2↑;2Cu2++4e-=2Cu (2) 小(3) 0.05。
