第二十章蛋白质和核酸
生物化学 第20章转录与加工

(三)链的延长
链的延长反应是RNA聚合酶核心酶催化下进行的。 链的延伸方向是5'-3',而核心酶沿模板链3'-5'方 向移动,这与RNA是在DNA指导下合成的结论是一致的。 同位素标记实验或用3‘-脱氧腺苷(冬虫夏草菌素) 作实验可以证实链的延伸方向是5'-3'。 当由起始向延伸阶段转变时,由于σ亚基的离去, 核心酶的构象发生变化,同DNA的结合力减弱,便于核 心酶沿模板运动,使模板链上的每个核苷酸具有同等 被转录的机会。 一条模板链上可以同时有多个RNA聚合酶结合,形 成羽毛状。
真核生物与5S rRNA的基因成串排列,中间被不 转录区分开。转录后的5S rRNA经过适当加工便参 与核糖体的装配。 某些真核生物的rRNA 具有自我加工的能力。 只有少数真核生物的rRNA基因含有内含子。 1982年,T.cech从四膜虫中分离到一种RNA具有酶 的作用。当这个pre—rRNA与鸟嘌呤核苷或鸟苷酸 (GMP、GDP、GTP)一起保温时(在蛋白质缺乏 下),它的一个413nt的内含子自我切除,并把它 的两侧的外显子连接起来,即这种pre-rRNA能自我 剪接。
启动子的核苷酸顺序很特别,富含A .T碱基对。靠近每 个转录的前导顺序。在转录起始位点的上游存在两段一致 顺序(consensus sequence)。
3’端
模板链
原核生物中转录起始区的共同序列
三
原核生物基因转录-RNA合成的过程
(一) 模版的识别与转录泡的形成 RNA聚合酶与DNA模板的结合RNA聚合酶先 同DNA非专一性结合。在σ因子的帮助下,聚合酶 很快地滑向转录的起始部位,找到启动子-35和 -10序列结合在启动子上。 该过程是不可逆的。DNA的两条链(模版链和编码 链)局部解开,同时形成一个解链区称为转录泡。
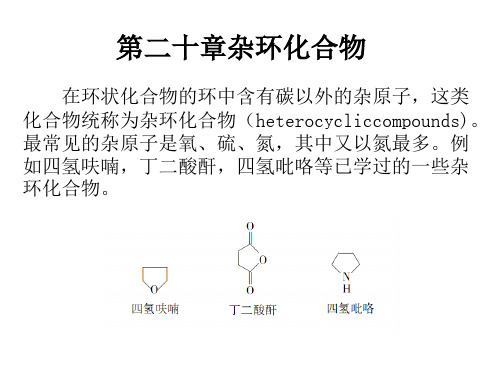
有机化学 第二十章杂环化合物
2.加成反应 呋喃、吡咯催化氢化,失去芳香性,得到饱和 的杂环化合物:
四氢吡咯为有机碱,广泛存在于自然界中的某 些生物碱中。
四氢呋喃是重要的有机溶剂。
噻吩中含硫,会使一般的催化剂中毒,氢化时必 须采用特殊催化剂。
工业上通常用开链化合物合成四氢噻吩。四氢噻 吩氧化成四亚甲基砜(或环丁砜),它是一个重要的 溶剂。
(6 )取代呋喃、噻吩、吡咯的定位效应
一取代呋喃、噻吩及吡咯进一步取代,定位效 应应由环上杂原子的α定位效应及取代基共同决定。 例如,3位上有取代基,第二个基团进入环的1位或5 位(即α位),是1位还是5位又由环上原有取代基 的性质决定◦例如,噻吩-3-甲酸溴代,生成5-溴噻 吩-3-甲酸。羧基是间位定位基,因此第二个基团进 入5位即羧基的间位。
一、五元杂环
五元环中含两个或两个(至少有一个氮原子) 以上的杂原子的体系称唑(azole)。如果杂原子不 同,则按氧、硫、氮的顺序编号。
二、六元杂环 三、稠杂环
20.2 五元单杂环化合物
一、呋喃、噻吩、吡咯的物理性质和结构
呋喃、噻吩、吡咯是最重要的含一个杂原子的 五元杂环化合物。它们的重要性不在于它们的单体, 而是它们的衍生物。它们的衍生物不但种类繁多, 而且有些是重要的工业原料,有些具有重要的生理 作用。
叶绿素与蛋白质结合,存在于植物的叶和绿色 的茎中,叶绿素利用卟啉环的多共辗体系易吸收紫 外光,成为激发态,促进光合作用,使光能转变为 化学能。
血红素存在于哺乳动物的红血球中,它与蛋白 质结合成血红蛋白,血红素中的Fe2+具有空的d轨道, 可以可逆地络合氧,在动物体内起到输送氧气的作 用。一氧化碳会使人中毒,其原因之一是因为它与 血红蛋白结合的能力强于氧,从而阻止了血红蛋白 与氧的结合。
二十二章节氨基酸多肽蛋白质和核酸

4〕与甲醛的反响:
〔2〕羧基的反响 1〕酸性
2〕酯化反响
3〕脱羧反响
〔3〕氨基、羧基共同参与的反响
1〕与水合茚三酮反响〔可用来鉴别α– 氨基酸〕: α-氨基酸可以和水合茚三酮发生呈紫色的反响:
O
OH O
+RCH O C H
OH
O
N2H
水合茚三酮
OO N
O OH
兰紫色
2) 成肽反响
第二十二章 氨基酸、多肽、蛋白质和核酸
(Amino acids、proteins and nucleic acids)
第二十二章
氨基酸、多肽、蛋白质和核酸 (Amino acids、proteins and nucleic acids)
一. 氨基酸的构造和命名 二. 氨基酸的性质 三. α – 氨基酸的合成 四. 多 肽 五. 核 酸
2.α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性碳,因此都具有
旋光性,且以L-型为主。
α-C为决定构型的碳原子:
3. 命名:由来源、性质命名。
氨基酸构型习惯用D、L标记,主要看α– 位手性碳, NH2 在右为D – 型, NH2在左为L – 型。
COOH
H 2N
H
CH3
L – 丙氨酸
自然界存在的氨基酸一般都是α– 氨基酸,而且是L–型。
O
O
RCH O C+ HCl RCH O CH Cl
N3H
N3H
O
O
RCH O C+NaOHRCH O C N+a
N3H
N2H
O R CHC O
NH2
OH H+
O R CHC O
生化习题集-修改版

⽣化习题集-修改版⽬录第⼀章蛋⽩质的结构与功能 (2)第⼆章核酸的结构与功能 (16)第三章酶 (25)第四章糖代谢 (35)第五章脂类代谢 (48)第六章⽣物氧化 (61)第七章氨基酸代谢 (70)第⼋章核苷酸代谢 (79)第九章物质代谢的联系与调节 (85)第⼗章 DNA⽣物合成 ---- 复制 (92)第⼗⼀章 RNA的⽣物合成----转录 (102)第⼗⼆章蛋⽩质的⽣物合成---- 翻译 (109)第⼗三章基因表达调控 (118)第⼗四章基因重组与基因⼯程 (127)第⼗五章细胞信息转导 (135)第⼗六章肝的⽣物化学 (150)第⼗七章维⽣素与微量元素 (161)第⼗⼋章常⽤分⼦⽣物学技术的原理及其应⽤ (165)第⼗九章⽔和电解质代谢 (170)第⼆⼗章酸碱平衡 (174)第⼀章蛋⽩质的结构与功能⼀. 单项选择题1. 下列不含有⼿性碳原⼦的氨基酸是A. GlyB. ArgC. MetD. PheE. Val2. 那⼀类氨基酸在脱去氨基后与三羧酸循环关系最密切A. 碱性氨基酸B. 含硫氨基酸C. 分⽀氨基酸D. 酸性氨基酸E. 芳⾹族氨基酸3. ⼀个酸性氨基酸,其pHa1=2.19,pHR=4.25,pHa2=9.67,请问其等电点是A. 7.2B. 5.37C. 3.22D. 6.5E. 4.254. 下列蛋⽩质组分中,那⼀种在280nm具有最⼤的光吸收A. 酪氨酸的酚环B. 苯丙氨酸的苯环C. 半胱氨酸的巯基D. ⼆硫键E. ⾊氨酸的吲哚环5. 测定⼩肽氨基酸序列的最好办法是A. 2,4-⼆硝基氟苯法B. ⼆甲氨基萘磺酰氯法C. 氨肽酶法D. 苯异硫氰酸酯法E. 羧肽酶法6. 典型的α-螺旋含有⼏个氨基酸残基A. 3B. 2.6C. 3.6D. 4.0E. 4.47. 每分⼦⾎红蛋⽩所含铁离⼦数为A. 5B. 4C. 3D. 2E. 18. ⾎红蛋⽩的氧合曲线呈A. U形线B. 双曲线C. S形曲线D. 直线E. Z形线9. 蛋⽩质⼀级结构与功能关系的特点是A. 氨基酸组成不同的蛋⽩质,功能⼀定不同B. ⼀级结构相近的蛋⽩质,其功能类似可能性越⼤C. ⼀级结构中任何氨基酸的改变,其⽣物活性即消失D. 不同⽣物来源的同种蛋⽩质,其⼀级结构相同E. 以上都不对10. 在中性条件下,HbS与HbA相⽐,HbS的静电荷是A. 减少+2B. 增加+2C. 增加+1D. 减少+1E. 不变11. ⼀个蛋⽩质的相对分⼦量为11000,完全是α-螺旋构成的,其分⼦的长度是多少nmA. 11B. 110C. 30D. 15E. 110012. 下⾯不是空间构象病的是A. ⼈⽂状体脊髓变性病B. ⽼年痴呆症C. 亨丁顿舞蹈病D. 疯⽜病E. 禽流感13. ⾕胱⽢肽发挥功能时,是在什么样的结构层次上进⾏的A. ⼀级结构B. ⼆级结构E. 以上都不对14. 测得某⼀蛋⽩质样品的含氮量为0.40g,此样品约含蛋⽩质多少克A. 2.00gB. 2.50gC. 6.40gD. 3.00gE. 6.25g15. 在pH6.0的缓冲液中电泳,哪种氨基酸基本不动A. 精氨酸B. 丙氨酸C. ⾕氨酸D. 天冬氨酸E. 赖氨酸16. 天然蛋⽩质不存在的氨基酸是A. 半胱氨酸B. 脯氨酸C. 丝氨酸D. 蛋氨酸E. ⽠氨酸17. 多肽链中主链⾻架的组成是A. -NCCNNCCNNCCN-B. ―CHNOCHNOCHNO―C. ―CONHCONHCONH―D. ―CNOHCNOHCNOH―E. ―CNHOCCCNHOCC―18. 在20种基本氨基酸中,哪种氨基酸没有⼿性碳原⼦A. ⾕氨酸B. 半胱氨酸C. 赖氨酸D. 组氨酸E.⽢氨酸19. 下列哪种物质从组织提取液中沉淀蛋⽩质⽽不变性A. 硫酸D. 丙酮E. 1N盐酸20. 蛋⽩质变性后表现为A. 粘度下降B. 溶解度增加C. 不易被蛋⽩酶⽔解D. ⽣物学活性丧失E. 易被盐析出现沉淀21. 对蛋⽩质沉淀、变性和凝固的关系的叙述,哪项是正确的A. 变性的蛋⽩质⼀定要凝固B. 变性的蛋⽩质⼀定要沉淀C. 沉淀的蛋⽩质必然变性D. 凝固的蛋⽩质⼀定变性E. 沉淀的蛋⽩质⼀定凝固22. 蛋⽩质溶液的稳定因素是A. 蛋⽩质溶液有分⼦扩散现象B. 蛋⽩质溶液有“布朗运动”C. 蛋⽩质分⼦表⾯带有⽔化膜和同种电荷D. 蛋⽩质的粘度⼤E. 蛋⽩质分⼦带有电荷23. 镰⼑型贫⾎症患者,Hb中氨基酸的替换及位置是A. α-链第六位Val换成GluB. β-链第六位Val换成GluC.α-链第六位Glu换成ValD. β-链第六位Glu换成ValE. 以上都不对24. 下列蛋⽩质通过凝胶过滤层析柱时,最先被洗脱的是A.⽜β乳球蛋⽩(分⼦量35000)B. 肌红蛋⽩(分⼦量16900)C. ⽜胰岛素(分⼦量5700)D. ⾎清清蛋⽩(分⼦量68500)E. 超氧化物歧化酶(分⼦量32000)25.下列哪⼀种物质不属于⽣物活性肽C. 促肾上腺⽪质激素D. ⾎红素E. 胰岛素26.下列不属于结合蛋⽩质的是A.核蛋⽩B. 糖蛋⽩C. 脂蛋⽩D. 清蛋⽩E.⾊蛋⽩27. 可⽤于裂解多肽链中蛋氨酸羧基侧形成的肽键的试剂是A. 甲酸B. 羟胺C. 溴化氰D.β-巯基⼄醇E. 丹磺酰氯⼆. 多项选择题1. 下列氨基酸那些是蛋⽩质的组分A. HisB. TrpC. ⽠氨酸D. 胱氨酸2. 下列氨基酸中那些具有分⽀的碳氢侧链A. MetB. CysC. ValD. Leu3. 在⽣理pH值情况下,下列氨基酸中的那些氨基酸侧链带正电荷A. ArgB. GluC. LysD. Asp4.下列对于肽键的叙述正确的是A. 具有部分双键性质B. 具有部分单键性质C. ⽐双键键长长,⽐单键键长短D.⽐双键键长短,⽐单键键长长5. 对⾕胱⽢肽叙述正确的是A. 有⼀个γ-肽键B. 有⼀个功能性的基团-巯基C. 分别由⾕氨酸胱氨酸和⽢氨酸组成D. 对⽣物膜具有保护作⽤6. 下⾯那些是结合蛋⽩质A. ⾎红蛋⽩B. ⽜胰核糖核酸酶C. 肌红蛋⽩D. 胰岛素7. 下列那些蛋⽩质具有四级结构A. ⾎红蛋⽩B. ⽜胰核糖核酸酶C. 肌红蛋⽩D. 蛋⽩激酶A8. 含有卟啉环的蛋⽩质是A. ⾎红蛋⽩B. 过氧化氢酶C. 肌红蛋⽩D. 细胞⾊素9. 下列那些蛋⽩质含有铁离⼦A. ⾎红蛋⽩B. ⽜胰核糖核酸酶C. 肌红蛋⽩D. 胰岛素10. 蛋⽩质变性是由于A. 氢键断裂B. 肽键破坏C. 破坏⽔化层和中和电荷D. 亚基解聚11. 镰⼑型红细胞贫⾎症患者⾎红蛋⽩β-链上第六位的⾕氨酸被缬氨酸所取代后,将产⽣那些变化A.在pH7.0电泳时增加了异常⾎红蛋⽩向阳极移动的速度B.导致异常脱氧⾎红蛋⽩的聚合作⽤C.增加了异常⾎红蛋⽩的溶解度D.⼀级结构发⽣改变12. 下⾯有哪些蛋⽩质或酶能协助蛋⽩质正确折叠A. 分⼦伴侣B. ⽜胰核糖核酸酶C. 胰岛素D. 伴侣素13. 下列哪些肽分⼦⼀级组成极相近,⽽且属于寡肽A. 脑啡肽B.催产素C. 加压素D. 促肾上腺⽪质激素14. 下⾯对氨基酸与蛋⽩质之间的关系叙述正确的是A. 氨基酸具有的性质蛋⽩质也⼀定具有B. 有些氨基酸的性质蛋⽩质也具有C.有些蛋⽩质的性质氨基酸不具有D.两者之间的性质关系并不紧密15. 肽键平⾯中能够旋转的键有A. C=OB. C-NC. Cα-N D. Cα-C16. 对⾎红蛋⽩的结构特点叙述正确的是A. 具有4个亚基B. 是⼀种结合蛋⽩质C. 每个亚基都具有三级结构D. 亚基键主要靠次级键连接三. 填空题1. 组成蛋⽩质的碱性氨基酸有、和。
《基础应用化学》课件 第二十章-生物高分子

C6 Hα-2DOH-(-O)-吡喃果C1 H糖2OH
5H
OH 2
H4
3 OH
OH
H
α-D-(-)-呋喃果糖
HH
H
6
H
6
1
COHO2O
H1
OCHH2OH
5 5 OHHOHH2 CHHO 22
OHOHHH4OH4
3CO3OHHH3
COHH2O H 1
C6Hβ2-OαDHC-6D-H(--2HO(O-H)-)4吡-吡CO喃喃果OO果H糖H糖C1 H2OH
第二十章 生物高分子
目录
CONTENTS
1 糖类
2
氨基酸和蛋白质
PART 1
糖类
糖类
一、单糖
1、单糖的结构
(1)单糖的开链式结构
单糖分子中都含有手性碳原子,所以 都有立体异构体。例如五羟基己醛分 子中有四个手性碳原子,其立体异构 体总数应为 24 个,天然葡萄糖是其中 的一个,其构型如右图:
CHO H C OH HO C H H C OH H C OH
CH2OH
CO
HO
H
H
OH
H
OH
CH2OH
+ 托伦试剂(斐林试剂)COOHH NhomakorabeaOH
OH H
H OH
+ Ag↓(Cu2O↓)
H
OH
CH2OH
糖类
一、单糖
(2)氧化反应
2、单糖的性质
在不同条件下,醛糖可被氧化成不同产物,比如用硝酸氧化葡萄糖时,得到葡萄糖 二酸,而用溴水氧化葡萄糖则得到葡萄糖酸。反应式如下:
抗生素中的链霉素含有氨基糖的 组分。
糖类
二、二糖
中药药理学-第二十章-补虚药

22
增强下丘脑-垂体-肾上腺皮质轴功能
• 补气药人参、刺五加、黄芪、白术、甘草 ,补血药熟地黄、当归、何首乌,补阴药 玄参、生地黄、知母,补阳药巴戟天、仙 茅、淫羊藿、鹿茸、杜仲,以及生脉注射 液等均有增强肾上腺皮质功能的作用。
ANHUI AGRICULTURAL UNIVERSITY
23
增强下丘脑-垂体-性腺轴功能
ANHUI AGRICULTURAL UNIVERSITY
30
• 人参、党参、刺五加、当归、淫羊藿、 补骨脂。麦冬、女贞子、黄精、墨旱莲 等能扩张冠脉、增加冠脉血流量、改善 心肌血氧供应,提高心肌抗缺氧能力, 具有抗心肌缺血作用。
• 甘草、刺五加、淫羊藿、冬虫夏草、当 归、麦冬、生脉散、参附汤、炙甘草汤 具有抗心律失常作用。
ANHUI AGRICULTURAL UNIVERSITY
24
Байду номын сангаас
调节下丘脑-垂体-甲状腺轴功能
• 甲状腺激素具有调节物质代谢增加产热的作用。 阴虚证和阳虚证病人的血清T3和T4含量均显著低 于正常人,而阴虚证病人又明显低于阳虚证病人 。
• 紫河车、人参具有增强甲状腺轴功能的作用。 • 人参及补阳药附子肉桂合剂具调节甲状腺轴功能
• Cu、Zn、Fe、Li为人体必需微量元素, 非必需或有害微量元素是Ni、Pb,黄芪 、枸杞、人参、灵芝等Zn含量均较高;
ANHUI AGRICULTURAL UNIVERSITY
20
④调节环核苷酸水平
补虚药可通过影响cAM P和cGMP的含量 而对细胞的代谢和功能起着重要的作用, 提高组织中的cAMP浓度而增强细胞活力 ,如黄芪、党参、甘草灌胃给药可显著升 高小鼠血浆和牌组织中cAMP的含量。
生物化学重点名词英文缩写

生物化学英文缩写第一章蛋白质氨基酸分类1、非极性脂肪族氨基酸Gly 甘氨酸Ala 丙氨酸Val 缬氨酸Leu 亮氨酸Ile 异亮氨酸Pro 脯氨酸2、极性中性氨基酸Ser 丝氨酸Cys 半胱氨酸Met 蛋氨酸Asn 天冬酰胺Gln 谷氨酰胺Thr 苏氨酸3、芳香族氨基酸Phe 苯丙氨酸Trp 色氨酸Tyr 酪氨酸4、酸性氨基酸Asp 天冬氨酸Glu 谷氨酸5、碱性氨基酸Lys 赖氨酸Arg 精氨酸His 组氨酸Hb 血红蛋白Mb 肌红蛋白PrP 阮病毒蛋白PI 等电点CD 圆二色光谱NMR 核磁共振技术第二章核酸cAMP 环腺苷酸HGP 人类基因组计划hnRNA 不均一核RNAm7GpppN 7-甲基鸟嘌呤-三磷酸核苷CBP 帽结合蛋白PABP poly(A)结合蛋白ORF 开放阅读框DHU 双氢尿嘧啶ψ假尿嘧啶核苷m G,m A 甲基化嘌呤snmRNA 非mRNA小RNAsnRNA 核内小RNAsnoRNA 核仁小RNAscRNA 胞质小RNAsiRNA 小片段干扰RNA第三章酶NAD+尼克酰胺腺嘌呤二核苷酸,辅酶I NADP+尼克酰胺腺嘌呤二核苷酸磷酸,辅酶IIFMN 黄素单核苷酸FAD 黄素腺嘌呤核苷酸LDH 乳酸脱氢酶CK 肌酸激酶PCR 聚合酶链反应BAL 二巯基丙醇PAM 解磷定第四章糖代谢SGLT Na 依赖型葡萄糖转运体GLUT 依赖一类葡萄糖转运体G-6-P 6-磷酸葡萄糖PEK-1 6-磷酸果糖激酶-1PEP 磷酸烯醇式丙酮酸FBP-2 果糖二磷酸酶-2TAC 三羧酸循环(TCA循环) GSH 谷胱甘肽UDPG 尿苷二磷酸葡萄糖UDPGA尿苷二磷酸葡萄糖醛酸PKA 蛋白激酶A第五章脂类代谢FA 脂肪酸PG 前列腺素TX 血栓烷LTs 白三烯CM 乳糜微粒FFA 游离脂肪酸HSL 激素敏感性甘油三酯脂酶ACP 酰基载体蛋白VLDL 极低密度脂蛋白LDL 低密度脂蛋白IDL 中密度脂蛋白HDL 高密度脂蛋白SRS-A 过敏反应的慢反应物质5-HPETE 氢过氧化廿碳四烯酸PA 磷脂酸PIP2磷脂酰肌醇-4,5-二磷酸IP3三磷酸肌醇RCDP 康-亨综合症MV A 甲羟戊酸SCP 固醇载体蛋白CE 胆固醇酯LRP LDL受体相关蛋白HL 肝脂酶FC 游离胆固醇CERP 胆固醇流出调节蛋白LCAT 卵磷脂胆固醇脂肪酰转移酶第六章生物氧化Fe-S 铁硫中心CoQ 辅酶Q(泛醌)F P2黄素蛋白-2(人复合体2)Cyt 细胞色素OSCP 寡霉素敏感蛋白DNP 二硝基苯酚mtDNA 线粒体DNACP 磷酸肌酸ROS 反应活性氧类(自由基)SOD 超氧物歧化酶第七章氨基酸代谢GPT 谷丙转氨酶ALT 丙氨酸转氨酶GOT 谷草转氨酶AST 天冬氨酸转氨酶IMP 次黄嘌呤核苷酸CPS-I 氨基甲酰磷酸合成酶IAGA N-乙酰谷氨酸OCT 鸟氨酸氨基甲酰转移酶5-HT 5-羟色胺FH4四氢叶酸SAM S-腺苷甲硫氨酸NOS 一氧化氮合酶第八章核苷酸代谢HGPRT 次黄嘌呤-鸟嘌呤磷酸核糖转移酶PRPP 磷酸核糖焦磷酸6MP 6-巯基嘌呤MTX 甲氨蝶呤5-FU 5-氟尿嘧啶FUTP 三磷酸氟尿嘧啶核苷第九章物质代谢的联系与调节MS 中心性肥胖CCK 胆囊收缩素第十章DNA的生物合成E、coli 大肠杆菌dNTP 脱氢三磷酸核苷(N代表任一碱基) DNA-pol DNA聚合酶SSB 单链DNA结合蛋白HDP 螺旋反稳定蛋白RF 复制因子/释放因子PCNA 增殖细胞核抗原CDK 细胞周期蛋白依赖激酶hTR 人类端粒RNAhTP1人类端粒协同蛋白1hTRT 端粒酶逆转录酶TT 胸苷酸二聚体第十一章RNA的生物合成CTP 羧基末端结合域Inr 转录起始子TF 转录因子PIC 转录起始前复合物TPB TATA-结合蛋白CDK-9 周期蛋白依赖性激酶9CPSF 断裂与聚腺苷酸化特异性因子CStF 断裂激动因子PAP 多聚腺苷酸聚合酶PAB II 腺苷酸结合蛋白II 第十二章蛋白质的生物合成rp 多种核糖体蛋白质EF 延长因子fMet N-甲酰甲硫氨酸THFA N10-甲酰四氢叶酸RBS 核糖体结合位点PAB/PABP poly A结合蛋白TF 触发因子HSP 热休克蛋白PDI 蛋白质二硫键异构酶PPI 肽-脯氨酰顺反异构酶POMC 鸦片促黑皮质素原ACTH 促肾上腺皮质激素β-LT β酯酸释放激素α-MSH α-促黑激素CLIP 促肾上腺皮质激素样中叶肽SRP 信号肽识别颗粒IFN 干扰素第十三章基因表达调控AFP 编码甲胎蛋白CAP 分解物基因激活蛋白IPTG 异丙基硫代半乳糖苷TAF TA TA盒结合蛋白(TBP)相关因子UAS 上游激活序列EBP 增强子结合蛋白bZIP 碱性亮氨酸拉链bHLH 碱性螺旋-环-螺旋RNP 核糖体复合物TfR 运铁蛋白受体IRE 铁反应元件eIF 翻译起始因子RBP RNA结合蛋白RISC 沉默复合体dsRNA 双链RNA第十四章基因重组与基因工程IS 插入序列bp 碱基对YAC 人工染色体载体cDNA 逆转录DNA第十五章细胞信息传导PDE 磷酸二酯酶cGPK cGMP依赖性蛋白激酶(PKG)PLC 磷脂酰肌醇特异性磷脂酶CDAG 二酯酰甘油PIKs 磷脂酰肌醇激酶CaM 钙调蛋白PP 蛋白磷酸酶HRE 激素反应元件GPCR G蛋白偶联型受体PTK 酪氨酸激酶EGF 表皮生长因子IκB NF-κB抑制蛋白β-AR β-肾上腺素能受体XLA 人类X染色体连锁低γ丢蛋白血症第十六章血液的生物化学Gal 半乳糖APP 急性时相蛋白质GRP C-反应蛋白IL-1 白细胞介素-1APR 急性时相反应物MHb 高铁血红蛋白ALA δ-氨基-γ-酮戊酸UPG-I 尿卟啉原I同合酶CPG III 粪卟啉原IIIEPO 促红细胞生成素第十七章肝的生物化学GK 葡糖激酶MEOS 肝微粒体乙醇氧化系统UGT 葡糖醛酸基转移酶COMT 可溶性儿茶酚-O-甲基转移酶GST 谷胱甘肽-S-转移酶第二十章癌基因Rb基因视网膜母细胞瘤基因。
生化英文缩写

生化英文缩写生物化学英文缩写第一章蛋白质氨基酸分类1、非极性脂肪族氨基酸Gly 甘氨酸Ala 丙氨酸Val 缬氨酸Leu 亮氨酸Ile 异亮氨酸Pro 脯氨酸2、极性中性氨基酸Ser 丝氨酸Cys 半胱氨酸Met 蛋氨酸Asn 天冬酰胺Gln 谷氨酰胺Thr 苏氨酸3、芳香族氨基酸Phe 苯丙氨酸Trp 色氨酸Tyr 酪氨酸4、酸性氨基酸Asp 天冬氨酸Glu 谷氨酸5、碱性氨基酸Lys 赖氨酸Arg 精氨酸His 组氨酸Hb 血红蛋白Mb 肌红蛋白PrP 阮病毒蛋白PI 等电点CD 圆二色光谱NMR 核磁共振技术第二章核酸cAMP 环腺苷酸HGP 人类基因组计划hnRNA 不均一核RNAmGpppN 7-甲基鸟嘌呤-三磷酸核苷CBP 帽结合蛋白PABP poly(A)结合蛋白ORF 开放阅读框DHU 双氢尿嘧啶ψ假尿嘧啶核苷G,A 甲基化嘌呤snmRNA 非mRNA小RNA snRNA 核内小RNA snoRNA 核仁小RNAscRNA 胞质小RNAsiRNA 小片段干扰RNA第三章酶NAD 尼克酰胺腺嘌呤二核苷酸,辅酶I NADP 尼克酰胺腺嘌呤二核苷酸磷酸,辅酶II FMN 黄素单核苷酸FAD 黄素腺嘌呤核苷酸LDH 乳酸脱氢酶CK 肌酸激酶PCR 聚合酶链反应BAL 二巯基丙醇PAM 解磷定第四章糖代谢SGLT Na依赖型葡萄糖转运体GLUT 依赖一类葡萄糖转运体G-6-P 6-磷酸葡萄糖PEK-1 6-磷酸果糖激酶-1PEP 磷酸烯醇式丙酮酸FBP-2 果糖二磷酸酶-2TAC 三羧酸循环(TCA循环)GSH 谷胱甘肽UDPG 尿苷二磷酸葡萄糖UDPGA尿苷二磷酸葡萄糖醛酸PKA 蛋白激酶A第五章脂类代谢FA 脂肪酸PG 前列腺素TX 血栓烷LTs 白三烯CM 乳糜微粒FFA 游离脂肪酸HSL 激素敏感性甘油三酯脂酶ACP 酰基载体蛋白VLDL 极低密度脂蛋白LDL 低密度脂蛋白IDL 中密度脂蛋白HDL 高密度脂蛋白SRS-A 过敏反应的慢反应物质5-HPETE 氢过氧化廿碳四烯酸PA 磷脂酸PIP 磷脂酰肌醇-4,5-二磷酸IP 三磷酸肌醇RCDP 康-亨综合症MVA 甲羟戊酸SCP 固醇载体蛋白CE 胆固醇酯LRP LDL受体相关蛋白HL 肝脂酶FC 游离胆固醇CERP 胆固醇流出调节蛋白LCAT 卵磷脂胆固醇脂肪酰转移酶第六章生物氧化Fe-S 铁硫中心CoQ 辅酶Q(泛醌)F P 黄素蛋白-2(人复合体2)Cyt 细胞色素OSCP 寡霉素敏感蛋白DNP 二硝基苯酚mtDNA 线粒体DNACP 磷酸肌酸ROS 反应活性氧类(自由基)SOD 超氧物歧化酶第七章氨基酸代谢GPT 谷丙转氨酶ALT 丙氨酸转氨酶GOT 谷草转氨酶AST 天冬氨酸转氨酶IMP 次黄嘌呤核苷酸CPS-I 氨基甲酰磷酸合成酶IAGA N-乙酰谷氨酸OCT 鸟氨酸氨基甲酰转移酶5-HT 5-羟色胺FH 四氢叶酸SAM S-腺苷甲硫氨酸NOS 一氧化氮合酶第八章核苷酸代谢HGPRT 次黄嘌呤-鸟嘌呤磷酸核糖转移酶PRPP 磷酸核糖焦磷酸6MP 6-巯基嘌呤MTX 甲氨蝶呤5-FU 5-氟尿嘧啶FUTP 三磷酸氟尿嘧啶核苷第九章物质代谢的联系与调节MS 中心性肥胖CCK 胆囊收缩素第十章DNA的生物合成E.coli 大肠杆菌dNTP 脱氢三磷酸核苷(N代表任一碱基)DNA-pol DNA聚合酶SSB 单链DNA结合蛋白HDP 螺旋反稳定蛋白RF 复制因子/释放因子PCNA 增殖细胞核抗原CDK 细胞周期蛋白依赖激酶hTR 人类端粒RNAhTP 人类端粒协同蛋白1hTRT 端粒酶逆转录酶TT 胸苷酸二聚体第十一章RNA的生物合成CTP 羧基末端结合域Inr 转录起始子TF 转录因子PIC 转录起始前复合物TPB TATA-结合蛋白CDK-9 周期蛋白依赖性激酶9 CPSF 断裂和聚腺苷酸化特异性因子CStF 断裂激动因子PAP 多聚腺苷酸聚合酶PAB II 腺苷酸结合蛋白II第十二章蛋白质的生物合成rp 多种核糖体蛋白质EF 延长因子fMet N-甲酰甲硫氨酸THFA N-甲酰四氢叶酸RBS 核糖体结合位点PAB/PABP poly A结合蛋白TF 触发因子HSP 热休克蛋白PDI 蛋白质二硫键异构酶PPI 肽-脯氨酰顺反异构酶POMC 鸦片促黑皮质素原ACTH 促肾上腺皮质激素β-LT β酯酸释放激素α-MSH α-促黑激素CLIP 促肾上腺皮质激素样中叶肽SRP 信号肽识别颗粒IFN 干扰素第十三章基因表达调控AFP 编码甲胎蛋白CAP 分解物基因激活蛋白IPTG 异丙基硫代半乳糖苷TAF TATA盒结合蛋白(TBP)相关因子UAS 上游激活序列EBP 增强子结合蛋白bZIP 碱性亮氨酸拉链bHLH 碱性螺旋-环-螺旋RNP 核糖体复合物TfR 运铁蛋白受体IRE 铁反应元件eIF 翻译起始因子RBP RNA结合蛋白RISC 沉默复合体dsRNA 双链RNA第十四章基因重组与基因工程IS 插入序列bp 碱基对YAC 人工染色体载体cDNA 逆转录DNA第十五章细胞信息传导PDE 磷酸二酯酶cGPK cGMP依赖性蛋白激酶(PKG)PLC 磷脂酰肌醇特异性磷脂酶C DAG 二酯酰甘油PIKs 磷脂酰肌醇激酶CaM 钙调蛋白PP 蛋白磷酸酶HRE 激素反应元件GPCR G蛋白偶联型受体PTK 酪氨酸激酶EGF 表皮生长因子IκB NF-κB抑制蛋白β-AR β-肾上腺素能受体XLA 人类X染色体连锁低γ丢蛋白血症第十六章血液的生物化学Gal 半乳糖APP 急性时相蛋白质GRP C-反应蛋白IL-1 白细胞介素-1APR 急性时相反应物MHb 高铁血红蛋白ALA δ-氨基-γ-酮戊酸UPG-I 尿卟啉原I同合酶CPG III 粪卟啉原IIIEPO 促红细胞生成素第十七章肝的生物化学GK 葡糖激酶MEOS 肝微粒体乙醇氧化系统UGT 葡糖醛酸基转移酶COMT 可溶性儿茶酚-O-甲基转移酶GST 谷胱甘肽-S-转移酶第二十章癌基因Rb基因视网膜母细胞瘤基因。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
赖氨酸(Lys)
返回
2 氨基酸的构型
组成蛋白质的氨基酸除甘氨酸外,α-碳原子都是手性的。 氨基酸的构型常用D/L法标记,但与糖D/L标记法不完全
一样。
CHO HO H CH2OH
L-甘油醛
COOH H2 N H CH3
L-丙氨酸
HN
COOH H
L-脯氨酸
在苏氨酸和异亮氨酸分子中还有第二个手性碳原子,它 们的构型分别为:
中性氨基酸
氨基羧基 数目相等 氨基数目 多于羧基
碱性氨基酸
酸性氨基酸
羧基数目 多于氨基
返回
H2NCCH2CHCOOH O NH2
门冬酰胺(Asn)
H2NCCH2CH2CHCOOH O NH2
谷氨酰胺(Gln)
按烃基的结构分为脂肪族氨基酸、芳香族氨基酸和杂环 氨基酸。 氨基酸的烃基不同和相互作用,在很大程度上影响 蛋白质的结构,特别是它的生理功能。
可以通过测定氨基酸的等电点来鉴别氨基酸。
课堂练习:
•下列氨基酸溶于水使之达到等电点应加酸还是加碱?
(1)赖氨酸
H2NCH2CH2CH2CH2CHCOOH NH2
等电点时pH>7,溶于水中使之达到等电点应当加碱 (2)甘氨酸 H2NCH2COOH 等电点时pH<7,溶于水中使之达到等电点应当加酸
(3)谷氨酸
α-氨基戊二酸 (谷氨酸)
NH2
β-氨基丙酸
返回
天然氨基酸常采用习惯名称,即按其来源或性质命名。
门冬氨酸最初是由天门冬的幼苗中发现的; 甘氨酸是因为具有甜味。
构成蛋白质的20种氨基酸,有一套通用的符号,这些 符号象元素符号一样,是国际通用的。
8种人体必需氨基酸:
CH3 (CH3)2CHCHCOOH NH2 (CH3)2CHCH2CHCOOH NH2 CH3CH2CHCHCOOH NH2
缬氨酸(Val)
OH CH3CHCHCOOH NH2
亮氨酸(Leu)
CH3SCH2CH2CHCOOH NH2
异亮氨酸(Ile)
C6H5CH2CHCOOH NH2
苏氨酸(Thr)
CH2CHCOOH
N
蛋氨酸(Met)
苯丙氨酸(Phe)
H2NCH2CH2CH2CH2CHCOOH NH2
NH2
色氨酸(Trp)
是通过相互作用,以内盐(偶极离子)形式存在的。 在溶液中存在下列平衡:
R
CH NH3+
COOH
OH - H+
R
CH NH3+
COO
-
OH - H+
R
CH NH2
COO
-
(3) 等电点 在不同pH值的溶液中,氨基酸能以正离子、负离子和两 性离子三种离子间形成动态平衡。 适当调节溶液的pH值,使得氨基酸的羧基与氨基的离子 化程度相等。 此时所带的正负电荷数相同,净电荷为零呈电中性。 这个等电状态的pH值,称为该氨基酸的等电点,用pI表示。 在等电点时,氨基酸几乎全部以两性离子形式存在,有 极少量的严格相等的正离子和负离子。
在自然界中存在的氨基酸目前知道的有400多种,但在 生物体内组成蛋白质的氨基酸只有20种。
组成蛋白质的氨基酸都是α-氨基酸,只是基团R不同。
R
CH NH2
COOH
这些氨基酸有的只有一个氨基和一个羧基,有的含有 第二个氨基(碱性基团)或第二个羧基(酸性基团) 。
根 据 氨 基 和 羧 基 的 相 对 数 目
在等电点时,氨基酸几乎全部以两性离子形式存在。 溶液的pH<pI时,氨基酸以正离子形式存在;
溶液的pH>pI时,氨基酸以负离子形式存在。
处于等电点的氨基酸溶解度最小。 分子结构不同的氨基酸,等电点各不相同。 中性氨基酸:pI=6.2~6.8; 酸性氨基酸:pI=2.8~3.2;
碱性氨基酸:pI=7.6~10.8。
(1) α-氨基酸的物理性质 熔点:α-氨基酸都是高熔点固体,多数在熔化时分解。 因此,α-氨基酸的熔点不能作为鉴定的可靠物理常数。 甘氨酸:262℃(分解);酪氨酸:310℃(分解) 。
(2) 酸碱性 氨基酸既能和酸反应生成铵盐,也能和碱反应生成羧酸 盐,是两性化合物。
氨基酸分子中的羧基和氨基不是以游离状态存在的,而
HOOCCH2CH2CHCOOH NH2
等电点时pH<7,溶于水中使之达到等电点应当加酸
返回
(4) 氨基的反应 蛋白质中的20种α-氨基酸除脯氨酸外,都能与亚硝酸反 应,放出氮气生成α-羟基酸。
氨基酸的命名
• 氨基酸的系统命名法是以羧酸为母体,氨基为取代基 来命名的。 但α -氨基酸通常按其来源或性质所得的 俗名来称呼。
H2NCH2COOH NH2CH2CH2CH2CH2CHCOOH NH2
α-氨基乙酸 (甘氨酸)
HOOCCH2CH2CHCOOH
α,ε-二氨基己酸 (赖氨酸)
NH2CH2CH2COOH
产品介绍:三聚氰胺是一种重要的有机 化工中间产品,主要用来制作三聚氰胺 树脂,具有优良的耐水性、耐热性、耐 电弧性、优良阻燃性。用途:可用于装 饰板的制作,用于氨基塑料、粘合剂、 涂料、币纸增强剂、纺织助剂等。 摄入人体后由于胃酸的作用三聚氰胺和三聚氰酸相互解离并被分别 通过小肠吸收进入血液循环并最终进入肾脏。在肾细胞中两者再次 结合沉积从而形成肾结石,堵塞肾小管,最终造成肾衰竭。由于三 聚氰胺结石微溶于水,对于成年人,由于经常喝水使得结石不容易 形成。但对于哺乳期的婴儿,由于喝水很少并且相比成年人肾脏狭 小,造成更容易形成结石。这也是2008年中国婴幼儿奶粉污染事件 中受害者基本为婴儿而很少见到其他年龄阶段的儿童或成人的原因 之一。中国卫生部对于该污染事件的指导治疗方案中,对于三聚氰 胺造成的轻度结石,推荐使用大量饮水的方法来消除,也是基于这 个原理。
COOH H2N H OH H CH3
L-苏氨酸 (2S,3R)
COOH H2N H H H3C CH2CH3
L-异亮氨酸 (2S,3R)
根据离羧基最近的手性碳原子的构型判定:氨基在左侧 的为L型,氨基在右侧的为D型。
由于组成蛋白质的氨基酸都是L型的,因此习惯上仍
使用D/L法。
3 氨基酸的性质
第十五章、氨基酸、多肽、蛋白质
蛋白质是重要的生物大分子,在生物体中含量较大,种类
繁多,生物体的各种生物功能就是依靠蛋白质来完成的。 蛋白质的基本结构单位是20种α-氨基酸。 多肽是多个α-氨基酸分子通过酰胺键(肽键)连接而生成的 化合物,蛋白质则是分子量很大的多肽。
1 氨基酸的结构、分类和命名
