玻尔的原子模型 (课堂PPT)
合集下载
玻尔的原子模型PPT精品课件

B、原子中,虽然核外电子不断做加速运动, 但只要能量状态不改变,就会向外辐射能量
C、原子从一种定态跃迁到另一种定态时,一 定要辐射一定频率的光子
D、原子的每一个能量状态都对应一个电子轨 道,并且这些轨道是不连续的
3、根据玻尔理论,氢原子中,量子数N越大,则下列 说法中正确的是( ACD ) A、电子轨道半径越大 B、核外电子的速率越大 C、氢原子能级的能量越大 D、核外电子的电势能越大
【答案】内容:漫画由奥运五环标志和萨马兰奇的 头像构成,五环成为萨马兰奇的眼镜。 寓意:萨马兰奇和现代奥运已经融为一体或萨马 兰奇透过奥运看世界。
5.中国传统年画,常常借助于喜庆明丽的色彩和象征吉祥 的事物来表现美好的愿望,如鱼象征着年年有余,凤凰象 征着富贵吉祥等。请用说明性的文字介绍下面这幅年画, 并从中任选一个象征事物,说出其中寄托的美好愿望。
(1)说明性的文字:___________________________ (2)_______________象征_____________________
答案 漫画揭示了普通家庭为子女教育不 堪经济重负的社会现实和高等教育存在的 制度缺陷。(关键词“普通家庭”“经济重 负”“制度缺陷”,意思对即可)
4.观察下面的漫画,完成下题。
(2)写出这幅漫画的寓意。 漫画讽刺了那些只听喜讯不听警告的自欺
欺人的人。
题型3、拟写标题
• 标题是漫画的眉目,它有揭示漫画寓 意或揭示讽刺对象的作用。
寓意参考:讽刺了现实中有些人打着集体利 益的旗号,却干着牟取私利的勾当的丑行。
标题示例:暗饱私囊 如此团结
假公济私 如此划船
题型4、编拟公益广告
例4、请根据 漫画内容设计一条 公益广告语。要求: 体现画意,通俗易 懂,有一定文采。 (不超过16个字)
C、原子从一种定态跃迁到另一种定态时,一 定要辐射一定频率的光子
D、原子的每一个能量状态都对应一个电子轨 道,并且这些轨道是不连续的
3、根据玻尔理论,氢原子中,量子数N越大,则下列 说法中正确的是( ACD ) A、电子轨道半径越大 B、核外电子的速率越大 C、氢原子能级的能量越大 D、核外电子的电势能越大
【答案】内容:漫画由奥运五环标志和萨马兰奇的 头像构成,五环成为萨马兰奇的眼镜。 寓意:萨马兰奇和现代奥运已经融为一体或萨马 兰奇透过奥运看世界。
5.中国传统年画,常常借助于喜庆明丽的色彩和象征吉祥 的事物来表现美好的愿望,如鱼象征着年年有余,凤凰象 征着富贵吉祥等。请用说明性的文字介绍下面这幅年画, 并从中任选一个象征事物,说出其中寄托的美好愿望。
(1)说明性的文字:___________________________ (2)_______________象征_____________________
答案 漫画揭示了普通家庭为子女教育不 堪经济重负的社会现实和高等教育存在的 制度缺陷。(关键词“普通家庭”“经济重 负”“制度缺陷”,意思对即可)
4.观察下面的漫画,完成下题。
(2)写出这幅漫画的寓意。 漫画讽刺了那些只听喜讯不听警告的自欺
欺人的人。
题型3、拟写标题
• 标题是漫画的眉目,它有揭示漫画寓 意或揭示讽刺对象的作用。
寓意参考:讽刺了现实中有些人打着集体利 益的旗号,却干着牟取私利的勾当的丑行。
标题示例:暗饱私囊 如此团结
假公济私 如此划船
题型4、编拟公益广告
例4、请根据 漫画内容设计一条 公益广告语。要求: 体现画意,通俗易 懂,有一定文采。 (不超过16个字)
chap3(II)-波尔原子模型.ppt
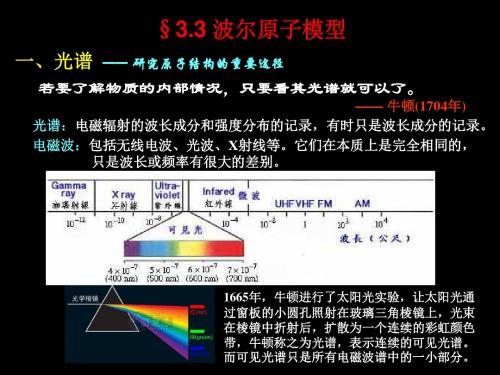
氢原子光谱的线系
~ 赖曼系(m = 1) :
1 ], n 2,3,4, RH [ 1 12 n 2 R H [ 12 12 ], n 3,4,5, 2 n
在紫外区,是1914年由赖曼发现的。
~ 巴耳末系(m = 2) : ~ 帕邢系(m = 3) :
体系的角动量是量子化的
2
2
2
r M 1 C
Ze
r2
v
m
V
Mm M m
消去,求得r
MVr1 m v r2 n
r n
2
2 2 4 π 4 π 2 0 0 rn n 2 r n n e 2 Z me 2 Z 2 2 2 Ze 1 1 原子体系的能量 E MV m v 2 2 4 π 0 r
434.010nm
486.074nm
• 波长遵守巴耳末公式的这一系列谱线称为巴耳末线系 • 波长间隔沿短波方向递减 • 谱线系的系限—谱线系中最短的波长
n
B 364.56 nm
2 ~ n 4 4 ( 1 1 ) 1 1 波数 B n2 B 22 n2
对氢原子,计算得 R H 理论 1 .097 373 1 10 7 m 1 玻尔理论的成功之四
当时实验测得
RH实验 1.096 775 8 10 7 m 1
问题:里德伯常数的理论计算结果与实验结果误差超过了万分之五,其原因何在?
۩ 考虑到核不会固定不动,上式中电子质量应理解为折合质量 mM mM 2 4
410.120nm
Ha : 红 Hb : 深绿 Hg : 青 Hd : 紫
656.210nm 486.074nm 434.010nm 410.120nm
(高中物理精品课件)玻尔的原子模型

轨能道半量径::Ernn==n1n22
r1 (n=1,2,3……) E1(n=1,2,3……)
式中r1 ( r1 =0.53×10-10m )、E1 ( E1=-13.6eV)、
分别代表第一条(即离核最近的)可能轨道的半
径和电子在这条轨道上运动时的能量,rn、En 分
别代表第n条可能轨道的半径和电子在第n条轨道 上运动时的能量,n是正整数,叫量子数。
18-4.波尔的原子模型
一、玻尔提出原子模型的背景:
卢瑟福的原子核式结构学说很好地 解释了a粒子的散射实验,初步建立了原 子结构的正确图景,但跟经典的电磁理 论发生了矛盾。
1、原来,电子没有被库仑力吸引到核 上,它一定是以很大的速度绕核运动,就 象行星绕着太阳运动那样。按照经典理论, 绕核运动的电子应该辐射出电磁波,因此 它的能量要逐渐减少。随着能量的减少, 电子绕核运行的轨道半径也要减小,于是电 子将沿着螺旋线的轨道落入原子核,就像 绕地球运动的人造卫星受到上层大气阻力 不断损失能量后要落到地面上一样。 这样 看来,原子应当是不稳定的,然而实际上 并不是这样。
叫做激发态。
4、原子发光现象:原子从较高的激发态向较低的激 发态或基态跃迁的过程,是辐射能量的过程,这个能 量以光子的形式辐射出去,这就是原子发光现象。
电子云
达标练习:
1、对玻尔理论的下列说法中,正确的是(ABCD)
A、继承了卢瑟福的原子模型,但对原子能量 和电子轨道引入了量子化假设
B、对经典电磁理论中关于“做加速运动的电 荷要辐射电磁波”的观点提出了异议
B、原子要吸收一系列频率的光子
C、原子要发出某一频率的光子
D、原子要吸收某一频率的光子
n 四、氢原子的能级图: E
人教版高中物理《玻尔的原子模型》PPT优秀课件

n=
n=5 n=4
n=3
巴
耳
n=2
末
系
0
-0.54 eV -0.85 eV -1.51 eV
-3.40 eV
n=1
-13.6 eV
1
巴尔末公式:
R(
1 22
1 n2
) n
3,4,
5,
第十三页,共24页。
R=1.10 107m1
Hα
Hβ
Hγ
Hδ
H
量子化条件的引进没有适当的理论解释
量子数越大,能量值越大,电子动能越小,电势能越大。
(2) 吸收实物粒子能量
只要实物粒子动能足以使氢原子向高能级跃迁,就能被氢 原子吸收全部或部分动能而使氢原子向高能级跃迁,多余
能量仍为实物粒子动能。
第十五页,共24页。
第十六页,共24页。
玻尔理论成功的解释并预言了氢原子辐射的电磁波的问题,
但是也有它的局限性 基态:能量最低的状态(离核最近)
用 14 eV 的光子照射
第一页,共24页。
经 典
电子绕核运动将不断向外辐 射电磁波,电子损失了能量,
e
理 论 认
其轨道半径不断缩小,最 终落在原子核上,而使原子变
e +
为
得不稳定
事
原子是稳定的
实
v
e
+F
r
e
第二页,共24页。
经
典
由于电子轨道的变化是连续的,辐射电磁波的频率等
理 于绕核运动的频率,连续变化,原子光谱应该是连续
论 光谱
认
为
事 原子光谱是不连续 实 的,是线状谱
第三页,共24页。
以上矛盾表明,从宏观现象总结出来的经典电磁理论不适用 于原子这样小的物体产生的微观现象。为了解决这个矛盾,1913
波尔的原子模型课件

2.能级跃迁:处于激发态的原子是不稳定的,它会自发地向较低 能级跃迁,经过一次或几次跃迁到达基态。所以一群氢原子处于量子 数为 n 的激发态时,可能辐射出的光谱线条数为:N=nn2-1=C2n.
3.光子的发射:原子由高能级向低能级跃迁时以光子的形式放出 能量,发射光子的频率由下式决定.
hν=Em-En(Em、En 是始末两个能级且 m>n) 能级差越大,放出光子的频率就越高.
A.氢原子从 n=2 跃迁到 n=1 的能级时, 辐射光的波长大于 656 nm B.用波长为 325 nm 的光照射,可使氢 原子从 n=1 跃迁到 n=2 的能级 C.一群处于 n=3 能级上的氢原子向低 能级跃迁时最多产生 3 种谱线 D.用波长为 633 nm 的光照射,不能 使氢原子从 n=2 跃迁到 n=3 的能级
特别提醒 (1)处于基态的原子是稳定的,而处于激发态的原子是不稳定的. (2)原子的能量与电子的轨道半径相对应,轨道半径大,原子的能 量大,轨道半径小,原子的能量小.
典例精析 (多选)玻尔在他提出的原子模型中所做的假设有( )
A.原子处于具有一定能量的定态中,虽然电子做加速运动,但 不向外辐射能量
2.能量量子化:与轨道量子化对应的能量不连续的现象. 电子在可能轨道上运动时,尽管是变速运动,但它并不释放能量, 原子是稳定的,这样的状态也称之为定态. 由于原子的可能状态(定态)是不连续的,具有的能量也是不连续 的,这样的能量形式称为能量量子化.
3.频率条件 原子从一种定态(设能量为 E2)跃迁到另一种定态(设能量为 E1)时, 它辐射或吸收一定频率的光子,光子的频率由这两种定态的能量差决 定,即 hν=E2-E1. 可见,电子如果从一个轨道到另一个轨道,不是以螺旋线的形式 改变半径大小的,而是从一个轨道上“跳迁”到另一个轨道上.玻尔 将这种现象称作电子的跃迁. 总而言之:根据玻尔的原子理论假设,电子只能在某些可能轨道 上运动,电子在这些轨道上运动时不辐射能量,处于定态.只有电子 从一条轨道跃迁到另一条轨道上时才辐射能量,辐射的能量是一份一 份的,等于这两个定态的能量差.这就是玻尔理论的主要内容.
玻尔的原子模型--优质获奖精品课件 (48)

某处出现的概率大小,如果用疏密不同的点子表示电子在各 个位置出现的概率,画出来的图就像云雾一样,稠密的地方
就是电子出现_□_6_概___率__大__的地方,形象地把它称做电子云。
[思维辨析] 1.(1)电子的轨道半径不是任意的,只有当半径的大小
符合一定条件时,这样的轨道才是可能的。( √ )
(2)氢原子吸收或辐射光子的频率条件是 hν=Em-
3.原子的能级跃迁问题 跃迁是指电子从某一轨道跃迁到另一轨道,而电子从某 一轨道跃迁到另一轨道对应着原子就从一个能量状态(定态) 跃迁到另一个能量状态(定态)。处于低能量状态的原子吸收 光子后跃迁到高能量状态,吸收的光子能量等于两定态的能 量差。 (1)跃迁时电子动能、原子电势能与原子能量的变化 当轨道半径减小时,库仑引力做正功,原子的电势能 Ep 减小,电子动能增大,原子能量减小。反之,轨道半径 增大时,原子电势能增大,电子动能减小,原子能量增大。
人教版物理选修3-5 第十八章原子结构
第十八章 原子结构 第4节 玻尔的原子模型
01课前自主学习
[动手填一填] 一、玻尔原子理论的基本假设 1.轨道量子化:玻尔认为,电子绕原子核做圆周运动, 服从经典力学的规律,但轨道半径不能是任意的,只有半径 在符合一定条件时,这样的轨道才是可能的,也就是说,电
运动,但不向外辐射能量 B.原子的不同能量状态与电子绕核运动时不同的圆轨
道相对应,而电子的可能轨道的分布是不连续的
C.电子从一个轨道跃迁到另一个轨道时,辐射(或吸 收)一定频率的光子
D.电子跃迁时辐射的光子的频率等于电子绕核做圆周 运动的频率
激发态。也就是说,原子只能处在一系列的能量状态中。
3.频率条件:当电子从能量__□_6_较__高____的定态轨道跃 迁到能量__□7__较__低____的定态轨道时,会放出能量为 hν 的光
就是电子出现_□_6_概___率__大__的地方,形象地把它称做电子云。
[思维辨析] 1.(1)电子的轨道半径不是任意的,只有当半径的大小
符合一定条件时,这样的轨道才是可能的。( √ )
(2)氢原子吸收或辐射光子的频率条件是 hν=Em-
3.原子的能级跃迁问题 跃迁是指电子从某一轨道跃迁到另一轨道,而电子从某 一轨道跃迁到另一轨道对应着原子就从一个能量状态(定态) 跃迁到另一个能量状态(定态)。处于低能量状态的原子吸收 光子后跃迁到高能量状态,吸收的光子能量等于两定态的能 量差。 (1)跃迁时电子动能、原子电势能与原子能量的变化 当轨道半径减小时,库仑引力做正功,原子的电势能 Ep 减小,电子动能增大,原子能量减小。反之,轨道半径 增大时,原子电势能增大,电子动能减小,原子能量增大。
人教版物理选修3-5 第十八章原子结构
第十八章 原子结构 第4节 玻尔的原子模型
01课前自主学习
[动手填一填] 一、玻尔原子理论的基本假设 1.轨道量子化:玻尔认为,电子绕原子核做圆周运动, 服从经典力学的规律,但轨道半径不能是任意的,只有半径 在符合一定条件时,这样的轨道才是可能的,也就是说,电
运动,但不向外辐射能量 B.原子的不同能量状态与电子绕核运动时不同的圆轨
道相对应,而电子的可能轨道的分布是不连续的
C.电子从一个轨道跃迁到另一个轨道时,辐射(或吸 收)一定频率的光子
D.电子跃迁时辐射的光子的频率等于电子绕核做圆周 运动的频率
激发态。也就是说,原子只能处在一系列的能量状态中。
3.频率条件:当电子从能量__□_6_较__高____的定态轨道跃 迁到能量__□7__较__低____的定态轨道时,会放出能量为 hν 的光
玻尔的原子模型 课件
警示(1)处于基态的原子是稳定的,而处于激发态的原子是不稳
定的。
(2)原子的能量与电子的轨道半径相对应,轨道半径大,原子的能量大,
轨道半径小,原子的能量小。
探究一
探究二
例题 1
已知氢原子的基态能量为-13.6 eV,核外电子的第一轨道半径为
0.53×10-10 m,电子质量 me=9.1×10-31 kg,电荷量为 1.6×10-19 C,求电子跃迁到 第三轨道时,氢原子的能量、电子的动能各多大?
点拨:原子的能量应根据能级进行计算。 解析:氢原子的能量可由氢原子能级公式 En=���1���2E1 求出,而动能可由氢 原子轨道半径公式以及向心力公式求出。氢原子的能量为电子的动能和电
势能之和,则第三个问题不难求出。氢原子的能量为 E3=312E1=-1.51 eV
电子在第三轨道时半径为 r3=n2r1=32r1=9r1
探究一
探究二
3.跃迁:原子从一种定态(设能量为 E2)跃迁到另一种定态(设能量为 E1) 时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决
定,即高能级 Em
低能级 En。可见,电子如果从一个轨
道到另一个轨道,不是以螺旋线的形式改变半径大小的,而是从一个轨道上
“跳跃”到另一个轨道上。玻尔将这种现象叫作电子的跃迁。
其中 E1 代表氢原子的基态的能级,即电子在离核最近的可能轨道上运 动时原子的能量值,E1=-13.6 eV。n 是正整数,称为量子数。量子数 n 越大, 表示能级越高。
(3)原子的能量:En=Ekn+Epn,即原子的能量包括:原子的原子核与电子所 具有的电势能和电子运动的动能。当氢原子中的电子绕核运动时���������������2���2 = ������������������2, 故 Ekn=12mv2=���2������������������2���。当电子的轨道半径增大时,库仑引力做负功,原子的电势 能增大,动能减小;反之电势能减小,动能增大。与卫星绕地球运行相似。
氢原子光谱和波尔的原子模型ppt课件
Na原子的发射光谱(明线)
H原子的吸收光谱(暗线)
H原子的发射光谱(明线)
吸收光谱和线状谱(发射光谱)的关系:
各种原子的吸收光谱中的每一条暗线都跟该种原子的发射光谱(线状光谱)中的
一条明线相对应。
3.光谱分析
既然每种原子都有自己的特征谱线,我们就可以利用它来鉴别物质和确定物质的组
成成分。这种方法称为光谱分析。
4.由于不同的原子具有不同的结构,能级各不
相同,因此辐射(或吸收)的光子频率也不相
同。这就是不同元素的原子具有不同的特征谱
线的原因。
六、玻尔理论的局限性
1.玻尔理论的不足之处在于保留了
经典粒子的观念,仍然把电子的运
动看作经典力学描述下的轨道运动。
2.玻尔理论成功地解释了氢原子光
谱的实验规律。但对于稍微复杂一
1
E1
激
发
态
h E n E m
基态
原子从低能级向高能级跃迁(电子从低轨道向高轨道跃迁): 吸收光子,原子能量增大
电子从低轨道向高轨道跃迁,电子克服库仑引力做
功,电势能增大,原子的能量增加,要吸收能量。
吸收光子能量:
h E n E m
原子从高能级向低能级跃迁(电子从高轨道向低轨道跃迁): 辐射光子,原子能量减小
优点:灵敏度高
样本中一种元素的含量达到10-13kg时就可
以被检测到。
利用白炽灯的光谱,能否检测出灯丝的成分?
不能,白炽灯的光谱是连续谱,不是原子
的特征谱线,因而无法检测出灯丝的成分
原子的特征光谱
二、氢原子光谱(发射光谱)的实验规律
氢原子是最简单的原子,其光谱也最简单。
n=6
n=5
