苯_乙醇_水混合液的分离提纯.
苯甲酸的分离提纯方法

苯甲酸的分离提纯方法苯甲酸是一种常用的有机酸,广泛应用于医药、染料、香料等领域。
然而,在实际应用中,苯甲酸的纯度往往不够高,需要进行分离提纯。
下面将介绍两种常用的分离提纯方法:结晶法和萃取法。
1. 结晶法结晶法是一种常用的分离提纯方法,适用于苯甲酸的固体样品。
其基本原理是利用物质在溶液中的溶解度随温度的变化而产生的结晶现象,将杂质与苯甲酸分离。
将苯甲酸样品加入适量的溶剂中,通常选择水或乙醇作为溶剂。
然后加热溶液,使苯甲酸完全溶解。
接着,慢慢降低溶液温度,使其逐渐冷却。
在适当的温度下,苯甲酸会开始结晶,杂质会留在溶液中。
最后,通过过滤或离心,将结晶的苯甲酸分离出来,并用冷溶剂洗涤,以去除残留的杂质。
最终,将苯甲酸在低温下干燥,得到纯净的苯甲酸晶体。
2. 萃取法萃取法是一种常用的液相分离提纯方法,适用于苯甲酸的液体样品。
其基本原理是利用不同溶剂对苯甲酸和杂质的不同溶解度,实现分离提纯。
将苯甲酸样品与适当的溶剂混合,搅拌均匀。
通常选择具有较高溶解度的有机溶剂,如乙酸乙酯或二氯甲烷。
然后,将混合溶液放置一段时间,使苯甲酸和杂质在两种溶剂中分配达到平衡。
接着,将两相分离,并收集有机相。
为了提高分离效果,可以进行多次萃取。
每次萃取后,将有机相收集起来,并与新鲜的溶剂进行下一轮的萃取。
通过多次萃取,可以逐渐提高苯甲酸的纯度。
将收集到的有机相进行蒸发,去除溶剂,得到纯净的苯甲酸。
以上就是苯甲酸的两种常用分离提纯方法:结晶法和萃取法。
根据实际情况,选择合适的方法进行分离提纯,可以得到高纯度的苯甲酸,满足不同领域的需求。
广东实验中学2022-2023学年高二下学期期中考试化学试题含答案

广东实验中学2022—2023学年高二下学期期中考试化学本试卷分选择题和非选择题两部分,共8页,满分100分,考试用时75分钟。
注意事项:1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考号填写在答题卷上。
2.选择题每小题选出答案后,用2B铅笔把答题卷上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其它答案;不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液.不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将答题卷收回。
可能用到的相对原子质量H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 Fe 56 Cu 64 Ni 59第Ⅰ卷(选择题共44分)一、选择题:本题共16小题,共44分。
第1~10小题每小题2分,第11~16题每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求。
1.下列化学用语或图示表达不正确的是( )A.基态氮原子的轨道表示式:B.顺式聚异戊二烯的结构简式:C.CaC2的电子式:D.基态24Cr的简化电子排布式:[Ar]3d44s22.下列有机物的系统命名正确的一组是( )A.CH2Br﹣CH2Br二溴乙烷B.1,3,4﹣三甲苯C.2,2,3−三甲基戊烷D.2﹣甲基﹣1,3﹣二丁烯3.下列有关芳香烃的叙述中,错误的是( )A.苯与浓硝酸、浓硫酸共热可反应生成硝基苯B.苯乙烯在合适条件下催化加氢可生成C.乙苯可被酸性高锰酸钾溶液氧化为(苯甲酸)D.甲苯与氯气在光照下发生一元取代反应,主要生成4.设N A为阿伏加德罗常数的值,下列说法不正确的是( )A.lmol SiO2晶体含有共价键数目为4N AB.12g金刚石中含有的晶胞数目为N A/8C.标准状况下,22.4LCH2Cl2中C—Cl键的数目为2N AD.28g乙烯和环己烷(C6H12)的混合物中含有碳原子数为2N A5.下列各项比较中前者高于(或大于或强于)后者的是( )A.戊醇和乙醇在水中的溶解度B.CH3CH2CH2COOH的酸性和CH3COOH的酸性C.SO2Cl2分子中的Cl﹣S﹣Cl键角和SO2F2分子中的F﹣S﹣F键角D.邻羟基苯甲醛()的沸点和对羟基苯甲醛()的沸点6.用下列装置进行实验,能达到实验目的的是( )证明乙炔可使溴水褪色制备溴苯并验证有HBr产生萃取振荡时放气7.下列关于有机化合物的说法错误的是( )A.正己烷和2,2﹣二甲基丁烷互为同系物B.中共平面的原子数目最多为15个C.正丁烷的沸点比异丁烷的高,乙醇的沸点比二甲醚的高D.甲苯能使酸性高锰酸钾溶液褪色,而烷烃则不能,说明苯环活化了甲基8. 下列由实验得出的结论正确的是( ) 9. 下列关于有机物的说法不正确的是( ) A .2-丁烯分子存在顺反异构B .有机物()的一氯代物有4种C .抗坏血酸分子()中有2个手性碳原子D .有机物()与氢气1∶1加成后的产物只有一种10. 溴苯可用于生产镇痛解热药和止咳药,其制备、纯化流程如图。
分离提纯方法

分离提纯方法分离提纯方法是化学领域中非常重要的一个环节,它涉及到从混合物中提取出纯净的物质,以便进行进一步的分析和应用。
在实际操作中,我们常常会遇到各种各样的混合物,而要想得到我们需要的单一物质,就需要借助于各种分离提纯方法。
本文将介绍几种常见的分离提纯方法,希望对大家有所帮助。
首先,最常见的分离提纯方法之一就是蒸馏。
蒸馏是利用混合物中各成分的沸点差异来进行分离的方法。
在蒸馏过程中,混合物被加热至其中一个成分的沸点,这个成分会转化为气体,然后通过冷凝器冷却成液体,从而分离出目标物质。
蒸馏方法适用于液体混合物的分离提纯,常用于酒精、水等液体的提纯过程。
其次,结晶是另一种常见的分离提纯方法。
结晶是通过溶解度的差异来分离混合物中的成分。
当溶解度较大的成分溶解在溶剂中,而溶解度较小的成分无法完全溶解时,就可以通过结晶的方式将溶解度较小的成分从溶液中分离出来。
结晶方法适用于固体混合物的分离提纯,常用于盐类、糖类等固体物质的提纯过程。
另外,萃取也是一种常用的分离提纯方法。
萃取是利用溶剂对混合物中成分的选择性溶解性来进行分离的方法。
通过与混合物中的目标成分有较高的亲和力,从而将目标成分从混合物中提取出来。
萃取方法适用于液-液或固-液混合物的分离提纯,常用于天然产物的提取和化学反应物的分离过程。
最后,色谱技术也是一种非常重要的分离提纯方法。
色谱技术是利用不同成分在固定相和移动相之间的分配系数差异来进行分离的方法。
通过在固定相上的吸附和移动相的流动,不同成分会以不同的速度通过色谱柱,从而实现分离。
色谱技术适用于各种复杂混合物的分离提纯,常用于化学分析和药物研发领域。
总之,分离提纯方法在化学领域中具有非常重要的意义,它们为我们提供了丰富的手段来从复杂的混合物中分离出纯净的物质。
不同的分离提纯方法各具特点,可以根据具体情况选择合适的方法来进行操作。
希望本文介绍的几种常见的分离提纯方法对大家有所帮助,也希望大家在实际操作中能够根据需要灵活运用,取得理想的分离提纯效果。
液体有机化合物的分离和提纯
2-5 液体有机化合物的分离和提纯在生产和实验中,经常会遇到两种以上组分的均相分离问题。
例如某物料经过化学反应以后,产生一个既有生成物又有反应物及副产物的液体混合物。
为了得到纯的生成物,若反应后的混合物是均相的,时常采用蒸馏(或精馏)的方法将它们分离。
一、简单蒸馏通过简单蒸馏可以将两种或两种以上挥发度不同的液体分离,这两种液体的沸点应相差30℃以上。
1. 简单蒸馏原理液体混合物之所以能用蒸馏的方法加以分离,是因为组成混合液的各组分具有不同的挥发度。
例如,在常压下苯的沸点为80.1℃,而甲苯的沸点为110.6℃。
若将苯和甲苯的混合液在蒸馏瓶内加热至沸腾,溶液部分被汽化。
此时,溶液上方蒸气的组成与液相的组成不同,沸点低的苯在蒸气相中的含量增多,而在液相中的含量减少。
因而,若部分汽化的蒸气全部冷凝,就得到易挥发组分含量比蒸馏瓶内残留溶液中所含易挥发组分含量高的冷凝液,从而达到分离的目的。
同样,若将混合蒸气部分冷凝,正如部分汽化一样,则蒸气中易挥发组分增多。
这里强调的是部分汽化和部分冷凝,若将混合液或混合蒸气全部冷凝或全部汽化,则不言而喻,所得到的混合蒸气或混合液的组成不变。
综上所述,蒸馏就是将液体混合物加热至沸腾,使液体汽化,然后,蒸气通过冷凝变为液体,使液体混合物分离的过程,从而达到提纯的目的。
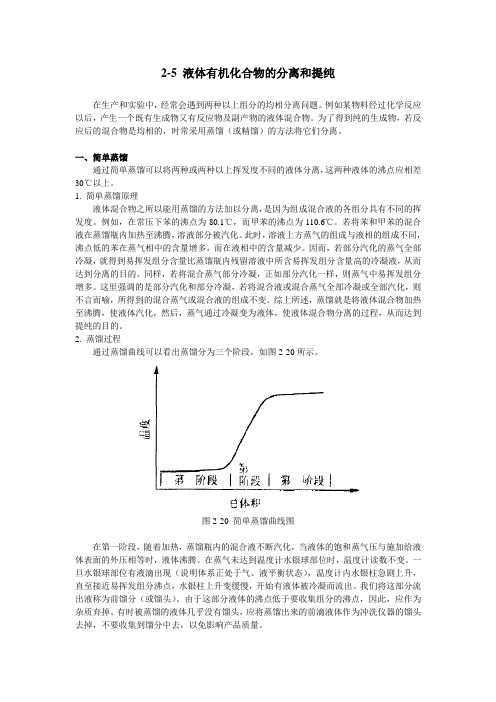
2. 蒸馏过程通过蒸馏曲线可以看出蒸馏分为三个阶段,如图2-20所示。
图2-20 简单蒸馏曲线图在第一阶段,随着加热,蒸馏瓶内的混合液不断汽化,当液体的饱和蒸气压与施加给液体表面的外压相等时,液体沸腾。
在蒸气未达到温度计水银球部位时,温度计读数不变。
一旦水银球部位有液滴出现(说明体系正处于气、液平衡状态),温度计内水银柱急剧上升,直至接近易挥发组分沸点,水银柱上升变缓慢,开始有液体被冷凝而流出。
我们将这部分流出液称为前馏分(或馏头)。
由于这部分液体的沸点低于要收集组分的沸点,因此,应作为杂质弃掉。
有时被蒸馏的液体几乎没有馏头,应将蒸馏出来的前滴液体作为冲洗仪器的馏头去掉,不要收集到馏分中去,以免影响产品质量。
苯甲酸的分离提纯方法

苯甲酸的分离提纯方法苯甲酸是一种常见的有机化合物,广泛应用于医药、染料、香料等领域。
在实验室中,对苯甲酸进行分离和提纯是常见的操作。
本文将介绍苯甲酸的分离提纯方法。
我们可以通过普通的提纯方法,如结晶法、萃取法等,对苯甲酸进行初步的分离。
其中,结晶法是一种常用且简便的方法。
首先将苯甲酸溶解在适量的溶剂中,如水或有机溶剂,然后加热溶液至溶解温度,使苯甲酸完全溶解。
随后,慢慢冷却溶液,苯甲酸会逐渐结晶出来。
最后,将生成的苯甲酸晶体用冷溶剂洗涤并过滤,即可得到相对纯净的苯甲酸。
除了结晶法,萃取法也是一种常用的分离提纯方法。
在萃取法中,我们可以选择适当的溶剂来萃取苯甲酸。
通常,苯甲酸具有较好的溶解性,可以选择无水乙醇、乙醚等有机溶剂进行萃取。
首先将苯甲酸与溶剂充分混合,然后分层,将有机相收集。
接着,用饱和氯化钠溶液洗涤有机相,去除杂质。
最后,用旋转蒸发仪将溶剂蒸发,得到纯净的苯甲酸。
我们还可以利用色谱技术进行苯甲酸的分离和提纯。
色谱是一种基于物质在固定相和流动相中分配系数差异而进行分离的方法。
对于苯甲酸的分离,可以选择合适的固定相和流动相,如硅胶、活性炭等固定相,甲醇、水等流动相。
将混合物溶解在流动相中,通过色谱柱,利用分配差异使苯甲酸与其他组分分离开来。
最后,用旋转蒸发仪将流动相蒸发,得到纯净的苯甲酸。
还可以通过亚氨基钼酸法对苯甲酸进行分离和提纯。
亚氨基钼酸法是一种常用的重金属离子分离的方法,也适用于苯甲酸的提纯。
首先将苯甲酸溶解于水中,加入亚氨基钼酸钠溶液,生成沉淀。
然后,通过过滤或离心的方式将沉淀收集。
最后,用水洗涤沉淀,去除杂质,即可得到纯净的苯甲酸。
苯甲酸的分离提纯方法有结晶法、萃取法、色谱技术和亚氨基钼酸法等。
在实际操作中,我们可以根据具体情况选择合适的方法进行分离提纯,以获得纯净的苯甲酸。
这些方法不仅可以应用于实验室中,也可以在工业生产中得到推广和应用。
简述水提醇沉法的操作要点

简述水提醇沉法的操作要点
水提醇沉法是一种常用的分离和提纯化合物的方法,它基于醇类物质在水中溶解度较高的特点。
在操作过程中,需要注意以下几个要点。
要选择合适的溶剂。
水提醇沉法主要利用水和醇的亲和性差异进行分离,因此需要选用适合的醇类溶剂。
常用的溶剂有乙醇、丙醇、异丙醇等,根据不同的化合物特性选择合适的醇类溶剂。
需要控制溶剂的浓度。
在水提醇沉法中,溶剂的浓度对分离效果有很大影响。
一般情况下,溶剂的浓度越高,分离效果越好。
但是过高的浓度会增加操作难度,因此需要根据实际情况选择适当的浓度。
接下来是溶剂的加入和混合。
在操作过程中,需要将溶剂逐渐加入待分离的混合物中,并进行充分的混合。
混合的方式可以是搅拌、摇晃或超声波处理等,目的是使混合物中的化合物充分溶解。
然后是等待分离。
在混合物中加入溶剂后,需要给予足够的时间让不同化合物在溶剂中分离。
这个过程一般需要一定的时间,可以通过观察溶液的透明度变化或者使用离心机加速分离。
最后是分离产物的收集。
分离完成后,需要将溶液中的上层液体(富含醇类溶剂)和下层液体(含有较少醇类溶剂)分别收集。
可以使用分液漏斗或离心机等工具进行分离,注意保持收集容器的清洁和干燥。
总结一下,水提醇沉法的操作要点包括选择合适的溶剂、控制溶剂的浓度、充分混合混合物、等待分离、分离产物的收集。
这些要点能够帮助我们有效地进行水提醇沉法的操作,实现对化合物的分离和提纯。
有机物分离和提纯的常用方法

有机物分离和提纯的常用方法分离和提纯有机物的一般原则是:根据混合物中各成分的化学性质和物理性质的差异进行化学和物理处理,以达到处理和提纯的目的,其中化学处理往往是为物理处理作准备,最后均要用物理方法进行分离和提纯.下面将有机物分离和提纯的常用方法总结如下:分离、提纯的方法目的主要仪器实例分液分离、提纯互不相溶的液体混合物分液漏斗分离硝基苯与水蒸馏分离、提纯沸点相差较大的混合溶液蒸馏烧瓶、冷凝管、接收器分离乙醛与乙醇洗气分离、提纯气体混合物洗气装置除去甲烷中的乙烯过滤分离不溶性的固体和液体过滤器分离硬脂酸与氯化钠渗析除去胶体中的小分子、离子半透膜、烧杯除去淀粉中的氯化钠、葡萄糖盐析胶体的分离��分离硬脂酸钠和甘油上述方法中,最常用的是分液(萃取)、蒸馏和洗气。
最常用的仪器是分液漏斗、蒸馏烧瓶和洗气瓶。
其方法和操作简述如下:1. 分液法��常用于两种均不溶于水或一种溶于水,而另一种不溶于水的有机物的分离和提纯。
步骤如下:分液前所加试剂必须与其中一种有机物反应生成溶于水的物质或溶解其中一种有机物,使其分层。
如分离溴乙烷与乙醇(一种溶于水,另一种不溶于水):又如分离苯和苯酚:2. 蒸馏法��适用于均溶于水或均不溶于水的几种液态有机混合物的分离和提纯.步骤为:蒸馏前所加化学试剂必须与其中部分有机物反应生成难挥发的化合物,且本身也难挥发。
如分离乙酸和乙醇(均溶于水):3。
洗气法�;�适用于气体混合物的分离提纯.步骤为:例如:此外,蛋白质的提纯和分离,用渗析法;肥皂与甘油的分离,用盐析法。
有机物分离和提纯的常用方法 1,洗气 2,萃取分液溴苯(Br2),硝基苯(NO2),苯(苯酚),乙酸乙酯(乙酸) 3, a,制无水酒精:加新制生石灰蒸馏 b,酒精(羧酸)加新制生石灰(或NaOH固体)蒸馏 c,乙醚中混有乙醇:加Na,蒸馏 d,液态烃:分馏 4,渗析 a,蛋白质中含有Na2SO4 b,淀粉中KI 5,升华奈(NaCl)鉴别有机物的常用试剂所谓鉴别,就是根据给定的两种或两种以上的被检物质的性质,用物理方法或化学方法,通过必要的化学实验,根据产生的不同现象,把它们一一区别开来.有机物的鉴别主要是利用官能团的特征反应进行鉴别.鉴别有机物常用的试剂及特征反应有以下几种:1. 水适用于不溶于水,且密度不同的有机物的鉴别.例如:苯与硝基苯.2。
乙醇和水的分离实验报告

乙醇-水精馏实验报告实验名称:共沸精馏实验人员:同组人:实验地点:实验时间:班级/学号:指导教师:实验成绩:共沸精馏一、实验目的1. 通过实验加深对共沸精馏过程的理解2. 熟悉精馏设备的构造掌握精馏操作方法3. 能够对精馏过程做全塔物料衡算4. 学会使用气相色谱分析气、液两相组成。
二、实验原理精馏是利用不同组份在气-液两相间的分配,通过多次气液两相间的传质和传热来达到分离的目的。
对于不同的分离对象,精馏方法也会有所差异。
例如分离乙醇和水的二元物系。
由于乙醇和水可以形成共沸物而且常压下的共沸温度和乙醇的沸点温度极为相近。
所以采用普通精馏方法只能得到乙醇和水的混合物。
而无法得到无水乙醇。
为此,在乙醇-水系统中加入第三种物质,该物质被称为共沸剂。
共沸剂具有能和被分离系统中的一种或几种物质形成最低共沸物的特性。
在精馏过程中共沸剂将以共沸物的形式从塔顶蒸出,塔釜则得到无水乙醇。
这种方法就称作共沸精馏。
乙醇-水系统加入共沸剂苯以后可以形成四种共沸物。
现将它们在常压下的共沸温度、共沸组成列于表1。
为了便于比较再将乙醇、水、苯三种纯物质常压下的沸点列于表2。
从表1和表2列出沸点看除乙醇-水二元共沸物的共沸物与乙醇沸点相近之外其余三种共沸物的沸点与乙醇沸点均有10℃左右的温度差。
因此,可以设法使水和苯以共沸物的方式从塔顶分离出来,塔釜则得到无水乙醇。
整个精馏过程可以用图1来说明。
图中A、B、W分别为乙醇、苯和水的英文字头,ABZ,AWZ,BWZ代表三个二元共沸物,T表示三元共沸物。
图中的曲线为25℃下的乙醇、水、苯三元共沸物的溶解度曲线。
该曲线的下方为两相区上方为均相区。
图中标出的三元共沸组成点T是处在两相区内。
以T为中心连接三种纯物质A、B、W及三个二元共沸点组成点ABZ、AWZ、BWZ将该图分为六个小三角形。
如果原料液的组成点落在某个小三角形内。
当塔顶采用混相回流时精馏的最终结果只能得到这个小三角形三个顶点所代表的物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第30卷第2期2010年3月云南师范大学学报Journa l o fYunnan Nor m alUn i v ersity*V o. l 30No . 2M ar . 2010苯-乙醇-水混合液的分离提纯苏永庆, 胡红艳, 段爱红(云南师范大学化学化工学院, 云南昆明650092摘要: 在大学物理化学实验教学中, 苯-乙醇-水三组分体系相图的绘制实验将产生大量的苯-乙醇-水混合废液, 并分层为上层苯液(含有少量水和乙醇, 下层乙醇-水溶液(含有大量乙醇和水, 以及少量苯. 文章根据苯、乙醇在水中的溶解度不同, 对上层苯液进行多次水萃取乙醇, 最后用无水CaC l 2干燥处理得到纯苯(98. 9%. 对于下层乙醇-水溶液, 由于苯与乙醇、水形成三元恒沸物, 通过蒸馏除去苯, 继续蒸馏得到乙醇-水的二元恒沸物(乙醇95. 6%, 水4. 4% 和纯乙醇(99. 7w t %. 将乙醇-水的二元恒沸物通过CaC l 2脱水处理, 得到99. 4w t %以上的乙醇. 关键词: 苯; 乙醇; 分离; 提纯; 萃取; 蒸馏中图分类号: O 622 文献标识码: A 文章编号: 1007-9793(2010 02-0059-04在大学的物理化学实验教学中[1], 作为经典混溶, 且苯、乙醇、水三组分混合后不会发生化学反应, 用水作溶剂, 通过少量水多次萃取, 就可以除去溶液里的乙醇. 萃取分离乙醇后的苯液含有少量的水(20 时水在苯中的含量为0. 050%, 通过干燥剂处理便可以除去里面的水. 通过密度测量来检测它的纯度.对于下层含有少量苯的乙醇-水溶液, 由于乙醇和水可以任意比例混溶, 用萃取的方法不能将它们分开, 但可借鉴工业提纯乙醇的方法. 工业上制得的酒精一般是乙醇(含量95%左右和水的混合液, 为了得到更纯的乙醇, 工业上常用苯法除去乙醇中所含的水分, 即把少量的苯加入到乙醇溶液中, 然后把含苯的乙醇-水混合液投入精溜塔中, 在64. 6 时蒸出苯、乙醇和水的三元恒沸物(苯74. 1%, 乙醇18. 5%, 水7. 4%. 如果苯过量, 则在69. 4 时蒸出苯和水的二元恒沸物(苯91. 1%, 水8. 9%, 继续加热, 则可以在78. 2 时蒸出乙醇和水的二元恒沸物(乙醇95. 6%, 水4. 4%, 当温度达到78. 5 时蒸出纯的乙醇, 通过这种方法得到的乙醇的含量可达到99%以上. 由于云南地处高原, 大气压力为605-608mmH g , 蒸馏温度与上述温度有所偏差. 对于[3, 4]实验之一的苯-乙醇-水三组分体系相图的绘制将产生大量的苯-乙醇-水的混合废液. 苯是有毒有机物, 如果不处理就把它随意倒掉, 将造成环境污染, 并且苯、乙醇是广泛使用的重要化工原料, 所以本文设计一种简单有效的方法来分离提纯这种混合废液, 使苯, 乙醇可以重复利用, 节约资源, 减少环境污染.1 实验原理图1是常温下苯-乙醇-水三组分体系的相图, 帽形图以内的为部分互溶区域, 帽形图以外的是完全互溶区域. 可以看到, 苯-乙醇-水的混合液, 由于两两组分溶解度不同, 在帽形区域内出现分层. 混合液的上层为含有少量乙醇和水的苯液, 下层为含有少量苯的乙醇-水溶液. 用分液漏斗分离上下两层溶液, 使各自都回到帽行区域外.上层苯液中主要含有苯、少量乙醇和水, 只要除去里面的少量乙醇和水就可以得到纯度较高的苯. 由于苯在水中的溶解度为0. 175g , 乙醇含有一个亲水性基团 -OH , 可以与水任意比例* 收稿日期:2009-08-28[2]基金项目:云南师范大学综合性、设计性实验研究项目(2007:(, 男, , 博士.60云南师范大学学报(自然科学版第30卷乙醇和水的二元恒沸物, 可以用工业生产无水乙醇的方法或直接加入干燥剂来制取纯度较高的乙醇.除去水的苯液中只含有苯和少量的乙醇, 在知道纯苯、纯乙醇的密度后, 可以根据下列公式计算得到苯的纯度.= 1a 1+ 2a 2= 1a 1+ 2(1-a 1 a 1=( - 2 /( 1- 2 式中: 溶液的密度; 1 纯苯的密度; 2 纯乙醇的密度; a 1 苯的质量分数; a 2 乙醇的质量分数.分别取50mL 纯乙醇和50mL 纯苯, 用比重天平测它们的密度, 重复三次, 取平均值, 结果见表1.表1 纯苯和纯乙醇的密度T ab . 1 The density of pure a lcohol and benzene 测量次数苯(分析纯 g /L乙醇(分析纯 g /L一次875786二次874787三次874786平均值8747862 实验材料与仪器设备2. 1 实验材料与试剂苯-乙醇-水混合废液(由物化实验室收集提供, 苯(A.R . , 乙醇(A. R. , 无水C a C l 2(A. R . , CuSO 4(A. R . , 蒸馏水等2. 2 仪器及设备阿贝(Abbe 折光仪(QG230 1998, 上海精密科学仪器有限公司, 比重天平(天津仪器厂, 恒温震荡器(TB 2000, 天津仪器厂, 梨形分液漏斗等.3. 3苯的提纯取100mL 苯液加入到梨形分液漏斗中, 加入20m L 蒸馏水. 轻轻振摇分液漏斗, 每隔几秒钟将漏斗倒置, 打开活塞放气, 重复操作2~3次. 然后将漏斗放到震荡器上, 振荡15m i n , 取下置于铁圈上, 静止分层. 当溶液分为两层后, 小心旋开活塞, 放出下层水液, 重复上述萃取过程. 最后将萃取后[4]的苯液倒入锥形瓶, 加入无水C a C l 2干燥. CaC l 2价格便宜, 吸水能力强, 但平衡速度慢, 所以用Ca C l 2干燥时, 需放置一段时间, 并间歇振摇. 干燥后的苯液用白色的无水CuSO 4检验, 若苯液中无水, CuSO 4不变色, 仍为白色; 若还含有水, CuSO 4会与水反应生成CuSO 4 5H 2O 而显蓝色.除尽水后的苯液, 用比重天平测量它的密度, 计算纯度. 实验数据及计算结果见表2.表2 水萃取次数对苯液密度的影响T ab . 2 E ffect o f the wa ter ex tracti ng ti m eson t he density o f benzene 萃取次数苯液的密度g /L苯的质量分数%二次86792. 0三次87297. 7四次87398. 9五次87398. 93 实验过程与结果讨论3. 1原料的预处理把从物化实验室收集的苯-乙醇-水混合废液放置分层, 用梨形分液漏斗分离上层苯液(含有少量乙醇和水和下层乙醇-水溶液(含有少量苯, 备用. 3. 2纯苯, 纯乙醇的密度测定纯苯, 纯乙醇的密度是确定后面萃取所得到的苯的纯度的依据, 尽管它们的密度在商品标签上已经给出, 但因为所处环境和所用仪器不同, 测.3. 4乙醇的提纯1第2期苏永庆, 等:苯-乙醇-水混合液的分离提纯61绘制物质的折光率不但与它的分子结构和光线波长有关, 而且也受温度, 压强等因素的影响. 通常, 温度升高一度, 液体有机物的折光率就减小3 5 10-4[5]3. 4. 2乙醇-水溶液中苯的分离取3. 1分离得到的下层乙醇-水溶液(含有少量苯 160mL , 倒入250mL 圆底烧瓶中, 加入2~3粒沸石, 安装好蒸馏的装置. 下层溶液蒸馏时, 在59 时开始沸腾, 59. 5 时出现第一滴馏分, 为苯、乙醇和水的三元恒沸物, 控制加热温度, 以每秒钟产生1~2滴馏分为益, 沸腾持续了一段时间后有所减弱. 到65. 9 又开始第二次激烈沸腾, 产生苯和水的二元恒沸物, 大约20s 后沸腾有所减弱. 温度升到74. 2 时, 开始第三次激烈沸腾, 到78. 6 时温度回落, 在此温度期间蒸出乙醇和水的二元恒沸物. 在第三次激烈沸腾, 滴出馏分3~4滴后, 收集馏分供后续的脱水处理. 在表3 乙醇水标准溶液的折光率(温度:30 水=998g /L, 乙醇=786g /L~5. 5 10. 在实际工作中, 一般都是-4固定某个温度, 所有的物质的折光率都在这个温度下测量, 本实验中固定温度为30 .将阿贝折光仪配套的恒温水浴调整运行到30 , 按照下表用移液管精确配置好乙醇溶液, 浓度由低到高测出不同浓度乙醇的折光率, 绘制乙醇标准溶液的组成折光率特性曲线. 数据计算见表3, 标准曲线见图2.78. 6 后继续加热, 得到含量99. 7w %t 的纯乙醇馏分.3. 4. 3乙醇的脱水处理上述收集到的乙醇-水的二元恒沸物, 乙醇的质量分数为95. 6%, 水的质量分数为4. 4%.要进一步除去水分, 可重复使用3. 4. 2的方法, 或者[6]采用氧化钙法制备无水乙醇(实验室法, 本实验采用后者, 即取250m L 短颈圆底烧瓶, 放入100mL 上步蒸馏得到的乙醇和水的溶液, 慢慢加入小快的生石灰40g 和氢氧化钠0. 5g . 装上回流装置, 封好瓶塞, 在水浴上煮沸回流约1h . 回流完毕, 拆下冷凝管, 改装为蒸馏装置, 用干燥的锥形瓶收集无水乙醇馏分.3. 4. 4乙醇纯度的检验对收集到的无水乙醇馏分进行折光率测定, 并对照图2的乙醇-水标准溶液的组成折光率曲线, 找到对应的点, 得到它的纯度, 见表4.表4 馏分在30 时的折光率T ab . 4The refractive i ndex of t he d i still ation a t 30 测量次数馏分的折光率(n 乙醇的质量分数%一次二次三次平均值 99. 4Tab . 3 Refracti ve i ndex of nor mati ve sol uti on of alcohol-water (T e m perature :30 , =998g /L, a lcoho l =786g /L w a te r乙醇体积/mL10. 009. 509. 008. 508. 007. 006. 005. 003. 00水体积/mL0. 000. 501. 001. 502. 003. 004. 005. 007. 00乙醇的质量分数%10093. 787. 681. 775. 964. 754. 144. 025. 2折光率(n 1.1. 1. 1. 1. 1. 1. 1. 1.3546352035073487347234433416339233561. 35441. 35451. 354599. 2 99. 599. 54 结论(1 对于苯-乙醇-水的混合液, 通过分液(62醇-水溶液(含有少量苯分离.云南师范大学学报(自然科学版第30卷[1] 云南师范大学化学化工学院物理化学教研室, 物理化学实验[M].昆明:云南民族出版社, 2003. [2] 化学工程手册编委会. 化学工程手册(第8篇[M].北京:化学工业出版社, 1989.[3] 刑存, 于跃芹. 有机化学(上册 [M ].济南:山东大学出版社, 2000.[4] 陆国元. 有机化学[M ].南京:南京大学出版社, 1999.[5] 苏联 , B . A 拉宾诺维奇, 哈文著. 尹承烈译. 简明化学手册[M].北京:化学工业出版社, 1983. [6] F i eser , L . F . , O rg an i c Exper i m ents , R ay theon Educa ti on Co . , L ex ing t on , M ass , . 1968.(2 对于上层苯液, 用蒸馏水萃取4~5次就可以除去苯液中的乙醇, 使苯的纯度达到98.9w %t 以上.(3 对于下层乙醇-水溶液, 通过蒸馏得到乙醇-水的二元恒沸物(乙醇95. 6%, 水4. 4% 和纯乙醇(99. 7w %t . 将乙醇-水的二元恒沸物通过Ca C l 2脱水处理, 可以得99. 4w %t 以上的乙醇.参考文献:Separation and purificati on of benzene -ethano l -waterwaste li qui dSu Yong qing , Hu Hong yan , Duan ai -hong(F acu lty of Che m istry &Che m i ca l Eng i neer i ng , Y unnan N orma lU n i ve rsity , 650092K un m i ng C ity , P . R. Chi naAbst ract :: A lot of benzene-ethanol-w ater w aste m i x ed liquid w as produced in physi c al-che m ical ex peri m ent course Phase dra w o f benzene-ethano l-w ater . The w aste liqu i d d i v ided into t w o layers . The up per layer w as benzene so l u ti o n w ith a little ofw ater and ethano. l The do w n layerw as ethano l solution w ith l o ts of ethano, l w ater and a little o f benzene . The upper benzene so lution w as ex tracted repetiti o usly by w ater accord i n g to the difference of so lubility o f benzene and ethano l i n w ater separate l y . Then itw as treated by desic cant and the pure benzene (98. 9% w as go tten . For the down ethano l solution , the benzene w as w i p ed o ff by distilli n g because benzene , ethanol and w ater can for m three do llars azeotrope . The t w o do llars azeotrope o f ethano l-w ater(ethano l 95. 6w %t , w ater 4. 4w %t and pure ethano l (99. 7w %t w ere gotten by Further dis tilling . The t w o do llar azeotrope o f et h ano l-w ater w as treated C a C l 2by desiccan t to get the pure alcoho l (99. 4%. K ey w ords :benzene ; et h ano; l separation ; purificati o n ; ex traction; distillation。
