专题:“无机框图推断”题眼汇总
高中化学无机框图题题眼归纳总结 .doc

无机框图题题眼归纳推理能力是高考测试的五项能力之一,无机推断题既可以综合考查元素化合物方面的基础知识,还可联系到化学基础理论、化学实验现象等等,另外无机物质推断题可以较好地测试推断能力,所以近几年的高考试题中,无机物质推断题成了每年高考中考查推理能力的保留题型。
在解题时,应首先抓住一些敏感的知识点,如特殊的颜色、状态、气味,特殊的反应条件及反应,特殊字眼等等,其中考查较多的有:1.特殊的颜色、状态MnO4-(紫色);Fe3+(黄色);Fe2+(浅绿色);Fe(OH)2→Fe(OH)3(白色→灰绿色→红褐色);S、AgBr和Na2O2(淡黄色);AgI(黄色);Cu2+(蓝色);Cu(OH)2(蓝色沉淀,溶于酸);Al(OH)3(白色沉淀,溶于强酸和强碱);Mg(OH)2(白色沉淀,溶于酸);BaSO4(白色沉淀,不溶于酸);BaCO3(白色沉淀,溶于酸);CaCO3(白色沉淀,溶于酸);AgCl(白色沉淀,不溶于酸);BaSO3(白色沉淀,溶于酸);还有焰色反应:钠及其化合物(黄色),钾及其化合物(紫色)等等。
2.气体的特殊性质O2能使带火星的木条复燃;SO2有刺激性气味,能使品红溶液褪色;H2S有臭鸡蛋气味,能使湿润的Pb(Ac)2试纸变黑;Cl2黄绿色气体,能使湿润的有色布条褪色,使湿润的淀粉-KI试纸变蓝;NH3有刺激性气味,能使湿润的红色石蕊试纸变蓝;NO2是红棕色,有刺激性气味的气体;溴蒸气亦是红棕色等等。
3.特殊的反应条件①电解:2NaCl+ 2H2O===Cl2↑+H2↑+2NaOH;MgCl2===Cl2↑+Mg;2Al2O3===3O2↑+4Al②高温:Al+金属氧化物金属+Al2O3;3Fe+4H2O Fe3O4+4H2;4FeS2+11O22Fe2O3+8SO2;Fe2O3+3CO2Fe+3CO2;CaCO3CO2↑+CaO;C+H2O CO+ H2;C+ CO22CO;2C+SiO22CO↑+Si;SiO2 +Na2CO3Na2SiO3+ CO2↑;SiO2+CaCO3CaSiO3+ CO2↑③催化剂:SO2转化生成SO3;氨催化氧化生成NO;KClO3分解生成O2;H2O2在MnO2作用下分解生成O2④高温高压催化剂:合成氨4.特殊的转换关系 ①连续氧化 NH 3(N 2) NO NO 2HNO 3 H 2S(S) SO 2SO 3H 2SO 4 C CO CO 2H 2CO 3NaNa 2ONa 2O 2NaOH②A 为弱酸的铵盐:(NH 4)2CO 3 或 NH 4HCO 3;(NH 4)2S 或 NH 4HS ;(NH 4)2SO 3 或 NH 4HSO 3③三角形转化关系5. 特殊字眼(1)联系工业生产的反应硫酸工业:FeS 2(S)—SO 2—SO 3—H 2SO 4 硝酸工业:N 2—NH 3—NO —NO 2—HNO 3 生产玻璃,氯碱工业,水煤气的制取等等。
“无机框图题”题眼归纳

无机框图推断专题复习一、高考展望无机框图推断是对常见元素的单质及其重要化合物相互关系的考查,它融元素化合物、基本理论、计算于一体。
侧重考查学生思维的能力和综合应用的能力,在历届高考中具有较好的区分度和选拔能力。
一般氯、硫、氧、氮、碳、钠、镁、铝、铁元素及化合物之间的转化是这类题的热点。
解决这类考题,首先要读懂题意和图意,找准突破口(题眼),从自己的记忆中搜寻出典型的反应,事物或模型,然后大胆推测,只要符合框图关系的答案都是正确的。
由于框图推断较好地考查了学生的直接思维品质,在高考中继续出现是理所当然。
二、“无机框图题”题眼归纳 (一)特征反应1.与碱反应产生气体(1)⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质(2)铵盐:O H NH NH 234+↑−→−+碱2.与酸反应产生气体(1)⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓 (2)()()()⎪⎪⎩⎪⎪⎨⎧↑−→−↑−→−↑−→−+++------2323222323SO HSO SO S H HS S CO HCO CO H H H 化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S↓+SO 2↑+H 2O4.与水反应产生气体(1)单质⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na(2)化合物()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na5.强烈双水解()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+32322323233222OH Al AlO OH Al S H HS S OH Al CO HCO CO Al O H O H O H 与 6.既能酸反应,又能与碱反应(1)单质:Al(2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
无机框图推断中常见题眼归类分析
无机框图推断题的解法一、【复习目标】:1、掌握无机框图题常见解题方法和技巧2、复习重要的金属和非金属元素(包括Na、Mg、Al、Fe、Cl、N、S、Si等)单质及其化合物的性质,以及它们之间存在的相互转化关系。
3、复习几种重要气体(包括H2、O2、CO2、Cl2、SO2、NH3)的性质以及离子(包括Cl―、CO32―、SO42―、和NH4+、Fe3+)的检验。
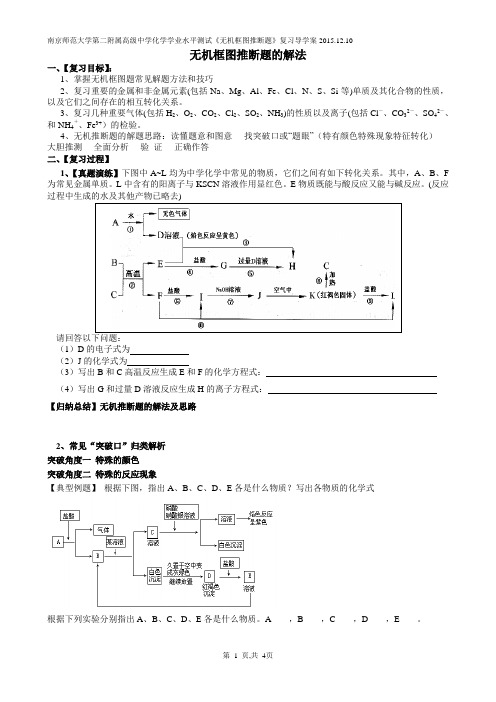
4、无机推断题的解题思路:读懂题意和图意----找突破口或“题眼”(特有颜色特殊现象特征转化)----大胆推测----全面分析----验证----正确作答二、【复习过程】1、【真题演练】下图中A~L均为中学化学中常见的物质,它们之间有如下转化关系。
其中,A、B、F 为常见金属单质。
L中含有的阳离子与KSCN溶液作用显红色。
E物质既能与酸反应又能与碱反应。
(反应过程中生成的水及其他产物已略去)(1)D的电子式为(2)J的化学式为(3)写出B和C高温反应生成E和F的化学方程式:(4)写出G和过量D溶液反应生成H的离子方程式:【归纳总结】无机推断题的解法及思路2、常见“突破口”归类解析突破角度一特殊的颜色突破角度二特殊的反应现象【典型例题】根据下图,指出A、B、C、D、E各是什么物质?写出各物质的化学式根据下列实验分别指出A、B、C、D、E各是什么物质。
A____,B____,C____,D____,E____。
【思考1、】常见的有色物质有哪些?【思考2、】常见的特征反应现象有哪些?【归纳总结1】1.唯一使湿润的红色石蕊试纸变蓝气体:2.使品红溶液褪色的气体:3. (由白色→灰绿色→红褐色):4.通CO2变浑浊的溶液:5.气体燃烧火焰呈苍白色:在空气中点燃火焰呈蓝色:6.使湿润的淀粉碘化钾试纸变蓝:7.焰色反应:8.在空气中变为红棕色:9.能使石灰水变浑浊:突破角度三特殊的反应条件突破角度四特殊的转化关系【真题演练2014】有关物质的转化关系如下图所示(部分物质和条件已略去)。
高三化学复习无机推断框图题总结

高三化学专题十一无机推测题部分立足基础找“题眼”1.题眼一:常有气体单质气体: H2、O2、N2、 Cl 2(黄绿色)、 F2(淡黄绿色)气态氢化物: NH3(无色、有刺激性气味,易液化,极易溶于水,能使润湿的红色石蕊试纸变蓝,碰到HCl 形成白烟) HCl(无色、有刺激性气味,极易溶于水,能使润湿的蓝色石蕊试纸变红,在空气中形成白雾,碰到 NH3形成白烟) H2S(无色、有臭鸡蛋气味,蛋白质腐败的产物,能溶于水,能使润湿的醋酸铅试纸变黑)非金属气态氧化物:CO、CO2(直线型非极性分子)、NO(碰到空气变红棕色)、NO2(红棕色,加压、降温会转变为无色N2O4)、 SO2(无色、有刺激性气味、能使品红溶液退色)[ 固态氧化物 ] : SO3(无色晶体、易挥发)、 P2O5(白色固体、易吸湿,常用作干燥剂)、SiO2(不溶于水、不溶于一般酸的高熔点固体,但溶于氢氟酸和强碱溶液)气态卤代烃:一氯甲烷(CH3Cl )、氯乙烯( CH2= CHCl)气态醛:甲醛(HCHO)2.题眼二:气体溶解性概括难溶于水的: H2、N2、CO、NO、CH4、C2H4;微溶于水的:O2、C2H2;能溶于水的:Cl 2( 1 : 1)、H2S( 1 :2.6 )、SO2( 1 : 40);极易溶于水的:NH3( 1 : 700)、HCl(1 : 500)、HF、HBr、HI。
3.题眼三:常有液态物质无机物:液溴Br 2、水( H2O)、过氧化氢(H2O2)、二硫化碳(CS2)、三氯化磷(PCl 3)有机物:一般 5 个碳原子以上的初级烃;除一氯甲烷、氯乙烯以外的初级卤代烃;初级醇;除甲醛以外的初级醛;初级羧酸;初级酯。
4.题眼四:常有物质的颜色①红色: Fe(SCN)3(红色溶液);Cu2O(红色固体); Fe2O3(红棕色固体);液溴(深红棕色);Fe(OH)3(红褐色固体); Cu (紫红色固体);溴蒸气、 NO2(红棕色)②紫色: Fe3+与苯酚反响产物(紫色);I2(有金属光彩紫黑色固体)KMnO4固体(紫黑色); MnO4—(紫红色溶液)钾的焰色反响(紫色)I 2蒸气、 I 2在非极性溶剂中(紫色)③橙色:溴水(橙色)K2Cr 2O7溶液(橙色)④黄色: AgI (黄色固体); AgBr (淡黄色固体);FeS2(黄色固体);Na 2O2(淡黄色固体);S(黄色固体);I 2的水溶液(黄色);Na 的焰色反响(黄色);工业浓盐酸(黄色)(含有 Fe3+);Fe3+的水溶液(黄色);久置的浓硝酸(黄色)(溶有分解生成的NO);浓硝酸粘到皮肤上2(天然蛋白质)(显黄色);1⑥棕色: FeCl 3 固体(棕黄色) ; CuCl 2 固体(棕色)2422+2 变蓝色; Cu(OH) 2溶于多羟基 ⑦蓝色: Cu(OH) 、 CuSO ·5H O 、 Cu 在水溶液中(蓝色) ; 淀粉遇 I 化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色) ; ⑧黑色: FeO ; Fe 3O 4; FeS ;CuO ; CuS ; Cu 2S ; MnO 2; C 粉; Ag 2 S ; Ag 2O ;PbS ;AgCl 、AgBr 、AgI 、AgNO 3光照分解均变黑;绝大多半金属在粉末状态时呈黑色或灰黑色。
专题 无机推断

三、根据特征转化关系推断
• 知识准备: • 1、一般思路是找出特别的变化关系,用可能的几 种情况试探,得出合理答案. • 2、掌握一些特别的连续变化关系 • A为NH3、H2S、S、CH4、C、Na, D为O2; • A为Cl2,D为Fe; • A为Al3+,D为OH- A为AlO2-,D为H+ • A为C, D为H2O • A为HNO3,D为Fe • A为NaOH D为CO2(SO2)
专题 无机推断
(一)无机框图推断题
解题思路
• 无论推断题属于哪种物质形式,均 遵循这样的推理思路:迅速浏览、 整体扫描、产生印象、寻找突破口 、注意联系、大胆假设、全面分析 (正推或逆推)、验证确认。解题的 关键是仔细审题,依物质的特性或 转化特征来确定“突破口”,顺藤 摸瓜。
框图题的“题眼”主要有以下几方 面
1、物质的特有颜色; 2、特征反应现象; 3、特征转化关系; 4、特殊反应条件; 5、重要工业生产反应;
一、根据物质的特有颜色推断
• 常见的有颜色的物质 • 黄色:S、Na2O2、AgBr、AgI久置的浓硝酸(溶有NO2)、工业盐酸( 含Fe3+); • 白色:无水CuSO4、AgCl、BaSO4、CaCO3、Al(OH)3、Mg(OH)2 黑色粉末、晶体:MnO2、Fe3O4、CuS、C、CuO;FeS 、 • 紫黑色固体:KMnO4、I2; 红色固体:Cu、Cu2O; • 红棕色粉末:Fe2O3、红磷; 红褐色沉淀:Fe(OH)3; • 红棕色气体:Br2、NO2;紫红色溶液:MnO4-;红色溶液Fe(SCN)3 • 橙(红)色溶液:Br2水(Br2CCl4溶液);蓝色晶体CuSO4•5H2O; 蓝 色沉淀:Cu(OH)2; 蓝色溶液:Cu2+;浅绿色溶液:Fe2+; 棕黄色溶 液:Fe3+; 黄绿色气体:Cl2。 • 火焰:淡蓝色:H2、CO、CH4、S在空气、S在纯氧(蓝紫色) 苍白色 :H2在Cl2中燃烧. 黄色:Na的燃烧 棕色的烟:CuCl2 白色的烟:HCl 与NH3反应
“无机框图推断题”题眼集锦

“无机框图推断题”题眼集锦方法一:根据物质的特殊颜色或状态推断 1.有色固体或沉淀:淡黄色:S 、Na 2O 2、FeS 2、AgBr ;黄色:AgI 、Ag 3PO 4 、Au ;红色固体:Cu Cu 2O ;红棕色粉末:Fe 2O 3、红磷;红褐色:Fe(OH)3;蓝色沉淀:Cu(OH)2;蓝色晶体:CuSO 4·5H 2O ;黑色粉末、晶体、沉淀:C 、Fe 粉、MnO 2、CuO 、FeO 、Fe 3O 4(磁性)、Ag 2O 、CuS 、Cu 2S 、 PbS ;黑色块状固体:FeS ;紫黑色:KMnO 4、I 2;白色胶状:H 2SiO 3、Al(OH)3;白色沉淀: BaSO 4、AgCl (二者不溶于酸)、CaCO 3、CaSO 3、BaCO 3、BaSO 3、MgCO 3、Mg(OH)2、Fe(OH)2。
2.有色溶液: Cu 2+蓝、 MnO 4-紫红、Fe 2+ 浅绿、Fe 3+ 棕黄、Fe (SCN )3 血红、Cr 2O 72-橙红、CrO 42-黄色、Cr 3+绿色。
氯水浅黄绿色、溴水橙黄色、碘水棕黄色、溴的有机溶液橙红或红棕色、I 2的有机溶液紫红色3.有色气体:F 2(淡黄绿色),Cl 2(黄绿色),NO 2(红棕色),溴蒸气(红棕色)、I 2蒸气(紫色)、O 3(淡蓝色)。
其余均为无色气体。
4.物质的状态、硬度等: 常温呈液态的金属单质:Hg 呈液态的非金属单质:Br 2 呈液态的化合物:H 2O (无色液体)、H 2O 2、H 2SO 4(无色油状)、HNO 3 常温呈气态的单质:H 2、O 2、Cl 2、N 2、F 2、稀有气体等。
方法二、根据特征反应现象或特殊性质推断1.焰色反应:Na +(黄色)、K +(紫色)(透过蓝色钴玻璃)2.与燃烧有关的现象:火焰颜色:苍白色:H 2在Cl 2中燃烧; (淡)蓝色:H 2、CH 4、CO 、H 2S 、C 2H 5OH等在空气中燃烧明亮的蓝紫色火焰:S 在纯氧中燃烧 黄色:Na 在Cl 2或空气中燃烧;烟的颜色:棕黄(或棕褐)色烟: Cu (或Fe )在Cl 2中燃烧 明亮火焰,浓烈黑烟:C 2H 2(C 6H 6)+O 2 白色烟雾:P 在Cl 2中燃烧。
高三化学无机框图推断专题

高三化学无机框图推断专题第1题:第2题:无色晶体A与黑色固体B可发生如下图所示的反应,除图中所示物质及反应条件外,其余反应物或生成物及反应条件均已略去。
其中D、L为固态单质,C、H为气态单质。
J的焰色反应为紫色。
第3题:如下图示:A、E、H是白色固体,且H不溶于水;G是一种微溶于水的白色固体;B、D、F是无色气体,且B能使湿润的红色石蕊试纸变蓝;C在常温下呈液态。
第4题:甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,它们之间存在如下转化关系:A与丙反应时,若A过量,则生成C和乙;若丙过量,则生成B和乙。
已知乙是双原子分子中键能最大的分子,C为固体。
(1)写出下列物质的化学式:甲.__________,丙.__________,C.__________。
(2)写出A过量时丙与A反应的化学方程式:____________________。
(3)向C的溶液中加入镁粉有甲生成,其原因是____________________。
第5题:甲、乙、丙是三种常见的单质,X、Y、Z是三种常见的化合物,它们在一定条件下的相互转化关系如右图所示:请填写以下空白:(1)在X、Y、Z三种化合物中肯定含有乙、丙两种元素的化合物是___________。
(2)当X为两种非金属元素组成的化合物时,写出X跟甲反应的化学反应方程式: ________________,丙跟乙反应的化学反应方程式:___________。
(3)当X为金属元素与非金属元素组成的化合物时,写出X跟甲反应的离子方程式。
第6题:下图的转化关系的每一方框表示有关的反应物或生成物,其中A 是由短周期元素组成的化合物。
第7题:图中的每一个子母表示一种物质或者同种物质不同浓度的溶液。
已知D 是一种盐,焰色反应呈浅紫色,E 、F 常温下是气体。
第8题:根据图2-2-1关系,确定A 、B 、C 、D 、E 、F 的化学式第9题:根据图2-2-2,指出A 、B 、C 、D 、E 各是什么物质 第10题:A 、B 、C 、D 分别是NaNO 3、NaOH 、HNO 3、Ba(NO 3)2中的一种。
无机框图题推断

B +E
催化剂,加热
D
F
E
+B +G
I
通电
+G
C
点 燃
H
加热
+G
高温
请按要求填空: CO2 H ____ O ; C: _____________ NH (1)写出下列物质的化学式:A: ___ 。 3 ; B: 2 (2)写出A→D的化学方程式 。 4NH +5O = 4NO+6H O
3 2 2
在实验室中引发反应④的操作是_
加少量KClO3,插上镁条并将其点燃。
(4)反应⑥的离子方程式是
2Al+2OH-+2 H2O =2AlO2-+3H2↑。
2.已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液 体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的 电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间 的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
(1)写出下列物质的化学式: A_____ ____ 。 NaAlO Al ___乙___ 2 (2)写出甲物质在工业上的任两种主要用途 耐高温材料、轴承 制取铝单质 ___。
(3)写出下列变化的化学方程式: ①A与NaOH溶液反应的化学方程式 _。
碱 NH NH 3 H 2 O 4 ⑵铵盐:
已知A为酸式盐,B为某二价主族金属元素的化合物, 常温常压下C、D、F、G、I均呈气态。等物质的量A、 B与少量的水充分混合能恰好完全反应。图中反应条 件(除高温外)均已略去。
(1)写出B的电子式 CH≡ CH ,D的结构简式 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题:“无机框图推断”题眼汇总【根据物质的特殊颜色推断】1.有色固体:白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3、铵盐淡黄色或黄色:S 黄或浅黄、FeS2黄、AgI 黄、Na2O2 浅黄、AgBr 浅黄。
红色或红棕色:Cu 紫红、Cu2O 红、Fe2O3红棕色、Fe(OH)3红褐色。
黑色:C、CuS、Cu2S 、FeS 、MnO2、FeO、Fe3O4(磁性物质)、CuO、PbS紫黑色:I2紫黑:KMnO4 。
2.有色溶液:Cu2+蓝、MnO4-紫红、Fe2+浅绿、Fe3+ 棕黄、Fe(SCN)3血红。
氯水:浅黄绿色、溴水:橙黄色、碘水:棕黄色、溴的有机溶液:橙红—红棕、I2的有机溶液:紫红。
3.气体小结(1)有颜色的气体:F2(淡黄绿色),Cl2(黄绿色),NO2(棕色),溴蒸气(红棕色)、I2(紫色)、O3(淡蓝色)。
其余均为无色气体。
(2)有刺激性的气体:HF,HCl,HBr,HI,NH3,SO2,NO2,F2,Cl2,溴蒸气。
有臭鸡蛋气味的气体:H2S (3)易溶于水的气体:HF,HCl,HBr,HI,NH3,SO2和NO2。
能溶于水的气体:CO2,Cl2,H2S和溴蒸气。
(4)易液化的气体:NH3,SO 2,Cl2(5)有毒的气体:F2,HF,Cl2,H2S,SO2,CO,NO,NO2和溴蒸气。
(6)在空气中易形成白雾的气体:HF,HCl,HBr,HI(7)常温下由于发生化学反应而不能共存的气体:H2S和SO2,H2S和Cl2,HI和Cl2,NH3和HCl,NO和O2,F2和H2(8)其水溶液呈酸性且能使紫色石蕊试液变红色的气体:HF,HCl,HBr,HI,H2S,SO2,CO2,NO2和溴蒸气。
可使紫色石蕊试液先变红后褪色的气体:Cl2。
可使紫色石蕊试纸变蓝且水溶液呈弱碱性的气体:NH3(9)漂白作用的气体:Cl2(有水时)和SO2。
(10)能使澄清石灰水变浑浊的气体:CO2,SO2,HF。
(11)能使无水CuSO4变蓝的气体:水蒸气。
(12)在空气中可燃的气体:H2,CH4,C2H2,C2H4,CO,H2S。
在空气中点燃后火焰呈淡蓝色的气体:H2S,CH4,CO,H2 ;气体燃烧呈苍白色:H2在Cl2中燃烧。
(13)具有氧化性的气体:F2,Cl2,溴蒸气,NO2,O2。
具有还原性的气体:H2S,H2,CO,NH3,HI,HBr,HCl,NO。
SO2和N2通常既可显示氧化性又可显示还原性。
(14)与水可发生反应的气体:Cl2,F2,NO2,溴蒸气,CO2,SO2,NH3。
其中Cl2,F2,NO2,溴蒸气和水的反应属于氧化还原反应。
(15)在空气中易被氧化变色的气体:NO。
(16)能使湿润的KI淀粉试纸变蓝的气体:Cl2,NO2,溴蒸气。
(17)遇AgNO3溶液可产生沉淀的气体:H2S,Cl2,溴蒸气,HCl,HBr,HI,NH3 。
其中NH 3通入AgNO 3溶液产生的沉淀当NH 3过量时会溶解。
(18)能使溴水和酸性KMnO 4溶液褪色的气体:H 2S ,SO 2,C 2H 2,C 2H 4。
(19)由于化学性质稳定,通常可作为保护气的气体:N 2和Ar 。
(20)制得的气体通常为混合气的是:NO 2和N 2O 4。
4.物质的状态、气味、硬度等:(1)呈液态的金属单质:Hg 呈液态的非金属单质:Br 2 呈液态的化合物:H 2O (2)常温呈气态的单质:H 2、O 2、Cl 2、N 2、F 2、稀有气体等。
(3)地壳中元素的含量:O 、Si 、Al 、Fe 、 硬度最大的单质:C (金刚石) (4)形成化合物种类最多的元素: C【根据特征反应现象推断】1.特征反应现象(1)])([])([32OH Fe OH Fe 红褐色白色沉淀空气−−→−(由白色→灰绿→红褐色) (2)在空气中变为红棕色:NO(3)遇酚酞显红色或湿润红色石蕊试纸变蓝的气体:NH 3(碱性气体) (4)使湿润的淀粉碘化钾试纸变蓝:Cl 2、Br 2、FeCl 3、碘水等。
(5)通CO 2变浑浊:石灰水(过量变清)、Na 2SiO 3、饱和Na 2CO 3、浓苯酚钠、NaAlO 2 (6)与H 2S 反应生成淡黄色沉淀的气体有Cl 2、O 2、SO 2、NO 2 (7)电解时阳极产生的气体一般是:Cl 2、O 2,阴极产生的气体是:H 2 (8)两种气体通入水中有沉淀的是2H 2S+SO 2=3S+2H 2O(9)同一元素的气态氢化物和最高价氧化物对应的水化物生成盐的元素一定是氮(NH 4NO 3) (10)两种溶液混合生成沉淀和气体,这两种溶液的溶质可能是①Ba(OH)2与(NH 4)2SO 4或(NH 4)2CO 3或(NH 4)2SO 3②强烈双水解 ③可溶性铁盐与可溶性碳酸盐或碳酸氢盐 ④Na 2S 2O 3溶液与强酸(11)能使溴水褪色的物质:H 2S 和SO 2及它们相对应的盐、活泼金属、不饱和烃、醛、酚、碱 (12)两物质反应先沉淀后溶解的有:CO 2与Ca(OH)2或Ba(OH)2、NaOH 与铝盐、氨水与AgNO 3、强酸与偏铝酸盐【依据特征结构】1.正四面体型分子:CH 4、SiH 4、CCl 4、SiCl 4、P 4等。
2.直线型分子:乙炔、二氧化碳、二硫化碳等。
3.平面型分子: 苯、乙烯等。
4.含有非极性共价键的离子化合物:过氧化钠(Na 2O 2)、二硫化亚铁(FeS 2)、CaC 2等。
5.含有10个电子的粒子:离子:O 2—、F —、Ne 、Na +、Mg 2+、Al 3+、NH 4+、H 3O +、OH —、 NH 2—()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+32322323233222与OH Al AlO OH Al S H HS S OH Al CO HCO CO Al O H O H O H分子:CH4、NH3、H2O 、HF6.电子总数为18的粒子:分子:Ar、F2、SiH4、PH3、H2S、HCl、H2O2、C2H6、CH3OH、N2H4等;离子:K+、Ca2+、HS—、S2—、Cl—、O22—7.9个电子的粒子:—OH、—CH3、—NH2、F【根据特殊反应条件推断】1、高温条件: C +H2O H2 +CO ,C +2H2O CO2 +2H2,3Fe +4H2O Fe3O4 +4H2 ,CaCO3 CaO +CO2 ,SiO2 +CaCO3 CaSiO3 +CO2 ,SiO2 +2C高温Si +2CO↑,SiO2 +Na2CO3高温Na2SiO3 +CO2 ,4FeS2 +11O2高温2Fe2O3 +8SO2,2、高温、高压、催化剂:N2 +3H2催化剂高温高压2NH33、催化剂、加热:4NH3 +5O2 催化剂△4NO +6H2O 2SO2 +O2催化剂加热2SO32KClO3MnO2△2KCl +3O2↑2H2O2MnO2△2H2O +O2↑4、放电:N2 +O22NO 3O22O35、电解:2NaCl +2H2O电解2NaOH +H2↑+Cl2↑ 2 NaCl(熔融)电解2 Na +Cl2↑Mg Cl2(熔融)电解Mg +Cl2↑【根据特征转化关系推断】知识准备:1.一般思路是找出特别的变化关系,用可能的几种情况试探,得出合理答案.2.掌握一些特别的连续变化关系(1)①②③④(2)A—A为弱酸的铵盐:(NH4)2CO3或NH4HCO3 ;(NH4)2S或NH4HS ;(NH4)2SO3、NH4HSO3(3)形如的反应,中学化学里常见的有:()⎪⎪⎩⎪⎪⎨⎧↑+↑+−−→−↑+−−→−↑+↑−−→−22232222HClNaOHNaClOAlOAlOHOH电解电解电解溶液熔融)(222酸或碱DCBA OHOO−−→−−→−−→−323222HNONONONH OHOO−−→−−→−−→−(气体)42322222SOHSOSOSH OHOO−−→−−→−−→−(气体)322222COHCOCOC OHOO−−→−−→−−→−(固体)NaOHONaONaNa OHOO−−→−−→−−→−222222(固体)⎪⎩⎪⎨⎧−−→−−−→−CB气体气体强碱强酸(4)非金属→金属 4、与碱反应产生气体⑴ ⑵铵盐:O H NH NH 234+↑−→−+碱5、与酸反应产生气体⑴ ⑵6、既能酸反应,又能与碱反应Al 、Al 2O 3、Al(OH)3 ; 弱酸的酸式盐(NaHCO 3、NaHSO 3、NaHS 等);弱酸的氨盐[NH 4HCO 3、(NH 4)2CO 3、NH 4HSO 3、 (NH 4)2SO 3、 (NH 4)2S 、NH 4HS 等;氨基酸等。
7、与水反应产生气体(1)单质 (2)化合物8、气体反应特征(1)苍白色:H 2在Cl 2中燃烧; (2)蓝色:CO 在空气中燃烧; (3)淡蓝色:H 2S 、H 2、CH 4、CH 3CH 2OH 、S 等在空气中燃烧; (4)明亮的蓝紫色:S 在纯氧中燃烧; (5)金属的焰色反应 9、烟、雾(1)在空气中形成白雾的:HCl 、HBr 、HI 、NH 3等气体及浓盐酸、浓硝酸;(2)相遇形成白烟或固体的:NH 3+HCl 、NH 3+HBr 、NH 3+HNO 3、H 2S+SO 2、H 2S+Cl 2;()()()⎪⎪⎩⎪⎪⎨⎧↑−→−↑−→−↑−→−+++------2323222323SO HSO SO S H HS S CO HCO CO H H H 化合物⎪⎩⎪⎨⎧+−−→−++−−→−+222CO C O H H 金属金属氧化物金属金属氧化物高温高温⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na ⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na(3)燃烧时出现白色烟雾的:(P+Cl 2); (4)燃烧时出现棕黄色烟的:(CuCl 2)。
