溶液配制步骤及练习汇编

一.用容量瓶配制溶液所用仪器:
1、烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、分析天平、药匙(固体溶质使用)、移液管(液体溶质使用)
2、容量瓶
2.1、.构造:磨口、细颈、梨形平底
2.2、特点:①容量瓶上注明温度和容积。②容量瓶颈部有刻度线。
2.3、使用范围:专门用来配制一定体积、一定物质的量浓度的溶液。
2.4、注意事项:①使用前先检漏。②不可装热或冷的液体。③不能用来溶解固体物质或存放液体或进
行化学反应。
3、使用容量瓶六忌:一忌用容量瓶进行溶解(体积不准确),二忌直接往容量瓶倒液(会洒到外面);三忌加水超过刻度线(浓度偏低);四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高);五忌不洗涤玻璃棒和烧杯(浓度偏低);六忌标准溶液存放于容量瓶(容量瓶是量器,不是容器)。
二.用容量瓶配制溶液的步骤:
全过程有计算,称量,溶解,冷却,转移,洗涤,定容,摇匀/装瓶八个步骤
八字方针:计,量,溶,冷,转,洗,定,摇
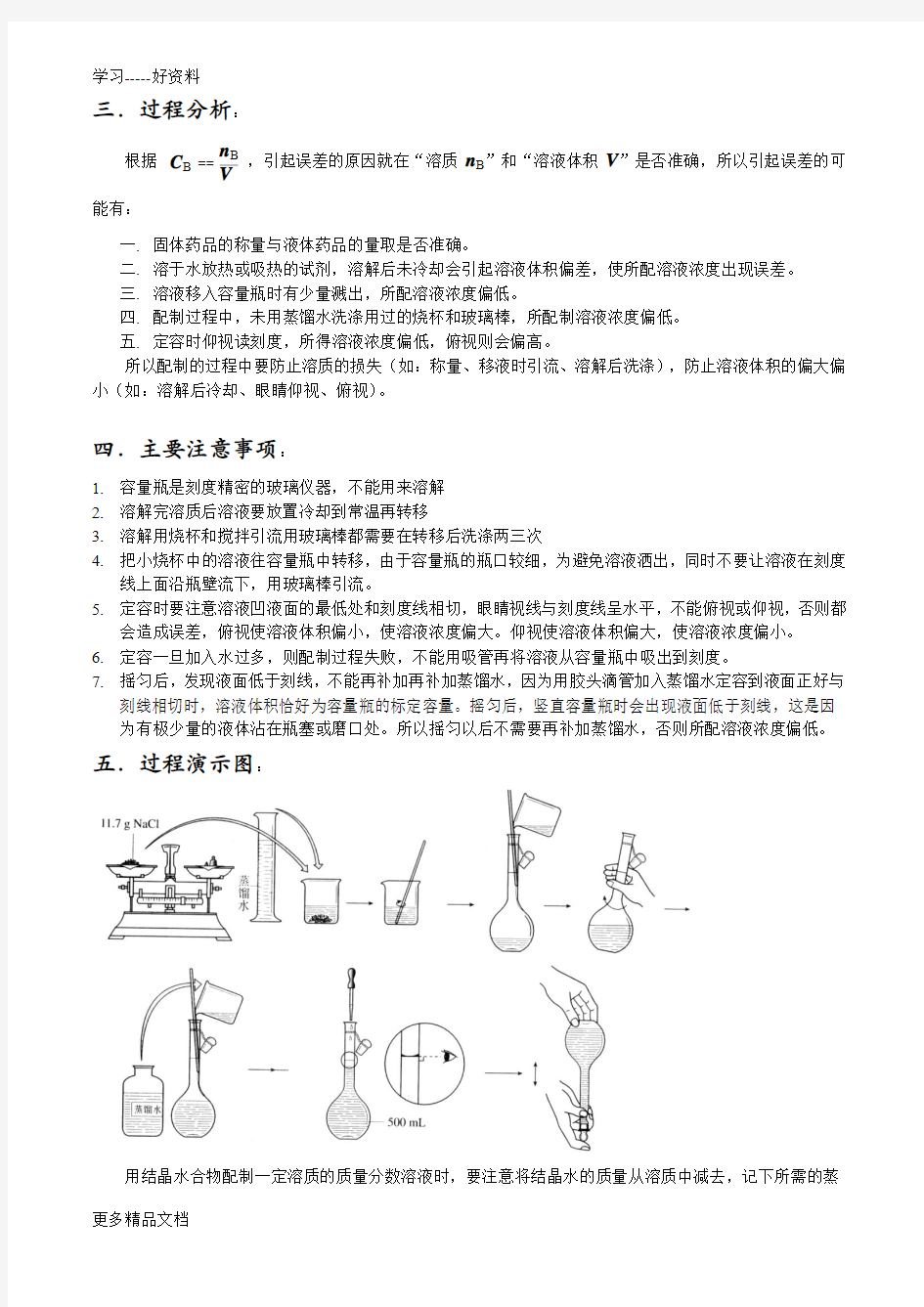
以0.1mol/LNaCO3溶液500ml为例说明溶液的配制过程
1.计算:NaCO3物质的量=0.1mol/L×0.5L=0.05mol,由NaCO3摩尔质量106g/mol, 则NaCO3质量=0.05mol ×106g/mol=5.3g
2.称量:用分析天平称量5.300g,注意托盘天平、分析天平的使用。
3.溶解:在烧杯中用100ml蒸馏水使之完全溶解,并用玻璃棒搅拌(注意:应冷却,不可在容量瓶中溶解)
4.转移,洗涤:把溶解好的溶液移入500ml容量瓶,,由于容量瓶瓶口较细,为避免溶液洒出,同时不要让溶液在刻度线上面沿瓶壁流下,用玻璃棒引流。为保证溶质尽可能全部转移到容量瓶中,应该用蒸馏水洗涤烧杯和玻璃棒二、三次,并将每次洗涤后的溶液都注入到容量瓶中。轻轻振荡容量瓶,使溶液充分混合。(用玻璃棒引流)
5.定容:加水到接近刻度2-3厘米时,改用胶头滴管加蒸馏水到刻度,这个操作叫定容。。定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视或仰视,否则都会造成误差
6.摇匀:定容后的溶液浓度不均匀,要把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次,使溶液混合均匀。这个操作叫做摇匀。
7.贴上标签:把定容后的Na2CO3溶液摇匀。把配制好的溶液倒入试剂瓶中,盖上瓶塞,贴上标签。
问题:在配制溶液的过程中哪些操作可能引起溶液浓度的误差?
三.过程分析:
根据 ,引起误差的原因就在“溶质n B ”和“溶液体积V ”是否准确,所以引起误差的可能有:
一. 固体药品的称量与液体药品的量取是否准确。
二. 溶于水放热或吸热的试剂,溶解后未冷却会引起溶液体积偏差,使所配溶液浓度出现误差。
三. 溶液移入容量瓶时有少量溅出,所配溶液浓度偏低。
四. 配制过程中,未用蒸馏水洗涤用过的烧杯和玻璃棒,所配制溶液浓度偏低。
五. 定容时仰视读刻度,所得溶液浓度偏低,俯视则会偏高。
所以配制的过程中要防止溶质的损失(如:称量、移液时引流、溶解后洗涤),防止溶液体积的偏大偏小(如:溶解后冷却、眼睛仰视、俯视)。
四.主要注意事项:
1.
容量瓶是刻度精密的玻璃仪器,不能用来溶解 2.
溶解完溶质后溶液要放置冷却到常温再转移 3.
溶解用烧杯和搅拌引流用玻璃棒都需要在转移后洗涤两三次 4. 把小烧杯中的溶液往容量瓶中转移,由于容量瓶的瓶口较细,为避免溶液洒出,同时不要让溶液在刻度
线上面沿瓶壁流下,用玻璃棒引流。
5. 定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视或仰视,否则都
会造成误差,俯视使溶液体积偏小,使溶液浓度偏大。仰视使溶液体积偏大,使溶液浓度偏小。
6. 定容一旦加入水过多,则配制过程失败,不能用吸管再将溶液从容量瓶中吸出到刻度。
7. 摇匀后,发现液面低于刻线,不能再补加再补加蒸馏水,因为用胶头滴管加入蒸馏水定容到液面正好与
刻线相切时,溶液体积恰好为容量瓶的标定容量。摇匀后,竖直容量瓶时会出现液面低于刻线,这是因为有极少量的液体沾在瓶塞或磨口处。所以摇匀以后不需要再补加蒸馏水,否则所配溶液浓度偏低。
五.过程演示图:
用结晶水合物配制一定溶质的质量分数溶液时,要注意将结晶水的质量从溶质中减去,记下所需的蒸C B == n B  ̄
V
馏水的质量中。如果用液体溶质配制溶液,需先根据溶质的密度计算出一定质量的溶质的毫升数,再用量筒来量取溶质的体积,其他操作方法及顺序与固体溶质相同。
1.在容量瓶上无需有标记的是
A .标线
B .温度
C .浓度
D .容量
2.某实验需要0.2 mol NaOH 固体,用托盘天平称取固体时,天平读数(游码及砝码)将
A .等于8.0g
B .等于8.00g
C .大于8.0g
D .等于0.2g
3.0.5L 1mol/L 的FeCl 3溶液与0.2L 1 mol/L 的KCl 溶液中,Cl -浓度比为
A .15∶2
B .1∶1
C .3∶1
D .1∶3
4.相对分子质量为M 的某物质在室温下的溶解度为S g ,此时测得饱和溶液的密度为ρg ·cm -3,则该饱和
溶液的物质的量浓度是
A .110-?L mol S M ρ
B .1)
100(1000-?+L mol S M S ρ C .110-?L mol M S ρ D .11000)100(-?+L mol S S M ρ
5.将标准状况下的a L HCl (气)溶于1000g 水中,得到的盐酸密度为b g/cm 3,则该盐酸的物质的量浓度
是
A .L mol a /4.22
B .L mol ab /22400
C .L mol a ab /5.3622400+
D .L mol a
ab /5.36224001000+
6.NA 为阿伏加德罗常数,下列关于0.2mol/L K2SO4溶液的正确说法是
A .500mL 溶液中所含K +、SO 42-总数为0.3N A
B .500mL 溶液中含有0.1N A 个K +离子
C .1L 溶液中K +离子浓度是0.2mol/L
D .2L 溶液中SO 42-离子浓度是0.4mol/L
7.取100mL 0.3mol/L 和300mL 0.25mol/L 的硫酸注入500mL 容量瓶中,加水稀释至刻度线,该混合溶液
中H +的物质的量浓度是
A .0.21mol/L
B .0.42mol/L
C .0.56mol/L
D .0.26mol/L
8.某Al 2(SO 4)3溶液V mL 中含a g Al 3+,取出V/4 mL 溶液稀释成4V mL 后,SO 42-的物质的量浓度为
A .125/54V mol ·L -1
B .125a/36V mol ·L -1
C .125a/18V mol ·L -1
D .125a/V mol ·L
-1
9.将2.4mol 某金属投入1.8L 2mol/L 的某酸溶液中,恰好完全反应,并产生7.2g 氢气,则该金属和酸分别是
A .二价金属,二元酸
B .二价金属,三元酸
C .三价金属,二元酸
D .一价金属,一元酸
10.配制一定体积、一定物质的量浓度的溶液,实验结果产生偏低影响的是
A .容量瓶中原有少量蒸馏水
B .溶解所用的烧杯未洗涤
C .定容时仰视观察液面
D .定容时俯视观察液面
11.有K 2SO 4和Al 2(SO 4)3的混合溶液,已知其中Al 3+的物质的量浓度为0.4mol/L ,SO 42-的物质的量浓度为
0.7mol/L ,则此溶液中K +的物质的量浓度为
A .0.1mol/L
B .0.15mol/L
C .0.2mol/L
D .0.25mol/L
12.在100g 浓度为18mol/L 、密度为ρ的浓硫酸中加入一定量的水稀释成9mol/L 的硫酸,则加入水的体积
A .小于100mL
B .等于100mL
C .大于100mL
D .等于mL ρ100
13.用密度为1.32g/cm 3的硫酸溶液逐滴滴入到BaCl 2溶液中,直到沉淀恰好完全为止。已知所生成的溶液
的质量等于原BaCl 2溶液的质量,则H 2SO 4溶液的浓度为
A .21.9%
B .42.1%
C .13.5mol/L
D .5.67mol/L
14.质量为8.02g 的铁片,放进1.0L 0.90mol/L 的CuSO 4溶液中,过一段时间取出洗净、干燥、称量,质量
为8.66g 。若认为溶液的体积没有变化,则Cu 2+的浓度变为
A .0.89mol/L
B .0.82mol/L
C .0.78mol/L
D .0.6mol/L
15.将4gNaOH溶解在10mL水中,稀至1L后取出10mL,其物质的量浓度是
A. 1mol/L
B. 0.1mol/L
C. 0.01mol/L
D. 10mol/L
16.用硫酸铜晶体配制500mL0.1mol/L的硫酸铜溶液,需要硫酸铜晶体的质量为
A. 25g
B. 12.5g
C. 6.25g
D. 37.5g
17.实验室常用98%(ρ=1.84g/mL)的浓H2SO4配制1:4的稀H2SO4,此稀H2SO4的密度为1.23g/mL,其物质的量浓度为
A. 4.6mol/L
B. 5.7mol/L
C. 3.88mol/L
D. 18.4mol/L
18.由Na2SO4和NaNO3组成的混合物88g溶于水配制成1L溶液,此溶液中Na+的浓度为1.2mol/L,则原混合物中NaNO3的质量为
A. 17g
B. 34g
C. 25.5g
D. 51g
