人教版高中化学选修4课堂学案第一章第一节第1课时焓变 反应热
化学选修四人教版第一章第一节化学反应与能量的变化学案第一课时

第一节化学反应与能量的变化第1课时焓变反应热班级姓名学号【学习目标】1.能够指出反应热焓变的定义;2.能够根据焓变的正负判断反应是吸热还是放热;3.能够说出反应热与键能及反应热与物质总能量之间的关系,并根据键能和物质总能量计算反应热。
预习案:【教材助读】1.阅读教材第一章导读部分填空:化学反应,不仅有___变化,还伴随___变化,其变化形式有。
2.想想必修二学过的知识填空:常见的放热反应有常见的吸热反应有3.阅读教材P2或P15,指出反应热的定义:(1)焓变:①概述:焓(H)是与内能有关的。
在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的即焓变(ΔH)决定。
②常用单位: (或 )。
(2)焓变与反应热的关系恒压条件下,反应的热效应等于焓变。
因此,我们常用表示反应热。
4.ΔH的正、负和吸热、放热反应的关系(1)放热反应:反应完成时,生成物释放的总能量反应物吸收的总能量的反应。
由于反应后放出热量(释放给环境)能使反应体系的能量,故ΔH_0(填“<”或“>”),即ΔH为 (填“正”或“负”)。
(2)吸热反应:反应完成时,生成物释放的总能量反应物吸收的总能量的反应。
由于反应时吸收环境能量而使反应体系的能量,故ΔH 0(填“<”或“>”),即ΔH为 (填“正”或“负”)。
【预习自测】1.下列各图中,表示正反应是吸热反应的图象是( )2.下列变化为放热反应的是()A.浓硫酸稀释B.形成化学键时共放出能量862KJ的化学反应C.H 2O(g)=H 2O(l) △H =—44.0kJ /molD. 2H 2(g)+O 2(g)===2H 2O(l) ΔH =-571.6 kJ/mol探究案:【学始于疑】1.反应热与物质所具有的总能量有什么关系,如何用总能量判断反应是吸热反应还是放热反应? 2反应热与键能有什么关系,如何用键能判断某反应是吸热反应还是放热反应?【质疑探究】探究一 反应热与物质总能量的关系若用E (反应物)表示反应物所具有的总能量,若用E (生成物)表示生成物所具有的总能量,则计算反应热的公式为ΔH =探究二 反应热与键能的关系1.从化学键的角度理解,化学反应为2.化学键断裂需要 能量,形成新的化学键需要 能量。
高中化学人教版选修4第一章第一节第一课时焓变反应热

只要不放弃努力和追求,小草也有点缀春天的 价值。 人生的成功不过是在紧要处多一份坚持,人生 的失败往往是在关键时刻少了坚持。
思考
1.化学反应中为何有能量变化?
2.是不是所有的化学反应都有能量的变化?为什么?
1.宏观:化学反应中能量变化的原因 ——反应物和生成物的总能量相对大小
能 量 反应物总能量高
释 放 能 量
生成物总能量低
反应进程
①反应物的总能量大于 生成物的总能量,反应放出能量。
②反应物总能量 小于 生成物总能量,反应吸收能量。
吸热反应:
1.判断正误(正确打“√”号,错误打“×”号)。 (1)化学变化过程是原子的重新组合过程。
√
(2)任何条件下,化学反应的焓变都等于化学反应的反应热。
(3)伴有能量变化的物质变化一定都是化学变化。
(4)化学反应中的能量变化都是以热能形式表现出来的。 (5)化学反应可分为吸热反应和放热反应。 (6)吸热反应过程是化学能转变为热能的过程。 (7)生成物总能量高于反应物总能量的反应是吸热反应。
若E(反应物)<E(生成物),则为吸热反应。 3)根据反应物和生成物的键能差判断。 若反应物的总键能大于生成物的总键能,则为吸热反应; 若反应物的总键能小于生成物的总键能,则为放热反应。
4)根据反应类型或具体的化学反应判断。如所有的燃烧反应、 酸、碱中和反应都属于放热反应。
1需要加热发生的反应一定是吸热反应吗?
差。即:ΔH =H(生成物)-H(反应物)
符号: ΔH 单位 :kJ/mol或 kJ· mol-1
2.反应热 (1)定义:化学反应过程中所释放或吸收的能量叫 做反应热。 符号: ΔH 单位 :kJ/mol或 kJ· mol-1 焓变和反应热是什么关系? 在恒压条件下进行的反应,其反应热就是焓 说明: 变.因此它们的符号均为ΔH,单位也相同.
人教版高二化学选修四 第一章 第一节 第一课时 焓变 反应热(共16张PPT)

能量 生成物释放的总能量 大于 反应 生成物释放的总能量 小于
变化 物吸收的总能量
反应物吸收的总能量
键能 变化
联系
生成物总键能大于反应物总键 生成物总键能小于反应物总
能
键能
键能越大,物质能量越低,越 稳定,反之键能越 小,物质 能量越高,越不稳定。
活化分子
E1 化学键断裂所吸收能量
反应物
反应热 生成物
常见的放热反应和吸热反应
放热反应
所有的燃烧 中和反应 溶液里的置换 一应般的化合反 热反应
一般的分解
特殊的化合
练习
例 1:1molC与1molH2O(g)反应生成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H=
+131.5 kJ/mol。
升高
规定放热反应是△H<0
是从哪个角度出发的? 体系
★判断一个反应是吸热反应还是放热反应的方法:
Ⅰ:H反应物和H生成物的相对大小△H= H生 - H反
若:△H > 0,则为吸热反应,△H为“+”, Q<0 △H < 0,则为放热反应,△H为“-”, Q>0
Ⅱ:成反新应化物学分键子时断释键放时的吸能收量的Σ生总的能相量对Σ大反与小生成物分子形 △H= Σ反- Σ生
旧键断裂需要吸收能量,
新键形成需要放出能量。
而一般化学反应中,旧键的断裂所吸收的 总能量与新键形成所放出的总能量是不相等的 ,而这个差值就是反应中能量的变化。所以化 学反应过程中都会有能量的变化。
化学反应过程中所释放或吸收的能量,都可以用 热量(或换算成相应的热量)来表述,叫做反应 热,在恒压条件下又称为焓变。
第一章 第一节 化学反应与能量的变化
人教版高中化学选修四第一章学案

第一章第一节化学反应与能量的变化(第1课时)学案班次姓名教学目标:1.了解焓变的含义2.理解反应热与焓变的关系,与键的断裂与生成的关系教学重点:反应热与焓变的关系。
教学内容:问题一:化学反应中的能量变化⑴放热反应与吸热反应物质发生化学反应时常伴有_______________,在一般化学反应里,常表现_______________________________。
常见的放热反应有_______________________、___________________。
常见的吸热反应有_______________________、___________________。
⑵化学反应中的能量变化的本质原因问题二:1.焓和焓变(1)焓(2)焓变(ΔH)2.反应热⑴定义:在化学反应过程中放出或吸收的热量,通常叫反应热⑵符号:用_________表示⑶单位;一般采用_______________。
⑷可直接测量,测量仪器叫量热计⑸反应热产生的原因(微观讨论)P2-3 以H2(g) + Cl2(g) = 2HCl(g)为例:①化学键断裂时需要_________________,②化学键形成时需要_________________。
____________________________________________即为反应热(6)反应热表示方法反应热是表示化学反应过程中整个体系的能量(即焓)增加或者减少的量值,ΔH =H 产物—H 反应物思考:焓增加----吸热-----则用“ ”表示;焓减少-----放热------则用“ ”表示。
(填“+”或“—”)练习:1. 1molC 与1molH 2O(g)反应生成1molCO(g)和1molH 2(g),需吸收131.5kJ 的热量,该反应的反应热为△H= kJ/mol 。
2. 拆开1molH —H 键、1molN —H 键、1molN ≡N 键分别需要的能量是436kJ 、391kJ 、946kJ ,则1molN 2生成NH 3的反应热为 ,1mol H 2生成NH 3的反应热为 。
选修4 第一章第一节第1课时

【任务2】认真阅读教材第2页到第3页的内容,分别完成下列任务:
1.什么是焓?什么是焓变?焓变的符号、单位分别是什么?
2.分析教材第2页图1-1,试计算反应H2(g)+Cl2(g) 2HCl(g)的能量变化。
【总结】从化学键的角度
课题人教版选修4第一章化学反应与能量
第一节第1课时——焓变反应热
学习目标
1.能从能量转化的角度分析吸热和放热反应的原因。
2.理解反应热和焓变的含义、符号及单位。
3.了解△H大小的两种判断方法。
学习重点
1.从能量转化的角度分析吸热和放热反应的原因;
2.理解反应热和焓变的涵义、符号及单位;
3.掌握△H大小的两种判断方法。
(1)当E1>E2时,反应;
(2)当E1<E2时,反应。
反应热产生的原因
【作业布置】
1.优化设计第2页成功体验1,第3页成功体验2,成功体验3
2.优化设计第3页随堂检测1、2、3、4
学习难点
1.由能量转化的原因分析吸热反应和放热反应。
2.掌握△H大小的种判断方法。
学习方法
交流讨论知识归纳
学习过程
教师导案
【任务1】阅读教材第一章的前言,认真领会其中的含义,回答下列问题:
1.化学反应过程中,除了物质的变化外,一定还伴随着什么变化?
2.根据化学反应中的能量变化,我们将化学反应分为哪两类?常见的放热反应和吸热反应有哪些?
人教版高中化学选修四第一章第一节第1课时.docx

高中化学学习材料唐玲出品第一章化学反应与能量第一节化学反应与能量的变化第1课时焓变反应热[目标要求] 1.了解反应热的概念,知道化学反应、热效应与反应的焓变之间的关系。
2.知道反应热与化学键的关系。
3.知道反应热与反应物、生成物总能量的关系。
焓变反应热在化学反应过程中,不仅有物质的变化,同时还伴有能量变化。
1.焓和焓变焓是与物质内能有关的物理量。
单位:kJ·mol-1,符号:H。
焓变是在恒压条件下,反应的热效应。
单位:kJ·mol-1,符号:ΔH。
2.化学反应中能量变化的原因化学反应的本质是反应物分子中旧化学键断裂和生成物生成时新化学键形成的过程。
任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。
ΔH=反应物分子的总键能-生成物分子的总键能。
3.放热反应与吸热反应当反应完成时,生成物释放的总能量与反应物吸收的总能量的相对大小,决定化学反应是吸热反应还是放热反应。
(1)当ΔH为“-”或ΔH<0时,为放热反应,反应体系能量降低。
(2)当ΔH为“+”或ΔH>0时,为吸热反应,反应体系能量升高。
4.反应热思维模型(1)放热反应和吸热反应放热反应吸热反应(2)反应热的本质(以H2(g)+Cl2(g)===2HCl(g)ΔH=-186 kJ·mol-1为例)E1:E(H—H)+E(Cl—Cl)E2:2E(H—Cl)ΔH=E1-E2知识点一有关反应热的概念1.下列说法正确的是( )A.需要加热才能发生的反应一定是吸热反应B.放热反应在常温下一定很容易发生C.吸热反应在一定的条件下也能发生D.焓变的符号是ΔH,单位是kJ·mol-1,反应热的单位是kJ答案 C2.已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。
人教版高中化学选修4-1.1《焓变_反应热》参考教案
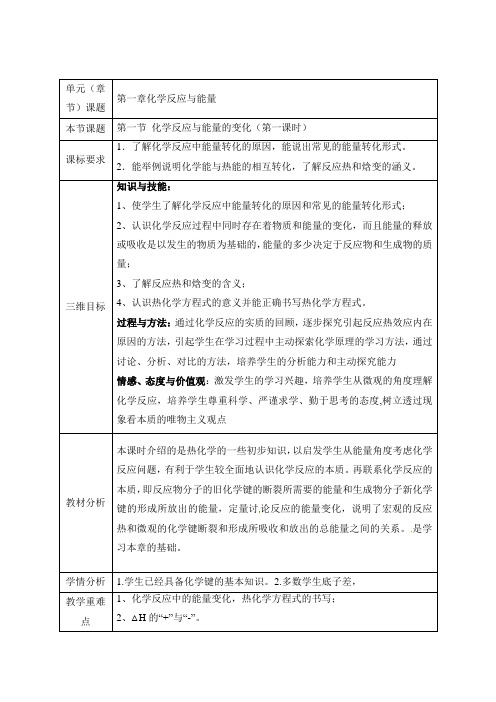
H2(g)+I2(g) ==== 2HI (g) ΔH=-14.9 kJ/mol
101 kPa
[板书]热化学方程式的书写:
1、状态(s、l、g、aq);
2、ΔH的“+”、“-”不能省略 ;
3、ΔH的数值与反应的系数成比例;
4、不需要注明反应的条件。
[回忆]化学键在形成和断裂的过程中能量的变化
[提问]当水从液态变成气态的时候能量是如何变化的?能否从微观的角度解释能量变化 的原因?
[分析]虽然力的种类和大小不同,但是本质都一样,就是形成作用力时要放出能量;破坏作用力时要吸收能量
[结论]物质的变化常常伴随能量的变化
[探讨]给出具体实例,图例,请学生分析图中包含的信息
[引导]现在大家看到的都是直观和表面的信息,有没有更深层次的信息?或者我们将得到的信息稍稍处理一下,能否得到更有价值的信息呢?。
[分析]给出反应热的定义
[质疑]Q是什么?H又是什么?△H又是什么?
[分析]化学 反应都伴随能量的变化,所以可以将化学反应分为两类
分析反应热之前,先弄清楚两个概念:环境和体系
教材分析
本课时介绍的是热化学的一些初步知识,以启发学生从能量角度考虑化学反应问题,有利于学生较全面地认识化学反应的本质。再联系化学反应的本质,即反应物分子的旧化学键的断裂所需要的能量和生成物分子新化学键的形成所放出的能量,定量讨 论反应的能量变化,说明了宏观的反应热和微观的化学键断裂和形成所吸收和放出的总能量之间的关系。 是学习本章的基础。
能量
[举例]举实例帮助学生理解概念
[板书]放热反应:体系环境
H
△H < 0为“-” Q > 0
[结论]△H和Q的角度不同,△H从体系的角度
2021-2022学年人教版高中化学选修4课堂学案:第一章 第一节 第1课时焓变 反应热

第1课时焓变反应热[目标导航] 1.知道化学键的断裂和形成是化学反应中能量变化的主要缘由。
2.通过生产、生活中的实例了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义并能正确书写热化学方程式。
一、化学反应的实质与特征1.实质:反应物中化学键断裂和生成物中化学键形成。
2.特征:既有物质变化,又伴有能量变化;能量转化主要表现为热量的变化。
二、焓变反应热1.焓与焓变2.反应热肯定温度下,化学反应所释放或吸取的热量称为反应热。
争辩证明,化学反应在恒压条件下的反应热与焓变相同。
(1)反应热的单位和焓变一样,为kJ/mol或kJ·mol-1;(2)反应热描述的是化学反应前后的热量变化;(3)任何化学反应都有反应热。
3.反应热和焓变的关系反应热焓变含义化学反应中吸取或放出的热量化学反应中生成物所具有的焓与反应物所具有的焓之差二者的相ΔH是化学反应在恒定压强下(即敞口容器中进行的化学反应)且不与外界进行互联系电能、光能等其他能量的转化时的反应热,即恒压条件下进行的反应的反应热等于焓变ΔH4.常见的放热反应和吸热反应(1)常见的放热反应有:①活泼金属与H2O或酸的反应,如2Al+6HCl===2AlCl3+3H2↑;②酸碱中和反应,如2KOH+H2SO4===K2SO4+2H2O;③燃烧反应,如2CO+O2=====点燃2CO2;④多数化合反应,如Na2O+H2O===2NaOH,CaO+H2O===Ca(OH)2;⑤铝热反应,如2Al+Fe2O3=====高温Al2O3+2Fe。
(2)常见的吸热反应有:①多数分解反应,如CaCO3=====高温CaO+CO2↑;②2NH4Cl(s)+Ba(OH)2·8H2O(s)===BaCl2+2NH3↑+10H2O;③C+H2O(g)=====高温CO+H2;④CO2+C=====高温2CO。
【合作探究】1.化学反应放热还是吸热是否与反应条件有关?答案反应吸热还是放热与是否加热等条件无直接关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1课时焓变反应热[目标导航]1.知道化学键的断裂和形成是化学反应中能量变化的主要原因。
2.通过生产、生活中的实例了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义并能正确书写热化学方程式。
一、化学反应的实质与特征1.实质:反应物中化学键断裂和生成物中化学键形成。
2.特征:既有物质变化,又伴有能量变化;能量转化主要表现为热量的变化。
二、焓变反应热1.焓与焓变2.反应热一定温度下,化学反应所释放或吸收的热量称为反应热。
研究证明,化学反应在恒压条件下的反应热与焓变相同。
(1)反应热的单位和焓变一样,为kJ/mol或kJ·mol-1;(2)反应热描述的是化学反应前后的热量变化;(3)任何化学反应都有反应热。
3.反应热和焓变的关系4.常见的放热反应和吸热反应 (1)常见的放热反应有:①活泼金属与H 2O 或酸的反应,如 2Al +6HCl===2AlCl 3+3H 2↑; ②酸碱中和反应,如2KOH +H 2SO 4===K 2SO 4+2H 2O ; ③燃烧反应,如2CO +O 2=====点燃2CO 2; ④多数化合反应,如 Na 2O +H 2O===2NaOH , CaO +H 2O===Ca(OH)2;⑤铝热反应,如2Al +Fe 2O 3=====高温Al 2O 3+2Fe 。
(2)常见的吸热反应有:①多数分解反应,如CaCO 3=====高温CaO +CO 2↑;②2NH 4Cl(s)+Ba(OH)2·8H 2O(s)===BaCl 2+2NH 3↑+10H 2O ; ③C +H 2O(g)=====高温CO +H 2; ④CO 2+C=====高温2CO 。
【合作探究】1.化学反应放热还是吸热是否与反应条件有关? 答案反应吸热还是放热与是否加热等条件无直接关系。
2.任何物质都具有一定的能量,怎样从物质所具有的总能量上理解放热反应和吸热反应? 答案如果反应物所具有的总能量高于生成物所具有的总能量,发生化学反应时,有一部分能量就会以热能的形式释放出来,表现为放热反应;若反应物所具有的总能量低于生成物所具有的总能量,发生化学反应时,就会从环境吸收一部分能量,表现为吸热反应。
三、热化学方程式1.概念表示参加反应的物质的量与反应热的关系的化学方程式。
2.意义热化学方程式既表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
3.热化学方程式与普通化学方程式的区别【合作探究】1.H 2(g)+12O 2(g)===H 2O(l)ΔH =-285.5kJ·mol -1,表示的意义是什么?答案表示在25℃,101kPa 时,1molH 2与12molO 2完全反应生成液态水时放出的热量为285.5kJ 。
2.ΔH 的单位中mol -1的含义是什么?答案反应焓变单位中的mol -1表明参加反应的各物质的量与化学方程式中各物质的化学式的化学计量数相同。
例如:H 2(g)+12O 2(g)===H 2O(l)ΔH (298K)=-285.8kJ·mol -1,表示298K 时,1molH 2(g)与0.5molO 2(g)反应生成1molH 2O(l),放热285.8kJ 。
一、焓变、反应热的产生原因【例1】由下图分析,有关叙述正确的是()A.A→B+C和B+C→A两个反应吸收或放出的能量不等B.A→B+C是放热反应C.A具有的能量高于B和C具有的能量总和D.A→B+C是吸热反应,则B+C→A必然是放热反应解析本题考查化学反应中的能量变化,由图可知,B+C的能量高于A的能量,则反应B+C→A一定是放热反应;反之A→B+C则是吸热反应。
根据能量守恒定律,两反应的反应热在数值上相等,符号相反。
答案D【归纳总结】焓变与反应物、生成物能量的关系一个化学反应是吸收能量还是放出能量,由反应物的总能量(∑E反)与生成物的总能量(∑E生)的相对大小来决定。
若∑E反>∑E生,则会放出能量;若∑E反<∑E生,则需要吸收能量,如下图所示。
变式训练1反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是()答案D解析根据反应物和生成物能量的高低来分析、解决问题。
化学反应都伴随能量变化,当反应物的总能量高于生成物的总能量时,该反应为放热反应;当反应物的总能量低于生成物的总能量时,该反应为吸热反应。
反应①的ΔH>0,为吸热反应,故可排除A项和C项;反应②的ΔH<0,为放热反应,B项错误,故选D。
【例2】已知H—H键键能为436kJ·mol-1,H—N键键能为391kJ·mol-1,根据化学方程式:N2+3H2高温、高压催化剂2NH3ΔH=-92.4kJ·mol-1,则N≡N键键能是()A.431kJ·mol-1B.945.6kJ·mol-1C.649kJ·mol-1D.869kJ·mol-1解析ΔH=反应物键能总和-生成物的键能总和。
所以-92.4kJ·mol-1=E(N≡N)+3×436kJ·mol-1-2×391kJ·mol-1×3。
E(N≡N)=945.6kJ·mol-1。
答案B【规律总结】反应热与键能的关系(1)化学键的断裂要吸收能量,形成新化学键要释放能量,若反应物断键所吸收的总能量大于生成物成键所释放的总能量,则为吸热反应,反之则为放热反应。
即E总(断键)>E总(成键),为吸热反应;E总(断键)<E总(成键),为放热反应。
ΔH=E总(断键)-E总(成键)。
(2)以H2与Cl2反应生成HCl为例来说明:上面分析过程可归纳如下表变式训练2(2016·石家庄二中)通常人们把拆开1mol 某化学键时吸收的能量看成该化学键的键能。
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(ΔH ),化学反应的ΔH 等于反应中断裂旧化学键吸收的能量与反应中形成新化学键释放的能量的差。
一些化学键的键能数据如表所示:根据键能数据估算反应CH 4(g)+4F 2(g)===CF 4(g)+4HF(g)的反应热ΔH 为() A .-1940kJ·mol -1B .1940kJ·mol -1 C .-485kJ·mol -1D. 485kJ·mol -1 答案A解析化学反应的反应热等于断裂旧化学键吸收的能量和形成新化学键放出的能量的差,根据键能数据可知,所求反应的反应热ΔH =414kJ·mol -1×4+155kJ·mol -1×4-489kJ·mol -1×4-565kJ·mol -1×4=-1940kJ·mol -1。
二、热化学方程式的书写及判断 (一)热化学方程式的书写【例3】写出下列反应的热化学方程式:(1)1molC 2H 5OH(l)完全燃烧生成CO 2(g)和H 2O(l),放出1366.8kJ 热量:_______________________________________________________________________________________。
(2)1molC(石墨)与适量H 2O(g)反应生成CO(g)和H 2(g),吸收131.3kJ 热量:_____________________________________________________________________________。
(3)1.7gNH 3(g)发生催化氧化反应生成气态产物,放出22.67kJ 的热量:_______________________________________________________________________________________。
解析已知反应物的物质的量及放出或吸收的热量,要写出热化学方程式,关键是要确定与方程式中的化学计量数相对应的ΔH 。
(1)C 2H 5OH 燃烧的化学方程式为C 2H 5OH +3O 2――→点燃2CO 2+3H 2O ,那么,相应的热化学方程式为C 2H 5OH(l)+3O 2(g)===2CO 2(g)+3H 2O(l)ΔH =-1366.8kJ·mol -1。
(2)1molC(石墨)完全反应吸收131.3kJ 热量,则相应的热化学方程式为C(石墨,s)+H 2O(g)===CO(g)+H 2(g)ΔH =+131.3kJ·mol -1。
(3)1.7gNH 3的物质的量为0.1mol ,则4molNH 3发生反应放出的热量为22.67kJ ×40= 906.8kJ ,1molNH 3完全反应放出的热量为226.7kJ 。
那么相应的热化学方程式为4NH 3(g)+5O 2(g)===4NO(g)+6H 2O(g)ΔH =-906.8kJ·mol -1或NH 3(g)+54O 2(g)===NO(g)+32H 2O(g)ΔH=-226.7kJ·mol -1。
答案(1)C 2H 5OH(l)+3O 2(g)===2CO 2(g)+3H 2O(l)ΔH =-1366.8kJ·mol -1 (2)C(石墨,s)+H 2O(g)===CO(g)+H 2(g) ΔH =+131.3kJ·mol -1(3)NH 3(g)+54O 2(g)===NO(g)+32H 2O(g)ΔH =-226.7kJ·mol -1【方法总结】热化学方程式的书写方法要求(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)在方程式右端注明能量的变化:吸热反应,ΔH >0;放热反应,ΔH <0。
(3)要注明反应物和生成物的聚集状态。
(4)化学计量数只表示物质的“物质的量”,因此可以是整数,也可以是分数。
(5)化学计量数改变,ΔH 要相应改变;逆反应的ΔH 数值与正反应的相等、符号相反。
变式训练3根据要求,写出下列反应的热化学方程式:(1)1molC 2H 4(g)与适量O 2(g)反应,生成CO 2(g)和H 2O(l),放出1411kJ 的热量。
________________________________________________________________________。
(2)1molAl(s)与适量O 2(g)发生反应,生成Al 2O 3(s),放出834.9kJ 的热量。
