医用超声耦合剂原材料进厂检验标准
医用超声耦合剂 标准

医用超声耦合剂标准医用超声耦合剂标准。
医用超声耦合剂是一种用于超声检查和治疗的特殊介质,它能够在超声波传播过程中消除空气,减少超声波的衰减,提高超声波的传播效率。
医用超声耦合剂在临床上应用广泛,但是由于市场上产品质量良莠不齐,因此有必要制定医用超声耦合剂的标准,以保障患者的安全和检查治疗的准确性。
首先,医用超声耦合剂的原材料应当符合国家相关标准,不得使用劣质原料或者添加有害物质。
其次,在生产过程中应严格控制生产工艺,确保产品的稳定性和可靠性。
医用超声耦合剂的外观应清澈透明,无异物悬浮,无沉淀物,无色素沉淀,无菌。
在使用过程中应具有良好的黏附性和易清洗性,不得对皮肤产生刺激或过敏反应。
医用超声耦合剂的包装应符合相关标准,包装材料应具有良好的密封性和防渗透性,能够有效隔绝外界空气和杂质的侵入。
在包装上应标注产品的生产日期、有效期、生产厂家、产品批号等信息,以便追溯和管理。
另外,产品的储存条件也应明确规定,避免高温、阳光直射和潮湿环境,以免影响产品质量。
医用超声耦合剂的质量检测应包括外观检查、PH值检测、黏度测试、细菌检测等多个方面,确保产品符合国家和行业标准。
此外,还应建立健全的质量追溯体系,对每一批产品进行记录和存档,以备查证。
在产品投放市场前,应进行严格的质量抽检,确保产品的质量稳定和可靠。
总的来说,医用超声耦合剂是临床上必不可少的辅助材料,它的质量直接关系到患者的健康和诊疗效果。
因此,制定医用超声耦合剂的标准是十分必要的,只有严格把关产品的原材料、生产工艺、外观包装、质量检测等方面,才能保证产品的质量稳定和可靠,确保患者的安全和诊疗的准确性。
希望相关部门能够加强对医用超声耦合剂的监管,提高产品质量,为患者提供更加安全可靠的医疗服务。
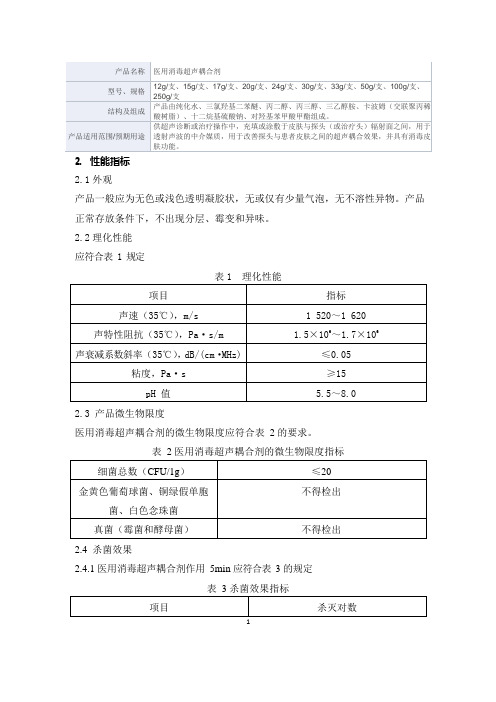
医用消毒超声耦合剂产品技术要求佛山市平创医疗
1
2. 性能指标 2.1 外观
产品一般应为无色或浅色透明凝胶状,无或仅有少量气泡,无不溶性异物。
产品正常存放条件下,不出现分层、霉变和异味。
2.2 理化性能 应符合表 1 规定
表 1 理化性能
2.3 产品微生物限度
医用消毒超声耦合剂的微生物限度应符合表 2 的要求。
表
2 医用消毒超声耦合剂的微生物限度指标
2.4 杀菌效果
2.4.1 医用消毒超声耦合剂作用 5min 应符合表 3 的规定
表 3 杀菌效果指标
2.4.2现场试验(自然菌)
医用消毒超声耦合剂作用5min 杀菌对数值应≥1
2.5装量要求
产品净含量应不低于标示量的95%
2.6三氯生及对羟基苯甲酸甲酯含量
2.6.1 三氯生含量0.05%~0.25%(质量比);
2.6.2 对羟基苯甲酸甲酯含量0.1%~0.25%(质量比以酸计)
2。
医用超声耦合剂标准

医用超声耦合剂标准
医用超声耦合剂是一种用于超声诊断和治疗的特殊凝胶或液体,它可以帮助超声波在皮肤和声音传感器之间传播,从而提高超声图
像的清晰度和准确性。
关于医用超声耦合剂的标准,可以从以下几
个方面来进行全面的回答:
1. 医用超声耦合剂的成分标准,医用超声耦合剂的成分应符合
相关的法规和标准,通常应该是无刺激性、无致敏性、无细菌污染的。
成分标准通常会涉及到对凝胶或液体成分的化学成分、纯度、
稳定性等方面的要求。
2. 医用超声耦合剂的性能标准,医用超声耦合剂的性能标准通
常包括其在超声波传导过程中的稳定性、传导效率、对皮肤的刺激性、对声音传感器的影响等方面的要求。
这些标准可以确保医用超
声耦合剂在临床应用中能够达到预期的效果。
3. 医用超声耦合剂的生产标准,医用超声耦合剂的生产标准涉
及到生产工艺、生产设备、生产环境等方面的要求,确保产品符合
相关的质量管理体系标准,如ISO13485等,以及符合医疗器械生产
许可证的要求。
4. 医用超声耦合剂的质量标准,医用超声耦合剂的质量标准通常包括对产品外观、包装、标识、保存条件等方面的要求,以及对产品的稳定性、有效期等方面的要求,以确保产品在使用前后的质量保证。
总的来说,医用超声耦合剂的标准涉及到成分、性能、生产和质量等多个方面的要求,这些标准的制定和执行能够保障医用超声耦合剂的安全性、有效性和可靠性,从而促进超声诊断和治疗的质量和安全。
医用超声耦合剂

医用超声耦合剂———认识但未必了解的朋友(牛凤岐等发表于2009年《中国医学影像技术》杂志)一.医用超声耦合剂应具的特性超声检查为什么一定要使用耦合剂呢?因为关于超声波的基本知识告诉我们,当其入射到两种不同媒质的分界面上时,二者阻抗相差越大,反射系数越大,穿过界面进入另一媒质的声能越少。
对于医用超声,如果让探头(或治疗头,下同)与皮肤“干接触”,由于二者之间空气薄层(有时还是厚层)的强烈反射作用,所发超声波根本无法到达并进入人体,何谈诊断或治疗作用。
为此,必须将某种物质充填于探头表面和皮肤之间,以驱除空气,形成使超声波顺畅和不失真传播的通道。
这种物质就称为“医用超声耦合剂(medical ultrasonic couplant)”,由于临床推崇的最佳剂型是凝胶状,故英文文献中用得更多的术语是“超声耦合凝胶(ultrasonic coupling gel)”。
但是,在临床实用中,耦合剂还起着润滑剂等作用,故人们关心的不只是其声学特性。
上世纪70年代初的美国专利中曾对“超声耦合凝胶”提出过10项要求,虽历经30多年,现在看来仍不过时。
其内容是:(1)与人体组织声速相等,以确保超声波束形状不致失真;(2) 衰减系数很小,不致降低信噪比,有利于检出弱回波信号;(3)与人体组织声特性阻抗近似相等,以减少反射损失;;(4)与探头表面和皮肤二者良好浸润,以彻底排除空气;(5)涂布后能保持较长时间而不干化;(6)涂布后在较长时间内保持黏性和粘附性,以便探头沿皮肤顺畅滑移;(7)不刺激皮肤,且即使较长时间接触也不引起致敏反应;(8)不使患者反感,即必须是非脏污的,外观悦目,呈水溶性,很容易洗掉;(9)具有热稳定性,即在临床环境下和涂布于皮肤上之后粘附力不降低;(10)同时具备声透射和电绝缘能力。
当然,最后一条是难以做到的,因作为耦合剂溶剂的水本身即有一定的导电性,而且某些品牌的产品恰恰是既作声耦合剂,又作导电膏的。
YZB超声藕合剂

YZB 医疗器械注册产品标准YZB/××××—2012医用超声藕合剂2012-09-08发布 2012-09-18发布有限公司发布前言本标准是依据YY0299-2008《医用超声藕合剂》标准编写而成。
本标准等同采用了YY 0299-2008《医用超声藕合剂》标准,各项技术内容均未改动。
依据《医疗器械标准管理办法》的规定,特制定本医疗器械注册产品标准,作为组织生产、检验和质量监督的依据。
本标准的编写格式贯彻了GB/T 1.1《标准化工作导则第1 部分:标准的结构和编写》的有关要求。
本标准由有限公司提出并负责起草。
本标准主要起草人:本标准首次发布日期:2012年9月医用超声藕合剂1 范围本标准规定了医用超声藕合剂的定义,要求,检验规则,试验方法,包装、标志、运输和贮存。
本标准适用于医用超声耦合剂产品(以下简称产品),包括企业作为商品制造、销售的,也包括医疗单位自制自用的。
该产品在超声诊断和治疗操作中用作探头(或治疗头)与皮肤之间的透声媒质。
本标准可供医用超声耦合剂垫参考采用。
本标准不适用于术中超声操作中与组织切口直接接触的产品。
对具有其它特性(如无菌、灭菌)的产品,制造商应补充其相应要求。
2 规范性引用檔下列文件对于本文件的应用是必不可少的。
凡是注日期的引用檔,仅注日期的版本适用于本档。
凡是不注日期的引用檔,其最新版本(包括所有的修改单)适用于本档。
YY0299-2008 医用超声耦合剂GB/T 191-2008 包装储运图标标志GB7916-1978 化妆品卫生标准GB/T16886.5—2003 医疗器械生物学评价第5部分:体外细胞毒性试验GB/T 16886.10-2005 医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T 15261 超声仿组织材料声学特性的测量方法中华人民共和国药典 2010年版二部3定义和规格下列术语和定义适用于本标准3.1 医用超声耦合剂medical ultrasonic couplant (medical ultrasound coupling agent)在超声诊断和治疗操作中,充填或涂敷于皮肤-黏膜与探头(或治疗头)辐射面之间,用于透射声波的中介媒质。
第一类医疗器械产品备案材料-超声耦合剂

第一类医疗器械产品备案材料-超声耦合剂1. 产品概述超声耦合剂是一种医疗器械产品,用于超声检查和超声治疗过程中的耦合介质,能够提高超声波的传导效率,提供清晰的超声图像和准确的治疗效果。
本文档主要介绍超声耦合剂的备案材料要求及内容。
2. 备案材料要求超声耦合剂作为第一类医疗器械产品,需要按照相关法规和规范的要求进行备案。
以下是超声耦合剂备案材料的要求:2.1 产品信息备案材料中应包含超声耦合剂的产品信息,包括但不限于以下内容:•产品名称:明确产品的名称,便于识别和审核。
•产品型号:标识产品的具体型号规格。
•产品分类:明确产品属于第一类医疗器械产品。
•适用范围:说明超声耦合剂的适用领域和用途。
•结构组成:描述超声耦合剂的主要组成部分。
2.2 技术要求备案材料中需要包含超声耦合剂的技术要求,包括但不限于以下内容:•物理参数:描述超声耦合剂的物理性质,如密度、粘度等。
•化学成分:列出超声耦合剂的化学成分,包括主要成分和辅助成分。
•性能指标:说明超声耦合剂的性能指标要求,如传导效率、稳定性等。
•使用方法:解释超声耦合剂的使用方法和注意事项。
2.3 制造工艺备案材料中需要包含超声耦合剂的制造工艺,包括但不限于以下内容:•原材料采购:描述超声耦合剂生产所使用的原材料,包括采购来源和质量控制要求等。
•生产工艺流程:详细描述超声耦合剂的生产工艺流程,包括原料配制、混合、包装等环节。
•工艺控制:说明生产过程中的工艺控制要求,如温度控制、湿度控制等。
•检验方法:列出超声耦合剂生产过程中的检验方法和标准,确保产品质量。
2.4 质量控制备案材料中需要包含超声耦合剂的质量控制要求,包括但不限于以下内容:•质量标准:制定超声耦合剂的质量标准,包括外观检查、物理性能、化学成分等方面的指标。
•检测方法:列出超声耦合剂质量检测的方法和标准,确保产品符合质量要求。
•质检记录:记录超声耦合剂生产和质检过程中的关键环节和结果,以便追溯和审核。
第一类医疗器械备案产品,超声耦合剂产品技术要求

医疗器械产品技术要求编号:
医用超声耦合剂
1、产品型号/规格及其划分的说明
1.1产品描述
超声诊断或治疗操作中,充填或涂敷于皮肤-黏膜与探头(或治疗头)辐射面之间,用于透射声波的中介媒质。
1.2预期用途
改善探头与患者之间的超声耦合效果,用于完好皮肤上。
1.3型号规格
按产品重量划分规格为:10g、20g、25g、50g、100g、250g、300g、500g。
2、产品性能指标
2.1外观
医用超声耦合剂应为无色或浅色透明凝胶状,无或仅有少量气泡,无不溶性异物。
2.2规格型号
产品规格应符合1.3的规定,允许偏差不超过±5%。
2.3粘度值(25℃)
产品粘度应≥15Pa.s。
2.4 pH值
应在5.5~8.0之间
2.5声速(35℃)
应在1520~1620m/s之间。
3、检验方法
3.1外观
以正常或矫正目力观察、验证,结果应符合2.1的要求。
3.2 规格型号
以通用或专用量具测量,结果应符合2.2的要求。
3.3粘度值检验
根据YY/T0299-2016的规定进行,结果应符合2.3的要求。
3.4 pH值测定
根据《中国药典》(2015年版)第四部0631pH值测定法的要求测定,结果应符合2.4的要求。
3.5 声速检验
按GB/T15261-2008标准中扬方法在35℃和2.5MHz~5 MHz范围内任一频率下测量,样品长度不小于5cm。
结果应符合2.5的要求。
4、术语
无。
医用耦合剂标准

医用耦合剂标准超声耦合剂耦合剂是一种由新一代水性高分子凝胶组成的医用产品。
它的PH值为中性,对人体无毒无害,不易干燥,不易酸败,超声显像清晰,粘稠性适宜,无油腻性,探头易于滑动,可湿润皮肤,消除皮肤表面空气,润滑性能好,易于展开;对超声探头无腐蚀、无损伤;市面上出现了具有杀菌消毒功能的超声耦合剂,相对于传统的普通型耦合剂,对于生产环境的更加严格,适用的范围也更广泛。
医用超声耦合剂是在超声诊断和治疗操作中,填充或涂覆于超声探头与人体组织间,用于透射超声波的中介媒质。
在临床超声检测过程中,超声探头和皮肤或组织间存在空气,超声波难以进入皮肤或组织。
而医用超声耦合剂通过填充探头和皮肤之间的空隙,隔绝空气,减小接触面间的摩擦,从而减小超声波能量的损失,便于信号传播。
医用超声耦合剂的分类临床应用的医用超声耦合剂主要包括非无菌型、无菌型和含消毒剂型。
目前市面上的主要以非无菌型产品为主,其中无菌型医用超声耦合剂管理类别为Ⅱ类,而非无菌型医用超声耦合剂管理类别为Ⅰ类。
非无菌型和含消毒剂型适用于完好皮肤,而无菌型适用于创面、黏膜、穿刺以及通过身体腔道进行的侵入性检查,婴儿也适用无菌型耦合剂。
对于无菌型医用超声耦合剂应满足无菌性能要求;对于非无菌型医用超声耦合剂要求其细菌数≤100cfu/1g(mL),霉菌和酵母菌数≤100cfu/1g(mL),金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌均不得检出。
随着监管机构对这类产品临床使用的进一步规范,无菌型以及含有消毒剂的超声耦合剂在临床应用将会越来越普遍。
有毒吗?会伤害皮肤吗?是否会致敏?医用超声耦合剂相对比较安全,行业内对其有严格的安全标准。
标准规定了包括pH值、无菌、微生物限度在内的一系列指标。
对其中的消毒剂成分有包括急性经口毒性试验、一次完整皮肤刺激试验、对破损皮肤刺激、对眼部刺激等的毒理学指标。
经历过多次修订,医用超声耦合剂最新修订的标准为YY/T0299-2022,于2022年7月1日发布,将于2024年7月1日正式实施。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医用超声耦合剂原材料进厂检验标准
编制_______________
审核_______________
批准_______________
发布日期_______________
实施日期_______________
文件更改控制记录
1.适用范围
本标准适用于重庆海扶公司生产的医用超声耦合剂的原材料进厂检验
2.性能要求
2.1 生产原料
2.1.1生产原料:羟乙基纤维素(HEC)
技术要求:
1.摩尔取代度(M.S) 1.8-2.0
2.水份(%) ≤10
3.水不溶物(%)≤0.5
4. PH值 6.0~-8.5
5.重金属(ug/g)≤20
6.灰分(%)≤5
7.粘度(mpa.s)2%20℃水溶液5~60000
8.铅(%)≤0.001
验收标准:
外观:
1.白色或微黄色无嗅无味易流动的粉末。
2.包装无破损,无受潮现象。
性能:
1. PH值在2~12范围内粘度变化较小,但超过此范围粘度下降。
2.检查供货厂家提供的检测报告或检测证明。
报告内容、参数须满足相关技术指标要求。
其他:
1.检查供货厂家是否提供合格证。
2.检查供货厂家的资质证书。
3.检查是否在使用有效期内。
2.1.2 生产原料:三乙醇胺
技术要求:
1. CAS:102-71-6
2.分子式:C6H15NO3
3.分子质量:149.19
4.沸点:360℃
5.熔点:21℃
6.相对密度:1.1242(20/4℃)
7.折射率(nD20):1.4852
8.闪点:193℃
验收标准:
外观:
1.常温下无色、粘稠液体,稍有氨味。
2.包装无破损,无泄漏。
性能:
1.能与水混溶。
2.检查供货厂家提供的检测报告或检测证明。
报告内容、参数须满足相关技术指标要求。
其他:
1.检查供货厂家是否提供合格证。
2.检查供货厂家的资质证书。
3.检查是否在使用有效期内。
2.1.3 生产原料:蒸馏水
技术要求:
1.灼烧渣含量(≤0.01 %)
2.锰(Mn)含量(≤0.00001%)
3.铁(Fe)含量(≤0.0004 %)
4.氯(Cl)(≤0.0005 %)
5.还原高锰酸钾物质(O)含量(≤0.0002 %)
6.电阻率(25℃)(≥10x104Ωcm)
7.硝酸及亚硝酸盐(以N计)(≤0.0003 %)
8.铵(NH4)含量(≤0.0008 %)
9.碱土金属氧化物(CaO计)(≤0.005 %)
验收标准:
外观:
1.无色透明液体。
2.包装无破损,无泄漏。
性能:
1.检查供货厂家提供的检测报告或检测证明。
报告内容、参数须满足相关技术指标要求。
其他:
1.检查供货厂家是否提供合格证。
2.检查供货厂家的资质证书。
3.检查是否在使用有效期内。
2.1.4 生产原料:甘油(丙三醇)
技术要求:
1.CAS No.:56-81-5
2.分子式:C3H8O3
3.分子量:92.09
4.熔点(℃):20
5.沸点(℃):182(2.7KPa)
6.相对密度(水=1):1.26(20℃)
7.相对蒸气密度(空气=1):3.1
8.饱和蒸气压(kPa):0.4(20℃)
9.闪点(℃):160
10.引燃温度(℃):370
11.溶解性:可混溶于醇,与水混溶,不溶于氯仿、醚、油类。
验收标准:
外观:
1.无色粘稠液体, 无气味。
2.包装无破损,无泄漏现象。
性能:
1.可混溶于醇,与水混溶,不溶于氯仿、醚、油类。
2.检查供货厂家提供的检测报告或检测证明,报告内容、参数须满足相关技术指标要求。
其他:
1.检查供货厂家是否提供合格证。
2.检查供货厂家的资质证书。
3.检查是否在使用有效期内。
2.1.5生产原料:耦合原剂
技术要求:
1.对皮肤和粘膜无细胞毒性、无致敏、无刺激。
2.细菌总数不得大于1000个/g
3.声速:1520~1650m/s(35℃)
4.声阻抗率:1.50~1.70×106 P a·s/m(35℃)
5.声衰减:≤0.05dB/(cm·MHz) (35℃)
6.气味:无味
7.粘度:≥15 Pa·s(25℃)
8.PH值:5.5~8.0
验收标准:
外观:
1.无色或浅色的水溶性透明凝胶,均质状无不溶性物质。
2.包装无破损,无泄漏。
性能:
1.粘度:≥15 Pa·s(25℃)
2.PH值:5.5~8.0
3.检查供货厂家提供的检测报告或检测证明。
报告内容、参数须满足相关技术指标要求。
其他:
1.检查供货厂家是否提供合格证。
2.检查供货厂家的资质证书。
3.检查是否在使用有效期内。
2.2生产耗材
2.2.1 生产耗材:圆管
技术要求:
20ml塑料管
对皮肤和粘膜无细胞毒性、无致敏、无刺激。
验收标准:
外观:
1.容积大于20ml。
2.包装无破损,无污物。
性能:
1.密封性好,注入蒸馏水观察,无渗漏。
2.检查供货厂家提供的检测报告或检测证明。
报告内容、参数须满足相关技术指标要求。
其他:
1.检查供货厂家是否提供合格证。
2.检查供货厂家的资质证书。
3.检查是否在使用有效期内。
2.2.2 生产耗材:氮气(N2)
技术要求:
无毒性、无致敏、无刺激。
验收标准:
外观:
1.罐装,无泄漏。
2.气压稳定,入厂气压不能低于正常同规格罐装气压90%。
性能:
1.检查供货厂家提供的检测报告或检测证明。
报告内容、参数须满足相关技术指标要求。
其他:
1.检查供货厂家是否提供合格证。
2.检查供货厂家的资质证书。
2.2.3生产耗材:连接头、堵头、外包袋
技术要求:
无破损。
对皮肤和粘膜无细胞毒性、无致敏、无刺激。
规格与设计选型一致。
验收标准:
外观:
1.无破损,无污物,颜色一致。
性能:
1.检查供货厂家提供的检测报告或检测证明。
报告内容、参数须满足相关技术指标要求。
其他:
1.检查供货厂家是否提供合格证。
2.检查供货厂家的资质证书。
3.检查是否在使用有效期内。
2.2.4 生产耗材:塑料管及盖帽
技术要求:
5~40ml特制
对皮肤和粘膜无细胞毒性、无致敏、无刺激。
验收标准:
外观:
1.容积与技术要求一致。
2.无破损,无污物。
性能:
1.检查供货厂家提供的检测报告或检测证明。
报告内容、参数须满足相关技术指标要求。
其他:
1.检查供货厂家是否提供合格证。
2.检查供货厂家的资质证书。
3.检查是否在使用有效期内。
