装量差异检验原始记录
中药制剂常规检查技术—重(装)量差异检查法

根据标示装量,查表确定装量差异限度
丸 剂
根据装量差异限度,计算允许装量范围
进行结果判断:供试品装量超过装量差异限度允许范围的不多于2份,且均未超过限度1倍 ,判为合格
三、丸剂装量差异检查
4.应用实例
加味逍遥丸的装量差异检查
批号:2021412
标示装量:6g/袋
编号
1
2
3
4
5
6
7
8
9 10
装量 6.35 6.28 6.48 6.53 6.17 5.98 6.38 6.12 5.96 6.10
一、方法概述
1.定义 重量差异:药品本身的重量与药品标示重量或平均重量的偏差程度。
重量差异检查:以药物制剂的标示量或平均重量为基准,对药品重量的偏差程度进行检查, 从而评价制剂质量的均一性。
一、方法概述
2.检查对象
《中国药典》(2020年版)对固体中药制剂的重量差异检查做出明确规定:
根据药品的聚集状态,药品颗粒较集中的应进行重量差异检查,如大蜜丸、浓缩丸、小蜜丸、 滴丸剂、片剂、贴膏剂、栓剂、锭剂和膏药等。
二、胶囊剂装量差异检查
1.简述
胶囊剂在生产过程中由于包装工艺、设备和管理等原因,都会引起胶囊剂的装量差异。本项 检查的目的在于控制最小包装内药品重量的一致性,保证用药剂量准确。
注意:凡规定检查含量均匀度的胶囊剂,一般不再进行装量差异检查。 每粒胶囊的两次称量中,应注意编号顺序以及囊体和囊帽的对号,不得混淆。 在称量前后,均应仔细查对胶囊数。称量过程中应避免用手直接接触供试品。已取出的
三、丸剂重量差异检查
1.简述
由于丸剂的类型、包装及剂量规格的多样性,《中国药典》规定滴丸、糖丸、蜜丸、水蜜丸、 浓缩丸等应进行重量差异检查。 注意:包糖衣丸剂应在包衣前检查丸芯的重量差异,符合规定后方可包衣,包糖衣后不再检査 重量差异。
药材检验原始记录样本

XXXXX药业(饮片)有限公司原药材检验报告单XXXXX药业(饮片)有限公司原药材检验记录【性状】结果:【鉴别】(1)显微鉴别横截面:结果:粉末:结果:(2)薄层鉴别供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加乙醇5ml使溶解。
对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。
再取绿原酸对照品,加乙醇制成每1ml含O.5mg的溶液。
温度:(℃)相对湿度:(%)展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液(6:1:1:0.1)薄层板:硅胶G显色剂:稀碘化铋钾试液灯光:白光、紫外光灯(365nm)展距:(cm)供试品色谱中,在与对照药材色谱相对应的位置上,显相同颜色的荧光斑点。
S1为对照药材(对照品为中检所提供编号为)S2为对照品(对照品为中检所提供编号为) T为样品结果:【检查】杂质不得过 XX % (附录IX A)杂质称重: g杂质计算结果为: % (标准规定不得过 XX %)结果:膨胀度应不低于4.0(附录IX O)温度:(℃)相对湿度:(%)电子天平型号:CP214 溶剂:水样品编号 1# 2# 3#干燥品称重: g g g第一次样品膨胀后体积: ml ml ml第二次样品膨胀后体积: ml ml ml(两次差异不超过0.1ml)膨胀度计算结果为:(标准规定不低于4.0)结果:水分不得过12.0% (附录Ⅸ H 第一法)。
温度:(℃)相对湿度:(%)烘箱型号:DHG-91012SA型电子天平型号:CP214样品编号 1# 2#第一次称量瓶干燥(105℃ 3h) (g)(g)第二次称量瓶恒重(105℃ 1h) (g)(g)样品称重(g)(g)第一次称量瓶+样品干燥(105℃ 5h) (g)(g)第二次称量瓶+样品恒重(105℃ 1h) (g)(g)水分计算结果为:(%)(标准规定不得过12.0%)结果:总灰分不得过4.0%(附录Ⅸ K)温度:(℃)相对湿度:(%)马福炉型号:SX2.5-10 电子天平型号:CP214样品编号 1# 2#第一次坩锅称重(600℃ 3h) (g)(g)第二次坩锅恒重(600℃ 0.5h) (g)(g)样品称重(g)(g)第一次坩锅+残渣称重(600℃ 3h) (g)(g)第二次坩锅+残渣恒重(600℃ 0.5h) (g)(g)总灰分计算结果为:(%)(标准规定不得过4.0%)结果:酸不溶性灰分不得过3.0%(附录Ⅸ K)。
模块五 药物制剂检查——装量差异检查

任务 胶囊剂的装量差异检查
3.数据处理与检验报告 ·处理检验数据判断检验结果 ·书写检验报告书 ·组内同学相互间复核 ·指导教师审核,提交原始记录单及检验报告书
任务 胶囊剂的装量差异检查
四、注意事项
·前后称量使用同一台天平,减少仪器误差。 ·称量过程中,应避免用手直接接触内容物。 ·倾出内容物时必须倒干净,以减少误差。
二、任务资料
(一)检验药品 名称:诺氟沙星胶囊 (二)质量标准 2015版《中国药典》第二部第1198页第四部第6页 诺氟沙星胶囊 Nuofushaxing Jiaonang Norfloxacin Capsules 本品含诺氟沙星(C16H18FN3O3)应为标示量的90.0%~110.0%。
任务 胶囊剂的装量差异检查来自平均装量或标示片重 0.30g以下 0.30g及0.30g以上
装量差异限度 ±10% ±7.5%(中药±10%)
任务 胶囊剂的装量差异检查
2.结果与判定 ·合格 (二项符合任一项即可) ①均未超出装量差异限度 ②超出装量差异限度的药片不多于两片,且均未超出限度1倍。 ·不合格 (二项符合任一项即可) ①超出装量差异限度的药片多于2片。 ②超出装量差异限度的药片虽不多于两片,但其中1片超出限度1倍。
任务 胶囊剂的装量差异检查
一、任务内容与目标 ·任务一、查找胶囊剂装量差异检查方法与标准。 ·任务二、依据《中华人民共和国药典》2015版进行重量差异检查。 ·任务三、依据标准对检查结果进行计算和判断。 ·任务目标:通过本实训,要求掌握胶囊剂的装量差异检查测定的程序、方法 与操作技能。
任务 胶囊剂的重量差异检查
装量差异检查
胶囊剂
任务 装量差异检查测定
基本知识 什么是装量差异?
定量包装商品原始记录(含公式函数示范计算)
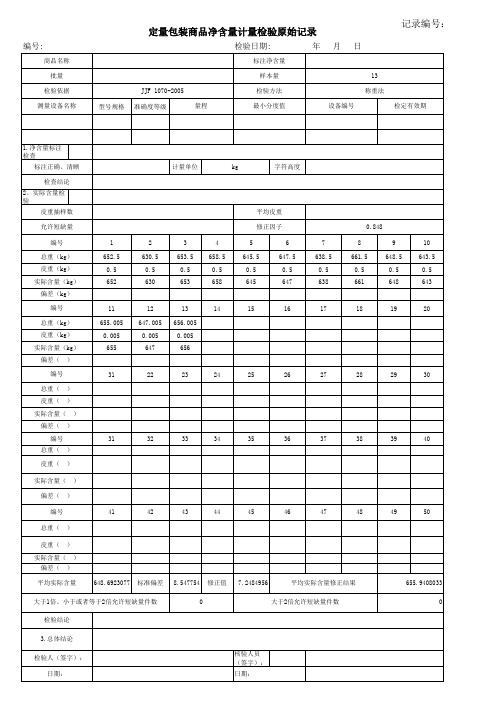
编号:
商品名称 批量 检验依据 测量设备名称 型号规格 JJF 1070-2005 准确度等级 量程
记录编号:
月 日
检验日期:
标注净含量 样本量 检验方法 最小分度值
年
13 称重法 设备编号 检定有效期
1.净含量标注检查 标注正确、清晰 检查结论 2、实际含量检验 皮重抽样数 允许短缺量 编号 总重(kg) 皮重(kg) 实际含量(kg) 偏差(kg) 编号 总重(kg) 皮重(kg) 实际含量(kg) 偏差( 编号 总重( 皮重( 实际含量( 偏差( 编号 总重( 皮重( 实际含量( 偏差( 编号 总重( 皮重( 实际含量( 偏差( ) 648.6923077 标准偏差 8.547754 0 修正值 7.2484956 平均实际含量修正结果 大于2倍允许短缺量件数 655.9408033 0 ) ) ) ) 41 42 43 44 45 46 47 48 49 50 ) ) ) ) 31 32 33 34 35 36 37 38 39 40 ) ) ) ) 31 22 23 24 25 26 27 28 29 30 11 655.005 0.005 655 12 647.005 0.005 647 13 656.005 0.005 656 14 15 16 17 18 19 20 1 652.5 0.5 652 2 630.5 0.5 630 3 653.5 0.5 653 4 658.5 0.5 658 5 645.5 0.5 645 平均皮重 修正因子 6 647.5 0.5 647 7 638.5 0.5 638 8 661.5 0.5 661 0.848 9 648.5 0.5 648 10 643.5 0.5 643 计量单位 kg 字符于或者等于2倍允许短缺量件数 检验结论 3.总体结论 检验人(签字): 日期:
定量包装商品净含量计量检验原始记录

检验日期
编号
商品名称
标注净含量
生产企业
批量
样本量
检验依据
检验方法
测量设备名称
规格型号
准确度等级
量程最小分度值设备源自号检定有效期\1、净含量标注检查
标注清晰正确
计量单位
字符高度
多件包装标注
检查结论
2、实际含量检验
允许短缺量
修正因子
皮重抽样数
平均皮重
编号
1
2
3
4
5
6
7
8
9
10
总重(g)
皮重(g)
实际含量(g)
偏差(g)
平均实际含量
标准偏差
修正值
实际含量修正结果
大于1倍,小于或等于2倍允许短缺量件数
大于2倍允许短缺量件数
结论
3.总体结论
检验人(签字):日期:校核人(签字):日期:
药物检验原始记录的格式大全

一、化学鉴别法药品检验原始记录检品名称:检验日期:批号:规格:【鉴别】/结果:□呈正反应□不呈正反应结论:□符合规定□不符合规定检验者: 复核者: 第页二、TLC鉴别法药品检验原始记录检品名称:检验日期:批号:规格:[鉴别]供试品溶液的制备:对照品(或对照药材、对照提取物)溶液的制备:对照物质来源:□均为中国药品生物制品检定所提供□其他:No:薄层色谱条件与结果详见附图()。
结论:□符合规定□不符合规定(规定:在供试品色谱中,在与对照品(或对照药材、对照提取物)色谱相应位置上,显相同颜色的斑点。
)检验者: 复核者: 第页三、TLC图薄层色谱检验记录图号:检品名称:检品编号: 检验日期:天气:室温:湿度:薄层板:展开温度:展开剂:显色剂及检视方法:点样量( l):点样顺序: 1 2结论:检验者: 复核者: 第页四、 相对密度药品检验原始记录检品名称: 检品编号: 检验日期: 规格: 批号 室温: 湿度: 相对密度(比重瓶法)照相对密度测定法(中国药典2010年版A V I AV II 二部附录一部附录)测定。
测定方法: □比重瓶法 □韦氏比重称法 (规定测定温度为20℃)。
天平: 实验温度: 空瓶重(W 1): 瓶+供试品重(W 2): 供试品重(W 2-W 1): 瓶+水重(W 3): 水重(W 3-W 1):结果计算:计算公式:相对密度 = 水重量供试品重量结论: (规定 ) 检验者: 复核者: 第 页五、PH值测定法药品检验原始记录检品名称:检品编号: 检验日期:批号:规格:温度:湿度:pH值照pH值测定法(《中国药典》2010年版一部附录VII G)测定。
仪器:校正仪器用标准缓冲液:邻苯二甲酸氢钾标准缓冲液(pH4.00)磷酸盐标准缓冲液(pH6.86)其它:供试品溶液的制备:pH值测定结果:结论:□符合规定□不符合规定(规定: ) 检验者: 复核者: 第页六、重量差异检查之一药品检验原始记录检品名称:检验日期:批号:规格:重量差异按《中国药典》2010年版一部附录I D片剂项下检查法取供试品20片,分别精密称定每片的重量。
样品检验原始记录(表格模板、doc格式)
名称
编号
精度检Βιβλιοθήκη 测记录备
注
检测员:年月日
样品检验原始记录
样品名称
规格型号
(级别)
编号
受检单位
生产单位
样品数量
检验性质
依据标准
检测项目
环境状况
你相信“人若有志,就不会在半坡停止。”就学习的阶段性而言,你处在初中的半山腰;就你进步的阶段而言,你也处在半山腰,这座右铭包含了你对自己的鼓励,希望你能真正意义上的做到勇往直前!使用
:你喜欢“走自己的路,让他们说去吧”!但你在班里似乎从不张扬,总是默默无闻的,用自己优秀的学习成绩证明着你的实力。你思维灵活,接受能力较强,勤于思考,作业本上那工整的字迹,是你文静开出的花朵。你文静有余而活动不足,希望你能再接再厉,百尺竿头更进一步主要仪器
原始记录书写规范

标准规定:每粒(或袋)装量与标示装量相比较(或平均装量比较),限度为± %,超出装量差异限度的不得多 于2粒(或袋),并不得有1粒(或袋)超出限度1倍。
实验结果:
称量(单位:g):(用电子天平可直接出数据)
每粒(或袋)装量:
(1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20)
测定: 精密量取对照品溶液与供试品溶液各 μl(或精密量取对照品溶液 μl与供试品溶液 μl) ,注入液 相色谱仪。
标准规定:按质量标准内容写
实验结果:
理论板数:(见第X页附图)符合或不符合规定
流动相与吸收池的吸光度(用紫外检测器时): (符合或不符合规定)
供试品溶液的主峰保留时间与对照品的主峰保留时间一致。(见第X页附图)
用语,如将片剂的“重量差异”记成“片 重差异”,或将“崩解时限”写成“崩解 度”等。现对一些常见项目的记录内容, 提出下述要求,检验人员可根据实际情况 酌情增加。
【性状】
检验日期: 年 月 日
标准规定:按质量标准内容写。
实验结果:原料药应根据检验中观察到的情况如实描述药品的 外观,不必照抄标准上的规定。
检验记录应先写明产品或物料的名称、
剂型、规格、批号或供货批号,必要时注 明供应商和生产商(如不同)的名称。接 着列检验依据凡按中国药典、部(局)颁 标准的,应列出标准名称、版本、页数或 标准批准文号。
检验中使用的标准品或对照品,应记录其
来源、批号和使用前的处理;用于含量(或 效价)测定的,应注明其含量(或效价)。
标准规定:按质量标准内容写。
实验结果:详细描述所见特征。中成药粉末特征组织应着重描 述特殊的组织细胞和内含物。如未能检出某应有药味的特征组 织应注明‘未检出XX’,如检出不应有的某味药,则应画出其 显微特征图,并注明‘检出不应有的XX’。
