2012年全国高考理综试题-福建卷
2012年普通高等学校招生全国统一考试理综(福建卷)

2012年普通高等学校招生全国统一考试(福建卷)理科综合相对原子质量:C 12O 16Cu 40Mn 55第Ⅰ卷(选择题共108分)本卷共18小题,每小题6分,共108分。
在每小题给出的四个选项中,只有一个选项符合题目要求。
1.(2012·福建理综,1)下列有关豌豆的叙述,正确的是()。
A.萌发初期,种子的有机物总重量增加B.及时排涝,能防止根细胞受酒精毒害C.进入夜间,叶肉细胞内ATP合成停止D.叶片黄化,叶绿体对红光的吸收增多B豌豆种子萌发初期,细胞呼吸消耗有机物,不能进行光合作用,种子的有机物总重量减少,A项错误;田间积水使得根细胞进行无氧呼吸,无氧呼吸产生的酒精对根细胞具有毒害作用导致烂根,及时排涝能防止此现象发生,B 项正确;夜间豌豆叶肉细胞虽不能进行光合作用,但细胞呼吸过程中会产生大量ATP,C项错误;叶绿素合成受阻或被分解时会导致叶片黄化,叶绿素主要吸收红光和蓝紫光,所以此时叶绿体对红光的吸收减少,D项错误。
2.(2012·福建理综,2)下表是生物科学史上一些经典实验的叙述,表中“方法与结果”和“结论或观点”能相匹配的是金丝雀A用显微镜观察到植物、动物受精卵通过细胞分裂产生新细胞,德国的魏尔肖在此基础上总结出“细胞通过分裂产生新细胞”“所有的细胞都来源于先前存在的细胞”,A项正确;B项中两组实验的自变量是胚芽鞘有无尖端,因此两组实验结果不同,说明胚芽鞘向光弯曲生长与尖端有关,B项错误;C项中细菌集中于受光照的部位,说明光合作用需要光,C项错误;D项的实验结果说明加热杀死的S型肺炎双球菌含有促使R型肺炎双球菌转化为S 型肺炎双球菌的转化因子,D项错误。
3.(2012·福建理综,3)科技人员选取某地同一自然条件下三种不同类型的茶园,进行物种丰富度的调查,结果如图。
据图判断正确的是()。
A.纯茶园物种数变化幅度最小,不易产生暴发性虫害B.杉茶间作园各物种的种群密度在10月份时最大C.梨茶间作园的营养结构在6月份时最为复杂D.人类生产活动不会改变茶园的群落结构C当群落中物种的丰富度越高时,害虫的天敌种类和数量就会越多,此群落中就不易产生暴发性虫害,A项错误;杉茶间作园在10月份物种数达到最高,但题中曲线并不能说明各物种的种群密度的大小,B项错误;生态系统中物种的数目越多,所形成的食物链就越多、食物网就越复杂,因此梨茶间作园在6月份的营养结构最复杂,C项正确;人类的活动如除草、喷施农药、改变种植结构等都会影响甚至改变茶园的垂直结构和水平结构,D项错误。
2012年高考真题——理综(福建卷)生物解析版(2)

2012年普通高等学校招生全国统一考试(福建卷)理综生物部分精校版解析一.选择题1 、下列有关碗豆的叙述,正确为是()A.萌发初期,种子的有机物总皿世增加B.及时排涝,能防止板细胞受酒精毒害C.进人夜间,叶肉细胞内ATP 合成停止D.叶片黄化,叶绿体对红光的吸收增多【答案】B【解析】萌发初期所需要的营养物质是由种子提供的,此时还不能进行光合作用,所以有机物不断消耗。
积水过多,根细胞的无氧呼吸可产生酒精,对细胞有害,及时排涝,可以减少酒精毒害。
进入夜间,叶肉细胞通过呼吸作用也可以产生ATP。
叶绿素的吸收光谱是红橙光和蓝紫光。
叶片黄化,说明叶绿素含量减少。
这样对红光的吸收会减少。
【试题点评】本题以豌豆为背景,考察有关植物细胞代谢的相关内容。
主要涉及细胞呼吸、叶绿体等知识。
要求学生能够运用相关知识对于日常生活和生产实际中的现象做出合理解释。
试题中文字简洁,但是信息量大,对于学生的分析能力要求较高。
2、下表是生物科学史上一些经典实验的叙述,表中“方法与结果”和“结论或观点”能匹配的是()[来黑暗且缺氧的环境中,用极细光束照射【答案】A【解析】A项符合细胞学说的基本观点。
B项中只能说明胚芽鞘的向光性与尖端有关。
C项说明光合作用的场所是在叶绿体。
D项说明S型菌中存在着转化因子。
【试题点评】本题以教材中生物科学史上的一些经典实验作为背影材料,考查生物学史上一些重要实验方法和重要结论。
要求学生有较好的理解能力。
3、科技人员选取某地同一自然条件下三种不同类型的茶园,进行物种丰富度的调查,结果如图。
据图判断正确的是()A.纯茶园物种变化幅度最小,不易产生暴发性虫害B.杉茶间作园各物种的种群密度在10月份时最大C.梨茶间作园的营养结构在6月份时最为复杂D.人类生产活动不会改变茶园的群落结构【答案】C【解析】纯茶园的物种单一,其抵抗力稳定性最差,容易产生暴发性虫害。
根据图中信息可以看出,10月份的杉茶园的物种数最大,但不并能说明各物种在此时的种群密度最大。
2012年高考(理科)试题及答案-福建省

2012年普通高等学校招生全国统一考试(福建卷)语文一、古代诗文阅读(27分)(一)默写常见的名句名篇(6分)1、补写出下列名句名篇中的空缺部分。
(6分)(1) ,三岁食贫。
(《诗经·氓》)(2)群贤毕至,。
(王羲之《兰亭集序》)(3)风急天高猿啸哀,。
(杜甫《登高》)(4) ,孰能无惑?(韩愈《师说》)(5) ,郁郁青青。
(范仲淹《岳阳楼记》)(6)浩荡离愁白日斜,。
(龚自珍《己亥杂诗》)(二)文言文阅读(15分)阅读下面的文言文,完成2一5题。
游龙鸣山记【明】陶安游之胜者,适其时可乐也,得其地尤可乐也,而所游又皆佳士,则所以宣其和、舒其郁、畅其心而发其文者,盖乐焉而不失乎正也。
至元丙子二月甲午.厚斋严君治酒肴,招予游龙鸣山,即无想山也。
时春霁既久,风日暄丽,耆英少俊,序齿而行,鼓吹前导。
从蓝溪东南行五六里,两山峙如双蠲,相距百步,绵亘东趋。
中夹石田,田右小路,随两山势深宵曲折。
行三四里,隘不宜田,仅可为路。
又数里,山益奇峻,轻岚暖霭,微袭襟帽。
山外崇峰复嶂,杳无穷极。
少焉,峭壁对立,状若华表,松杉万章①,夹路北转。
涧多石底,云深树茂,繁卉被岩,鸟声清碎,似非人间世。
僧舍雄丽,榜日“禅寂”。
门外独松古秀,大连数抱。
修篁干霄,森列门内。
寺长老出迎客,延坐后堂,匪曰“白云深处”。
其西有“听松轩”,又西即韩熙载读书堂遗址,所植桧犹存。
其北有“甘露室”。
又北,上为“招云亭”,气象空旷,攒峰玉立,视向所历群山,低俯其顶矣。
遂蹑蹬至潮音岩,怪石异态百出。
同游者疲于跻攀,于是止焉。
予以未登绝顶为怏,与三二友决意直上。
地势斗峻,褰裳②。
援萝,履苍莽中。
上有天池沆瀁③,其水下飞潮音岩,引以给庖。
其西绝顶,巨石雄坦,可坐数十人。
渺焉四顾,心目豁然。
其东绝顶,视西又高,倦不欲登,还饮“白云深处”。
于时暖气薰席,蒸焉如夏,凄焉如秋,粟焉如冬,觥筹无算,谈笑甚欢,虽从者乐工各适其意。
酒既,长老引客看花,徐行登环翠阁。
2012年福建卷理综化学高考试卷(原卷 答案)

绝密★启用前2012年普通高等学校招生全国统一考试(福建卷)理综化学本试卷共13题,共100分。
考试结束后,将本试卷和答题卡一并交回。
注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题1.(3分)(2012•福建)下列做法不正确的是()A.易燃试剂与强氧化性试剂分开放置并远离火源B.用湿润的红色石蕊试纸检验氨气C.在50 mL量筒中配制0.1000 mol•L﹣1碳酸钠溶液D.金属钠着火时,用细沙覆盖灭火2.(3分)(2012•福建)下列关于有机物的叙述正确的是()A.乙醇不能发生取代反应B.C4H10有三种同分异构体C.氨基酸、淀粉均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别3.(3分)(2012•福建)短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T 所处的周期序数与族序数相等.下列判断不正确的是()A.最简单气态氢化物的热稳定性:R>QB.最高价氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>RD.含T 的盐溶液一定显酸性4.(3分)(2012•福建)将如图所示实验装置的K闭合,下列判断正确的是()A.Cu电极上发生还原反应B.电子沿Zn→a→b→Cu 路径流动C.片刻后甲池中c(SO42﹣)增大D.片刻后可观察到滤纸b点变红色5.(3分)(2012•福建)下列说法正确的是()A.0.5molO3与11.2 LO2所含的分子数一定相等B.25℃与60℃时,水的pH相等C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n (Na0H)相等D.2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等6.(3分)(2012•福建)下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是()A.二氧化氮B.钠C.硫酸镁D.二氧化硅7.(3分)(2012•福建)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是()A.在0﹣50min之间,pH=2和pH=7 时R的降解百分率相等B.溶液酸性越强,R 的降解速率越小C.R的起始浓度越小,降解速率越大D.在20﹣25min之间,pH=10 时R 的平均降解速率为0.04mol•L﹣1•min﹣1二、非选择题8.(14分)(2012•福建)(1)元素M 的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为.(2)硫酸铝溶液与过量氨水反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.(3)能证明Na2SO3溶液中存在SO32﹣+H2O⇌HSO3﹣+OH﹣水解平衡的事实是C(填序号).A.滴入酚酞溶液变红,再加入H2SO4溶液后红色退去B.滴入酚酞溶液变红,再加入氯水后红色退去C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色退去(4)元素X、Y 在周期表中位于向一主族,化合物Cu2X和Cu2Y 可发生如下转化(其中D 是纤维素水解的最终产物):①非金属性X<Y(填“>”或“<”)②Cu2Y与过量浓硝酸反应有红棕色气体生成,化学方程式为Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O (5)在恒容绝热(不与外界交换能量)条件下进行2A (g )+B (g)⇌2C (g )+D (s)反应,按下表)电镀时,镀件与电源的负极连接.(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.①若用铜盐进行化学镀铜,应选用还原剂(填“氧化剂”或“还原剂”)与之反应.②某化学镀铜的反应速率随镀液pH 变化如图所示.该镀铜过程中,镀液pH 控制在12.5左右.据图中信息,给出使反应停止的方法:使反应停止,调节溶液的pH至8﹣9之间.10.(10分)(2012•福建)酸浸法制取硫酸铜的流程示意图如下①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O.②步骤(ii)所加试剂起调节pH 作用的离子是HCO3﹣(填离子符号).③在步骤(iii)发生的反应中,1mol MnO2转移2mol 电子,该反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.④步骤(iv)除去杂质的化学方程式可表示为:3Fe3++NH4++2SO42﹣+6H2O=NH4Fe3(SO4)2(OH)6+6H+过滤后母液的pH=2.0,c (Fe3+)=a mol•L﹣1,c (NH4+)=b mol•L﹣1,c (SO42﹣)=d mol•L﹣1,该反应的平衡常数K=(用含a、b、d 的代数式表示).11.(13分)(2012•福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).(1)制备实验开始时,先检查装置气密性,接下来的操作依次是ACB(填序号)A.往烧瓶中加入MnO2粉末B.加热C.往烧瓶中加入浓盐酸(2)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量.乙方案:采用酸碱中和滴定法测定.丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量.丁方案:与足量Zn 反应,测量生成的H2体积.继而进行下列判断和实验:①判定甲方案不可行,理由是残余液中的MnCl2也会与AgNO3反应形成沉淀.②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样.a.量取试样20.00mL,用0.1000mol•L﹣1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为0.1100mol•L﹣1b.平行滴定后获得实验结果.③判断丙方案的实验结果偏小(填“偏大”、“偏小”或“准确”).[已知:Ksp(CaCO3)=2.8×10﹣9、Ksp(MnCO3)=2.3×10﹣11④进行丁方案实验:装置如右图2所示(夹持器具已略去).(i)使Y形管中的残余清液与锌粒反应的正确操作是将锌粒转移到残留溶液中.(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变.气体体积逐次减小的原因是气体未冷却到室温(排除仪器和实验操作的影响因素).三、选考部分12.(13分)(2012•福建)[化学一物质结构与性质](1)元素的第一电离能:Al<Si(填“>”或“<“).(2)基态Mn2+的核外电子排布式为[Ar]3d5.(3)硅烷(Si n H2n+2)的沸点与其相对分子质量的变化关系如图1所示,呈现这种变化关系的原因是硅烷是分子晶体,相对分子质量越大,沸点越高.(4)硼砂是含结晶水的四硼酸钠,其阴离子X m﹣(含B、0、H 三种元素)的球棍模型如图2所示:①在X m﹣中,硼原子轨道的杂化类型有SP2杂化、SP3杂化;配位键存在于4号与5号原子之间(填原子的数字标号);m=2(填数字).②硼砂晶体由Na+、X m﹣和H2O构成,它们之间存在的作用力有(填序号)ADE.A.离子键B.共价键C.金属键D.范德华力E.氢键.13.(13分)(2012•福建)[化学一有机化学基础]对二甲苯(英文名称p﹣xylene,缩写为PX)是化学工业的重要原料.(1)写出PX的结构简式.(2)PX可发生的反应有取代反应、加成反应(填反应类型).(3)增塑剂(DEHP)存在如图所示的转化关系,其中A 是PX的一种同分异构体.①B的苯环上存在2种不同化学环境的氢原子,则B的结构简式是.②D分子所含官能团是醛基(填名称).③C分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是(4)F是B的一种同分异构体,具有如下特征:a.是苯的邻位二取代物;b.遇FeCl3溶液显示特征颜色;c.能与碳酸氢钠溶液反应.写出F与NaHCO3溶液反应的化学方程式.2012年普通高等学校招生全国统一考试(福建卷)理综化学(参考答案)1.【考点】化学实验安全及事故处理;物质的检验和鉴别的基本方法选择及应用;配制一定物质的量浓度的溶液.【专题】化学实验基本操作.【分析】A、易燃、易爆药品在一定温度和氧气充足时,会发生爆炸;B、氨气能使红色石蕊试纸变蓝色,所以能用红色石蕊试纸检验氨气;C、根据量筒的用途分析,量筒只能量取溶液;D、根据钠的性质分析,能和水、氧气反应.【解答】解:A、强氧化剂为可燃物发生氧化反应的氧化剂,在有火源的地方可燃物达到着火点就可以燃烧,所以易燃试剂与强氧化性试剂分开放置并远离火源,故A正确;B、氨气和水反应生成氨水,氨水电离生成铵根离子和氢氧根离子,红色石蕊试纸遇碱变蓝色,所以能用湿润的红色石蕊试纸检验氨气,故B正确;C、量筒只能量取溶液不能在量筒中配制溶液,故C错误;D、钠性质很活泼,能和水、氧气反应,所以为防止钠燃烧,必须隔绝空气和水,一般用细沙覆盖灭火,故D正确;故选C.【点评】本题考查了实验室安全、氨气的检验等知识点,难度不大,明确氨气能用湿润的红色石蕊试纸检验,不能用蓝色的石蕊试纸检验.2.【考点】乙醇的化学性质;有机物的鉴别;同分异构现象和同分异构体;氨基酸、蛋白质的结构和性质特点.【专题】同分异构体的类型及其判定;有机物的化学性质及推断.【分析】A、乙醇可以与钠反应,可以发生酯化反应、与HBr反应;B、C4H10是丁烷,有两种同分异构体;C、氨基酸不是高分子化合物;D、乙烯与溴水发生加成反应,使溴的四氯化碳溶液褪色.【解答】解:A、乙醇与钠反应可认为是取代反应,乙醇与HBr反应,酯化反应等都是取代反应,故A错误;B、C4H10是丁烷,有正丁烷、异丁烷两种同分异构体,故B错误;C、氨基酸不是高分子化合物,故C错误;D、乙烯与溴水发生加成反应,使溴的四氯化碳溶液褪色,甲烷不能使溴的四氯化碳溶液褪色,可以区别,故D正确;故选D.【点评】本题考查有机反应类型、同分异构体、有机物鉴别、高分子化合物概念等,题目综合性较大,难度较小,旨在考查学生对基础知识的理解掌握.3.【考点】位置结构性质的相互关系应用.【专题】元素周期律与元素周期表专题.【分析】短周期元素R、T、Q、W,根据元素所处的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素,据此结合选项解答.【解答】解:短周期元素R、T、Q、W,根据元素所处的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素,A、非金属性N>Si,故最简单气态氢化物的热稳定性:NH3>SiH4,故A正确;B、非金属性Si<S,故最高价氧化物对应水化物的酸性:H2SiO3<H2SO4,故B正确;C、同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:T>Q>R,故C正确;D、含铝离子的盐溶液是显酸性,但NaAlO2溶液显碱性,故D错误;故选D.【点评】本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识,难度中等,D 选项设问角度新颖独特.4.【考点】原电池和电解池的工作原理.【专题】电化学专题.【分析】A、依据装置图分析装置的K闭合,为原电池装置电解滤纸上的饱和硫酸钠溶液,甲和乙形成原电池反应锌做负极失电子发生氧化反应,铜做正极,电极上得到电子发生还原反应;B、电子从原电池负极流出经外电路流向电解池阴极a,通过电解质溶液离子定向移动到b;电子不能通过电解质溶液;C、甲池中锌离子浓度增大,盐桥中的氯离子移向甲池,硫酸根离子浓度基本不变;D、滤纸处是电解池,a做阴极,氢离子得到电子发生还原反应,水电离平衡破坏附近氢氧根离子浓度增大,酚酞变红,b做阳极氢氧根离子失电子生成氧气,附近氢离子浓度增大;【解答】解:A,Zn作原电池的负极,Cu作原电池的正极,Cu电极是发生还原反应;故A正确;B、电子流向是负极到正极,但a→b这一环节是在溶液中导电,是离子导电,电子并没沿此路径流动;故B错误;C、选项中硫酸根离子浓度基本保持不变;故C错误;D、选项中是滤纸a点是阴极,氢离子放电,水电离平衡破坏附近氢氧根离子浓度增大,酚酞变红;b做阳极氢氧根离子失电子生成氧气,附近氢离子浓度增大,故D错误;故选A.【点评】本题考查电化学知识,原电池、电解池原理的应用,装置图设计有些复杂,B选项干扰作用明显,设问巧妙,题目难度中等.5.【考点】酸碱混合时的定性判断及有关ph的计算;气体摩尔体积;反应热和焓变;水的电离;溶液pH的定义.【专题】化学反应中的能量变化;电离平衡与溶液的pH专题.【分析】A.没有指明标况下,11.2L氧气不一定是0.5mol;B.水的电离受到温度的影响,温度不同,水电离的氢离子浓度不同;C.酸碱发生中和反应,一元酸和一元碱的物质的量相同;D.△H数值是与方程式中化学计量数有关.【解答】解:A.没有明确气体是否在标准状况下,则11.2L氧气不一定是0.5mol,二者的分子数不一定相等,故A错误;B.水的电离受到温度的影响,温度不同,水电离的氢离子浓度不同,pH也不同,故B错误;C.盐酸和醋酸都是一元酸,等体积、等物质的量浓度的盐酸和醋酸物质的量相等,消耗NaOH的物质的量相等,故C正确;D.△H数值是与方程式中化学计量数有关,计量数不同,反应热不同,故D错误.故选C.【点评】本题考查知识比较基础简单,但知识覆盖面比较广,注意把握反应热与化学计量数的关系.6.【考点】钠的化学性质;铵盐.【专题】压轴题;元素及其化合物.【分析】能和氯化铵反应生成氨气说明该溶液呈碱性,和水反应生成碱的物质即是正确选项,据此分析解答.【解答】解:A、二氧化氮和水反应生成硝酸和一氧化氮,硝酸和氯化铵不反应,所以不符合条件,故A错误.B、钠和水反应生成氢氧化钠,氢氧化钠和氯化铵反应生成氨气,所以符合条件,故B正确.C、硫酸镁和氯化铵不反应,所以不符合条件,故C错误.D、二氧化硅和氯化铵不反应,所以不符合条件,故D错误.故选B.【点评】本题考查了元素化合物的性质,难度不大,明确“和氯化铵反应生成氨气的溶液必须是碱性溶液”即可解答本题.7.【考点】化学反应速率的影响因素;反应速率的定量表示方法.【专题】压轴题;化学反应速率专题.【分析】A、根据图中的信息可以知道在0﹣50min之间,pH=2和pH=7时R的降解百分率;B、对比溶液的酸性强弱对R的降解速率的影响情况;C、可以根据同一pH条件下,图示R的起始浓度与降解速率的关系来判断;D 、根据平均降解速率v=来计算即可.【解答】解:A 、根据图示可知:在0﹣50min 之间,pH=2和pH=7时R 的降解百分率都为100%,故A 正确;B 、溶液酸性越强,即pH 越小,线的斜率越大,可以知道R 的降解速率越大,故B 错误;C 、同一pH 条件下,R 的起始浓度与降解速率的关系:曲线斜率增大,则降解速率越小,即R 的起始浓度越小,降解速率越小,故C 错误;D 、在 20﹣25min 之间,pH=10时R 的平均降解速率为=0.04×10﹣4mol •L ﹣1•min ﹣1,故D 错误.故选A .【点评】本题考查学生的识图能力,要求学生具有分析和解决问题的能力,难度不大.8.【考点】电解质在水溶液中的电离;位置结构性质的相互关系应用;盐类水解的应用.【专题】元素周期律与元素周期表专题;电离平衡与溶液的pH 专题;盐类的水解专题.【分析】(1)N 的质子数为7,H 的质子数为1,所以NH 4+中质子数为11,电子数为10个,据此解答;(2)硫酸铝溶液与氨水反应可生成氢氧化铝沉淀和硫酸铵;(3)如果亚硫酸钠不水解,则溶液中氢氧根离子和氢离子浓度相等,溶液呈中性,向溶液中加入酚酞后溶液不变色,加入和亚硫酸根离子反应的物质后,溶液红色褪色,则证明存在水解平衡;(4)①采用逆推法,悬浊液与D 的溶液(葡萄糖溶液)生成砖红色沉淀是氧化亚铜,推出X 、Y 元素,再解答;②Cu 2Y 为氧化亚铜,+1价的铜具有还原性,硝酸具有氧化性,根据得失电子守恒配平;(5)根据压强和温度对化学反应平衡移动的影响因素结合化学平衡常数计算公式解答;【解答】解:(1)N 的质子数为7,H 的质子数为1,NH 4+中含有10个电子,11个质子,与之相同的单核离子为钠离子,则M 的原子结构示意图为,故答案为:;(2)硫酸铝溶液与氨水反应可生成氢氧化铝沉淀和硫酸铵,氢氧化铝不能溶于弱碱,则该反应为Al 2(SO 4)3+6NH 3.H 2O ═2Al (OH )3↓+3(NH 4)2SO 4,其离子反应为2Al 3++3NH 3.H 2O ═2Al (OH )3↓+3NH 4+,故答案为:Al 3++3NH 3•H 2O=Al (OH )3↓+3NH 4+; (3)A .滴入酚酞试液变红,说明溶液呈碱性,再加入硫酸溶液后,生成具有漂白性的SO 2,溶液褪色,不能说明存在SO 32﹣+H 2O ⇌HSO 3﹣+OH ﹣水解平衡,故A 错误;B .滴入酚酞试液变红,再加入氯水后,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,能使红色褪色,氯气具有强氧化性,Cl 2+SO 32﹣+H 2O ═SO 42﹣+2Cl ﹣+2H +,Cl 2+HSO 3﹣+H 2O ═SO 4 2﹣+2Cl ﹣+3H +,氯气和碱发生歧化反应,Cl 2+2OH ﹣═ClO ﹣+Cl ﹣+H 2O ,溶液褪色,不能说明存在SO 32﹣+H 2O ⇌HSO 3﹣+OH ﹣水解平衡,故B 错误; C .滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,再加入氯化钡溶液后,钡离子和亚硫酸根离子反应而和亚硫酸氢根离子不反应,钡离子和亚硫酸根离子反应生成亚硫酸钡沉淀,且溶液红色褪去,所以说明存在SO 32﹣+H 2O ⇌HSO 3﹣+OH ﹣水解平衡,故C 正确;故选C .(4)①根据悬浊液与D的溶液(葡萄糖溶液)生成砖红色沉淀是氧化亚铜,推出Y为O元素,再根据X,Y同主族,推出X为S元素,同一主族,从上往下,非金属性在逐渐减弱,所以,非金属性X<Y;故答案为:<;②Cu2Y为氧化亚铜,Cu2O与浓硝酸反应生成红棕色的气体NO2,利用氧化还原反应原理配平,该反应的方程式为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O,故答案为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;(5)D为固态,2A (g )+B (g)⇌2C (g )+D (s)正反应是一个体积缩小的反应,由起始D的物质的量为0可知,反应2A (g)+B(g)⇌2C(g)+D(s)向正反应进行建立平衡,正反应是气体体积减小的反应,容器的体积不变,平衡时压强增大,故绝热条件下,混合气体的温度升高,则正反应为放热反应,升高温度平衡向逆反应进行,平衡常数K=减小,所以该题化学平衡常数与温度成反比,故答案为:平衡常数与温度成反比.【点评】本题较为综合,主要考查推断和逻辑分析能力,明确物质的性质及发生的化学反应是解答的关键,题目难度中等.9.【考点】电解原理.【专题】电化学专题.【分析】(1)电镀时,镀件就是待镀金属,作阴极;(2)①用铜盐进行化学镀铜,铜离子在阴极得电子,应选还原剂发生反应;②镀铜过程中,镀液pH 控制在12.5左右,结合图可知,pH=8﹣9之间,反应速率为0来解答.【解答】解:(1)电镀池中,镀件就是待镀金属,作阴极,与电源的负极相连;镀层金属为阳极,与电源正极相连,故答案为:负;(2)①要把铜从铜盐中置换铜出来,铜离子在阴极得电子,如用铁作还原剂即可,所以加入还原剂,故答案为:还原剂;②根据图示信息,pH=8﹣9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8﹣9 之间,故答案为:使反应停止,调节溶液的pH至8﹣9 之间.【点评】本题考查电解原理,熟悉电镀及明确读图信息的重要性是解答本题的关键,题目难度不大.10.【考点】铜金属及其重要化合物的主要性质;化学平衡常数的含义.【专题】压轴题;几种重要的金属及其化合物.【分析】①碱式碳酸铜与硫酸反应生成硫酸铜、二氧化碳和水;②硫酸氢铵加入溶液中调节溶液PH是为了和i步骤中加入的过量硫酸反应同时提高溶液PH利于除去铁离子;铵根离子不反应,所以是碳酸氢根离子;③二氧化锰是强氧化剂,可以和亚铁离子发生氧化还原反应,亚铁离子被氧化为铁离子;④依据平衡常数的概念计算,用生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积.【解答】解:①碱式碳酸铜与硫酸反应的方程式直接写,用观察法配平.Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,故答案为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;②题目要求调高PH,铵根离子显酸性,碳酸氢根离子显碱性,则起作用的离子是碳酸氢根离子,故答案为;HCO3﹣;③依题意亚铁离子变成了铁离子,1mol MnO2转移电子2 mol,则锰元素从+4变成+2价,溶液是显酸性的,方程式经过观察可要补上氢离子,综合上述分析可写出离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;④除去杂质的化学方程式可表示为:3Fe3++NH4++2SO42﹣+6H2O=NH4Fe3(SO4)2(OH)6+6H+;过滤后母液的pH=2.0,c(Fe3+)=a mol•L﹣1,c(NH4+)=b mol•L﹣1,c(SO42﹣)=d mol•L﹣1,氢离子浓度为10﹣2,依据K的表达式写出K==,故答案为:.【点评】本题考查了工艺流程的分析判断,物质分离的方法和试剂选择方法,离子方程式的书写,氧化还原反应的分析判断,平衡常数的计算,没有在流程上设置障碍,问题设计平实,难度不大.平衡常数计算简单,只要代入即可,没有复杂的数学变换,降低了难度.对图中信息的获取要求较高.11.【考点】氯气的实验室制法;中和滴定.【专题】压轴题;卤族元素.【分析】(1)依据反应物及制取气体的操作步骤分析解答;加药顺序一般是先加入固体药品,再加入液药品,最后再加热.则依次顺序是ACB.(2)①甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故反应不可行;②乙同学的方案:依据滴定实验过程中的化学反应定量计算;③与已知量CaCO3(过量)反应,称量剩余的CaCO3质量.由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大;④依据锌粒与稀盐酸反应生成氢气进行分析解答;化学反应释放热量,气体体积具有热胀冷缩的特点.使Zn粒进入残余清液中让其发生反应.这样残余清液就可以充分反应,如果反过来,残余清液不可能全部转移到左边.若残余清液转移到左边则会残留在Y型管内壁,导致产生气体的量减少,使测定的盐酸浓度偏小;反应完毕时,相同时间内则气体体积减少,又排除了其它影响因素,只能从气体本身角度思考,联想到该反应是放热的,就可能想到气体未冷却了.【解答】解:(1)加药顺序一般是先加入固体药品,再加入液药品,最后再加热.检查装置气密性后,先加入固体,再加入液体:浓盐酸,然后加热;则依次顺序是ACB;故答案为:ACB;(2)①与足量AgNO3溶液反应,称量生成的AgCl质量,加入足量的硝酸银溶液只能求出氯离子的量,而不能求出剩余盐酸的浓度;故答案为:残余液中的MnCl2也会与AgNO3反应形成沉淀;②量取试样20.00mL,用0.1000mol•L﹣1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为,由C HCl V HCl=C NaOH V NaOH可得出盐酸的浓度为0.1100mol/L;故答案为:0.1100mol/L;③根据题意碳酸锰的Ksp比碳酸钙小,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小;故答案为:偏小;④丁同学的方案:将锌转移到残留溶液中,反应完毕后,每间隔1分钟读取气体体积.气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;故答案为:气体未冷却到室温;【点评】本题考查了实验室制备氯气的试剂添加顺序,中和滴定的实验操作和计算应用,实验题总体比较基础简单,可能最后一问比较出人意料,难以想到,题目难度中等.12.【考点】原子轨道杂化方式及杂化类型判断;原子核外电子排布;元素电离能、电负性的含义及应用;配合物的成键情况;不同晶体的结构微粒及微粒间作用力的区别.【专题】压轴题;化学键与晶体结构.【分析】(1)同周期从左到右第一电离能逐渐增大趋势,ⅡA和ⅤA族则反常;(2)根据Mn的核外电子排布式判断基态Mn2+的核外电子排布式;(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高;(4)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化;B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,结合化合价代数和为0的原则判断;②注意题目要求,钠离子与X m﹣形成离子键,结晶水分子间存在氢键和范德华力.【解答】解:(1)同周期从左到右第一电离能逐渐增大趋势,ⅡA和ⅤA族则反常,所以铝的第一电离能小硅,故答案为:;(2)Mn的电子排布式为[Ar]3d54s2,则基态Mn2+的核外电子排布式为[Ar]3d5,故答案为:[Ar]3d5;(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高,故答案为:硅烷是分子晶体,相对分子质量越大,沸点越高;。
2012年普通高考福建卷理科综合化学试题与解析

2012年普通高等学校招生全国统一考试理科综合能力测试(福建卷)化学试题第Ⅰ卷(选择题共108分)本卷共18小题,每小题6分,共108分。
在每小题给出的四个选项中,只有一个选项符合题目要求。
相对原子质量(原子量):C 12O 16Cu 40Mn 556.下列做法不正确...的是()A.易燃试剂与强氧化性试剂分开放置并远离火源B.用湿润的红色石蕊试纸检验氨气C.在50 mL量筒中配制0.100 0 mol·L-1碳酸钠溶液D.金属钠着火时,用细沙覆盖灭火7.下列关于有机物的叙述正确的是()A.乙醇不能发生取代反应B.C4H10有三种同分异构体C.氨基酸、淀粉均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别8.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。
下列判断不正确...的是() Array A.最简单气态氢化物的热稳定性:R>QB.最高价氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>RD.含T的盐溶液一定显酸性)9.将下图所示实验装置的K闭合,下列判断正确的是( ArrayA.Cu电极上发生还原反应B.电子沿Zn→a→b→Cu路径流动C.片刻后甲池中c(SO42-)增大D.片刻后可观察到滤纸b点变红色10.下列说法正确的是()A.0.5 mol O3与11.2 L O2所含的分子数一定相等B.25 ℃与60 ℃时,水的pH相等C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等D.2SO2(g)+O2(g)===2SO3(g)和4SO2(g)+2O2(g)===4SO3(g)的 H相等11.下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是()A.二氧化氮B.钠C.硫酸镁D.二氧化硅12.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。
下列判断正确的是()A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1第Ⅱ卷(非选择题共192分)必考部分第Ⅱ卷必考部分共9题,共157分。
2012年高考理科综合福建卷-答案

2012年普通高等学校招生全国统一考试(福建卷)理科综合能力测试答案解析第Ⅰ卷(选择题)1.【答案】B【解析】萌发初期所需要的营养物质是由种子提供的,此时还不能进行光合作用,所以有机物不断消耗.积水过多,根细胞的无氧呼吸可产生酒精,对细胞有害,及时排涝,可以减少酒精毒害.进入夜间,叶肉细胞通过呼吸作用也可以产生ATP.叶绿素的吸收光谱是红橙光和蓝紫光.叶片黄化,说明叶绿素含量减少.这样对红光的吸收会减少.【考点】种子的萌发,细胞呼吸,光合作用2.【答案】A【解析】A项符合细胞学说的基本观点.B项中只能说明胚芽鞘的向光性与尖端有关.C项说明光合作用的场所是在叶绿体.D项说明S型菌中存在着转化因子.【考点】生物学史上一些重要实验方法和重要结论3.【答案】C【解析】纯茶园的物种单一,其抵抗力稳定性最差,容易产生暴发性虫害.根据图中信息可以看出,10月份的杉茶园的物种数最大,但不并能说明各物种在此时的种群密度最大.同时,也可以看出,6月份时,梨茶间作园的物种数最大,这样,其营养结构最为复杂,因为营养结构的复杂程度于物种的丰富度.人类活动会对茶园的群落结构造成影响.【考点】物种丰富度,种群密度,群落的演替,生态系统的稳定性4.【答案】C【解析】小鼠B细胞注入家兔的体内,产生免疫反应后,在家兔的血清中可以找到相应的抗体.而血清也可以和小鼠T细胞凝集,根据抗原和抗体之间的特异性结合特点来看,说明小鼠的B细胞和小鼠T细胞具有相同的抗原.【考点】免疫原理5.【答案】D【解析】根据题意,胸腺嘧啶双脱氧核苷酸也可和单链模板上的腺嘌呤脱氧核苷酸进行配对.在该模板上共有4个腺嘌呤脱氧核苷酸,这样,可能有0、1、2、3、4个的胸腺嘧啶双脱氧核苷酸与模板上的腺嘌呤脱氧核苷酸进行配对,所以总共有5种不同长度的子链.【考点】DNA分子复制和碱基互补配对的运用6.【答案】C【解析】A项:燃烧过程是一个发生氧化还原反应的过程,易燃试剂作还原剂,在强氧化性试剂存在下,当温度达到可燃物的着火点就容易发生火灾,正确;B项:氨气是碱性气体,使湿润的红色石蕊试纸变蓝,正确;C项:量筒不是精密仪器,配制0.1000mol/L碳酸钠溶液要用到容量瓶,不正确;D项:金属钠遇到水或二氧化碳都会发生反应,所以金属钠着火时,用细沙覆盖灭火,正确.【考点】药品的取用,仪器的使用,实验的基本操作7.【答案】D【解析】A项:乙醇和乙酸发生酯化反应,而酯化反应是取代反应中的一种,错误;B项:C4H10只存在两种同分异构体,一种是正丁烷,一种是异丁烷,错误;C项:氨基酸不属于高分子化合物,错误;D项:乙烯可以使溴的四氯化碳褪色,正确.【考点】有机化学中的取代反应,同分异构体,高分子化合物和物质的检验8.【答案】D【解析】依题意可知;T是铝,Q是硅,R是氮,W是硫;A项:N的非金属性强于P,P 非金属性强于Si,正确;B项:S的非金属性强于Si,正确;C项:同一周期,从左到右.原子半径依次减小,N的原子半径小于P,正确;D项:比如:偏铝酸钠的水溶液显碱性.错误.【考点】元素周期表、元素周期律9.【答案】A【解析】K闭合时,Zn当负极,铜片当正极构成原电池,使得a为阴极,b为阳极,电解饱和硫酸钠溶液.A项:正确.B项:在电解池中电子不能流入电解质溶液中,错误;C项:甲池中硫酸根离子没有放电,所以浓度不变.错误;D项:b为阳极,OH-放电,使得b附近溶液显酸性,不能使试纸变红,错误.【考点】原电池和电解池原理10.【答案】C【解析】A项:题目没有指明在标准状况下,11.2L的O物质的量不一定为0.5mol,错误;2B项:水的电离程度随着温度的升高而增大,25℃的PH大于60℃.错误;C项:等体积等物质的量浓度的盐酸和醋酸,虽然醋酸是弱电解质,但随着中和反应的进行,氢离子不断电离出来,最终氢离子的物质的量与盐酸的相同,正确;D项:H与化学计量数成正比,错误.【考点】化学的基本概念 11.【答案】B 【解析】++4232NH +H ONH H O+H ,只要能使平衡往正方向进行,而且在一定条件下温度升高或者氨水的浓度足够大就可能生成3NH ,A 项:产生NO 气体,错误;B 项:钠消耗了+H 而且该反应放热可以产生氨气,正确;C 项:不能产生氨气,错误;D 项:二氧化硅可以与氢氟酸反应,跟其他酸很难反应,所以也没有氨气产生,错误. 【考点】铵离子水解平衡 12.【答案】A【解析】A 项:在0-50min 内,PH=2时,20min 时,R 已经降解完了,因此R 平均降解速率计算按0-20min ,而P H 7=时,40min 时,R 已经降解完了,因此R 平均降解速率计算按0-40min ,通过计算,正确;B 项:,PH=2时大约在20min 降解完,PH 7=大约在40min 降解完,但是起始浓度不相同,所以溶液的酸性与R 降解速率没有直接联系,错误.C 项:与B 相同,错误;D 项:P H 10=时,在20-25min ,R 的平均降解速为44411(0.6100.410/50.0410mo L min )-----⨯-⨯=⨯.【考点】化学反应速率的图像分析 13.【答案】A【解析】根据波的形成和传播规律可知,波沿x 轴负向传播,B 、D 错误;由图甲可知波长=24m λ,由图乙可知周期T=(0.55-0.15)s=0.40s ,则波速λ24v==m/s=60m/s T 0.40,选项A 正确,C 错.【考点】波动图像和振动图像 14.【答案】C【解析】交流电表的示数表示交流电的有效值,选项A 、B 错误;滑片P 向下滑动过程中,原、副线圈的匝数n 1、n 2不变,U 1不变,则2211n U =U n 不变;R 连入电路的电阻减小,则流过副线圈的电流220U I =R+R 变大,根据1122U I U I =,可知I 1变大,选项C 正确,D 错. 【考点】交流电的三值:有效值、最大值、瞬时值的关系及理想变压器原理和动态电路分析 15.【答案】C【解析】由外力克服电场力做功可知电场力做负功,点电荷Q 带负电,电场线指向Q ,根据“沿着电场线电势降低”可知B 点的电势高于A 点的电势,选项A 错误;根据场强2kQE=r 可知,距离Q 较近的A 点的场强较大,选项B 错误;电荷在某点的电势能等于把电荷从该点移到零电势能点的过程中电场力做的功,可知两个电荷在两点的电势能相等,选项D 错误.根据电势p E φ=q,A B φφ>可知,q 1的电荷量小于q 2的电荷量,选项C 正确【考点】点电荷电场分布,电场线于电势高低的关系,电势差于电场力做功的关系. 16.【答案】B【解析】行星对卫星的万有引力提供其做匀速圆周运动的向心力,有22Mm v G m R R='';行星对处于其表面物体的万有引力等于物体重力有,2Mm G Rg m =;而N=mg ,可得4mv M=GN ,选项B 正确.【考点】万有引力、星球表面重力和万有引力的关系、卫星的向心力和万有引力的关系 17.【答案】D【解析】A 、B 静止有A B m g=m gsin θ,二者速率的变化量(加速度大小)分别为g 、gsin θ,它们相等,选项A 错误;两个物体下滑过程中机械能分别守恒,因而机械能的变化量都为零,选项B 错误;重力势能的变化量等于重力做的功,分别为A A W m gh =、B B W m gh =,又A m m B <,后者较大,选项C 错误;由2A 1h=gt 2、2B h 1=gsin θt sin θ2可得A 、B 下滑时间;根据平均功率P W/t =可得A B P P =,选项D 正确. 【考点】物体的平衡,机械能守恒定律及瞬时功率 18.【答案】B【解析】圆环下落过程中,穿过的磁通量先增大后减小,电流方向为先顺时针后逆时针(从上往下看),选项D 错误.圆环通过O 位置时,不切割磁感线,没有感应电流,只受重力作用,而在关于O 对称的位置上穿过圆环的磁通量相等,磁通量的变化率随圆环速度的不同而不同.在正x 轴上的相应位置上,圆环的速度较大,其磁通量的变化率较大,因而感应电流的最大值大于圆环在负x 轴上的感应电流最大值,选项B 正确,A 、C 错误. 【考点】楞次定律,电磁感应图像第Ⅱ卷(非选择题)必考部分19.【答案】(1)①A②1.970mm(2)①9.4②(ⅰ)(ⅰⅰ)(ⅰⅰⅰ)9.5~11.1【解析】(1)①调节光源高度使光束沿遮光筒轴线照在屏中心时,无须放上单缝和双缝.②主尺的示数为1.5mm(半毫米刻度线已经露出),可动尺的示数为47.0×0.01mm=0.470mm,总的示数为(1.5+0.470)mm=1.970mm.(2)①选择开关位于直流电压10V档,按电表中央刻度0-10V刻度读数,最小刻度为0.2V,电池的电动势为9.4V.②(ⅰ)连线如右图(ⅰⅰ)所作图象如右图(ⅰⅰⅰ)根据闭合电路欧姆定律有0U E=U+R R ,化简得0R 111=+U E E R ,可知11U R-图线在纵轴的截距b 1/E =.由图线可知b 0.10=,则E 10V =. 【考点】双缝干涉,仪器度数,电动势测量 20.【答案】(1)1m/s (2)0.2【解析】(1)物块做平抛运动,在竖直方向上有21H gt 2=① 在水平方向上有0s=v t ②①②式解得0v (2)物块离开转台时,最大静摩擦力提供向心力,有20m v F =m R③m f N F =F =μF =μmg ④由③④式解得20v μ=gR,μ=0.2.【考点】平抛运动和圆周运动的综合运用 21.【答案】(1)fd(2(3f m【解析】(1)小船从A 点运动到B 点克服阻力做功f W fd =①(2)小船从A 点运动到B 点,电动机牵引绳对小船做功 1W Pt =②由动能定理有22f 1011W W =mv mv 22--③由①②③式解得1v (3)设小船经过B 点时绳的拉力大小为F ,绳与水平方向夹角为θ,电动机牵引绳的速度大小为u 则P=Fu ⑤ 1u=v cos θ⑥由牛顿第二定律有Fcos θf=ma -⑦由④⑤⑥⑦得f m-【考点】动能定理,牛顿第二定律及运动的合成与分解,功等 22.【答案】(1)0qB rm(2)①20qB r2m π ②22205q B r 8m【解析】(1)小球运动时不受细管侧壁的作用力,因而小球所受洛伦兹力提供向心力2000mv qv B =r①由①式得00qB rv =m② (2)①在T 0到1.5T 0这段时间内,细管内一周的感应电动势2B E =r t∆π∆感③ 由图乙可知2B B =t T ∆∆④由于同一电场线上各点的场强大小相等,所以E E 2r=π感⑤由③④⑤式及002m T B q π=得20qB rE=2πm⑥ ②在T 0到1.5T 0这段时间内,小球沿切线方向的加速度大小恒为Eqa=m⑦ 小球运动的末速度大小0v v a t =+∆⑧由图乙0t 0.5T ∆=,并由②⑥⑦⑧式得:0003qB r3v =v 22m=⑨ 由动能定理,电场力做功为: 221011W=mv mv 22-⑩由②⑨⑩式解得:2222005q B r 5W mv =88m=. 【考点】带电粒子在电,磁场中运动23.【答案】(1)(2)3++32343NH H O Al =Al(OH)+3NH +↓ (3)C (4)①<②233222Cu O+6HNO ()=2Cu(NO )+2NO +3H O -浓 (5)化学平衡常数随温度升高而减小【解析】(1)10电子,11质子的单核离子为钠离子,则M 的原子结构示意图为(2)硫酸铝溶液与氨水反应可生成氢氧化铝沉淀和硫酸铵,氢氧化铝不能溶于过量的氨水中,则硫酸铝溶液与过量氨水反应的离子方程式为:3++32343NH H O Al =Al(OH)+3NH +↓ (3)此题关键是亚硫酸离子水解生成的OH -使得酚酞试液变红,还有可能是亚硫酸离子本身能使得酚酞试液变红,所以要排除亚硫酸离子干扰,C 正确.(4)悬浊液与D 溶液(葡萄糖溶液)生成砖红色沉淀氧化亚铜,则Y 为O 元素,X ,Y 同主族,则X 为S 元素.(5)测得反应后,体系压强增大,达到平衡前,反应逆向进行.如果正反应是放热的情况下,则升高温度,逆向进行,因此平衡常数随着温度的升高而减小. 【考点】原子结构示意图,离子方程式的书写,化学平衡的判断和实验检验 24.【答案】(1)负 (2)①还原剂②调节溶液pH 在8~9之间(3)①22324422Cu (OH)CO +2H SO =2CuSO +CO +3H O ↑ ②3HCO -③2++2+3+22MnO +2Fe +4H =Mn +2Fe +2H O -④123210a bd- 【解析】(1)电镀池中,镀件与电源的负极相连,待镀金属为阳极与电源正极相连. (2)①要把铜从铜盐中置换铜出来,则加入还原剂,②根据图示信息,PH 89=-之间,反应速率为0.(3)化工流程题解题指导,通过图示分析:加入什么物质---发生什么反应---留在里面什么物质.(最好通过微粒判断到底过程中发生哪些离子反应)①碱式碳酸铜中碳酸根离子和氢氧根离子与硫酸中的氢离子反应生成2CO 和2H O ,②调高PH 则只能是弱酸根离子水解;③依题意锰元素从+4变成+2价,MnO 2当氧化剂.则与亚铁离子反应.④氢离子浓度为10-2,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积得到123210K=a bd-.【考点】电镀原理,化学平衡的应用,物质的制备 25.【答案】(1)ABC (按序写出三项)(2)①残余清液中,+n(Cl )n(H )->(或其他合理答案) ②0.1100 ③偏小 ④(ⅰ)Zn 粒残余清液(按序写出两项) (ⅰⅰ)装置内气体尚未冷却至室温【解析】(1)组装仪器时从下到上,然后再加热.则依次顺序是ACB (2)①生成物氯化锰也可以与硝酸银形成沉淀.②HCl HCl NaOH NaOH C V C V 得:盐酸的浓度为:0.1100mol/L ;③依据题意:碳酸锰的Ksp 比碳酸钙小,其中有部分碳酸钙与锰离子反应生成碳酸锰沉淀.使得剩余的碳酸钙质量变小.④使Zn 粒进入残留清液中让其发生反应.为反应结束时,相同时间内则气体体积减少,说明反应速率减小,可能是反应物的浓度降低引起.但是反应完毕时,相同时间内则气体体积减少,说明可能是气体会热胀冷缩导致的. 【考点】化学实验方案基本操作,实验的设计与评价 26.【答案】Ⅰ.(1)幽门盲囊蛋白酶 (2)①蛋白质 双缩脲试剂 ②2 8 ③恒温箱底物消耗量(或产物生成量) ④不能在15℃~18℃范围内,随着温度的升高酶活性一直在增强,没有出现下降的拐点,所以不能得出大菱鲆蛋白酶的最适温度 (3)淀粉和脂肪 Ⅱ.(1)升高 雌性激素 (2)染色体 (3)体液 受体【解析】Ⅰ.(1)从图一可知,三种蛋白酶在各自最适PH 值下,幽门盲囊蛋白酶对应的酶活性值最大,所以催化效率最高;(2)①酶具有专一性,蛋白酶只能催化蛋白质的水解,干酪素为蛋白质类化合物,可用双缩脲试剂检测;②要验证大菱鲆蛋白酶的最适温度,要遵循单一变量、对照、重复等原则,并控制其他无关变量相同,由题意可知,此实验温度为自变量,PH 值等为无关变量,为了得到准确的结果,PH 应与相对应的蛋白酶的最适值,由图1可知,胃蛋白酶最适PH 值为2,幽门盲囊蛋白酶最适PH 值为8;③为了控制温度保持不变,底物和酶都应放在恒温箱中保温,酶的催化效率可以用单位时间内底物的消耗量或产物的生成量来表示;④由图2可以看出,当温度从15℃~18℃梯度变化过程中,随着温度的升高,蛋白酶的活性一直在增强,没有出现下降的拐点,因此,不能得出大菱鲆蛋白酶的最适温度在15℃到18℃;(3)大菱鲆消化道内淀粉酶和脂肪酶少,对淀粉和脂肪的消化存在障碍,所以在人工投放饲料时要减少淀粉和脂肪的比例;Ⅱ.(1)由题中实验结果可知,双酚A进入雄蛙体内后,可以提高雄蛙体内芳香化酶的水平,而芳香化酶能促进雄性激素转化为雌性激素,所以双酚A进入雄蛙体内后,雌性激素含量增加,要比较双酚A和雌性激素对精巢机能的影响,可设置水中含有雌性激素的实验组作为条件对照,培养一段时间后精巢进行镜检,观察实验结果.(2)减数分裂各时期主要根据染色体数目和行为特征来判断,所以镜检用高倍镜观察细胞的染色体.(3)激素通过体液运输到达相应的靶器官或靶细胞,与相应的受体结合,从而调节靶器官或靶细胞的生命活动.【考点】酶的本质,检测和影响酶活性的因素,减数分裂,激素调节27.【答案】(1)杂合子(2)(3)裂翅(♀)×非裂翅膀(♂)或裂翅(♀)×裂翅(♂)(4)不遵循不变【解析】(1)F1出现了非裂翅,说明亲本的裂翅是杂合子.(2)见遗传图解.(3)用一次杂交实验,确定该等位基因位于常染色体还是X染色体,需要常染色体遗传的杂交结果与伴X遗传的杂交结果不一致才能判断.可用组合:裂翅♀× 非裂翅♂,若是常染色体遗传,后代裂翅有雌也有雄,若是伴X遗传,裂翅只有雌;也可以用组合:裂翅(♀)×裂翅(♂),若是常染色体遗传,后代非裂翅有雌也有雄,若是伴X遗传,后代非裂翅只有(4)由于两对等位基因位于同一对同源染色体上,所以不遵循自由组合定律;图2所示的个体只产生两种配子:AD 和ad ,含AD 的配子和含AD 的配子结合,胚胎致死;含ad 的配子和含ad 的配子结合,也会胚胎致死;能存活的个体只能是含AD 的配子和含ad 的配子结合,因此无论自由交配多少代,种群中都只有AaDd 的个体存活,A 的基因频率不变.【考点】基因分离定律和自由组合定律,生物的进化等知识及实验设计能力选考部分28.【答案】(1)D(2)A【解析】(1)一定量气体吸收热量的同时对外做功,则其内能可能不变或减小,选项A 错误;在外界做功的前提下,热量可以由低温物体传递到高温物体,选项B 错误;若两分子间距增大,分子力可能做正功或负功,其势能可能减小或增大,选项C 错误.根据分子动理论可知,若分子之间的距离减小,分子间的引力和斥力都增大,选项D 正确.(2)根据玻意耳定律有11223P V +P V =P V ,即316196P ⨯⨯=+,解得3P 25atm =.. 【考点】内能,分子势能,分子间相互作用,气体定律29.【答案】(1)D(2)C【解析】(2)α射线是高速运动的氦原子核,选项A 错误;选项B 中10n 表示中子;由光电方程2m 1mv =h νW 2-可知最大初动能与照射光的频率成线性关系而非正比,选项C 错误;根据波尔原子理论可知,选项D 正确.(2)设水平向右为正方向,根据动量守恒定律,对救生员和船有,0χ(M+m)v =mv+Mv -,解得χ00m v v (v v)M=++.选项C 正确. 【考点】核反应、动量守恒等30.【答案】(1)<(2)22626551s 2s sp 3s 3p 3d ([Ar]3d )(3)硅烷的相对分子质量越大,分子间作用力越强(4)①23sp sp 、4,5(或5,4)【解析】(1)同周期,从左到右,总体上第一电离能逐渐增大(第二和第五主族例外).则:铝的第一电离能小硅.(2)Mn 是25号元素,其电子排布式为22626521s 2s sp 3s 3p 3d 4s ,故2+Mn 的电子排布式为22626551s 2s sp 3s 3p 3d ([Ar]3d ) .(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高. (4)①1,3,5,6代表氧原子,2,4代表B 原子,利用中心原子价电子对数n=σ键数+孤电子对数,如果n 2SP =杂化,2n 3SP =杂化.2号B 形成3个σ键,则B 原子为2SP 杂化,4号B 形成4个σ键,则B 原子为3SP 杂化;配位键存在4号上的B 原子,m=5,②钠离子与m X -形成离子键,水分子间存在氢键和范德华力.【考点】元素第一电离能的变化规律,基态离子核外电子排布,分子晶体熔沸点高低的决定因素,轨道杂化,配位键,微粒间的作用力31.【答案】(1)(2)取代反应氧化反应(或其它合理答案) (3)①②醛基 ③(4)【解析】(1)对二甲苯中两个甲基处于苯环的对位,结构简式为.(2)苯环上可以发生取代和加成反应,甲基上可以发生取代反应,有机物一般都可以燃烧,因此易被氧化.(3)①A 通过反应生成B ,则A 中含有苯环上有两个甲基,而且苯环上存在2种不同环境的氢原子,则A 为邻二甲基苯.②D 分子能发生银镜反应则含有醛基.③正向思维和逆向思维结合,则DEHP的结构简为(4)依题意得,则F结构中含有酚羟基,含有羧基,则F的结构简示为:,其与NaHCO3溶液反应的化学方程式为:【考点】有机物的推断,物质的官能团及其性质32.【答案】(1)限制性核酸内切酶(或限制)启动子(2)胰蛋白(3)RNARAS蛋白【解析】(1)过程①表示基因表达载体的构建,在该过程中需要用限制酶对载体进行切割以便于目的基因的插入(限制性核酸内切酶,简称限制酶,写其他的不得分);启动子是一段特殊的DNA序列,是RNA聚合酶结合和识别的位点,RNA聚合酶结合到该位点,可驱动转录过程.(2)过程②表示动物细胞培养,培养过程中出现接触抑制后可以用胰蛋白酶处理,使之分散成单个的细胞,之后分装到其他培养瓶里面进行传代培养.(3)判断目的基因是否在受体细胞中转录,可用分子杂交技术来进行,从细胞中提取mRNA 和用放射性同位素或者荧光标记的目的基因单链DNA片段进行杂交.根据题中信息“肺组织细胞中的let-7基因表达减弱,癌基因RAS表达就增强,引发肺癌”导入let7基因后,肺癌细胞受到抑制,说明RAS基因表达减弱,导致细胞中的RAS蛋白质含量减少进而导致癌细胞受抑制.【考点】基因工程和细胞工程的知识中表达载体的构建,目的基因的检测,动物细胞培养。
高考理科综合物理试题(福建卷).docx
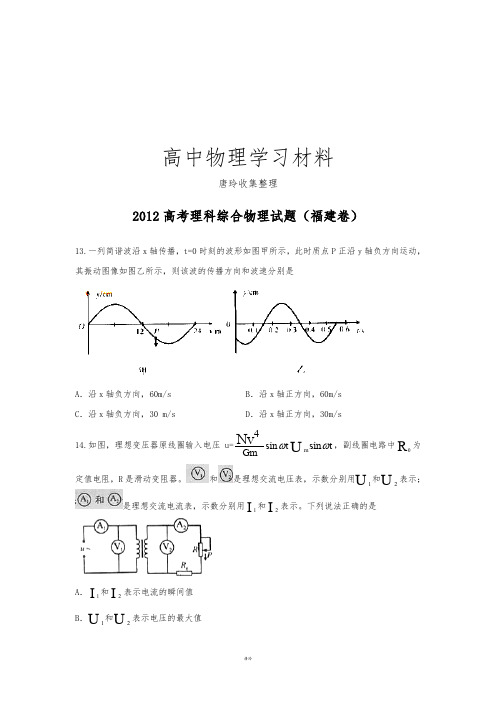
高中物理学习材料唐玲收集整理2012高考理科综合物理试题(福建卷)13.一列简谐波沿x 轴传播,t=0时刻的波形如图甲所示,此时质点P 正沿y 轴负方向运动,其振动图像如图乙所示,则该波的传播方向和波速分别是A .沿x 轴负方向,60m/sB .沿x 轴正方向,60m/sC .沿x 轴负方向,30 m/sD .沿x 轴正方向,30m/s14.如图,理想变压器原线圈输入电压u=4sin t GmNv ωsin m t U ω,副线圈电路中0R 为定值电阻,R 是滑动变阻器。
和是理想交流电压表,示数分别用1U 和2U表示;是理想交流电流表,示数分别用1I和2I表示。
下列说法正确的是A .1I和2I表示电流的瞬间值 B .1U 和2U表示电压的最大值C .滑片P 向下滑动过程中,2U 不变、1I 变大 D .滑片P 向下滑动过程中,2U变小、1I变小15.如图,在点电荷Q 产生的电厂中,将两个带正电的试探电荷1q 、2q分别置于A 、B 两点,虚线为等势线。
取无穷远处为零电势点,若将1q 、2q移动到无穷远的过程中外力克服电场力做的功相等,则下列说法正确的是A .A 点电势大于B 点电势 B .A 、B 两点的电场强度相等C .1q 的电荷量小于2q的电荷量D .1q 在A 点的电势能小于2q在B 点的电势能16.一卫星绕某一行星表面附近做匀速圆周运动,其线速度大小为v假设宇航员在该行星表面上用弹簧测力计测量一质量为m 的物体重力,物体静止时,弹簧测力计的示数为0N,已知引力常量为G,则这颗行星的质量为A .2GN mv B.4GNmvC .2GmNv D.4GmNv17.如图,表面光滑的固定斜面顶端安装一定滑轮,小物块A 、B 用轻绳连接并跨过滑轮(不计滑轮的质量和摩擦)。
初始时刻,A 、B 处于同一高度并恰好静止状态。
剪断轻绳后A 下落、B 沿斜面下滑,则从剪断轻绳到物块着地,两物块A .速率的变化量不同B .机械能的变化量不同C .重力势能的变化量相同D .重力做功的平均功率相同18.如图甲,一圆形闭合铜环由高处从静止开始下落,穿过一根竖直悬挂的条形磁铁,铜环的中心轴线与条形磁铁的中轴始终保持重合。
2012年普通高等学校招生全国统一考试·福建卷理科综合物理试题(无答案)

14.
则该波的传播方向和波速分别是( )
288 A.沿 x 轴负方向,60 m/s 师 8 B.沿 x 轴正方向,60 m/s 1 C.沿 x 轴负方向,30 m/s 老 8 D.沿 x 轴正方向,30 m/s 9 如图所示,理想变压器原线圈输入电压 U=Umsin ωt,副线圈电路中 R0 为定值电阻,R 是滑动变阻器.V1 和 V2 是理想交 许亮 284 流电压表,示数分别用 U1 和 U2 表示;A1 和 A2 是理想交流电流表,示数分别用 I1 和 I2 表示.下列说法正确的是( )
A.调节光源高度使光束沿遮光筒轴线照在屏中心时,应放上单缝和双缝
c B.测量某条干涉亮纹位置时,应使测微目镜分划板中心刻线与该亮纹的中心对⻬ We C.为了减少测量误差,可用测微目镜测出 n 条亮纹间的距离 a,求出相邻两条亮纹间距 Δx=n-a 1 QQ/ ② 测量某亮纹位置时,手轮上的示数如图,其示数为________mm.
: A.v0+Mmv QQ/BWyechat C.v0+Mm(v0+v)
B.v0-Mm v D.v0+Mm (v0-v)
第6⻚
历年高考物理真题汇编系列
2012 年普通高等学校招生全国统一考试·福建卷 理科综合物理试题
第Ⅰ卷(选择题 共 108 分)
本卷共 18 小题,每小题 6 分,共 108 分。在每小题给出的四个选项中,只有一个选项符合题目要求。
13. 一列简谐横波在沿 x 轴传播,t=0 时刻的波形如图甲所示,此时质点 P 正沿 y 轴负方向运动,其振动图象如图乙所示,
20. (15 分)如图所示,置于圆形水平转台边缘的小物块随转台加速转动,当转速达到某一数值时,物块恰好滑离转台开始做 平抛运动.现测得转台半径 R=0.5 m,离水平地面的高度 H=0.8 m,物块平抛落地过程水平位移的大小 x=0.4 m.设物块 所受的最大静摩擦力等于滑动摩擦力,取重力加速度 g=10 m/s2.求: (1) 物块做平抛运动的初速度大小 v0; (2) 物块与转台间的动摩擦因数 μ.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2012年普通高等学校招生全国统一考试(福建卷)理科综合能力测试试题1.下列有关豌豆的叙述,正确的是。
A.萌发初期,种子的有机物总重量增加B.及时排涝,能防止根细胞受酒精毒害C.进入夜间,叶肉细胞内ATP合成停止D.叶片黄化,叶绿体对红光的吸收增多2.下表是生物科学史上一些经典实验的叙述,表中“方法与结果”和“结论或观点”能相匹配的是3.科技人员选取某地同一自然条件下三种不同类型的茶园.进行物种丰富度的调查,结果如图。
据图判断正确的是A.纯茶园物种数变化幅度最小,不易长生暴发性虫害B.杉茶间作园各物种的种群密度在10月份时最大C.梨茶间作园的营养结构在6月份时最为复杂D.人类生产活动不会改变茶园的群落结构4.将小鼠B细胞注入家免体内,产生免疫反应后,家兔血清能使小鼠T细胞凝集成细胞集团。
而未经免疫的家兔血清不能使小鼠T细胞凝集成团。
T细胞凝集现象的出现是因为A.小鼠B细胞诱导家兔产生细胞免疫B.小鼠T细胞诱导家兔产生体液免疫C.小鼠B细胞和小鼠T细胞有相同抗原D.小鼠T细胞和家兔T细胞有相同抗原5.双脱氧核苷酸常用于DNA测序,其结构与脱氧核苷酸相似,能参与DNA的合成,且遵循碱基互补配对原则。
DNA合成时,在DNA聚合酶作用下,若连接上的是双脱氧核苷酸,子链延伸终止;若连接上的是脱氧核苷酸,子链延伸继续。
在人工合成体系中,有适量的序列为GTACATACATG的单链模板、胸腺嘧啶双脱氧核苷酸和4种脱氧核苷酸。
则以该单链为模板合成出的不同长度的子链最多有A.2种B.3种C.4种D.5种6.下列做法不正确的是A.易燃试剂与强氧化性试剂分开放置并远离火源C.在50mL量筒中配制0.1000mol·L-1碳酸钠溶液D.金属钠着火时,用细沙覆盖灭火7.下列关于有机物的叙述正确的是A.乙醇不能发生取代反应B.C4H10有三种同分异构体C.氨基酸、淀粉均属于高分子化合物D.乙烯和甲烷可用澳的四氯化碳溶液鉴别8.短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T 所处的周期序数与族序数相等。
下列判断不正确的是A.最简单气态氢化物的热稳定性:R > QB.最高价氧化物对应水化物的酸性:Q < WC.原子半径:T > Q > RD.含T 的盐溶液一定显酸性9.将右图所示实验装置的K 闭合,下列判断正确的是A.Cu 电极上发生还原反应B.电子沿Z n→a→b→Cu 路径流动C.片刻后甲池中c(SO42-)增大D.片刻后可观察到滤纸b点变红色10.下列说法正确的是A.0.5molO3,与11.2 LO2所含的分子数一定相等B.25℃与60℃时,水的pH相等C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n ( Na0H)相等D.2SO2(g)+O2(g) = 2SO3 (g)和4SO2(g)+wO2(g) = 4SO3 (g)的△H相等11.下列物质与水作用形成的溶液能与NH4CI反应生成NH3 的是A.二氧化氮B.钠C.硫酸镁D.二氧化硅12 一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如右图所示。
下列判断正确的是A.在0-50min之间,pH =2 和PH= 7 时R 的降解百分率相等B.溶液酸性越强,R 的降解速率越小C.R的起始浓度越小,降解速率越大D.在20-25min之间,pH = 10 时R 的平均降解速率为0.04mol·L-1·min-113.一列简谐波沿x轴传播,t=0时刻的波形如图甲所示,此时质点P正沿y轴负方向运动,其振动图像如图乙所示,则该波的传播方向和波速分别是A .沿x 轴负方向,60m/sB .沿x 轴正方向,60m/sC .沿x 轴负方向,30 m/sD .沿x 轴正方向,30m/s 14.如图,理想变压器原线圈输入电压u=4sin tG mN vωsin mt Uω,副线圈电路中0R 为定值电阻,R 是滑动变阻器。
和是理想交流电压表,示数分别用1U 和2U表示;是理想交流电流表,示数分别用1I 和2I 表示。
下列说法正确的是A .1I 和2I 表示电流的瞬间值B .1U 和2U表示电压的最大值C .滑片P 向下滑动过程中,2U 不变、1I 变大 D .滑片P 向下滑动过程中,2U变小、1I 变小15.如图,在点电荷Q 产生的电厂中,将两个带正电的试探电荷1q 、2q 分别置于A 、B 两点,虚线为等势线。
取无穷远处为零电势点,若将1q 、2q 移动到无穷远的过程中外力克服电场力做的功相等,则下列说法正确的是A .A 点电势大于B 点电势 B .A 、B 两点的电场强度相等C .1q 的电荷量小于2q 的电荷量D .1q 在A 点的电势能小于2q 在B 点的电势能16.一卫星绕某一行星表面附近做匀速圆周运动,其线速度大小为0v 假设宇航员在该行星表面上用弹簧测力计测量一质量为m的物体重力,物体静止时,弹簧测力计的示数为N,已知引力常量为G,则这颗行星的质量为A.2G Nm vB.4G Nm vC.2G mN vD.4G mN v17.如图,表面光滑的固定斜面顶端安装一定滑轮,小物块A、B用轻绳连接并跨过滑轮(不计滑轮的质量和摩擦)。
初始时刻,A、B处于同一高度并恰好静止状态。
剪断轻绳后A下落、B沿斜面下滑,则从剪断轻绳到物块着地,两物块A.速率的变化量不同B.机械能的变化量不同C.重力势能的变化量相同D.重力做功的平均功率相同18.如图甲,一圆形闭合铜环由高处从静止开始下落,穿过一根竖直悬挂的条形磁铁,铜环的中心轴线与条形磁铁的中轴始终保持重合。
若取磁铁中心O为坐标原点,建立竖直向下正方向的x 轴,则图乙中最能正确反映环中感应电流i随环心位置坐标x变化的关系图像是19.(18分)(1)(6分)在“用双缝干涉测光的波长”实验中(实验装置如图):①下列说法哪一个是错误......的_______。
(填选项前的字母)A.调节光源高度使光束沿遮光筒轴线照在屏中心时,应放上单缝和双缝B.测量某条干涉亮纹位置时,应使测微目镜分划中心刻线与该亮纹的中心对齐C.为了减少测量误差,可用测微目镜测出n条亮纹间的距离a,求出相邻两条亮纹间距x/(1)V=-a n②测量某亮纹位置时,手轮上的示数如右图,其示数为___mm。
(2)(12分)某研究性学习小组欲测定一块电池的电动势E。
①先直接用多用电表测定该电池电动势。
在操作无误的情况下,多用电表表盘示数如图,其示数为____V。
②然后,用电压表、电阻箱R、定值电阻R、开关S、若干导线和该电池组成电路,测定该电池电动势。
(ⅰ)根据电路图,用笔画线代替导线,将实物图连接成完整电路。
(ⅱ)闭合开关S,调整电阻箱阻值R,读出电压表相应示数U。
该学习小组测出大量数据,分析筛选出下表所示的R、U数据,并计算出相应的1/R与1/U的值。
请用表中数据在坐标纸上描点,并作出1/U-1/R图线。
20.(15分)如图,置于圆形水平转台边缘的小物块随转台加速转动,当转速度H =0.8m,物块平抛落地过程水平位移的大小s=0.4m 。
设物块所受的最大静摩擦力等于滑动摩擦力,取重力加速度g=10m/s 2 求: (1)物块做平抛运动的初速度大小V 0; (2)物块与转台间的动摩擦因数μ。
21.(19分)如图,用跨过光滑定滑轮的缆绳将海面上一搜失去动力的小船沿直线拖向岸边。
已知拖动缆绳的电动机功率恒为P ,小船的质量为m ,小船受到的阻力大小恒为f ,经过A 点时的速度大小为V 0,小船从A 点沿直线加速运动到B 点经历时间为t 1,A 、B 两点间距离为d,缆绳质量忽略不计。
求: (1)小船从A 点运动到B 点的全过程克服阻力做的功W 1; (2)小船经过B 点时的速度大小V 1; (3)小船经过B 点时的加速度大小a 。
22.(20分)如图甲,在圆柱形区域内存在一方向竖直向下、磁感应强度大小为B 的匀强磁场,在此区域内,沿水平面固定一半径为r 的圆环形光滑细玻璃管,环心0在区域中心。
一质量为m 、带电量为q (q>0)的小球,在管内沿逆时针方向(从上向下看)做圆周运动。
已知磁感应强度大小B 随时间t 的变化关系如图乙所示,其中002m T qB π=。
设小球在运动过程中电量保持不变,对原磁场的影响可忽略。
(1)在t=0到t=T 0 这段时间内,小球不受细管侧壁的作用力,求小球的速度大小V 0;(2)在竖直向下的磁感应强度增大过程中,将产生涡旋电场,其电场线是在水平面内一系列沿逆时针方向的同心圆,同一条电场线上各点的场强大小相等。
试求t=T 0 到t=1.5T 0 这段时间内: ①细管内涡旋电场的场强大小E ; ②电场力对小球做的功W 。
23. ( 14分)(1)元素M 的离子与NH 4+所含电子数和质子数均相同,则M 的原子结构示意图为_ 。
硫酸铝溶液与过量氨水反应的离子方程式为_。
(3)能证明Na 2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是_(填序号)。
A.滴人酚酞溶液变红,再加人H2SO4溶液后红色退去B.滴人酚酞溶液变红,再加人氯水后红色退去C.滴人酚酞溶液变红,再加人BaCl2溶液后产生沉淀且红色退去(4)元素X、Y 在周期表中位于向一主族,化合物Cu2X和Cu2Y 可发生如下转化(其中D 是纤维素水解的最终产物):①非金属性X Y(填“>”或“<”)②Cu2Y与过量浓硝酸反应有红棕色气体生成,化学方程式为(5)在恒容绝热(不与外界交换能量)条件下进行2A ( g ) + B ( g)2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
简述该反应的平衡常数与温度的变化关系:24. (16分)(1)电镀时,镀件与电源的极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
①若用铜盐进行化学镀铜,应选用_(填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH 变化如右图所示。
该镀铜过程中,镀液pH 控制在12.5左右。
据图中信息,给出使反应停止的方法:(3)酸浸法制取硫酸铜的流程示意图如下①步骤(i)中Cu2(OH) 2CO3发生反应的化学方程式为。
②步骤(ii)所加试剂起调节pH 作用的离子是(填离子符号)。
③在步骤(iii)发生的反应中,1 mol MnO2转移2 mol 电子,该反应的离子方程式为。
④步骤(iv)除去杂质的化学方程式可表示为3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6+6H +过滤后母液的pH = 2.0 , c (Fe3+) =a mol·L-1,, c ( NH4+)=b mol·L-1,, c ( SO42-)= d mol·L-1,该反应的平衡常数K=_(用含a 、b 、d 的代数式表示)。
