甘肃地区201X年中考化学总复习第九单元溶液课件
合集下载
中考总复习人教版化学知识点总结第九单元溶液PPT课件
溶液性质的易错、易混点
(1)溶液都是透明的,但不一定是无色的,如硫酸铜溶液是蓝色的,碘酒是棕黄 色的。 (2)溶液的质量=溶质的质量+溶剂的质量;溶液的体积≠溶质的体积+溶剂的 体积。
2.溶解时的吸热或放热现象 (1)有些物质溶解时会出现吸热现象,溶解时溶液温度降低,如 硝酸铵 溶
于水。 (2)有些物质溶解时会出现放热现象,溶曲 曲线 线下 上方 方的 的点 点::表 表示 示溶 溶液 液为 饱和不且饱有和未溶溶液晶体
中 考 总 复 习 人教版 化学知 识点总 结第九 单元溶 液PPT课 件
中 考 总 复 习 人教版 化学知 识点总 结第九 单元溶 液PPT课 件
(3)溶解度曲线的应用
①判断某种物质在不同温度下的溶解度大小;
溶质质量+100g
中 考 总 复 习 人教版 化学知 识点总 结第九 单元溶 液PPT课 件
中 考 总 复 习 人教版 化学知 识点总 结第九 单元溶 液PPT课 件
[拓展思考2] 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液吗? 答案:对于不同溶质的溶液来说,溶液的“浓、稀”与饱和、不饱和无关, 浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。对于同一种溶质 来说,在一定温度下,饱和溶液比不饱和溶液浓。
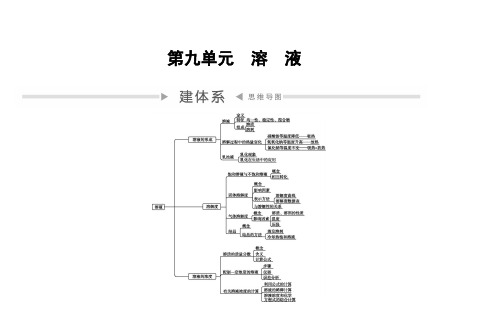
第九单元 溶 液
溶液的形成
1.溶液 (1)概念: 一种或几种 物质分散到另一种物质里,形成 均一 的、 稳定 的 混合物。 (2)溶液的特征:具有 均一 性、 稳定 性。 (3)溶液的组成 ①溶质: 被溶解 的物质。可以是固体,也可以是液体或气体。 ②溶剂: 能溶解其他物质 的物质。水是一种最常用的溶剂。
(1)实验用品 托盘天平 、 量筒 、 烧杯
(2)实验步骤 ① 计算 、② 称量 、③ 量取
中考化学复习专题第九单元 溶液(共28张PPT)

(1)表示某物质的溶解度随温度变化的趋势。
其变化趋势可分为三种:
变化趋势 图Ⅰ物质 代表物质 溶质从溶液中分离的方法
陡升型
甲
KNO3 __冷__却_热__饱__和__溶_液____(降温结晶)
缓升型
乙
NaCl
_蒸__发__溶__剂___(蒸发结晶)
缓降型
丙
Ca(OH)2
蒸发结晶或升温
(2)确定某物质在某一温度下的溶解度。 如图Ⅱ,①10 ℃时,A 的溶解度为__5__g,即 100 g 水中可溶解__5__g A。 ②20 ℃时,若把 5 g A 溶于 100 g 水中,则所得溶液为__不_饱__和___(填“饱和”或“不 饱和”)溶液。 (3)比较同一温度下,不同物质的溶解度大小。 如图Ⅱ,①在 10 ℃ 时,A 的溶解度_小__于___(填“大于”“小于”或“等于”)B 的 溶解度。 ②20 ℃时(曲线交点),A、B 两物质的溶解度_相__等___。 ③30 ℃时,A 的溶解度大于 B。此温度下,用 100 g 水分别将 A、B 配制成饱和溶 液,所需溶质 A 的质量__大_于___(填“大于”“小于”或“等于”)B 的质量。 ④分别将 100 g A、B 的饱和溶液的温度由 30 ℃降到 10 ℃,析出晶体的质量较多的 是物质__A__。
3.根据不同物质的性质,提纯物质的方法可以有多种。下面呈现的是化学课堂上 “物质提纯”的小组竞赛场景。
(1)甲组抽到的题目是“从 30 g NaCl 和 2 g KNO3 的混合物中提纯 NaCl”。同学们 经研究认为依据两物质的溶解度曲线,可采用如下物理方法来提纯。
上述两固体__能__(填“能”或“不能”)全部溶解,操作 m 的名称是__过_滤___,蒸发结 晶后得到的 NaCl 的质量_小__于___30 g(填“大于”“小于”或“等于”)。
九年级化学下册 第九单元《溶液》复习课件

我会做:
1.有下列物质:
20分钟
①牛奶;②无水酒精;③澄清石灰水;④泥水;
⑤澄清透明的海水;⑥食盐水;⑦茅台酒;⑧
面粉与水的混合物,
③ 其中(qízhōng)属于溶液是 ⑤ ⑥ ⑦
;
第三页,共二十二页。
பைடு நூலகம் 再接再厉
4.有下列有关溶液的认识,是否错误(cuòwù)?如有错
误(cuòwù),请举例说明。
A.升高温度
B.降低(jiàngdī)温度
C.加入一定量蒸馏水 D.静置后过滤
5.20℃时,在10g水中溶解了6gA物质,下列结论正确
是C( ) (zhèngquè)
A 、20℃时, 物质A的溶解度为60g
B. 温度降到5℃时,一定有晶体析出
C、A物质属于易溶物质 12/11/2021
D. 保持温度不变时,若蒸发掉5g水,则析出3g晶体
12/11/2021
第二十一页,共二十二页。
内容(nèiróng)总结
第九单元复习。错,熟石灰和气体的溶解度随温度的升高而减小。6.自然界中的某些现象都跟物质的溶解度 有关。根据下列事实推测外界因素是如何影响物质的溶解度的:。⑵ 加热到20℃时的饱和石灰水,石灰水变浑浊。 当堂训练
No 《学习新策略》P129-130单元练习
时出现图2所示的现象。则t2℃时烧杯中甲物质
溶液的质量是 115 克;配制360克t1℃时乙的
饱和溶液,需要乙物质
克。
60
乙
第十二页,共二十二页。
6.下图是氢氧化钙的溶解度曲线图。现有10℃
含l00g水的澄清氢氧化钙饱和溶液。若把该溶
液用水浴加热到60℃(水的蒸发忽略不汁).下列
说法错误的是( B)
初中九年级化学中考总复习第9单元溶液课件PPT

第一部分 教材同步复习
6
3.转化 (一般情况) 增加 溶质、_______ 蒸发 溶剂或降低温度 __________饱和 不饱和_______ 溶液 溶液 增加 溶剂或__________ 升高温度 _______
②溶剂性质(同一种溶质在不同种溶剂中的溶解度不同)。
外因:温度。 ①多数固体物质的溶解度随温度的升高而增大,如硝酸钾。 ②少数固体物质的溶解度随温度变化的影响很小,如氯化钠。 ③极少数固体物质的溶解度随温度升高而减小,如氢氧化钙。
第一部分 教材同步复习
11
2.气体溶解度 (1)定义:在压强为101 kPa和一定温度时,气体溶解在1体积水里达到饱和状态
第一部分 教材同步复习
2
【注意】①均一、稳定的液体不一定是溶液,如水、酒精等。②溶液不一定都 是无色的,如硫酸铜溶液为蓝色,氯化亚铁溶液为浅绿色,氯化铁溶液为黄色。③
溶质可以是固体,也可以是液体或气体;水是最常用的溶剂,汽油、酒精等也可以
作溶剂。④溶液质量=溶质质量+溶剂质量,但溶液体积≠溶质体积+溶剂体积。
初中九年级化学中考总复习第9 单元溶液课件
第一部分 教材同步复习
1
知识要点 ·归纳
要点1 溶液的形成
1.溶液(高频考点) (1) 定 义 : 一 种 或 几 种 物 质 分 散 到 另 一 种 物 质 里 , 形 成 均 一 的 、 稳 定 的
混合物 。 __________
均一 性、________ 稳定 性。 (2)特征:具有_______ 溶质 和________ 溶剂 组成。被溶解的物质叫________ 溶质 ,能溶解其他物 (3)组成:由_______ 溶剂 。 质的物质叫_______
中考化学总复习 第九单元 溶液课件

内容
点
考点(kǎo
diǎn)二
考点(kǎo
diǎn)三
考点四
表示意义
曲线上 表示物质在对应温
的点
度时的溶解度
两曲线 表示两物质在某温
交点
度时的溶解度相等
表示物质的溶解度
线
随温度改变而变化
的趋势
举例(以图为例)
如 A 点、B 点分别表示物质 N、M
在 t1 ℃时的溶解度分别为 a g 和 b
g
如 C 点表示 M、N 在 t2 ℃时的溶
考点(kǎo
diǎn)二
考点(kǎo
diǎn)三
考点四
5.结晶
(1)定义:在一定条件下,固体物质从它的饱和溶液中以晶体的形式析出的过
程。
(2)结晶方法。
①蒸发结晶法:适用于溶解度受温度影响较小 的物质,如氯化钠;
②降温结晶法:适用于溶解度受温度影响较大 的物质,如硝酸钾。
第八页,共二十六页。
考点(kǎo
小 ,随压强增大而增大 。
第十四页,共二十六页。
考点(kǎo
diǎn)一
考点(kǎo
diǎn)二
考点(kǎo
diǎn)三
考点四
溶质的质量分数及计算
1.溶质的质量分数的计算公式
(1)适用于所有的溶液:
溶质质量
溶质的质量分数=
(2)适用于饱和溶液:
溶质质量分数=
×100%
。
溶质质量+溶剂质量
溶解度
。
×100%
所配制溶液的溶质质量分数偏小的原因:(1)量取水时仰视量取;(2)使用游
码称量时将溶质与砝码的位置放反了;(3)配制溶液的烧杯内有少量水;(4)
中考(甘肃)化学总复习课件:第九单元 溶液(共28张PPT)

3
考点4
考点1
考点2
考点3
考点4
考点1
考点2
考点3
考点4
内容
表示意义
点
曲线上 表示物质在对应温 的点 度时的溶解度
两曲线 表示两物质在某温 交点 度时的溶解度相等 表示物质的溶解度 线 随温度改变而变化 的趋势
举例(以图为例) 如 A 点、 B 点分别表示物质 N、 M 在 t1 ℃时的溶解度分别为 a g 和 b g 如 C 点表示 M、 N 在 t2 ℃时的溶 解度相等, 均为 c g 如 M 的溶解度随温度的升高而增 大,N 的溶解度随温度的升高而减 小
考法1
考法2
考法3
考法4
解析t1 ℃时,A、C的溶解度相同,A、C两种物质的饱和溶液中溶 质的质量分数相等,此处没有提溶液的质量,故无法比较溶质质量 的大小,A项错误;t2 ℃时,A的溶解度是50 g,把50 g A放入50 g水中 能得到A的饱和溶液,此时只能溶解25 g A,故溶液质量是75 g,其中 溶质和溶液的质量比为25 g∶75 g=1∶3,B项正确;t2 ℃时,将A、B、 C三种物质的饱和溶液降温至t1 ℃,A、B的溶解度减小,有晶体析 出,t1 ℃时B的溶解度大于A的溶解度,故B的溶质质量分数大于A的 溶质质量分数,C的溶解度随温度的降低而增大,故溶液组成不变,此 时,C溶液的溶质质量分数与t2 ℃时相同,据图可以看出,C的溶质质 量分数最小,故所得溶液溶质质量分数的大小关系是B>A>C,C项错 误;将C的饱和溶液变为不饱和溶液,可采用降温的方法,D项错误。
仅供学习交流!!!
考法1
考法2
考法3
考法4
解析由溶解度曲线分析可知,甲、乙两种物质在30 ℃时溶解度 相等,A项正确;20 ℃时甲中有固体剩余,说明20 ℃时甲的溶解度小, 所以M是甲的溶解度曲线,N是乙的溶解度曲线,B项正确;图1中表 示20 ℃时甲一定是饱和溶液,乙可能是饱和溶液,C项错误;图2中均 无固体剩余,说明全部溶解,相同质量的溶剂溶解了相同质量的溶 质,所以两溶液中溶质的质量分数一定相等,D项正确。
考点4
考点1
考点2
考点3
考点4
考点1
考点2
考点3
考点4
内容
表示意义
点
曲线上 表示物质在对应温 的点 度时的溶解度
两曲线 表示两物质在某温 交点 度时的溶解度相等 表示物质的溶解度 线 随温度改变而变化 的趋势
举例(以图为例) 如 A 点、 B 点分别表示物质 N、 M 在 t1 ℃时的溶解度分别为 a g 和 b g 如 C 点表示 M、 N 在 t2 ℃时的溶 解度相等, 均为 c g 如 M 的溶解度随温度的升高而增 大,N 的溶解度随温度的升高而减 小
考法1
考法2
考法3
考法4
解析t1 ℃时,A、C的溶解度相同,A、C两种物质的饱和溶液中溶 质的质量分数相等,此处没有提溶液的质量,故无法比较溶质质量 的大小,A项错误;t2 ℃时,A的溶解度是50 g,把50 g A放入50 g水中 能得到A的饱和溶液,此时只能溶解25 g A,故溶液质量是75 g,其中 溶质和溶液的质量比为25 g∶75 g=1∶3,B项正确;t2 ℃时,将A、B、 C三种物质的饱和溶液降温至t1 ℃,A、B的溶解度减小,有晶体析 出,t1 ℃时B的溶解度大于A的溶解度,故B的溶质质量分数大于A的 溶质质量分数,C的溶解度随温度的降低而增大,故溶液组成不变,此 时,C溶液的溶质质量分数与t2 ℃时相同,据图可以看出,C的溶质质 量分数最小,故所得溶液溶质质量分数的大小关系是B>A>C,C项错 误;将C的饱和溶液变为不饱和溶液,可采用降温的方法,D项错误。
仅供学习交流!!!
考法1
考法2
考法3
考法4
解析由溶解度曲线分析可知,甲、乙两种物质在30 ℃时溶解度 相等,A项正确;20 ℃时甲中有固体剩余,说明20 ℃时甲的溶解度小, 所以M是甲的溶解度曲线,N是乙的溶解度曲线,B项正确;图1中表 示20 ℃时甲一定是饱和溶液,乙可能是饱和溶液,C项错误;图2中均 无固体剩余,说明全部溶解,相同质量的溶剂溶解了相同质量的溶 质,所以两溶液中溶质的质量分数一定相等,D项正确。
