第一节 常见的金属材料
金属的性质与利用
第一节金属的性质和利用一、常见金属的物理性质1. 一起回想,你知道哪些金属?你见过哪些金属?2. 翻看元素周期表,看看已知的都有哪些金属?3. 想一想生活中哪些地方用到了金属?分别利用了金属的哪些性质?(1)铁、铝常用来做锅、铲等炊具,表现出金属的哪种物理性质?(2)铁、铝、铜等可以加工成导线、薄片,表现出金属的哪些物理性质?(3)金、银、箔等做成各种首饰,表现出金属的哪种物理性质?4. 金属的物理性质(1)相似性:大多数金属都有金属光泽,密度、硬度较大,熔、沸点较高、具有良好的导电、导热、延展性。
(2)汞常温下为液态,铜为紫红色,银的导电能力最强,熔点最高的金属是钨,钠、钾很软且密度比水小等。
注意:金属光泽只有在金属成块时才能表现出来,金属粉末一般呈暗灰色或黑色,但铝粉呈银白色,常用于防锈。
思考:(1)为什么铁制锅铲上要加木柄或塑料柄?(2)银的导电性最好,为什么不用银作导线?(3)联合国卫生组织为什么提倡使用铁锅炊具?(4)选择铸造硬币的金属时要考虑到哪些因素?(5)为什么制造菜刀、镰刀、锤子时用铁不用铅?(6)为什么用钨丝做白炽灯的灯丝?二、金属的化学性质根据你已有的知识,推测金属有哪些化学性质1. 金属与氧气反应许多金属都能和氧气反应,但是反应的难易程度和剧烈程度是不同的,如镁、铝等在常温下就能与氧气发生反应;铁、铜在常温下很难与氧气发生反应,但在点燃或加热时能与氧气反应;金在高温下也不和氧气发生反应。
根据上述实验说明铁、铝、镁、铜、金的活泼性。
“真金不怕火炼”说明了金的什么性质?2. 金属与酸的反应许多金属还能和盐酸或稀硫酸反应,生成氢气和金属化合物。
常见的金属与(稀)酸反应的现象及反应的化学方程式如下:(1)铜与稀盐酸、稀硫酸不反应;镁、铝、锌、铁都能与盐酸、稀硫酸反应,生成氢气和相应的化合物。
(2)镁、铝、锌、铁和稀盐酸、稀硫酸反应的剧烈程度不同,说明金属的活动性有差异。
(3)金属的活动性顺序:人们经过长期的实践,总结出常见金属在溶液中的活动性顺序如下:在金属活动性顺序中,金属的位置越靠前,它的活动性就越强;排在氢之前的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
常见的金属材料

4
导电 性好
硬度 5
大
6
密度 大
金属的物理性质(熔点的比较)
大部分固态金属熔点都比较高,同学们 仔细观察,水银的熔点是?这是大部分
金属的共性?这是汞的--个---性?
倾
倒
铝片
水
银 铁片
金属的物理性质(硬度的比较)
大部分的金属硬度都比较大,同学们观察用
小金刀属切的割共金性属?钠 这,是钠钠的的硬-个-度--是-性??这是大部分
A 铝合金
密度小、强度大、抗腐蚀
B 不锈钢
抗腐蚀好
D 黄铜
强度高、耐磨、耐腐蚀
我是设计师
C 锰钢
韧性好、硬度大
E 铅锑合金
电阻率大、熔点较低
E
1、列车电路保险丝
B
3、列车餐具
4、列车铁轨
C
A 2、列车车厢 D
5、列车轴承
(知识梳理)思维导图 通过本节的学
习探究,你有那些收获啊?
课外拓展
家庭实验:将长铁钉和长钢钉同时一半浸没 水中一个周,比较二者的不同部位生锈情况
鼎
锡 11.64%
铅 2.79%
合金
青铜是人类最早使用的合金, 在工农业生产生活中,我们很少 使用纯金属,而主要使用合金。 同学们谈一谈你所知道的合金材料 有哪些?
生活中常见的合金
铝镁合金 钛铝钒合金
铁铬镍合金 铁锰碳合金
合金—认识合金
【探究活动一】 1、实验目的:金属与合金的性质比较 2、试剂:铜片、黄铜片、铁片、锡粒、焊锡丝
械化主战兵器,坦克、大炮、飞机、 军舰都不能造,差距非常大。
侵华日军机枪 侵华日军坦克
化学第六章常见的金属单质 及其化合物

2FeCl3
2.与水反应
在高温条件下,铁能与水蒸气反应生成四氧化三铁和氢气,反应的化学方程
式为
高温
3Fe 4H2O(g)
图1-2 铝
二、铝
(二)铝的化学性质 1.与氧气反应 常温下,铝能够与空气中的氧气反应,表面生成一层致密而坚固的氧化
物薄膜,从而失去光泽,这层氧化物薄膜能阻止铝继续与氧气反应。 在点燃的条件下,铝能够与氧气发生剧烈反应,生成氧化铝(Al2O3),
放出大量的热,并发出耀眼的白光,反应的化学方程式为:
点燃
4Al 3O2
2Al2O3
二、铝
2.与酸反应
铝可以与稀盐酸、稀硫酸等反应,生成铝盐,并放出氢气,其实
质是铝与酸溶液中的氢离子反应,反应的离子方程式为:
2Al 6H
3.与碱反应
2Al3 3H2
铝可以与碱反应,生成偏铝酸盐和氢气。例如,铝和氢氧化钠溶
液反应,生成偏铝酸钠( NaAlO2)和氢气,反应的化学方程式为:
(一)金属的物理性质 纯金属在常温下一般都是固体(汞除外),具有金属光泽,大多呈银白
色或灰色(铜、金等少数金属除外),具有良好的导电性、导热性和延展性, 密度较大,熔点较高。 (二)金属的化学性质
金属在化学反应中,易失去最外层的电子而被氧化,变成阳离子。因此, 金属具有还原性,且活泼性越强的金属还原性越强:
图1-1 储存在煤油中的钠
一、钠
(二)钠的化学性质 钠原子的最外电子层上只有一个电子,其在化学反应中易失去最外层电子,
所以钠的化学性质非常活泼。 1.与氧气反应 在常温下,钠与氧气反应生成白色固体氧化钠( Na2O);在受热的情况下,
钠与氧气会发生剧烈反应,发出黄色火焰,并生成淡黄色固体过氧化钠 ( Na2O2 )。这两个反应的化学方程式分别为
常见的六种金属材料

常见的六种金属材料有色金属,狭义的有色金属又称非铁金属,是铁、锰、铬以外的所有金属的统称。
广义的有色金属还包括有色合金。
有色合金是以一种有色金属为基体(通常大于50%),加入一种或几种其他元素而构成的合金。
1、锌锌闪着银光又略带蓝灰色,它是继铝和铜之后第三种应用最广泛的有色金属。
美国矿产局的一项统计显示——一个普通人在其一生要消耗总共要消耗掉331千克的锌。
锌的熔点很低,所以它也是一种非常理想的浇注材料。
锌质铸件在我们日常生活中十分常见:门把手表层表层下面的材料、水龙头、电子元件等,锌具有极高的防腐蚀性,这一特性使它具备了另外最基本的一项功能,即作为钢的表面镀层材料。
除此之外,锌还是与铜一起合成青铜的合金材料。
材料特性:卫生保健、防腐蚀、优良的可铸性、出色的防腐蚀性、高强度、高硬度、原材料廉价、低熔点、抗蠕变、易与其他金属形成合金、具有保健性、常温下易碎、100摄氏度左右具有延展性。
典型用途:电子产品元件。
锌是形成青铜的合金材料之一。
锌也有着清洁卫生以及抗腐蚀的特性。
另外,锌也被应用在屋顶材料,照片雕刻盘、移动电话天线以及照相机中的快门装置。
2、铝相对于已经有9000年使用历史的黄金而言,铝,这种略带蓝光的白色金属,实在只能算是金属材料中的婴儿。
铝于18世纪初问世并被命名。
与其他金属元素不同,铝并不是以直接的金属元素的形式存在于自然界中,而是从含50%氧化铝(亦称矾土)的铝土矿中提炼出来的。
以这种形态存在于矿物中的铝也是我们地球上产量量最丰富的金属元素之一。
当铝这种金属最早出现的时候,它并没有被立刻应用到人们的生活当中。
后来,针对其独特功能和特性的一批新产品逐渐问世,这种高科技材料也逐渐拥有越来越宽阔的市场。
虽然铝的应用历史相对较短,但现在市面上铝产品的产量已经远远超过了其他有色金属产品的总和。
材料特性:柔韧可塑、易于制成合金、高强度-重量比、出色的防腐蚀性、易导电导热、可回收。
典型用途:交通工具骨架、飞行器零部件、厨房用具、包装以及家具。
九年级化学下册_知识点大全_新人教版

在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
钾、钙、钠不符合这一条。它们会先和水反应生成碱和氢气,然后碱和盐反应。
金属与盐溶液的反应:金属+盐→另一金属+另一盐(条件:
“前换后,盐可溶” )
在活动性顺序中,金属的距离大的,反应先发生。一个置换反应结束后,另一个置换反应才会发生。如在硫酸亚
判断溶液是否饱和的方法:继续加入该种溶质,如果该物质的质量减少,那么溶液是不饱和溶液;如果该物质的 质量不变,那么溶液是饱和溶液。 由于水可以和酒精以任意比例互溶,所以水和酒精不可以形成饱和溶液。
不饱和溶液与饱和溶液的转化
不饱和溶液
降温、恒温蒸发溶剂、加溶质 升温、加溶剂
饱和溶液
① 氢氧化钙和气体的溶解度随着温度升高而降低。所以若把氢氧化钙和气体的不饱和溶液变成饱和溶液,在改
黄铜
青铜
焊锡
钛和钛合金
含碳量 成分
2%~ 4.3%
含碳量 铜锌合金
0.03%~ 2%
铜锡合金
铅锡合金
备注
不锈钢是含铬、镍的钢, 具有抗锈蚀性能。 生铁较脆, 钢铁具有韧性。
紫铜是纯铜
熔点低
见下
形状记忆合金
钛镍合金
具有形状记忆 效应
1
生铁常制成暖气片。 钛和钛合金:被认为是 21 世纪的重要金属材料,钛合金与人体具有良好的“相容性” 钛和钛合金的优点:① 熔点高、密度小; ② 可塑性好、易于加工、机械性能好; 生铁和钢性能不同的原因:含碳量不同。
溶液的命名: “ [ 溶质 ] 的 [ 溶剂 ] 溶液”。如果没有指明溶剂,我们就认为水是溶剂。
水和酒精能以任意体积互溶。
探究水与乙醇能否互溶时,要先滴入红墨水(目的:为了显色,利于观察)
常用金属材料介绍

常用金属材料金属材料来源丰富,并具有优良的使用性能和加工性能,是机械工程中应用最普遍的材料,常用以制造机械设备、工具、模具,并广泛应用于工程结构中。
金属材料大致可分为黑色金属两大类。
黑色金属通常指钢和铸铁;有色金属是指黑色以外的金属及其合金,如铜合金、铝及铝合金等。
1.2.1 钢钢分为碳素钢(简称碳钢)和合金两大类。
碳钢是指含碳量小于2.11%并含有少量硅、锰、硫、磷杂质的铁碳合金。
工业用碳钢的含碳量一般为0.05%~1.35%。
为了提高钢的力学性能、工艺性能或某些特殊性能(如耐腐蚀性、耐热性、耐磨性等),冶炼中有目的地加入一些合金元素(如Mn、Si、Cr、Ni、Mo、W、V、Ti等),这种钢称为合金钢。
(一)碳钢1.碳钢的分类碳钢的分类方法有多种,常见的有以下三种。
(1)按钢的含碳量多少分类分为三类:低碳钢,含碳量<0.25%;中碳钢,含碳量为0.25%~0.60%;高碳钢,含碳量>0.60%。
(2)按钢的质量(即按钢含有害元素S、P的多少)分类分为三类:普通碳素钢,钢中S、P含量分别≤0.055%和0.045%;优质碳素钢,钢中S、P含量均≤0.040%;高级碳素钢,钢中S、P含量分别≤0.030%和0.035%。
(3)按钢的用途分类分为两类:碳素结构钢,主要用于制造各种工程构件和机械零件;碳素工具钢,主要用于制造各种工具、量具和模具等。
2.碳钢牌号的表示方法(1)碳素结构钢碳素结构钢的牌号由屈服点“屈”字汉语拼音第一个字母Q、屈服点数值、质量等级符号(A、B、C、D)及脱氧方法符号(F、b、Z)等四部分按顺序组成。
其中质量等级按A、B、C、D顺序依次增高,F代表沸腾钢,b代表镇静钢,Z代表镇静钢等。
如Q235-A·F表示屈服强度为235Mpa的A 级沸腾碳素结构钢。
(2)优质碳素结构钢优质碳素结构钢的牌号用两位数字表示。
这两位数字代表钢中的平均含碳量的万分之几。
例如45钢,表示平均含碳量为0.45%的优质碳素结构钢。
常见金属材料及非金属材料简介
C:0.33~0.38、Si :0.15~0.35、Mn :0.60~0.90、Mo:0.15~0.3(P≤0.030、S≤0.030、Cr:0.90~1.20、Ni≤0.25、Cu≤0.30)SCM435SWRMPTFE(聚四氟乙烯)FEP(全氟乙烯丙烯共聚物)PFA(全氟烷氧基树脂)PE(聚乙烯)一种使用了氟取代聚乙烯中所有氢原子的人工合成高分子材料。
这种材料具有抗酸抗碱、抗各种有机溶剂的特点,几乎不溶于所有的溶剂。
聚四氟乙烯本身对人无毒性。
有密封性、高润滑不粘性、电绝缘性和良好的抗老化能力、耐温优异(能在+250℃至-180℃的温度下长期工作)一种软性塑料,是聚四氟乙烯的改性材料。
其拉伸强度、耐磨性、抗蠕变性低于许多工程塑料。
化学惰性,不引燃,可阻止火焰的扩散。
具有优良的耐候性,摩擦系数较低。
几乎对所有的化学试试剂和溶剂惰性,但和其他全氟碳聚合物一样,会与熔融碱金属和元素氟反应。
常温下PFA材料物理机械性能与PTFE十分相似,高温时强度比FEP好,耐力开裂性显著优于FEP。
在日本JIS-G3505标准中,SWRM代表成分不同分为 SWRM6、SWRM8、SSWRM15、SWRM17、SWRM乙烯经聚合制得的一种热塑性树脂。
聚乙烯无臭,无毒,手感似蜡,具有优良的耐低温性能(最低使用温度可达-70~-100℃),化学稳定性好,能耐大多数酸碱的侵蚀(不耐具有氧化性质的酸)。
常温下不溶于一般溶剂,吸水性小,电绝缘性能优良。
性能铬钼钢中文商品名“特氟龙”、“特氟隆”(teflon),被称“塑料王”,被广泛地应用作为密封材料和填充材料。
用作工程塑料,可制成聚四氟乙烯管、棒、带、板、薄膜等,一般用于性能要求较高的耐腐蚀的管道、容器、泵、阀以及制雷达、高频通讯器材、无线电器材等。
有很高的静力强度、冲击韧性及较高的疲劳极限。
用作在高负荷下工作的重要结构件,如车辆和发动机的传动件;汽车发电价的转子、主轴、重载荷的传动轴,大断面零件。
常用金属材料成分

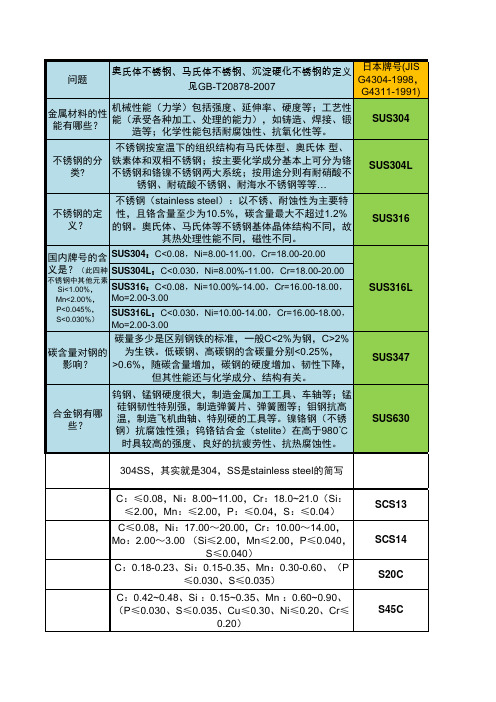
黑色金属20,45,65Mn,1Cr18Ni9Ti,60SI2Mn,2Cr13,CrWMn,40CrNiMo精密合金1J79(Ni含量高,不太适于直读光谱检测),4J36铝合金LF2,LF6,LF21,LC4,LY12,ZL101A,LD5铜合金TU2,HPb59-1,H62,H96,QBe2,锡青铜,铝青铜一、黑色金属45:化学成分(%)0.42-0.50C, 0.17-0.37Si, 0.50-0.80Mn, ≤0.035P, ≤0.035S, 0.25Ni, 0.25Cr, 0.25Cu65Mn碳 C :0.62~0.70硅 Si:0.17~0.37锰 Mn:0.90~1.20硫 S :≤0.035磷 P :≤0.035铬 Cr:≤0.25镍 Ni:≤0.30铜 Cu:≤0.2560SI2Mn:碳 C :0.56~0.6硅 Si:1.50~2.00 锰 Mn:0.60~0.90 硫 S :≤0.035磷 P :≤0.035铬 Cr:≤0.35 镍 Ni:≤0.35 铜 Cu:≤0.251Cr18Ni9Ti碳 C :≤0.12%。
硅 Si:≤1.00%。
锰 Mn:≤2.00%。
硫 S :≤0.030%。
磷 P :≤0.035%。
铬 Cr:17.00~19.00%。
镍 Ni:8.00~11.00%。
钛 Ti:0.50~0.80%。
2Cr13碳 C :0.16~0.25硅 Si:≤1.00锰 Mn:≤1.00硫 S :≤0.030 磷 P :≤0.035铬Cr:12.00~14.00镍 Ni:允许含有≤0.60CrWMn碳 C :0.85~0.95 硅 Si:≤0.40 锰 Mn:0.90~1.20 硫 S :≤0.030 磷 P :≤0.030铬 Cr:0.50~0.80 镍 Ni:允许残余含量≤0.25 铜 Cu:允许残余含量≤0.30钨 W :0.70~1.240CrNiMo:碳C 0.37~0.44 硅Si 0.17~0.37 锰Mn 0.50~0.80, 硫S允许残余含量≤0.025,磷P允许残余含量≤0.025, 铬Cr 0.60~0.90,镍Ni 1.25~1.65,铜Cu允许残余含量≤0.025, 钼Mo 0.15~0.25精密合金4J364J36 镍Ni 铬Cr 铁Fe 碳C 锰Mn 硅Si 钴Co 磷P 硫S最大值35-37 0.2 余量0.03 0.35 0.2 0.5 0.02 0.01其他:易切削钢,比常规碳钢S、Pb(0.3)高一点二、铝合金LF6铝Al :余量硅Si :≤0.40铜Cu :≤0.10镁Mg:5.8~6.8锌Zn:≤0.20锰Mn:0.50~0.8 钛Ti :0.02~0.10铍Be :0.0001~0.005铁Fe:0.000~0.400LF21硅Si:0.60 铁Fe: 0.70 铜Cu:0.20 锰Mn:1.0-1.6 镁Mg:0.05锌Zn:0..15 钛Ti:0.10-0.20 铝Al:余量LY12硅 Si: 0.50 铁 Fe:0.50 铜 Cu:3.8~4.9 锰 Mn:0.3~0.9 镁 Mg:1.2~1.8 铬Cr:0.10 镍 Ni: -- 锌 Zn:0.25 钛 Ti :0.15 其它: 0.15 铝 Al:余量LC4硅Si:0.50 铁Fe: 0.50 铜Cu:1.4-2.0 锰Mn:0.20-0.6 镁Mg:1.8-2.8 铬Cr:0.10-0.25 锌Zn:5.0-7.0 钛Ti:0.10 铝Al:余量LD5硅Si:0.7-1.2铁Fe: 0.7铜Cu:1.8-2.6锰Mn:0.40-0.8镁Mg:0.40-0.8锌Zn:0.30 钛Ti:0.15镍Ni:0.10铝Al:余量ZL101A硅 Si :6.5~7.5 镁 Mg:0.25~0.45 钛 Ti:0.08-0.20 铝 Al :余量铁(砂型铸造): 0.000~ 0.200 铜 Cu :≤0.1(杂质) 锰 Mn:≤0.10(杂质) 锌 Zn:≤0.1(杂质) 稀 Zr:≤0.20(杂质) 锡 Sn :≤0.01(杂质) 铅 Pb:≤0.03(杂质) ZL114A硅 Si :6.5~7.5 镁 Mg:0.45-0.60 钛 Ti:0.10-0.20 铍 Be :0.04~0.07(保证力学时,可不加) 铝 Al :余量铁(砂型铸造): 0.000~ 0.200锰 Mn:≤0.1(杂质) 镁 Mg:≤0.1(杂质)钛 Ti:≤0.1(杂质)钛+稀土 Ti+Sb:≤0.20(杂质) 锡 Sn :≤0.01(杂质) 铅 Pb:≤0.03(杂质) 注:杂质总和:(砂型铸造)≤0.75三、铜合金TU2紫铜Cu+Ag:99.5,P:0.002 ,Bi:0.001,Sb:0.002,As:0.002 ,Fe:0.004 ,Ni:0.002 Pb:0.004,Sn:0.002,S:0.004 ,Zn:0.003,O:0.03HPb59-1Cu:57.0-60.0 Ni:1.0 Fe:0.5 Pb:0.8-1.9 Zn:余量杂质:1.0H62铜(Cu):60.5~63.5% 铁(Fe):≤ 0.15%铅(Pb):≤ 0.08% 锑(Sb):≤0.005% 铋(Bi):≤0.002%磷(P):≤0.01%锌(Zn):余量杂质总和:≤0.5%H96铜 Cu :95.0~97.0 锌 Zn:余量铅 Pb:≤0.03 磷 P:≤0.01铁 Fe:≤0.10 锑 Sb :≤0.005 铋 Bi:≤0.002 注:≤0.2(杂质)QBe2铝(Al)≤0.15,硅(Si)≤0.15,铅(Pb)≤0.005,(Cu)余量,铁(Fe)≤0.15,铍(Be)1.8~2.1,镍(Ni)0.2~0.4,杂质总各%≤0.5(QSn1-1)QSn4-3化学成分:锡(Sn)3.5~4.5,锌(Zn)2.7~3.3,铝(Al)≤0.002,硅(Si)≤0.002,磷(P)≤0.03,铁(Fe)≤0.05,铅(Pb)≤0.02,铜(Cu)余量,锑(Sb)≤0.002,铋(Bi)≤0.002,杂质总和%≤0.2QSi3.5-3-1.5化学成分:锑(Sb)≤0.002,铁(Fe)1.2~1.8,镍(Ni)≤0.2,硅(Si)3.0~4.0,锡(Sn)≤0.25,铅(Pb)≤0.03,铜(Cu)余量,锌(Zn)2.5~3.5,锰(Mn)0.5~0.9,磷(P)≤0.03,砷(As)≤0.002,杂质总和%≤1.1铝青铜9-4-4-2铜 Cu :其余铅 Pb:≤0.02(杂质) 镍 Ni:4.0~5.0 铝 Al:8.5~10.0铁 Fe:4.0~5.0 锰 Mn:0.8~2.5 硅 Si :≤0.15(杂质) 碳 C:≤0.10(杂质) 注:杂质总和≤1.0。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铝和铝合金的应用
2、生活中为什么大量使 用铝合金做门窗,而不 用纯铝? 铝合金的硬度比铝大。 一架波音767大型飞机约由 70%的铝及其合金构成。 1、铝合金做用于制造飞行 是利用了什么性质? 铝合金的硬度大、密度小。
黄 铜
铜
焊 锡
锡
二、合金
1.定义:
在金属中加热熔合某些金属或非金属形成的具有金属 特征的物质。
黄铜硬度大
焊锡硬度大
合金的硬度比组成其纯金属大
实验二:
将绿豆大的焊锡、锡和铅放置在铁片上,加热铁片 的中心部分,观察,比较焊锡和组成它的纯金属锡、 铅的熔化温度
焊锡 锡 铅
焊锡最先熔化,锡次 现象 之,铅最后熔化 合金的熔点低于纯 结论 金属
3.几种常见的合金
1)铁的合金 生铁:含碳2%-4.3% 钢 :含碳0.03%-2%
△
Cu + H2O Cu + CO2
高温
C + 2CuO
高温
2Cu + CO2↑
2Fe + 3H2O 2Fe + 3CO2
3H2 + Fe2O3 3CO + Fe2O3
△
高温
3C + 2Fe2O3
高温
4Fe + 3CO2↑
Fe2O3
现象:红色固体变黑,澄清石灰水变浑浊。
2.CO还原Fe2O3
思考:
资源丰富 无毒轻便 耐磨耐腐蚀 美观、易加工
钛和钛合金 被认为是 21 世纪的重要材
钛金属手表
料,它具有很多优良的性能,如熔点高、 密度小、可塑性好、易于加工、机械性能 好等。尤其是抗腐蚀性能非常好,即使把 它们放在海水中数年,取出后仍光亮如新, 其抗腐蚀性能远优于不锈钢,因此被广泛 用于火箭、导弹、航天飞机、船舶、化工 和通讯设备等
钛合金与人体有很好的“相容性”,因此可用来制造人造骨
白金
白金全称为“白色 K 金”,是将黄金与铜、 镍、锌等金属熔合在 一起后所制成的一种 白色合金。其中,黄 金的质量分数最多为 75%。
铂金
铂是稀有的贵金属,在首饰 行业又叫做铂金,开采量只 有黄金的5%。铂金的强度和 韧性都比其他贵金属高得多, 1 g铂金可以拉成1.6 km长的 细丝而不断裂,因此用铂金 制作的首饰坚韧,如钻石镶 嵌其中会很牢固,不易脱落。 铂金的白色光泽是天然的, 经久不会改变,而白金的色 泽不是天然的,时间长了就 可能会褪色。
气——灯——灯——气
练一练
1、反应开始应先 ,目的是: 。 2、A、B两个酒精灯的作用分别是 、 。 3、玻璃管内的现象是 。澄清石灰水处 的现象为 ,证明生成了 。 4、反应结束,应先 后 , 目的是为了防止 。
关于氧化反应和还原反应以及氧化 剂和还原剂。
• 请判断:在下列反应中,哪些物质是还原 剂,那些物质是氧化剂。
相同点:主要成分都是铁。 不同点:含碳量不同 不锈钢除含铁、碳、还含铬和镍,硬度和抗腐蚀性 都比纯铁好。 2)黄铜(铜锌合金),外观像金 3)焊锡(锡铅合金) 4)18K黄金(含金量75%)
常见合金的主要成分、性能和用途 合金 球墨铸铁 锰钢 不锈钢 黄铜 青铜 白铜 焊锡 硬铝 主要成分 铁、碳、硅、锰 铁、锰、碳 铁、铬、镍 铜、锌 铜、锡 铜、镍 锡、铅 铝、铜、镁、硅 金、银、铜 主要性能 机械强度好 韧性好、硬度大 抗腐蚀性好 强度高、可塑性好、 易加工、耐腐蚀 强度高、可塑性好、 耐磨、耐腐蚀 光泽好、耐磨、耐 腐蚀、易加工 熔点低 强度和硬度好 主要用途 在某些场合可代替钢 钢轨、挖掘机铲斗、坦克 装甲、自行车架 医疗器械、炊具、容器、 反应釜 机器零件、仪表、日用品 机器零件如轴承、齿轮等 钱币、代替银做饰品 焊接金属 火箭、飞机、轮船等制造业
铬 铁 银
铜
金
铝 铅
石的硬度为 10作标 (大) 准)
9 4~5 2.5~4 2.5~3 2.5~3 2~2.9 1.5 (小)
•通过观察上面的表格,你对金属的物理性质又有哪些新的认识? 讨论: 3. 1. 为什么菜刀、镰刀、锤子等用铁制而不用铅制? 4 .为什么灯泡里的灯丝用钨制而不用锡制?如果用锡 为什么有的铁制品如水龙头等要镀铬?如果镀金怎么样? 2. 银的导电性比铜好,为什么电线一般用铜制而不用银制? 制的话,可能会出现什么情况? 铬硬度大, 耐磨、美观,又防锈;金的价格高、硬度小 铅的硬度小 ,而铁的硬度大 银的价格比铜高许多 一般情况下,金属的密度比较大、熔点比较高、硬度比较大。
99 74
61 27
铁 铅
17
7.9 (良)
金 铅 银 铜 铁 锌 铝 密度 (g· cm-3)(大)19.3 11.3 10.5 8.92 7.86 7.14 2.70
(小)
熔点(℃)
硬度 (以金刚
钨 铁 铜 金 银 铝 锡
(高)3410 1535 1083 1064 962 660 232 (低)
三、炼铁的原理
铁是目前产量最大应用最广的一种金属!
铁矿石 赤铁矿 主要成分 Fe2O3 Fe% 70%
磁铁矿
菱铁矿 黄铁矿 来?
Fe3O4
FeCO3 FeS2
72.4%
48.3% 46.7%
思考:还需要一种具有什么性质的物质才能炼出铁
1.还原反应
还原剂:H2、C、CO H2 + CuO CO + CuO
C + CO2
高温
2CO 2Fe + 3CO2
CO2
3CO + Fe; O2
四:工业电解法冶炼铝
2Al2O3===4Al+3O2↑
通电
高温
Fe2O3+3CO===2Fe+3CO2
CuO+H2===Cu+H2O
△
CaCO3====CaO+CO2↑ C+O2====CO2 CO2+C====2CO
高温 点燃
高温
Fe2O3+3CO===2Fe+3CO2
根据方程式思考: 焦炭在炼铁过程中的作用 是什么?
高温
3.高炉炼铁
CaCO3
高温
CaO + CO2↑
一、金属的物理性质
根据下面的图片,你能说出金属的用途吗?从中 你又可以总结出金属具有哪些物理性质?
有金属光泽
良好的导电性
良好的导热性
延展性(展成薄片) 良好的延展性 (能拉成细丝)
能够弯曲
比较金属的物理性质
物理性质 导电性 (以
银的导电性为 100 (优) 100 作标准)
物理性质比较
银 铜 金 铝 锌
钨的熔点高,锡的熔点低;如果用锡,则锡丝易烧断。 如果镀金则会增加成本且不耐用。
金属之最
地壳中含量最高的金属元素— 铝 目前世界年产量最高的金属— 铁
导电、导热性最好的金属— 银 延展性最好的金属— 铂 金 硬度最大的金属— 铬 熔点最高的金属— 钨 熔点最低的金属— 汞
制造飞机的材料中,大量使用铝 合金,为什么不使用纯铝呢?
18K ① 黄金
18K 白金
光泽好、耐磨、易加工 金饰品、钱币、电子元件
金、铜、镍、锌
光泽好、耐磨、易 加工
金饰品
①K是表示金的纯度的指标。24K表示含金量达100%,18k表示含金量达75%, 14K表示含金量达58.5%。
铝镁合金 钛铝钒合金
铁铬镍合金 铁锰碳合金
用来铸造硬币的金属材料需要具有什么性质?
第一节 常见的金属材料
金
属
单质
纯净物
物质
混合物
非金属 O2 氧化物 CO2 化合物 酸 HCl H2SO4 NaOH Ca(OH)2 碱 盐 Na2CO3
金属材料
• • • • • •
纯金属 合 金
建筑 桥梁 器械 车辆、飞机、舰艇 生活用具 其它
青铜器时代
• 司母戊鼎是中国目前 已发现的最重的青铜 器。司母戊鼎含铜 84.77%、锡11.64%、 铅27.9%。充分显示 出商代青铜铸造业的 生产规模和技术水平。
先通入CO还是先加热? 反应结束,先停止加热还是先停止通CO? 为什么要将尾气点燃? 实验过程中玻璃管内和广口瓶内会出现什么现象?
步骤:
点燃酒精灯B或系气球点燃或收集剩余的CO,防止污染空气。 ①通CO: 排净空气,防止爆炸。
②点燃酒精灯A: ③熄灭酒精灯A: ④停止通CO:通至冷却到室温,防止生成的铁被氧化。
2.特点:
硬度大、熔点低、强度高(韧性好,耐拉伸、耐弯曲、 耐压打)、抗腐蚀性好
所以,尽管目前人类已制得的纯金属只有90余种,但人们 为适用各种用途而将这些纯金属按一定组成和质量比制得 的合金已达几千种。
实验一:
比较黄铜片和铜片、焊锡和锡的光泽和 颜色;将它们 互相刻划,比较它们的硬度。
性质 比较 光泽 和颜色 硬度 结论 黄铜 黄色 现 象 铜 亮红 焊锡 银白 锡 银白
