常见的有机物化学式
甲醇乙醇化学式

甲醇乙醇化学式
甲醇和乙醇是常见的醇类有机物,它们的化学式分别为CH3OH和C2H5OH。
甲醇和乙醇在我们的生活中扮演着重要的角色,不仅在工业生产中有广泛的应用,而且作为消费品也广泛存在。
作为一种有机物,甲醇和乙醇的化学性质极为活泼。
它们可以与许多无机物发生反应,形成各种化合物。
例如,甲醇可以与氧气反应生成二氧化碳和水,释放出大量的能量。
这种化学反应在工业生产中被广泛应用。
乙醇也有类似的反应,但是其反应活性略低于甲醇。
除此之外,甲醇和乙醇还可以被用作有机试剂,用于有机合成反应。
它们作为亲电性较强的醇类有机物,可以与一些碳原子带有氢原子的化合物发生酯化反应,生成酯类有机化合物。
这种反应在日常生活中也有应用,例如制作香料和油漆。
然而,甲醇和乙醇也有毒性,过量摄入会对人体产生不良影响。
甲醇摄入过量可能导致中枢神经系统和视觉系统损伤,乙醇则会产生烈性饮酒、酒精中毒等毒性反应。
因此,我们应该正确使用甲醇和乙醇,避免对身体产生不必要的伤害。
综上所述,甲醇和乙醇作为常见的醇类有机物,在生产和生活中扮演着重要的角色。
我们应该了解它们的化学性质和应用,并正确使用,以充分发挥它们的作用。
初中化学常见物质化学式

K2CO3
NaNO3
七、常见的碱
名称
氢氧化钠
氢氧化钙
氢氧化钡
氢氧化铜
氢氧化铁
氢氧化钾
氢氧ቤተ መጻሕፍቲ ባይዱ铝
化学式
NaOH
Ca(OH)2
Ba(OH)2
Cu(OH)2
Fe(OH)3
KOH
Al(OH)3
名称
氢氧化亚铁
氢氧化镁
化学式
Fe(OH)2
Mg(OH)2
八、常见有机物
名称
甲烷
乙炔
甲醇
乙醇
乙酸
化学式
硫
S
32
银
Ag
108
氧
O
16
氯
Cl
35.5
碘
I
127
氟
F
19
氩
Ar
40
钡
Ba
137
氖
Ne
20
钾
K
39
铂
Pt
195
钠
Na
23
钙
Ca
40
金
Au
197
镁
Mg
24
锰
Mn
55
汞
Hg
201
氧化亚铜
三氧化钨
氧化银
氧化铅
化学式
NO
MgO
CuO
BaO
Cu2O
WO3
Ag2O
PbO
名称
三氧化二铝
三氧化二铁(铁红)
四氧化三铁
氧化亚铁
五氧化二磷
化学式
Al2O3
Fe2O3
Fe3O4
FeO
P2O5
初中常见化学式大全.

初中常见化学式常见的化学式 一、常见单质氢气 H 2 氮气 N 2 氯气 Cl 2氧气 O 2臭氧 O 3氦气 He氖气 Ne 氩气 Ar碳钾CK 硅钙 SiCa 硫钠 SNa 磷镁 PMg 碘铝I 2Al锌 Zn铁Fe铜Cu汞Hg银Ag二、化合物 1、氧化物水H 2O 三氧化硫 SO 3 一氧化碳 CO 二氧化碳 CO 2 五氧化二磷 P 2O 5 过氧化氢 H 2O 2 二氧化氮 NO 2 二氧化硫 SO 2 氧化钙CaO氧化亚铁 FeO 氧化铁 Fe 2O 3 四氧化三铁 Fe 3O 4氧化镁氧化汞MgOHgO 氧化锌氧化铝ZnOAl 2O 3 二氧化锰氧化铜MnO 2CuO2、其他化合物 硝酸碳酸氢氧化钠氢氧化镁HNO 3 H 2CO 3NaOHMg(OH)2 硫酸硫化氢氢氧化钾氢氧化铝H 2SO 4 H 2SKOHAl(OH)3盐酸氢氧化钙氢氧化锌 HClCa(OH)2 Zn(OH)2氢氧化铁氢氧化钡Fe(OH)3 Ba(OH)2 氢氧化亚铁 Fe(OH)2氨水 NH 3·H 2O 氢氧化铜Cu(OH)2氯化钠氯化钾氯化银氯化钡高锰酸钾碳酸钙硝酸铁 NaClKClAgClBaCl 2 KMnO 4 CaCO 3 Fe(NO 3)3氯化铜氯化亚铁氯化钙氯化锌锰酸钾硝酸钾硝酸亚铁 CuCl 2 FeCl 2 CaCl 2 ZnCl 2 K 2MnO 4 KNO 3 Fe(NO 3)2氯化铝氯化铁氯化镁硫酸铜氯酸钾硝酸钠硝酸铝AlCl 3 FeCl 3 MgCl 2 CuSO 4 KClO 3 NaNO 3 Al(NO 3)3碳酸钠碳酸氢钠硝酸银Na2CO3NaHCO3AgNO3碳酸钙硫酸铁硝酸钡CaCO3Fe2(SO4)3Ba(NO3)2碳酸铵硫酸亚铁硝酸铵(NH4)2CO3FeSO4NH4NO3硫酸钡BaSO43、常见有机化合物甲烷CH4乙醇C2H5OH葡萄糖C6H12O6初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+O点燃2MgO22、铁在氧气中燃烧:3Fe+2O点燃Fe O2343、铝在空气中燃烧:4Al+3O点燃2Al O2234、氢气在空气中燃烧:2H+O点燃2H O2225、红磷在空气中燃烧:4P+5O点燃2P O2256、硫粉在空气中燃烧:S+O点燃SO227、碳在氧气中充分燃烧:C+O点燃CO228、碳在氧气中不充分燃烧:2C+O点燃2CO29、二氧化碳通过灼热碳层:C+CO高温2CO210、一氧化碳在氧气中燃烧:2CO+O点燃2CO2211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO+H O===H CO222 12、生石灰溶于水:CaO+H O===Ca(OH)2213、无水硫酸铜作干燥剂:CuSO+5H O====CuSO·5H O424214、钠在氯气中燃烧:2Na+Cl点燃2NaCl2二、分解反应315、实验室用双氧水制氧气:2H O MnO2H O+O↑2222216、加热高锰酸钾:2KMnO加热K MnO4+MnO+O↑422217、水在直流电的作用下分解:2H O通电2H↑+O↑22218、碳酸化学物理学报不稳定而分解:H CO===H O+CO↑232219、高温煅烧石灰石(二氧化碳工业制法):CaCO高温CaO+CO↑32三、置换反应20、铁和硫酸铜溶液反应:Fe+CuSO==FeSO+Cu4421、锌和稀硫酸反应(实验室制氢气):Zn+H SO==ZnSO+H↑244222、镁和稀盐酸反应:Mg+2HCl===MgCl+H↑2223、氢气还原氧化铜:H+CuO加热Cu+H O2224、木炭还原氧化铜:C+2CuO高温2Cu+CO↑225、甲烷在空气中燃烧:CH+2O点燃CO+2H O422226、水蒸气通过灼热碳层:H O+C高温H+CO2227、焦炭还原氧化铁:3C+2Fe O高温4Fe+3CO2↑23其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO==Cu(OH)↓+Na SO4422 29、甲烷在空气中燃烧:CH+2O点燃CO+2H O4222:30、酒精在空气中燃烧:C H OH+ 3O 点燃 2CO +3H O2 5 2 2 231、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe O 高温 2Fe+ 3CO2 3 233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH) + CO ==== CaCO ↓+ H O2 23 234、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO ==== Na CO +H O2 23 235、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法) CaCO +2HCl === CaCl +H O +CO ↑3 2 2 236、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO + 2HCl === 2NaCl +HO3 2+CO ↑2一. 物质与氧气的反应: (1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O 点燃 2MgO22. 铁在氧气中燃烧:3Fe+ 2O 点燃 Fe O2 3 43. 铜在空气中受热:2Cu+ O 加热 2CuO24. 铝在空气中燃烧:4Al +3O 点燃 2Al O2 2 35. 氢气中空气中燃烧:2H +O 点燃 2H O2 2 26. 红磷在空气中燃烧:4P+ 5O 点燃 2P O2 2 57. 硫粉在空气中燃烧: S +O 点燃 SO2 28. 碳在氧气中充分燃烧:C+ O 点燃 CO2 29. 碳在氧气中不充分燃烧:2C+ O 点燃 2CO2(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O 点燃 2CO2 211. 甲烷在空气中燃烧:CH +2O 点燃 CO 2H O4 2 2 212. 酒精在空气中燃烧:C H OH +3O 点燃 2CO + 3H O2 5 2 2 2二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H O 通电 2H ↑+ O ↑2 2 214. 加热碱式碳酸铜:Cu (OH) CO 加热 2CuO +H O +CO ↑2 23 2 215. 加热氯酸钾(有少量的二氧化锰):2KClO ==== 2KCl+ 3O ↑3 216. 加热高锰酸钾:2KMnO4 加热 K MnO +MnO +O ↑2 4 2 217. 碳酸不稳定而分解:H CO === H O +CO ↑2 3 2 218. 高温煅烧石灰石:CaCO 高温 CaO +CO ↑3 2三.几个氧化还原反应:19. 氢气还原氧化铜:H + CuO 加热 Cu+ H O2 220. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO ↑22 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe O 高温 4Fe+ 3CO ↑2 3 222. 焦炭还原四氧化三铁:2C +Fe O 高温 3Fe+ 2CO ↑3 4 223. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe O 高温 2Fe +3CO2 3 225. 一氧化碳还原四氧化三铁:4CO +Fe O 高温 3Fe+ 4CO 3 4四.单质、氧化物、酸、碱、盐的相互关系2(1)金属单质+酸 -------- 盐+氢气 (置换反应) 26. 锌和稀硫酸 Zn+ H SO = ZnSO + H ↑2 4 4 227. 铁和稀硫酸 Fe +H SO = FeSO + H ↑244228.镁和稀硫酸Mg+H SO=MgSO+H↑244229.铝和稀硫酸2Al+3H SO=Al(SO)+3H↑24243230.锌和稀盐酸Zn+2HCl===ZnCl+H↑2231.铁和稀盐酸Fe+2HCl===FeCl+H↑2232.镁和语文教案格式稀盐酸Mg2HCl===MgCl+H↑2233.铝和稀盐酸2Al+6HCl==2AlCl+3H↑32(2)金属单质+盐(溶液)-------另一种金属+另一种盐34.铁和硫酸铜溶液反应:Fe+CuSO===FeSO+Cu4435.锌和硫酸铜溶液反应:Zn+CuSO===ZnSO+Cu4436.铜和硝酸汞溶液反应:Cu+Hg(NO)===Cu(NO)+Hg3232(3)碱性氧化物+酸--------盐+水37.氧化铁和稀盐酸反应:Fe O+6HCl===2FeCl+3H O233238.氧化铁和稀硫酸反应:Fe O+3H SO===Fe(SO)+3H O2324243239.氧化铜和稀盐酸反应:CuO+2HCl====CuCl+H O2240.氧化铜和稀硫酸反应:CuO+H SO====CuSO+H O244241.氧化镁和稀硫酸反应:MgO+H SO====MgSO+H O244242.氧化钙和稀盐酸反应:CaO+2HCl====CaCl+H O22(4)酸性氧化物+碱--------盐+水43.苛性钠暴露在空气中变质:2NaOH+CO====Na CO+H O223244.苛性钠吸收二氧化硫气体:2NaOH+SO====Na SO+H O223245.苛性钠吸收三氧化硫气体:2NaOH+SO====Na SO+H O324246.消石灰放在空气中变质:Ca(OH)+CO====CaCO↓+H O223247.消石灰吸收二氧化硫:Ca(OH)+SO====CaSO↓+H O2232(5)酸+碱--------盐+水48.盐酸和烧碱起反应:HCl+NaOH====NaCl+H O249.盐酸和氢氧化钾反应:HCl+KOH====KCl+H O250.盐酸和氢氧化初中家长会课件铜反应:2HCl+Cu(OH)====CuCl+2H O222 51.盐酸和氢氧化钙反应:2HCl+Ca(OH)====CaCl+2H O22252.盐酸和氢氧化铁反应:3HCl+Fe(OH)====FeCl+3H O33253.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)====AlCl+3H O33254.硫酸和烧碱反应:H SO4+2NaOH====Na SO+2H O224255.硫酸和氢氧化钾反应:H SO4+2KOH====K SO+2H O224256.硫酸和氢氧化铜反应:H SO4+Cu(OH)====CuSO+2H O224257.硫酸和氢氧化铁反应:3H SO+2Fe(OH)====Fe(SO4)+6H O24323258.硝酸和烧碱反应:HNO3+NaOH====NaNO+H O32(6)酸+盐--------另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO+2HCl===CaCl H O+CO↑322260.碳酸钠与稀盐酸反应:Na CO+2HCl===2NaCl+H O+CO↑232261.碳酸镁与稀盐酸反应:MgCO+2HCl===MgCl+H O+CO↑322262.盐酸和硝酸银溶液反应:HCl+AgNO===AgCl↓+HNO3363.硫酸和碳酸钠反应:Na CO+H SO===Na SO+H O+CO↑2324242264.硫酸和氯化钡溶液反应:H O+BaCl====BaSO↓+2HCl2S424(7)碱+盐--------另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO====Cu(OH)↓Na SO422466.氢氧化钠与氯化铁:3NaOH FeCl====Fe(OH)↓3NaCl3367.氢氧化钠与氯化镁:2NaOH MgCl====Mg(OH)↓2NaCl2268.氢氧化钠与氯化铜:2NaOH CuCl====Cu(OH)↓2NaCl2269.氢氧化钙与碳酸钠:Ca(OH)Na CO===CaCO↓2NaOH2233(8)盐+盐-----两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl+AgNO====AgCl↓+NaNO3371.硫酸钠和氯化钡:Na SO+BaCl====BaSO↓+2NaCl2424五.其它反应:72.二氧化碳溶解于水:CO+H O===H CO222373.生石灰溶于水:CaO+H O===Ca(OH)2274.氧化钠溶于水:Na O+H O====2NaOH2275.三氧化硫溶于水:SO+H O====H SO322476.硫酸铜晶体受热分解:CuSO·5H O加热CuSO5H O424277.无水硫酸铜作干燥剂:CuSO+5H O====CuSO·5H4242化学方程式反应现象应用2Mg+O点燃或Δ2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟2白色信号弹2Hg+O点燃或Δ2HgO银白液体、生成红色固体拉瓦锡实验22Cu+O点燃或Δ2CuO红色金属变为黑色固体24Al+3O点燃或Δ2Al O银白金属变为白色固体2233Fe+2O点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热4Fe+3O2高温22Fe O23C+O点燃CO剧烈燃烧、白光、放热、使石灰水变浑浊22S+O点燃SO剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.22氧气中蓝紫色火焰2H O点燃2H O淡蓝火焰、放热、生成使无水CuSO变蓝的液体(水)高能燃2224料4P+5O2点燃2P O剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧25气含量CH+2O点燃2H O+CO蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4222变蓝的液体(水)甲烷和天然气的燃烧4 2C H+5O点燃2H O+4CO蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和22222使无水CuSO变蓝的液体(水)氧炔焰、焊接切割金属42KClO MnO2、Δ2KCl+3O↑生成使带火星的木条复燃的气体实验室制备氧气322KMnOΔK2MnO MnO+O↑紫色变为黑色、生成使带火星木条复燃的气体实验4422室制备氧论文气2HgOΔ2Hg+O↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验22H2O通电2H↑+O↑水通电分解为氢气和氧气电解水22Cu(OH)COΔ2CuO+H O+CO↑绿色变黑色、试管壁有液体、使石灰水变浑浊气22322体铜绿加热NH HCOΔNH↑+H O+CO↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳43322酸氢铵长期暴露空气中会消失Zn+H SO=ZnSO+H↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气2442Fe+H SO=FeSO+H↑有大量气泡产生、金属颗粒逐渐溶解2442Mg+H SO=MgSO+H↑有大量气泡产生、金属颗粒逐渐溶解24422Al+3H SO=Al(SO4)+3H↑有大量气泡产生、金属颗粒逐渐溶解24232Fe O+3HΔ2Fe+3H O红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢2322气的还原性Fe O+4HΔ3Fe+4H O黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、3422利用氢气的还原性WO+3HΔW+3H O冶炼金属钨、利用氢气的还原性322MoO+3HΔMo+3H O冶炼金属钼、利用氢气的还原性3222Na+ClΔ或点燃2NaCl剧烈燃烧、黄色火焰离子化合物的形成、2H+Cl点燃或光照2HCl点燃苍白色火焰、瓶口白雾共价化合物的形成、制备22盐酸CuSO+2NaOH=Cu(OH)↓+Na SO蓝色沉淀生成、上部为澄清溶液质量守恒定律4224实验2C+O点燃2CO煤炉中常见反应、空气污染物之一、煤气中毒原因22CO+O点燃2CO蓝色火焰煤气燃烧22C+CuO高温2Cu+CO↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶2炼金属2Fe O+3C高温4Fe+3CO↑冶炼金属232Fe O+2C高温3Fe+2CO↑冶炼金属342C+CO2高温2COCO+H O=H CO碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文2223H COΔCO↑+H O石蕊红色褪去2322Ca(OH)+CO=CaCO↓+H O澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁2232CaCO+H O+CO=Ca(HCO)白色沉淀逐渐溶解溶洞的形成,石头的风化32232Ca(HCO)ΔCaCO↓+H O+CO↑白色沉淀、产生使澄清石灰水变浑浊的气体水32322垢形成.钟乳石的形成2NaHCOΔNa CO+H O+CO↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头32322CaCO高温CaO+CO↑工业制备二氧化碳和生石灰32CaCO+2HCl=CaCl+H O+CO↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实3222验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1.镁在空气中燃烧:2Mg+O点燃2MgO22.铁在氧气中燃烧:3Fe+2O点燃Fe O2343.铜在空气中受热:2Cu+O加热2CuO24.铝在空气中燃烧:4Al+3O2点燃2Al O235.氢气中空气中燃烧:2H+O点燃2H O2226.红磷在空气中燃烧(研究空气组成的实验):4P+5O点燃2P O5227.硫粉在空气中燃烧:S+O点燃SO228.碳在氧气中充分燃烧:C+O点燃CO229.碳在氧气中不充分燃烧:2C+O点燃2CO2(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O点燃2CO2211.甲烷在空气中燃烧:CH+2O点燃CO+2H O422212.酒精在空气中燃烧:C H OH+3O点燃2CO+3H O25222(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO加热Hg+O↑214.加热高锰酸钾:2KMnO加热K MnO+MnO+O↑(实验室制氧气原理1)4242215.过氧化氢在二氧化锰作催化剂条件下分解反应:H O MnO2H O+O↑(实22222验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H O通电2H↑+O↑222 17.生石灰溶于水英语六级作文:CaO+H O==Ca(OH)2218.二氧化碳可溶于水:H O+CO==H CO2223三、质量守恒定律:19.镁在空气中燃烧:2Mg+O点燃2MgO220.铁和硫酸铜溶液反应:Fe+CuSO===FeSO+Cu4421.氢气还原氧化铜:H+CuO加热Cu+H O2222.镁还原氧化铜:Mg+CuO加热Cu+MgO四、碳和碳的氧化物:(1)碳的化学性质23.碳在氧气中充分燃烧:C+O点燃CO2224.木炭还原氧化铜:C+2CuO高温2Cu+CO↑225.焦炭还原氧化铁:3C+2Fe2O高温4Fe+3CO↑32(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C+O点燃CO2227.煤炉的中层:CO+C高温2CO228.煤炉的上部蓝色火焰的产生:2CO+O点燃2CO22(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO+2HCl==CaCl+H O+CO↑322230.碳酸不稳定而分解:H CO==H O+CO↑232231.二氧化碳可溶于水:H O+CO==H CO222332.高温煅烧石灰石(工业制二氧化碳):CaCO高温CaO+CO↑3233.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)+CO===CaCO↓+H O2232(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+CuO加热Cu+CO235.一氧化碳的可燃性:2CO+O点燃2CO22其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na CO2HCl==2NaCl+H O+CO↑2322五、燃料及其利用:37.甲烷在空气中燃烧:CH+2O点燃CO+2H O422238.酒精在空气中燃烧:C H OH+3O2点燃2CO+3H O252239.氢气中空气中燃烧:2H+O点燃2H O222六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+O点燃2MgO241.铁在氧气中燃烧:3Fe+2O点燃Fe O23442.铜在空气中受热:2Cu+O加热2CuO243.铝在空气中形成氧化膜:4Al+3O=2Al O223(2)金属单质酸--------盐氢气(置换反应)44.锌和稀硫酸Zn+H SO=ZnSO+H↑244245.铁和稀硫酸Fe+H SO=FeSO+H↑244246.镁和稀硫酸Mg+H SO=MgSO+H↑244247.铝和稀硫酸2Al+3H SO=Al(SO)+3H↑24243248.锌和稀盐酸Zn+2HCl==ZnCl+H↑2249.铁和稀盐酸Fe+2HCl==FeCl+H↑2250.镁和稀盐酸Mg+2HCl==MgCl+H↑2251.铝和稀盐酸2Al+6HCl==2AlCl+3H↑32(3)金属单质盐怎样学好高中物理(溶液)-------新金属新盐52.铁和硫酸铜溶液反应:Fe+CuSO==FeSO+Cu4453.锌和硫酸铜溶液反应:Zn+CuSO==ZnSO+Cu4454.铜和硝酸汞溶液反应:Cu+Hg(NO)==Cu(NO)+Hg3232(3)金属铁的治炼原理:55.3CO+2Fe O高温4Fe+3CO↑232七、酸、碱、盐1、酸的化学性质(1)酸金属--------盐氢气(见上)(2)酸金属氧化物--------盐水56.氧化铁和稀盐酸反应:Fe O+6HCl==2FeCl+3H O233257.氧化铁和稀硫酸反应:Fe O+3H2SO4==Fe(SO4)+3H O2323258.氧化铜和稀盐酸反应:CuO+2HCl==CuCl+H2O259.氧化铜和稀硫酸反应:CuO+H SO4==CuSO+H O242(3)酸碱--------盐水(中和反应)60.盐酸和烧碱起反应:HCl+NaOH==NaCl+H O261.盐酸和氢氧化钙反应:2HCl+Ca(OH)==CaCl+2H O22262.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)==AlCl+3H O332 63.硫酸和烧碱反应:H SO+2NaOH==Na SO+2H O24242(4)酸盐--------另一种酸另一种盐64.大理石与稀盐酸反应:CaCO+2HCl==CaCl+H O+CO↑322265.碳酸钠与稀盐酸反应:Na CO+2HCl==2NaCl+H O+CO↑232266.碳酸氢钠与稀盐酸反应:NaHCO+HCl==NaCl+H O+CO↑32267.硫酸和氯化钡溶液反应:H SO+BaCl==BaSO↓+2HCl24242、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物--------盐水68.苛性钠暴露在空气中变质:2NaOH+CO==Na CO+H O223269.苛性钠吸收二氧化硫气体:2NaOH+SO==Na SO+H O223270.苛性钠吸收三氧化硫气体:2NaOH+SO==Na SO+H O324271.消石灰放在空气中变质:Ca(OH)+CO==CaCO↓+H O22323、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 26、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O72. 消石灰吸收二氧化硫:Ca(OH) +SO == CaSO ↓+ H O2 23 2(2)碱 酸-------- 盐 水(中和反应,方程式见上) (3)碱 盐 -------- 另一种碱 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH) +Na CO == CaCO ↓+ 2NaOH2 23 33、盐的化学性质(1)盐(溶液) 金属单质------- 另一种金属 另一种盐 74. 铁和硫酸铜溶液反应:Fe+ CuSO == FeSO +Cu4 4(2)盐 酸-------- 另一种酸 另一种盐75.碳酸钠与稀盐酸反应: Na CO +2HCl == 2NaCl +H O+ CO ↑2 3 2 2碳酸氢钠与稀盐酸反应:NaHCO +HCl== NaCl+ H O +CO ↑3 2 2(3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH) +Na CO == CaCO ↓+ 2NaOH2 23 3(4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO == AgCl↓+NaNO 378.硫酸钠和氯化钡:Na SO +BaCl == BaSO4↓+2NaCl2 4 2一、其他反应类型31、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O△5、酒精燃烧:C 2H 5OH + 3O 2点燃 2CO 2 + 3H 2O点燃。
常见化学式大全

常见化学式?常见的化学式一、常见单质氢气H2氮气N2氯气Cl2氧气O2臭氧O3氦气He 氖气Ne氩气Ar碳C硅Si硫S磷P碘I2钾K钙Ca钠Na镁Mg铝Al锌Zn 铁Fe铜Cu汞Hg银Ag二、化合物1、氧化物水H2O三氧化硫SO3一氧化碳CO二氧化碳CO2五氧化二磷P2O5过氧化氢H2O2二氧化氮NO2二氧化硫SO2氧化钙CaO氧化亚铁FeO氧化铁Fe2O3四氧化三铁Fe3O4氧化镁MgO氧化锌ZnO二氧化锰MnO2氧化汞HgO氧化铝Al2O3氧化铜CuO2、其他化合物硝酸HNO3硫酸H2SO4盐酸HCl碳酸H2CO3硫化氢H2S氢氧化钠NaOH氢氧化钾KOH氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化锌Zn(OH)2氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化铜Cu(OH)2氢氧化钡Ba(OH)2氨水NH3·H2O氯化钠NaCl氯化铜CuCl2氯化铝AlCl3氯化钾KCl氯化亚铁FeCl2氯化铁FeCl3氯化银AgCl氯化钙CaCl2氯化镁MgCl2氯化钡BaCl2氯化锌ZnCl2硫酸铜CuSO4高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸钙CaCO3硝酸钾KNO3 硝酸钠NaNO3硝酸铁Fe(NO3)3硝酸亚铁Fe(NO3)2硝酸铝Al(NO3)3碳酸钠Na2CO3碳酸钙CaCO3碳酸铵(NH4)2CO3碳酸氢钠NaHCO3硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硝酸银AgNO3硝酸钡Ba(NO3)2硝酸铵NH4NO3硫酸钡BaSO43、常见有机化合物甲烷CH4乙醇C2H5OH 葡萄糖C6H12O6初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧: C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl2点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑ 16、加热高锰酸钾:2KMnO4加热 K2MnO4 + MnO2 +O2↑ 17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑ 18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑ 三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑ 22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑ 23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑ 25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑ 其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== N a2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑ 36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑ 一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C+ O2点燃 CO29. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑ 14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑ 15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑ 16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑ 17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑ 18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑ 三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑ 2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe+ 3CO2↑ 22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑ 23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑ 27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑ 28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑ 29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑ 30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑ 31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑ 32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑ 33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑ (2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg (3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O (4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O 45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ C u(OH)2==== C uCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl 2 H2O +CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑ 62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑ 64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O2点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O2点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+ C O2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O2点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 +O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4 +H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O2点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ C O2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO +CO2↑工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧: C +O2点燃 CO29. 碳在氧气中不充分燃烧:2C +O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2 ↑ 14.加热高锰酸钾:2KMnO4加热 K2MnO4+ MnO2 +O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+O2 ↑ 17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧: C + O2点燃 CO224.木炭还原氧化铜: C + 2CuO 高温 2Cu+ CO2↑ 25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑ (2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑ 30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑ 31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑ 33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO2 35.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl+ H2O +CO2↑ 五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O 38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2 +3H2O 39.氢气中空气中燃烧:2H2+ O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑ 45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑ 46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑ 47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑ 48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑ 49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑ 50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑ 51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑ (3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3 高温 4Fe +3CO2↑ 七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl 2 +H2O+ CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O (2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl +H2O+ CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+ H2O +CO2↑ (3)盐碱 -------- 另一种碱另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH(4)盐盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3== AgCl ↓+NaNO 378.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2== BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 22CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2CO 2 + 2H 2O△点燃点燃。
初中常见化学式
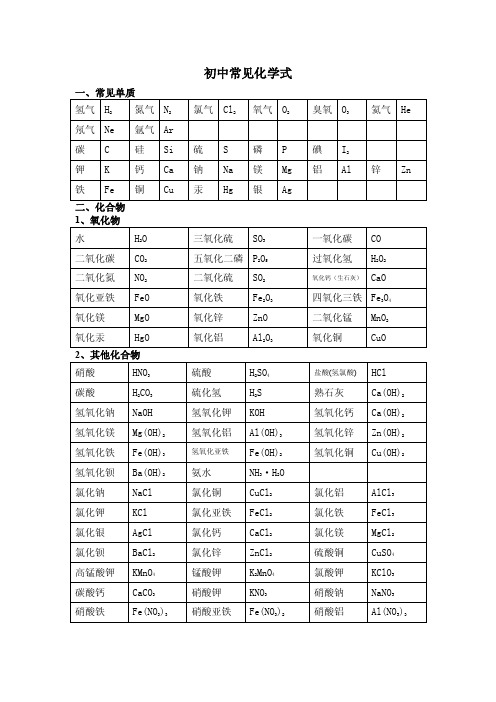
葡萄糖
C6H12O6
豆丁致力于构 建全球领先的文档发布与销售平 台,面向世界范围提供便捷、安 全、专业、有效
的文档营销服 务。包括中国、日本、韩国、北 美、欧洲等在内的豆丁全球分站 ,将面向全球各地
的文档拥有者 和代理商提供服务,帮助他们把 文档发行到世界的每一个角落。 豆丁正在全球各地
建立便捷、安 全、高效的支付与兑换渠道,为 每一位用户提供优质的文档交易 和账务服务。
过氧化氢 H2O2 氧化钙(生石灰) CaO
四氧化三铁 Fe3O4
二氧化锰 MnO2
氧化铜
CuO
盐酸(氢氯酸)
熟石灰 氢氧化钙 氢氧化锌 氢氧化铜
HCl Ca(OH)2 Ca(OH)2 Zn(OH)2 Cu(OH)2
氯化铝 氯化铁 氯化镁 硫酸铜 氯酸钾 硝酸钠 硝酸铝
AlCl3 FeCl3 MgCl2 CuSO4 KClO3 NaNO3 Al(NO3)3
碳酸钠
Na2CO3
碳酸钙
CaCO3
碳酸铵
(NH4)2 CO3
碳酸氢钠 NaHCO3
硫酸铁
Fe2(SO4)3
硫酸亚铁 FeSO4
硝酸银
AgNO3
硝酸钡
Ba(NO3)2
硝酸铵
ቤተ መጻሕፍቲ ባይዱ
NH4NO3
硫酸钡
BaSO4
3、常见有机化合物
胆矾(蓝胆) CuSO4·5H2O 石灰石(大理石) CaCO3
甲烷
CH4
乙醇
C2H5OH
氯化钾
KCl
氯化银
AgCl
氯化钡
BaCl2
高锰酸钾 KMnO4
碳酸钙 硝酸铁
CaCO3 Fe(NO3)3
初中常用化学式大全

初中化学必背化学式大全1.元素符号:氢H 、氦He、锂Li、铍Be、硼B、碳C、氮N、氧O、氟F、氖Ne、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氯Cl、氩Ar、钾K、钙Ca、锰Mn、铁Fe、铜Cu、锌Zn 、银Ag 、钡Ba、铂Pt 、金Au、汞Hg、碘I2.常见离子和化合物中元素的化合价:+1价:氢离子H+、钠离子Na+、钾离子K+、银离子Ag+、铵根离子NH4++2价:钙离子Ca2+、镁离子Mg2+、铜离子Cu2+、钡离子Ba2+、锌离子Zn2+、亚铁离子Fe2++3价:铁离子Fe3+、铝离子Al3+-1价:氯离子Cl-、氢氧根离子OH- 、硝酸根离子NO3--2价:氧离子O2-、硫酸根离子 SO42-、碳酸根离子 CO32-3.常见物质的化学式与名称:单质:C:碳 S:硫 P:磷 Na:钠Fe:铁Mg:镁 Al:铝 Hg:汞Zn:锌 He:氦Si:硅Ar:氩 K:钾 Ca:钙 Zn:锌Cu:铜Ag:银O2:氧气 H2:氧气 N2:氮气O3:臭氧Cl2:氯气(以下都是化合物)非金属氧化物:水H2O、二氧化碳CO2、一氧化碳CO、五氧化二磷P2O5、二氧化硫SO2、三氧化硫SO3、过氧化氢(双氧水)H2O2、二氧化氮NO2。
金属氧化物:氧化铁Fe2O3(赤铁矿,铁锈的主要成分)、四氧化三铁 Fe3O4(磁铁矿的主要成分)、氧化铝 Al2O3(铝土矿的主要成分)、氧化铜CuO、氧化钙CaO、二氧化锰MnO2、氧化镁MgO、氧化汞HgO酸:盐酸HCl(胃酸的主要成分)、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、乙酸CH3COOH(俗称醋酸)、H2S亚硫酸。
碱:氢氧化钠NaOH(俗称火碱、烧碱、苛性钠,易溶于水)、氢氧化钡Ba(OH)2(易溶于水)、氢氧化钙 Ca(OH)2(俗称熟石灰、消石灰。
微溶于水,水溶液俗称澄清石灰水)、氢氧化镁Mg(OH)2(不溶于水,白色沉淀)、氢氧化钾KOH、氢氧化铝Al(OH)3、氢氧化铁 Fe(OH)3(不溶于水,红褐色沉淀)、氢氧化铜 Cu(OH)2(不溶于水,蓝色沉淀)、一水合氨NH3•H2O(水溶液俗称氨水)。
苯乙烯的分子式

苯乙烯的分子式1. 介绍苯乙烯是一种常见的有机物,其化学式为C8H8,结构式为Ph-CH=CH2。
它是一种无色液体,具有芳香气味。
苯乙烯是由苯和乙烯通过反应得到的,是一种重要的化工原料,广泛用于塑料、橡胶、纤维和化妆品等行业。
2. 分子结构苯乙烯的分子式为C8H8,其中包含8个碳原子和8个氢原子。
它的分子结构可以看作是苯环和乙烯基团的结合。
苯环由6个碳原子和6个氢原子组成,构成了一个平面六元环。
乙烯基团由2个碳原子和4个氢原子组成,其中一个碳原子与苯环中的一个氢原子连接。
3. 物理性质苯乙烯是无色液体,密度为0.90 g/cm³,沸点为145-146 °C,熔点为-31 °C。
它具有良好的挥发性和溶解性,能够溶解于许多有机溶剂中,如醇类、醚类和酮类。
苯乙烯的燃点为425 °C,能够燃烧产生二氧化碳和水。
4. 化学性质4.1 不饱和性苯乙烯是一种不饱和化合物,含有双键。
由于双键的存在,使得苯乙烯具有较高的反应活性,容易发生加成反应、聚合反应和氧化反应。
4.2 加成反应苯乙烯能够与氢气发生加成反应,生成乙烷。
该反应是一个典型的催化加氢反应,常用铂族金属作为催化剂。
4.3 聚合反应苯乙烯是一种重要的聚合物原料,能够通过聚合反应制备聚苯乙烯(简称PS)。
聚苯乙烯是一种常见的塑料,具有良好的透明性、机械性能和热稳定性。
4.4 氧化反应苯乙烯能够与氧气发生燃烧反应,生成二氧化碳和水。
在适当的条件下,苯乙烯还可以进行选择性氧化反应,从而生成苯乙酮等有机化合物。
5. 应用领域苯乙烯是一种重要的化工原料,广泛用于塑料、橡胶、纤维和化妆品等行业。
5.1 塑料苯乙烯可以通过聚合反应制得聚苯乙烯(PS),具有良好的透明性、机械性能和热稳定性,常用于制造塑料制品、电子产品外壳和光盘。
5.2 橡胶苯乙烯可以与丁二烯等共聚,产生合成橡胶。
聚苯乙烯-丁二烯共聚物具有良好的弹性和耐磨性,常用于制造轮胎、橡胶管和密封件。
初中常见物质的化学式大全

氧化亚铜
SO2
SO3
NO
MgO
CuO
BaO
Cu2O
氧化亚铁
三氧化二铁
四氧化三铁
三氧化二铝
FeO
Fe2O3
Fe3O4
Al2O3
4、氯化物/盐酸盐
氯化钾
氯化钠
氯化镁
氯化钙
氯化铜
氯化锌
氯化钡
氯化铝
氯化银
KCl
NaCl
MgCl2
CaCl2
CuCl2
ZnCl2
BaCl2
AlCl3
AgCl
氯化铁
氯化亚铁
FeCl3
FeSO4?7H2O
10、常见化肥
尿素
硝酸铵
硫酸铵
碳酸氢铵
磷酸二氢钾
CO(NH2)2
NH4NO3
(NH4)2SO4
NH4HCO3
KH2PO4
11、沉淀
微溶于水
淡黄色沉淀
浅绿色沉淀
红褐色絮状沉淀
蓝色絮状沉淀
Ca(OH)2,CaSO4
S
Fe(OH)2
Fe(OH)3
Cu(OH)2
白色沉淀
Mg(OH)2、CaCO3、BaCO3、AgCl、BaSO4
初中常见物质的
化学式
1、非金属单质
氢气
碳
氮气
氧气
磷
硫
氯气
H2
C
N2
O2
P
S
Cl2
2、金属单质
钠
镁
铝
钾
钙
铁
锌
铜
Na
Mg
Al
K
Ca
Fe
Zn
Cu
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见的有机物化学式
有机化学是研究含碳的化合物的一门学科,它探索着构成我们生活
的基础,包括石油、药物、聚合物和天然产物等等。
有机物的化学式
由元素符号和表示结构的符号组成。
在这篇文章中,我将介绍一些常
见的有机物的化学式,让我们一起来了解并学习它们的结构及性质。
1. 甲烷(CH4)
甲烷是一种最简单的有机化合物,也是天然气的主要成分之一。
它
由一个碳原子和四个氢原子组成。
甲烷是无色、无味的气体,是一种
燃料和温室气体。
它的化学式表示为CH4。
2. 乙醇(C2H6O)
乙醇是一种常见的醇类化合物,也是我们日常生活中使用的酒精。
它由两个碳原子、六个氢原子和一个氧原子组成。
乙醇是一种无色、
挥发性液体,可用作溶剂、消毒剂和燃料。
它的化学式表示为C2H6O。
3. 乙烯(C2H4)
乙烯是一种简单且重要的烯烃类化合物,也被称为乙烯烃。
它由两
个碳原子和四个氢原子组成。
乙烯是一种无色、易燃的气体,在化学
工业中广泛用作合成聚乙烯的原料。
它的化学式表示为C2H4。
4. 苯(C6H6)
苯是一种具有芳香性的有机化合物,由六个碳原子和六个氢原子组成。
它是无色液体,常用作溶剂和化学反应的中间体。
苯是许多重要
有机化合物的基础,例如苯胺、苯酚和苯甲酸。
它的化学式表示为
C6H6。
5. 丙酮(C3H6O)
丙酮是一种常见的酮类化合物,由三个碳原子、六个氢原子和一个氧原子组成。
它是一种无色、易挥发的液体,具有溶解脂肪的能力。
丙酮在工业上被广泛用作溶剂和化学反应的介质。
它的化学式表示为C3H6O。
6. 氨基酸(RCH(NH2)COOH)
氨基酸是生物体内最基本的有机化合物之一,它们是蛋白质的组成单元。
每种氨基酸的结构基本相同,由一个氨基、一个羧基和一个侧链组成。
每种氨基酸的侧链不同,决定了它们的性质和功能。
氨基酸的化学式表示为RCH(NH2)COOH,其中R代表不同的侧链。
通过了解这些常见有机物的化学式,我们能够更好地理解它们的结构和性质。
有机化学的研究和应用正在不断发展,为制药、材料和能源等领域的发展做出了重要贡献。
希望这篇文章对您对有机化学有所启发,谢谢阅读!。
