江苏省如皋市白蒲镇中考化学专题复习24物质的分离与提纯活动学案2无答案新版新人教版
江苏省如皋市白蒲镇中考化学专题复习24物质的分离和提纯活动学案1无答案新版新人教版

物质的分别和提纯一.学习目标:⑴知道除杂的基本方法物理方法和化学方法;⑵把握除杂不引杂的原则;⑶依据被除杂质的性质特征,能选择恰当的除杂试剂和方法。
二、活动方案:活动一:相识除杂常用的物理方法例一:除去CaCl2中的CaCO3;分析:CaCl2和CaCO3的溶解性不同,可先加水溶解再过滤,除去CaCO3,最终再将溶液蒸发结晶就可获得较纯净的CaCl2。
例二:如何除去铜粉中的铁粉?分析:铜和铁磁性不同,铁粉能被磁铁吸引而铜不能,故选用磁铁吸引除去铁粉。
归纳:依据物质不同的物理性质选用适当的物理方法。
常用方法:溶解、过滤、蒸发、结晶洗涤、烘干、洗气(即干燥)等。
试一试: 1、KNO3( NaCl)2、NaCl(KNO3)3、02(H2O)4、CO2(H2O)活动二:学会用化学方法除杂酸碱盐溶液中的除杂(实质是除去溶液中的杂质阳离子或阴离子)1、沉淀法:例:NaOH溶液(Ca(OH)2)分析:实质是除去溶液中的Ca2+,使溶液中只保留Na+和OH—,故可以选用含阴离子CO32-的试剂与Ca2+生成沉淀,为了不带进新的阳离子杂质,试剂中的阳离子只能选用原溶液中的阳离子Na+,所以选用的试剂可以是适量的Na2CO3;(能不能选用K2CO3?试剂为什么要适量?)除杂原理是:Ca2++ CO32-= CaCO3↓试一试:NaCl(Na2CO3)HCl(H2SO4)Ba(NO3)2(BaCl2)2、气体法:例:NaCl(Na2CO3)分析:实质是除去溶液中的CO32-,使溶液中只保留Na+和Cl—,所以可以选用含阳离子是H+的试剂使CO32-转化为气体而除去,为了不带进新的阴离子杂质,试剂中的阴离子只能用原溶液中的Cl—,所以选用的试剂是适量的稀HCl;除杂原理是:H++ CO32-=H2O+CO2↑试一试:KCl(KHCO3)3、转化法:(转化为主要物质)例、CO2(CO):将混合气体通过灼热的CuO,将CO转化为CO2;试一试:CO(CO2)CO2(HCl)H2O(H2O2)4、加热法:例:CaO(CaCO3) 无需加试剂干脆将固体加热,就能使CaCO3分解而除去;试一试:Na2CO3(NaHCO3)KCl(KClO3)MnO2( C )5、置换法:例:Cu ( Fe ) 在金属活动依次里 Fe>H,Cu<H,可加入足量的稀HCl、H2SO4、CuCl2、 CuSO4等充分反应后再过滤、洗涤、烘干。
江苏省如皋市白蒲镇中考化学专题复习24物质的分离与提纯活动学案2(无答案)(新版)新人教版
24物质的分别与提纯【学习目标】1.弄清含有多种杂质的物质提纯的一般思路。
2.认识物质分别、提纯的原则。
3.依照物质的性质特点,能选择适合的除杂方法或除杂试剂。
【活动方案】物质的分别是将混淆物中各成分一一分开成为纯净物的过程,而物质的提纯是除掉物质中混有杂质的过程。
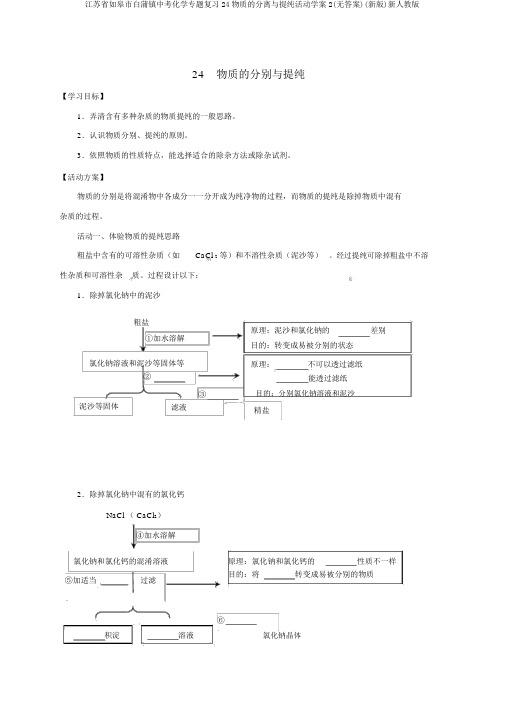
活动一、体验物质的提纯思路粗盐中含有的可溶性杂质(如CaCl 2等)和不溶性杂质(泥沙等)。
经过提纯可除掉粗盐中不溶性杂质和可溶性杂质。
过程设计以下:1.除掉氯化钠中的泥沙粗盐①加水溶解氯化钠溶液和泥沙等固体等② _______泥沙等固体滤液2.除掉氯化钠中混有的氯化钙NaCl ( CaCl2)④加水溶解氯化钠和氯化钙的混淆溶液⑤加适当过滤原理:泥沙和氯化钠的_______差别目的:转变成易被分别的状态原理: _______不可以透过滤纸_______能透过滤纸③ _______目的:分别氯化钠溶液和泥沙精盐原理:氯化钠和氯化钙的_______性质不一样目的:将 _______ 转变成易被分别的物质⑥______________积淀_______溶液氯化钠晶体提纯的原理:利用杂质与被提纯物质的___________和 ___________的差别,进行提纯。
活动二、感悟物质提纯的原则为除掉氢氧化钠溶液中混有碳酸钠,甲、乙、丙、丁、戊五位同学设计了不一样的方案。
操作能否可行理由甲加水溶解、过滤乙溶解、加稀盐酸至恰好无气泡产生丙溶解、加适当的氢氧化钙溶液、过滤丁溶解、加适当的氢氧化钡溶液、过滤戊溶解、加适当的氯化钙溶液、过滤经过上述活动的学习,你能说出物质提纯的原则吗?活动三、概括物质提纯的方法1.请选择适合方法,除掉以下各组物质中的杂质(括号内为杂质):⑴NaCl固体(泥沙):______⑵ KNO 3( NaCl):_____⑶ 水(色素):______⑷铜粉 ( 铁粉 ) : ______A 活性炭吸附B磁铁吸引C溶解、过滤、蒸发D高温溶解、降温结晶、过滤2.请选择适合方法或试剂,除掉以下各组物质中的杂质(括号内为杂质),写出有关的化学方程式。
江苏省如皋市白蒲镇中考化学专题复习24物质的分离和提纯活动学案1(无答案)(新版)新人教版

物质的分别和提纯一.学习目标:⑴知道除杂的基本方法物理方法和化学方法;⑵掌握除杂不引杂的原则;⑶依照被除杂质的性质特点,能选择适合的除杂试剂和方法。
二、活动方案:活动一:认识除杂常用的物理方法例一:除掉 CaCl2中的 CaCO3;剖析: CaCl2和 CaCO3的溶解性不一样,可先加水溶解再过滤,除掉最后再将溶液蒸发结晶便可获取较纯净的CaCl2。
例二:怎样除掉铜粉中的铁粉?剖析:铜和铁磁性不一样,铁粉能被磁铁吸引而铜不可以,应采用吸引除掉铁粉。
CaCO3,磁铁概括:依据物质不一样的物理性质采用适合的物理方法。
常用方法:溶解、过滤、蒸发、结晶清洗、烘干、洗气(即干燥)等。
试一试: 1 、KNO3( NaCl)2、NaCl( KNO3)3、02(H2O)4、CO2(H2O)活动二:学会用化学方法除杂酸碱盐溶液中的除杂(本质是除掉溶液中的杂质阳离子或阴离子)1、积淀法:22++—,故能够采用例: NaOH溶液( Ca(OH) )剖析:本质是除掉溶液中的Ca ,使溶液中只保存Na和 OH含阴离子CO32-的试剂与Ca2+生成积淀,为了不带进新的阳离子杂质,试剂中的阳离子只好采用原溶液中的阳离子+适当的 Na2CO;(能不可以采用 KCO? Na ,因此采用的试剂能够是323试剂为何要适当?)除杂原理是:2+2-= CaCO3↓Ca + CO3试一试: NaCl( Na2CO3)HCl(H2SO4)Ba(NO3) 2(BaCl2)2、气体法:例: NaCl(Na2CO3)剖析:本质是除掉溶液中的2-,使溶液中只保存+—,因此能够采用含CO3Na 和 Cl阳离子是 H+的试剂使 CO32-转变为气体而除掉,为了不带进新的阴离子杂质,试剂中的阴离子只好用原溶液中的 Cl —,因此采用的试剂是适当的稀 HCl;+2-除杂原理是: H + CO=H O+CO↑322试一试: KCl(KHCO3)3、转变法:(转变为主要物质)例、 CO2(CO):将混淆气体经过灼热的CuO,将 CO转变为 CO2;试一试: CO(CO2)CO2(HCl)H2O(H2O2)4、加热法:例: CaO(CaCO3)无需加试剂直接将固体加热,就能使CaCO3分解而除掉;试一试: Na2CO3( NaHCO3)KCl(KClO 3 )MnO2(C)5、置换法:例: Cu ( Fe )在金属活动次序里Fe>H,Cu<H, 可加入足量的稀HCl、 H2SO4、 CuCl2、CuSO4等充足反响后再过滤、清洗、烘干。
中考化学物质的提纯与分离复习学案

九年级化学《物质的提纯与分离》专题复习学案一、知识要点物质的分离提纯(1)基本原理①物质的分离是把混合物经过处理和转化分开后,要求恢复原来的状态。
②物质的提纯只要求弃去杂质,不要求将杂质复原。
在除去杂质过程中必须遵循:不增——所选试剂不能带入新的杂质不减——所选试剂只与杂质反应而不与被提纯的物质反应易分——试剂与杂质反应的产物与被提纯的物质容易分离(2)方法:(如下表)二、知识运用典型习题1、欲除去混入CO中的少量H2O、O2、CO2,所用试剂为:①热的铜网;②浓硫酸;③NaOH溶液。
正确的顺序是()A.①②③ B.②③①C.③②① D.①③②2、除去下列物质中混有的少量杂质(括号中的物质为杂质)所设计的试验方案或操作中,合理的是()3晶体(NaCl):将固体溶于水,配置成热的饱和溶液,采用降温结晶的方法2气体(HCl):将气体通过装有NaOH溶液得洗气瓶2溶液[Ba(OH)2]:加入过量的稀硫酸,过滤2(N2):将混合气体通过炽热得铜网。
3、除去下列物质中的少量杂质,所用试剂或方法不正确的是( )5、除去下列物质中的杂质(括号内为杂质),所选的试剂及操作方法均正确的一组()6.下表中,除去物质所含少量杂质的方法和反应类型归类均正确的是()7、从抹有石灰浆的墙壁上掉下的一块白色固体,为鉴定其成分,进行了如下实验:由此得出的结论正确的是()A.一定有Ca(OH)2和CaCO3B.一定有Ca(OH)2,可能有CaCO3C.一定没有Ca(OH)2和CaCO3D.一定有CaCO3,可能有Ca(OH)28、用实验方法除去下列①~④各物质中的少量杂质,限从A~D提供的试剂及操作方法中进行选择,并将其序号填在相应的短线上。
A.加适量的稀盐酸、搅拌、蒸发、结晶 B.加适量的稀盐酸、搅拌、过滤、洗涤沉淀C.加适量水溶解、过滤、洗涤沉淀 D.加适量水溶解、过滤、蒸发①CaCO3中含有少量杂质Na2CO3;②Cu粉中含有少量杂质Fe粉;③CaCl2中含有少量CaCO3;④NaCl中含有少量杂质MnO2。
江苏省如皋市白蒲镇中考化学专题复习32物质的推断活动学案2(无答案)(新版)新人教版.doc

江苏省如皋市白蒲镇中考化学专题复习32物质的推断活动学案2(无答案)(新版)新人教版专题复习物质的推断【学习目标】1、了解推断题的特点,掌握推断题的解题思路。
2、培养逻辑推理能力、文图转换的能力和综合应用能力。
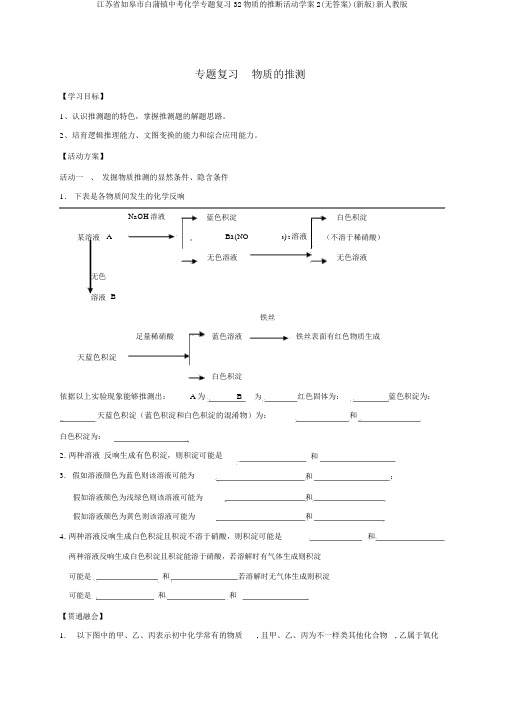
【活动方案】活动一、挖掘物质推断的明显条件、隐含条件1.下表是各物质间发生的化学反应NaOH溶液蓝色沉淀白色沉淀某溶液A BaNO32溶液(不溶于稀硝酸)无色溶液无色溶液无色溶液B 铁丝足量稀硝酸蓝色溶液铁丝表面有红色物质生成天蓝色沉淀白色沉淀根据以上实验现象可以推断出A为___ __B为___ _红色固体为________蓝色沉淀为________ 天蓝色沉淀(蓝色沉淀和白色沉淀的混合物)为____ 和___ 白色沉淀为____ ____ 2.两种溶液反应生成有色沉淀,则沉淀可能是和3. 如果溶液颜色为蓝色则该溶液可能为和如果溶液颜色为浅绿色则该溶液可能为和如果溶液颜色为黄色则该溶液可能为和4.两种溶液反应生成白色沉淀且沉淀不溶于硝酸,则沉淀可能是和两种溶液反应生成白色沉淀且沉淀能溶于硝酸,若溶解时有气体生成则沉淀可能是和若溶解时无气体生成则沉淀可能是和和【举一反三】 1. 下图中的甲、乙、丙表示初中化学常见的物质,且甲、乙、丙为不同类别的化合物,乙属于氧化物。
胃液中含有适量的甲,可帮助消化。
图中“”表示两端的物质间能发生化学反应;“”表示物质间存在转化关系;部分反应物、生成物已略去。
1甲是胃液中成分,可帮助消化。
写出甲的化学式。
2①若乙在常温下为液体,丙可用来改良酸性土壤,则乙的化学式为,丙的化学式为。
②若乙在常温下为气体,且可由甲与大理石反应得到,则乙的化学式为,丙能与①中的丙发生复分解反应,其化学方程式为写出一个即可。
③写出①中的乙和②中的乙发生化合反应的化学方程式。
活动二、找准物质推断的突破口以物质的颜色、个性现象、元素或物质之最、物质用途、物质组成、化学反应特征为突破口1.AG是初中常见的7种物质,它们有如下图所示的转化关系(部分产物已略去)。
中考化学实验专题复习:物质的分离、除杂和提纯(教案)

中考化学实验专题复习:物质的分离、除杂和提纯(教案)一、教学目标:1. 理解物质的分离、除杂和提纯的基本原理。
2. 掌握常见的物质分离和提纯方法,如过滤、蒸发、蒸馏、萃取等。
3. 能够运用所学的知识解决实际问题,提高实验操作能力和科学思维。
二、教学内容:1. 物质的分离方法:过滤、蒸发、蒸馏、萃取等。
2. 除杂原则:不增、不减、易分离、易复原。
3. 提纯方法:结晶、干燥、吸附等。
4. 实验操作技巧和注意事项。
三、教学过程:1. 导入:通过回顾已学的物质分离和提纯方法,引导学生思考如何选择合适的方法进行实验。
2. 讲解:详细讲解物质的分离、除杂和提纯的基本原理和方法,结合实例进行解释。
3. 演示:进行实验演示,展示常见的物质分离和提纯操作,让学生直观地理解实验过程。
4. 练习:学生分组进行实验练习,运用所学的知识进行物质的分离和提纯操作。
5. 讨论:学生分组讨论实验过程中遇到的问题和解决方法,分享实验心得。
四、教学评价:1. 学生能够理解物质的分离、除杂和提纯的基本原理。
2. 学生能够掌握常见的物质分离和提纯方法,并能够运用所学的知识解决实际问题。
3. 学生具备一定的实验操作能力和科学思维。
五、教学资源:1. 实验仪器和试剂:烧杯、漏斗、滤纸、蒸馏器、萃取剂等。
2. 教学课件和教案:提供详细的课件和教案,帮助学生理解和掌握所学内容。
3. 参考资料:提供相关的参考书籍和网络资源,供学生进一步学习。
六、教学重点与难点:教学重点:1. 掌握过滤、蒸发、蒸馏、萃取等物质分离方法的操作步骤及适用条件。
2. 理解除杂原则及应用。
3. 学会使用结晶、干燥、吸附等方法进行物质的提纯。
教学难点:1. 不同分离方法的选择与操作。
2. 除杂原则在实际操作中的应用。
3. 复杂物质体系中物质的分离与提纯。
七、教学方法:1. 采用问题驱动的教学方法,引导学生思考和探索。
2. 利用实验演示和分组实践,提高学生的动手操作能力。
3. 采用讨论和小组合作的方式,培养学生的团队协作和沟通能力。
江苏省如皋市白蒲镇中考化学专题复习2物质的类别与命名活动学案(无答案)(新版)新人教版.doc

江苏省如皋市白蒲镇中考化学专题复习2物质的类别与命名活动学案(无答案)(新版)新人教版2 物质的类别与命名学习目标1.认识初中常见的化学物质,会从宏观、微观角度对物质进行分类;2.理解混合物与纯净物、单质与化合物、金属与非金属、氧化物与酸碱盐、有机物与无机化合物的概念。
活动方案活动一、熟悉常见的混合物你知道的混合物有哪些___________________________________________________ ____... 1.判别依据_____________________________________________(宏观);若由分子构成的物质中,若含有__________分子,则为混合物(微观)。
想一想用“”和“ ”表示不同元素的原子,根据下列示意图回答问题上图中A属于混合物的理由是什么___________________;______图表示的也是混合物。
2.常见的混合物蓝色溶液_____________________ (1)a溶液浅绿色溶液___________________ b悬浊液、c乳浊液黄色溶液_____________________ 混合物2合金铁合金(包括_________、________);黄铜________...... 3三大矿物化石燃料__________ __________ ____________ (4)自然界存在的大多数物质,如空气、河水、石灰石、铁矿石等 3.写出下列常见混合物有效成分的化学式石灰石__________ 赤铁矿石__________ 铁锈___________ 草木灰___________ 过氧化氢溶液_________ 石灰水_________ 稀盐酸_________ 稀硫酸________ 生铁________、________ 钢________、________ 黄铜________、________ 活动二、理解纯净物及其分类判别依据_____________________________________________(宏观);若由分子构成的物质中,若含有__________分子,则为纯净物(微观)。
江苏省如皋市白蒲镇中考化学专题复习32物质的推断活动学案2(无答案)(新版)新人教版
专题复习物质的推测【学习目标】1、认识推测题的特色,掌握推测题的解题思路。
2、培育逻辑推理能力、文图变换的能力和综合应用能力。
【活动方案】活动一、发掘物质推测的显然条件、隐含条件1.下表是各物质间发生的化学反响NaOH溶液蓝色积淀白色积淀某溶液A Ba(NO3) 2溶液(不溶于稀硝酸)无色溶液无色溶液无色溶液B铁丝足量稀硝酸蓝色溶液铁丝表面有红色物质生成天蓝色积淀白色积淀依据以上实验现象能够推测出: A 为 ___ __B为___ ________ 天蓝色积淀(蓝色积淀和白色积淀的混淆物)为:_红色固体为:____________蓝色积淀为:和___白色积淀为:________2. 两种溶液反响生成有色积淀,则积淀可能是和3.假如溶液颜色为蓝色则该溶液可能为和:假如溶液颜色为浅绿色则该溶液可能为和假如溶液颜色为黄色则该溶液可能为和4. 两种溶液反响生成白色积淀且积淀不溶于硝酸,则积淀可能是和两种溶液反响生成白色积淀且积淀能溶于硝酸,若溶解时有气体生成则积淀可能是和若溶解时无气体生成则积淀可能是和和【贯通融会】1. 以下图中的甲、乙、丙表示初中化学常有的物质, 且甲、乙、丙为不一样类其他化合物, 乙属于氧化物。
胃液中含有适当的甲, 可帮助消化。
图中“——”表示两头的物质间能发生化学反响; “”表示物质间存在转变关系; 部分反响物、生成物已略去。
(1) 甲是胃液中成分,可帮助消化。
写出甲的化学式(2) ①若乙在常温下为液体, 丙可用来改进酸性土壤:。
, 则乙的化学式为, 丙的化学式为。
②若乙在常温下为气体, 且可由甲与大理石反响获得生复分解反响 , 其化学方程式为的乙发生化合反响的化学方程式:, 则乙的化学式为( 写出一个即可, 丙能与①中的丙发) 。
③写出①中的乙和②中。
活动二、找准物质推测的打破口以物质的颜色、个性现象、元素或物质之最、物质用途、物质构成、化学反响特色为打破口1.A— G 是初中常有的 7 种物质,它们有以以下图所示的转变关系(部分产物已略去)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
24 物质的分离与提纯
【学习目标】
1.弄清含有多种杂质的物质提纯的一般思路。
2.了解物质分离、提纯的原则。
3.依据物质的性质特征,能选择恰当的除杂方法或除杂试剂。
【活动方案】
物质的分离是将混合物中各成分一一分开成为纯净物的过程,而物质的提纯是除去物质中混有杂质的过程。
活动一、体验物质的提纯思路
粗盐中含有的可溶性杂质(如CaC l 2等)和不溶性杂质(泥沙等)。
通过提纯可除去粗盐中不溶性杂质和可溶性杂质。
过程设计如下:
1.除去氯化钠中的泥沙
2.除去氯化钠中混有的氯化钙
NaCl (CaCl 2)
提纯的原理:利用杂质与被提纯物质的___________和___________的差异,进行提纯。
活动二、感悟物质提纯的原则
为除去氢氧化钠溶液中混有碳酸钠,甲、乙、丙、丁、戊五位同学设计了不同的方案。
通过上述活动的学习,你能说出物质提纯的原则吗?
活动三、归纳物质提纯的方法
1.请选择合适方法,除去下列各组物质中的杂质(括号内为杂质):
⑴ NaCl固体(泥沙):_____ _ ⑵ KNO3(NaCl): ____ _
⑶水(色素):_____ _ ⑷铜粉(铁粉):_____ _
A活性炭吸附 B磁铁吸引 C溶解、过滤、蒸发 D高温溶解、降温结晶、过滤
2.请选择合适方法或试剂,除去下列各组物质中的杂质(括号内为杂质),写出相关的化学方
程式。
⑴CaO(CaCO3)___________________________ (2) CuO(Cu) __________________________
讨论:有同学认为上述两组物质中杂质,都可以通过加入足量稀盐酸而除去,你认为可行吗?
3.请选择合适方法或试剂,除去下列各组物质中的杂质(括号内为杂质),写出相关的化学方
程式。
(1)C粉(CuO)★(2)Cu(Fe)
思考:上述除杂过程的具体操作顺序是:
A过滤 B干燥 C洗涤 D加入过量稀盐酸
4.请选择合适方法或试剂,除去下列各组物质中的杂质(括号内为杂质),写出相关的化学方
程式。
(1)CO2(CO)_________________________(2)CO(CO2)____________________________
讨论:实验室制取的二氧化碳气体中常有少量氯化氢气体,能否用氢氧化钠溶液来除?为什么?
5.请选择合适试剂,除去下列各组物质中的杂质(括号内为杂质),并写出相关的化学方程式。
FeSO4溶液(CuSO4)___________________________
6.请选择合适试剂,除去下列各组物质中的杂质(括号内为杂质),并写出相关的化学方程式。
NaCl溶液(Na2SO4) ________________________________________
★Na2SO4溶液(Na2CO3)_____________ ____________
★NaCl溶液(NaOH) _________________________________________
★思考:上述除杂过程中所加入的除杂试剂的量能否过量?如何判断所加试剂的量为适量?
【课堂反馈】
A组1.混合物按溶解、过滤、蒸发分离的是()A.NaCl 和KNO3 B.CaCO3和C C.NaCl和CaCO3 D.Fe和CuCl2
AB组2.下列除去杂质的方法错误的是()
B组3.有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。
某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。
方案流程如图:
回答下列问题:
(1)步骤②中:需加入的物质是,分离所得混合物的方法是。
(2)步骤③中:需加入的物质是,发生反应的化学方程式是。
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合
理?,理由是 .
(4)步骤④的操作是,溶液2和溶液3为什么要混合?。
