环境化学原理
环境化学原理及环境污染控制技术

环境化学原理及环境污染控制技术环境化学原理是研究环境中各种物质的转化、分布和迁移规律的科学,而环境污染控制技术是指通过各种手段和方法,减少或消除环境污染物对生态环境和人类健康的危害。
环境化学原理为环境污染控制技术提供了科学依据和理论支持。
本文将从环境化学原理的角度出发,探讨环境污染控制技术在保护环境方面的应用。
一、环境化学原理1. 环境污染物的来源与分类环境污染物来源广泛,包括工业排放、农业活动、交通尾气、生活废水等。
根据物质的性质,环境污染物可分为有机污染物和无机污染物。
有机污染物包括挥发性有机化合物(VOCs)、氨氮、亚硝酸盐等,而无机污染物则涵盖了重金属离子、无机盐等。
2. 污染物的转化与迁移环境污染物在大气、水体和土壤中会发生各种转化和迁移过程。
例如,有机污染物在大气中可发生光解和氧化反应;水体中的污染物可通过生物降解、吸附和溶解作用发生转化。
这些转化和迁移过程直接影响着环境污染物的去除和控制。
3. 污染物的积累与生物效应环境污染物在生物体内会发生积累现象,进而对生物体产生不良影响。
重金属污染物是典型的积累型污染物,它们在生物链中逐级富集,直至达到一定浓度时造成生物中毒作用。
此外,环境污染物还会干扰生物体内的代谢过程,引发一系列的生物效应。
二、环境污染控制技术1. 大气污染控制技术大气污染控制技术主要包括源头减排措施和尾气净化技术。
源头减排措施通过改变工业生产过程、优化能源结构等方式减少污染物的排放。
尾气净化技术包括静电除尘、活性炭吸附、催化氧化等,可有效去除大气中的颗粒物、有机物和无机污染物。
2. 水体污染控制技术水体污染控制技术包括污水处理和水质净化。
污水处理主要通过物理化学处理和生物处理来去除污水中的悬浮物、有机物和无机污染物。
水质净化技术则通过溶解性污染物的吸附、沉淀和生物降解等方式提高水体的水质。
3. 土壤污染控制技术土壤污染控制技术主要包括土壤修复和土壤保护。
土壤修复通过物理、化学和生物等手段,修复受污染的土壤,恢复其功能和生态系统服务。
酸碱平衡 环境化学原理

若用cT表示水中碳酸物质总量,则有
[H2CO3*] = cT 0 [HCO3-] = cT 1
[CO32-] = cT 2
K a1 K a1K a 2 1 0 (1 ) 2 [H ] [H ]
[H ] K a 2 1 1 (1 ) K a1 [H ]
(二)天然水的碱度和酸度
碱度 (Alkalinity) 是指水中能与强酸 发生中和反应的全部物质,即能接受质 子 H+ 的物质总量,这里指的碱度即水体 的总碱度。 酸度 (Acidity) 是指水中能与强碱发 生中和反应的全部物质,即放出 H+ 或经 水解能产生 H+ 的物质的总量,这里指的 酸度即水体的总酸度。
2
6
8
10
12
pH
pH=1/2(pKa1+pKa2)=8.34
图3-2 碳酸形态分布图
pCO 2 作为开放体系[CO2(aq)]=KH · 溶液中,碳酸形态总量相应为:
[H2CO3*] = [CO2(aq)] = cT 0
cT [CO2 (aq)] / 0
1
Ka1 1 [HCO3 ] cT1 KH pCO KH pCO 0 [H ] K a1K a 2 2 2 [CO3 ] cT 2 K H pCO K H pCO 2 0 [H ]
[H ] [H ] 1 2 (1 ) K a1K a 2 K a 2
2
封闭体系的碳酸平衡(视H2CO3为非挥发酸,且
不受大气中CO2含量的影响)
100
pH=6.35=pKa1 pH=10.33=pKa2
80 60
40 20 0
南开大学环境化学教案

课时:2课时教学目标:1. 让学生了解环境化学的基本概念、研究内容和应用领域。
2. 使学生掌握环境化学的基本原理和方法,培养环境化学实验技能。
3. 培养学生关注环境保护意识,提高环保素养。
教学内容:1. 环境化学基本概念及研究内容2. 环境化学的基本原理3. 环境化学实验方法4. 环境污染及治理教学过程:第一课时一、导入1. 教师简要介绍环境化学的定义和重要性。
2. 学生分享自己对环境化学的认识。
二、环境化学基本概念及研究内容1. 教师讲解环境化学的基本概念,如环境、污染物、环境化学等。
2. 学生分组讨论环境化学的研究内容,如大气污染、水污染、土壤污染等。
三、环境化学的基本原理1. 教师讲解环境化学的基本原理,如质量守恒定律、反应速率与平衡等。
2. 学生通过实例分析环境化学原理在环境问题中的应用。
四、环境化学实验方法1. 教师介绍环境化学实验的基本方法,如样品采集、分析测试等。
2. 学生分组进行环境化学实验操作,如水质检测、大气污染检测等。
第二课时一、环境污染及治理1. 教师讲解环境污染的类型、来源及危害。
2. 学生分组讨论环境污染的治理方法,如物理治理、化学治理等。
二、案例分析1. 教师选取典型案例,如雾霾、水污染等,引导学生分析环境污染的原因及治理措施。
2. 学生分组进行案例讨论,提出自己的观点和建议。
三、总结与拓展1. 教师总结本节课的主要内容,强调环境化学在环境保护中的重要性。
2. 学生分享自己的学习心得,提出对环境保护的建议。
教学评价:1. 课堂表现:学生的参与度、讨论积极性等。
2. 实验操作:学生的实验技能、实验报告等。
3. 案例分析:学生的分析能力、提出建议的合理性等。
教学反思:1. 教师应注重激发学生的学习兴趣,提高课堂氛围。
2. 实验环节要确保学生的安全,培养学生的实验技能。
3. 案例分析要引导学生关注环境保护,提高环保素养。
环境化学-环境化学实验
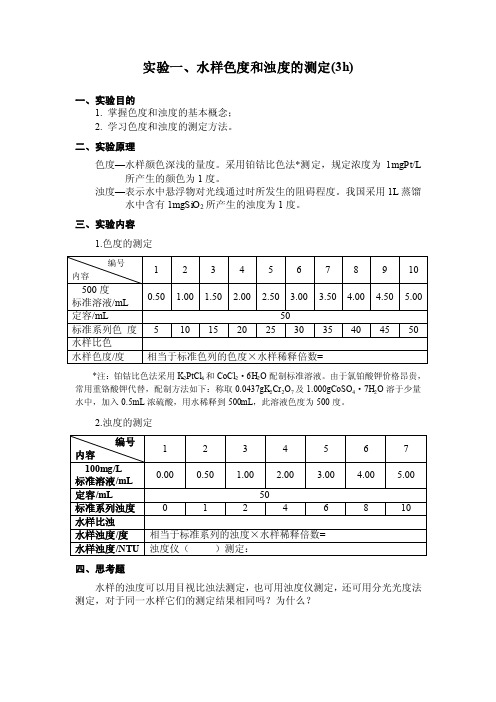
实验一、水样色度和浊度的测定(3h)一、实验目的1. 掌握色度和浊度的基本概念;2. 学习色度和浊度的测定方法。
二、实验原理色度—水样颜色深浅的量度。
采用铂钴比色法*测定,规定浓度为1mgPt/L 所产生的颜色为1度。
浊度—表示水中悬浮物对光线通过时所发生的阻碍程度。
我国采用1L蒸馏水中含有1mgSiO2所产生的浊度为1度。
三、实验内容1.色度的测定编号1 2 3 4 5 6 7 8 9 10 内容500度0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00 4.50 5.00 标准溶液/mL定容/mL 50标准系列色度 5 10 15 20 25 30 35 40 45 50 水样比色水样色度/度相当于标准色列的色度×水样稀释倍数=*注:铂钴比色法采用K2PtCl6和CoCl2·6H2O配制标准溶液。
由于氯铂酸钾价格昂贵,常用重铬酸钾代替,配制方法如下:称取0.0437gK2Cr2O7及1.000gCoSO4·7H2O溶于少量水中,加入0.5mL浓硫酸,用水稀释到500mL,此溶液色度为500度。
2.浊度的测定编号1 2 3 4 5 6 7内容100mg/L0.00 0.50 1.00 2.00 3.00 4.00 5.00 标准溶液/mL定容/mL 50标准系列浊度0 1 2 4 6 8 10水样比浊水样浊度/度相当于标准系列的浊度×水样稀释倍数=水样浊度/NTU 浊度仪()测定:四、思考题水样的浊度可以用目视比浊法测定,也可用浊度仪测定,还可用分光光度法测定,对于同一水样它们的测定结果相同吗?为什么?实验二、水样酸度和碱度的测定(3h)一、目的和要求1. 掌握酸度和碱度的基本概念;2. 学习酸度和碱度的测定方法。
二、实验原理酸度—指水中含有能与强碱发生中和作用的物质的总和。
①OH- + H+ = H2O (pHeq=7.0)②OH- + H2CO3 = HCO3- + H2O(pHeq=8.3)③OH-+ HCO3- = CO32- + H2O(pHeq=10.8)(甲基橙为指示剂—无机酸度①;酚酞为指示剂—CO2酸度①②)碱度—指水中含有能与强酸发生中和作用的物质的总和。
环境化学

一、名词解释:1、环境化学:环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学。
它既是环境科学的核心组成部分,也是化学科学的一个新的重要分支。
2、污染物的迁移:污染物在环境中所发生的空间位移及其所引起的富集、分散和消失的过程;污染物的转化:污染物在环境中通过物理化学或生物的作用改变存在形式或转变为另一种物质的过程3、一次污染物():是指由一次污染物经化学反应式形成的污染物质。
二次污染物():是指直接从污染物源排放的污染物质。
4、垂直递减率():随温度升高气温的降低率为大气垂直递减率。
干绝热垂直递减率():干空气在上升是温度降低值与上升高度之比。
5、光化学烟雾现象:含有氮氧化合物和碳氢化合物第一次污染物的大气,在阳光照射下发生光化学反应而产生二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象。
硫酸烟雾型污染:是由燃烧煤而排放出来的so2,颗粒物以及由so2氧化所形成的硫酸盐颗粒物所造成的大气污染现象。
6、一次颗粒物():直接由污染源排放出来的二次颗粒物():大气中某些污染组分之间或这些组分与大气成分之间发生反应而产生的颗粒物。
7、干沉降():是指颗粒物在重力作用下沉降或与其他物体碰撞后发生的沉降。
湿沉降():是指通过降雨降雪等使颗粒物从大气中去除的过程。
8、雨除():是指一些颗粒物可作为形成云得凝结核,成为云滴中心,通过凝结过程和碰撞过程使其增大为雨滴,进一步长大而形成雨降落到地面,颗粒物也随之从大气中被去除。
冲刷():降雨时在云下面的颗粒物与降下来的雨滴发生惯性碰撞或扩散,吸附过程从而使颗粒物去除。
9、分配系数:非离子性有机物可通过溶解作用分配到土壤有机质中并经过一定时间达到分配平衡,此时有机物在土壤有机质和水中含量的比值称分配系数。
标准化的分配系数:即有机碳为基础表示的分配系数。
辛醇——水分配系数:即化学物质在辛醇中质量和在水中质量的比值。
环境化学实验讲义

实验一 有机物的正辛醇-水分配系数有机化合物的正辛醇-水分配系数(K ow )是指平衡状态下化合物在正辛醇和水相中浓度的比值。
它反映了化合物在水相和有机相之间的迁移能力,是描述有机化合物在环境中行为的重要物理化学参数,它与化合物的水溶性、土壤吸附常数和生物浓缩因子密切相关。
通过对某一化合物分配系数的测定,可提供该化合物在环境行为方面许多重要的信息,特别是对于评价有机物在环境中的危险性起着重要作用。
测定分配系数的方法有振荡法、产生柱法和高效液相色谱法。
一、实验目的1. 掌握有机物正辛醇-水分配系数的测定方法。
2. 学习使用紫外分光光度计。
二、实验原理正辛醇-水分配系数是平衡状态下有机化合物在正辛醇相和水相中浓度的比值。
即:wo ow c c K 式中:K ow —— 分配系数;c o —— 平衡时有机化合物在正辛醇相中的浓度;c w —— 平衡时有机化合物在水相中的浓度。
本实验采用振荡法进行有机化合物的正辛醇-水分配系数的测定。
由于正辛醇中有机化合物的浓度难以确定,本实验中通过测定平衡时水相中有机物浓度,然后根据体系中有机物的初始加入量以及两相的体积来确定平衡时正辛醇中有机物的浓度。
首先,取一定体积含已知浓度待测有机化合物的正辛醇,加入一定体积的水,震荡,平衡后分离正辛醇相和水相,测定水相中有机物浓度,根据下式计算分配系数:式中:c o0 ——起始时有机化合物在正辛醇相中的浓度μL/L;c w——平衡时有机化合物在水相中的浓度μL/L;V0、V w ——分别为正辛醇相和水相中的体积,L。
三、仪器和试剂1. 仪器(1) 紫外分光光度计。
(2) 恒温振荡器。
(3) 离心机。
(4) 具塞比色管:1OmL。
(5) 微量注射器:5mL。
(6) 容量瓶:1OmL、25mL、250mL。
2. 试剂(1) 正辛醇:分析纯。
(2) 乙醇:95%,分析纯。
(3) 对二甲苯:分析纯。
(4) 苯胺:分析纯。
四、实验步骤1. 标准曲线的绘制(1) 对二甲苯的标准曲线移取1.00mL对二甲苯于10mL容量瓶中,用乙醇稀释至刻度,摇匀。
环境化学原理和知识点总结

环境化学原理和知识点总结环境化学的研究对象主要包括大气、水体和土壤环境中的化学物质。
在大气环境中,环境化学研究大气污染物的来源、转化过程,以及大气中的化学反应、形成和消解机制。
在水体环境中,环境化学研究水中各种化学物质的赋存形式、分布规律,以及水质污染的识别、监测和治理技术。
在土壤环境中,环境化学研究土壤中各种污染物的迁移、转化和归趋规律,以及土壤污染的防治和修复措施。
此外,环境化学还涉及各种环境介质之间的相互作用和耦合效应,以及生物体对环境中化学物质的吸收、富集和代谢过程。
环境化学的基本原理包括化学动力学、热力学、电化学、光化学等多个方面。
在环境化学中,化学动力学是研究化学反应速率和反应机制的核心原理。
化学动力学可以描述环境中的化学反应速率的变化规律,揭示环境中的化学反应过程。
热力学是研究物质能量转化和平衡状态的原理,它可以描述环境中化学反应的热效应和平衡态条件。
电化学是研究化学反应中电荷转移和电化学反应的原理,它可以揭示环境中的电化学过程和电化学污染物的迁移规律。
光化学是研究光能与物质之间相互作用的原理,它可以解释环境中的光化学反应和光化学污染物的转化机制。
环境化学中的一些重要知识点包括污染物的生物富集和生物放大效应、环境中的化学平衡和动态平衡、环境中的氧化还原反应和氧化还原电位、环境中的化学分馏和物质迁移、环境中的化学传递和物质转换、环境中的污染物降解和修复技术等。
在污染物的生物富集和生物放大效应中,环境化学关注生物体对环境污染物的吸收和富集能力以及生物体之间污染物的传递和转化规律。
在环境中的化学平衡和动态平衡中,环境化学研究环境中各种化学平衡态条件的形成机制和破坏规律。
在环境中的氧化还原反应和氧化还原电位中,环境化学揭示了环境中氧化还原反应的热力学和动力学机制,以及氧化还原电位的测定和应用方法。
在环境中的化学分馏和物质迁移中,环境化学研究环境中物质在不同介质之间的分馏和迁移规律,以及分馏过程中的物质分布和转化机制。
环境化学原理-1-5精品文档

由表3-7可以看出,只要水环境中存在S2-,几 乎所有的重金属离子均可从水体中除去。在天然水 体中,S2-的含量约为10-10 mol/L,相当于3.210-6 mg/L。以Cu2+为例,CuS溶度积等于6.310-36,在 25℃下:
[Cu2+][S2-] = 6.310-36 把天然水中S2-的浓度代入上式,便可得天然水 中Cu2+的平衡浓度: [Cu2+] = 6.310-36/10-10 = 6.310-26 (mol/L) 由此说明,只要天然水中有少量S2-存在,Cu2+ 完全可从天然水中沉淀出来。
[H])1 Ka2
)
如在pH = 7,cT = 310-3 mol/L下
2 = 3.8210-4
[Ca2+] = Ksp/cT 2
= 2.910-9/(310-33.8210-4)
= 2.510-3(mol/L)
= 2.5(mmol/L)
- lg[Ca2+] = 2.60
不同深度水体PO4-P随时间的 变化情况
结论:1)长江口海域PO4-P沿长江径流入海方向 的浓度分布则呈现出先增加后降低的特征,最高 值出现在咸淡水交界面附近, 为2.06μmol/L;2) 连续观测数据显示, PO4-P浓度可能在4h的时间 里发生较大幅度的波动;3) 在混合水区,由于水 深较浅,水体混合较容易,垂直方向上各元素的浓 度平均值差异不大; 4) 在水深较深的海水区,随 着水深的增加, PO4-P浓度平均值总体上呈上升 趋势。
■ 水中Ca2+对pH的调节作用
C1:CaCl2 2mmol/L C2: CaCl2 8mmol/L N1:NaHCO3 2mmol/L N2: NaHCO3 8mmol/L 因此,CaCl2在降低盐碱性水体的pH有显著作用
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(三)碳酸盐
两价金属离子的碳酸盐通常是一些难溶 性化合物,表3-8列出了金属碳酸盐的溶度积。 由于碳酸盐在不同pH条件下,溶解度不同, 加上空气中CO2分压对溶液中碳酸形态的影 响,故碳酸盐对水中金属离子迁移的贡献随 环境条件的变化而异。
表3-8 金属碳酸盐的溶度积
S2-的含量约为10-10 mol/L,相当于3.210-6 mg/L [CO2] = 1.028×10-5mol/L,相当于0.45 mg/L,这时 CO32-含量约为10-7mol/L。
表3-9 金属磷酸盐的溶度积
注:引自张孙玮等编,1987
PO43-→水体 Ca2+?Mg 2+?
Fe3+?Al3+?
下面以磷与Ca2+、Fe3+和Al3+的 反应为例,讨论磷在天然水中的溶解 度与水体pH的关系。
在天然水中,[Ca2+]一般为10-4
mol/L,假设磷与其生成CaHPO4和 Ca3(PO4)2型沉淀,与Fe3+ 或Al3+形 成FePO4 或AlPO4型沉淀。
根据溶度积规则,可以得出二氧
化碳开放体系中的金属离子浓度的计
算公式为:
[Me2+] = 0 Ksp/( 2 KH pCO 2 )
[Me2+] = 0 Ksp/( 2 KH pCO 2 )
= [H+]2Ksp /Ka1Ka2 KH pCO 2
在大气CO2分压固定的情况下,金属 碳酸盐的lg[Me2+]与水体pH的关系为一条 斜率为-2的直线,也就是说,水体pH每提 高1单位,金属离子的浓度就下降2个数量 级。
于是:
[Ca2+] = Ksp/[CO32-] = Ksp/cT 2
这就是计算水溶液中钙离子浓度
的公式。
对于其它金属Me2+,有
[Me2+]= Ksp/ cT 2 由于 2 是pH的函数,说明CaCO3
或MeCO3的溶解与pH有关。
(
2
(1[H]2 Ka1Ka2
[H])1 Ka2
)
如在pH = 7,cT = 310-3 mol/L下
当磷形成的磷酸盐为CaHPO4时, 遵循下列平衡:
CaHPO4
Ca2+ + HPO42-
pKsp = 7.0
而HPO42-在水中还须与其它磷酸
形态相平衡,如:
H2PO4-
H+ + HPO42-
pKa2 = 7.20
根据溶度积原理,有
pKsp = p[Ca2+] + p[HPO42-] = p[Ca2+] + pKa2 + p[H2PO4-] - pH
即
p[H2PO4-] = pKsp – p[Ca2+] - pKa2 + pH pKsp、pKa2分别为CaHPO4的溶度积和
磷酸的二级离解常数的负对数,将有关常数
和p[Ca2+]代入上式,便得到25℃时,水中 磷酸盐浓度为:
p[H2PO4-] = pH – 4.2
水中CaHPO4在较短时间内会转 化 为 Ca3(PO4)2 , 类 似 于 CaHPO4 反 应 , Ca3(PO4)2 与 水 中 磷 达 到 平 衡 时 , 有
■ 水中Ca2+对pH的调节作用
C1:CaCl2 2mmol/L C2: CaCl2 8mmol/L N1:NaHCO3 2mmol/L N2: NaHCO3 8mmol/L 因此,CaCl2在降低盐碱性水体的pH有显著作用
由于方解石(CaCO3)是天然水 体中钙的主要矿物,其对水中离子的
调节非常重要。因此,下面以CaCO3 和其它金属的碳酸盐为例,对碳酸盐
环境化学原理
由表3-7可以看出,只要水环境中存在S2-,几 乎所有的重金属离子均可从水体中除去。在天然水 体中,S2-的含量约为10-10 mol/L,相当于3.210-6 mg/L。以Cu2+为例,CuS溶度积等于6.310-36,在 25℃下:
[Cu2+][S2-] = 6.310-36 把天然水中S2-的浓度代入上式,便可得天然水 中Cu2+的平衡浓度: [Cu2+] = 6.310-36/10-10 = 6.310-26 (mol/L) 由此说明,只要天然水中有少量S2-存在,Cu2+ 完全可从天然水中沉淀出来。
pKa0 -1
pKa1
•
pKa2
-2
-3 H+
CT
CO32-
lgc -4 -5 -6 -7 -8
HCO3-
•
OH-
H2CO3*
Ca2+
真实H2CO3
4
5
6
7
8
9 10 11
pH
图3-3 开放体系的碳酸平衡
(四)磷酸盐
水溶液中正磷酸根易于和许多金属离子 形成难溶性化合物,没有被重金属污染的天然 水体,主要含碱土金属离子,而土壤、岩石中 的构成元素,如铁、铝等在其化学风化过程中 汇入水体,从而与水中包括磷酸根在内的阴离 子发生沉淀作用。反过来,磷酸盐的沉淀也会 影响环境中一些金属离子的有效性。
2 = 3.8210-4
[Ca2+] = Ksp/cT 2
= 2.910-9/(310-33.8210-4)
= 2.510-3(mol/L)
= 2.5(mmol/L)
- lg[Ca2+] = 2.60
再如在这一条件下,PbCO3的溶解 度为:
[Pb2+] = Ksp/cT 2
= 7.410-14/(310-33.8210-4)
2. 开放体系
天然水体实际上是CO2的开放体 系,水体中CaCO3的形成是与水中碳 酸各形态基本上处于平衡之中。根据
亨利定律,大气中CO2一定,溶液中 [CO2]也相应固定:
即 cT = [CO2]/ 0 = KH pCO 2/ 0
而 [CO32-]= cT 2 = 2 KH pCO 2 / 0
的溶解度与pH的关系作进一步介绍。
1. 封闭体系
其特征为: 1) 只考虑溶液相碳酸形态和固相碳酸 盐碳酸形态; 2) 把H2CO3*当成不挥发酸处理; 3) 碳酸形态总浓度cT为常数, 其中
[CO32-] = cT 2
根据沉淀溶解平衡,有
CaCO3(s)
Ca2+ + CO32-
Ksp = [Ca2+][CO32-]
= 6.410-8 (mol/L)
- lg[Pb2+] = 7.19
0
pKa1
pKsp (CaCO3)
pKa2
2 4
-1gc 6 H+
8
• •
CO32OH-
•
Ca2+
Zn2+
10
Pb2+
12 4 5 6 7 8 9 10 11 12
pH
图3-6 封闭体系中CaCO3、ZnCO3和PbCO3的溶解度 (cT = 310-3 mol/L)
