第二章 稳态极化曲线的测量和应用
极化曲线的测定

实验八 极化曲线的测定一、实验目的1、掌握稳态恒电势法测定金属极化曲线的基本原理和测试方法。
2、了解极化曲线的意义和应用。
3、掌握恒电势仪的使用方法。
二、实验原理1、极化现象与极化曲线当电极处于平衡状态,电极上无电流通过时,这时的电极电势称为平衡电势。
当有电流明显地通过电极时,电极的平衡状态被破坏,电极电势偏离平衡值,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大,电极电势将越来越偏离平衡电势。
这种由于有电流存在而造成电极电势偏离平衡电极电势的现象称为电极的极化。
在某一电流密度下,实际发生电解的电极电势与平衡电极电势之间的差值称为超电势。
阳极上由于超电势使电极电势变大,阴极上由于超电势使电极电势变小。
超电势的大小与流经电极的电流密度有关,电极电势(或超电势)与电流密度的关系曲线称为极化曲线,极化曲线的形状和变化规律反映了电化学过程的动力学特征。
除电流密度外,影响超电势的因素还有很多,如电极材料,电极的表面状态,温度,电解质的性质、浓度及溶液中的杂质等。
金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M →M n++n e此过程只有在电极电势正于其热力学电势时才能发生。
阳极的溶解速度(用电流密度表示)随电势变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象。
图3-8-1为钢在硫酸溶液中的阳极极化曲线。
图中曲线表明,从A 点开始,随着电势向正方向移动,电流密度也随之增加,电势超过B点后,电流密度随电势增加迅速减至最小,这是因为在金属表面生产了一层电阻高,耐腐蚀的钝化膜。
B 点对应的电势称为临界钝化电势,对应的电流称为临界钝化电流。
电势到达C点以后,随着电势的继续增加,电流却保持在一个基本不变的很小的数值上,该电流称为维钝电流,直到电势升到D 点,电流才有随着电势的上升而增大,表示阳极又发生了氧化过程,可能是高价金属离子产生也可能是水分子放电析出氧气,DE 段称为过钝化区。
极化曲线的测定
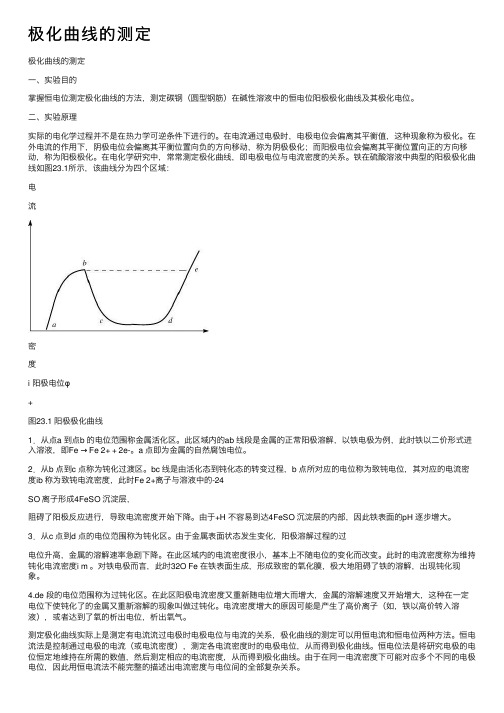
极化曲线的测定极化曲线的测定⼀、实验⽬的掌握恒电位测定极化曲线的⽅法,测定碳钢(圆型钢筋)在碱性溶液中的恒电位阳极极化曲线及其极化电位。
⼆、实验原理实际的电化学过程并不是在热⼒学可逆条件下进⾏的。
在电流通过电极时,电极电位会偏离其平衡值,这种现象称为极化。
在外电流的作⽤下,阴极电位会偏离其平衡位置向负的⽅向移动,称为阴极极化;⽽阳极电位会偏离其平衡位置向正的⽅向移动,称为阳极极化。
在电化学研究中,常常测定极化曲线,即电极电位与电流密度的关系。
铁在硫酸溶液中典型的阳极极化曲线如图23.1所⽰,该曲线分为四个区域:电流密度i 阳极电位φ+图23.1 阳极极化曲线1.从点a 到点b 的电位范围称⾦属活化区。
此区域内的ab 线段是⾦属的正常阳极溶解,以铁电极为例,此时铁以⼆价形式进⼊溶液,即Fe → Fe 2+ + 2e-。
a 点即为⾦属的⾃然腐蚀电位。
2.从b 点到c 点称为钝化过渡区。
bc 线是由活化态到钝化态的转变过程,b 点所对应的电位称为致钝电位,其对应的电流密度ib 称为致钝电流密度,此时Fe 2+离⼦与溶液中的-24SO 离⼦形成4FeSO 沉淀层,阻碍了阳极反应进⾏,导致电流密度开始下降。
由于+H 不容易到达4FeSO 沉淀层的内部,因此铁表⾯的pH 逐步增⼤。
3.从c 点到d 点的电位范围称为钝化区。
由于⾦属表⾯状态发⽣变化,阳极溶解过程的过电位升⾼,⾦属的溶解速率急剧下降。
在此区域内的电流密度很⼩,基本上不随电位的变化⽽改变。
此时的电流密度称为维持钝化电流密度i m 。
对铁电极⽽⾔,此时32O Fe 在铁表⾯⽣成,形成致密的氧化膜,极⼤地阻碍了铁的溶解,出现钝化现象。
4.de 段的电位范围称为过钝化区。
在此区阳极电流密度⼜重新随电位增⼤⽽增⼤,⾦属的溶解速度⼜开始增⼤,这种在⼀定电位下使钝化了的⾦属⼜重新溶解的现象叫做过钝化。
电流密度增⼤的原因可能是产⽣了⾼价离⼦(如,铁以⾼价转⼊溶液),或者达到了氧的析出电位,析出氧⽓。
极化曲线的测定

实验八 极化曲线的测定一、实验目的1、掌握稳态恒电势法测定金属极化曲线的基本原理和测试方法。
2、了解极化曲线的意义和应用。
3、掌握恒电势仪的使用方法。
二、实验原理1、极化现象与极化曲线当电极处于平衡状态,电极上无电流通过时,这时的电极电势称为平衡电势。
当有电流明显地通过电极时,电极的平衡状态被破坏,电极电势偏离平衡值,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大,电极电势将越来越偏离平衡电势。
这种由于有电流存在而造成电极电势偏离平衡电极电势的现象称为电极的极化。
在某一电流密度下,实际发生电解的电极电势与平衡电极电势之间的差值称为超电势。
阳极上由于超电势使电极电势变大,阴极上由于超电势使电极电势变小。
超电势的大小与流经电极的电流密度有关,电极电势(或超电势)与电流密度的关系曲线称为极化曲线,极化曲线的形状和变化规律反映了电化学过程的动力学特征。
除电流密度外,影响超电势的因素还有很多,如电极材料,电极的表面状态,温度,电解质的性质、浓度及溶液中的杂质等。
金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M →M n++n e此过程只有在电极电势正于其热力学电势时才能发生。
阳极的溶解速度(用电流密度表示)随电势变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象。
图3-8-1为钢在硫酸溶液中的阳极极化曲线。
图中曲线表明,从A 点开始,随着电势向正方向移动,电流密度也随之增加,电势超过B点后,电流密度随电势增加迅速减至最小,这是因为在金属表面生产了一层电阻高,耐腐蚀的钝化膜。
B 点对应的电势称为临界钝化电势,对应的电流称为临界钝化电流。
电势到达C点以后,随着电势的继续增加,电流却保持在一个基本不变的很小的数值上,该电流称为维钝电流,直到电势升到D 点,电流才有随着电势的上升而增大,表示阳极又发生了氧化过程,可能是高价金属离子产生也可能是水分子放电析出氧气,DE 段称为过钝化区。
电化学研究方法

2. 循环伏安法
b
a
a
t i
在很低的扫描速度下,当
电极反应可逆时,
Ep
(1)相对应的峰电流相等, 反应电量相等; (2)Ep = 2.3RT/nF
循环伏安法的应用 1. 研究电化学反应的可逆性,尤其是二次电池的 反应可逆性和循环稳定性;
2. 研究多电子反应,求出反应电子数;
3. 与恒电流法配合,研究电极反应的相变化,例 如,金属Sn, 石墨碳的多种含锂化合物(LiC18, LiC12, LiC6)。
3. 交流阻抗法 电池和电解池的等效电路
Cd Rl
Zf
实际的电化学系统中,法拉第阻抗包括反应电阻Rr和 浓差极化引起的Warburg阻抗Zw.
Cd Rl
Rw = -0.5 Cw = -0.5 /
Zf
Rw Cw
= RT/ [n2F2Co(2Do)0.5]
Z''
B
Cd = 1/BRr
Levich通过解稳态条件下的流体力学方程: 在非极限情况下:I = 0.62nFAD2/3-1/61/2(Co-Cs) 在极限条件下: IL = 0.62nFAD2/3-1/61/2Co 其中, 为介质的动力粘度, = 粘度/密度
i
IL 1/2
D,
四、电化学研究方法
1、稳态极化曲线测量:
一般采用三电极体系,采用慢速动电流扫描或慢速动电位扫 描法。若有电流极大值,则必须用动电位扫描。
曲线类型:i ~ E, i ~ , i ~ log 慢扫描近稳态条件下的测试可以防止电流或电位的迟后效应, 也能避免双电层充电电流的影响。
为了提高电位的测试精度,需要消除研究电极与参比电极之 间的欧姆电位降,主要的方法有:
第二章 电化学稳态和准稳态研究方法 2017

t i
t
逐点手动扫描法:操作简单、工作量大、时间长、由于测 量者对稳态的标准掌握不同,重现性差。
阶梯波法:利用阶梯波发生器控制恒电流仪或恒电势仪从而自动测定极化曲线。
起始电势(“Init E”或“Initial Potential”) 终止电势(“Final E”或“Final Potential”) 步增电势(“Incr E”或“Step E”)Increment potential of each step 步宽值(“Step Width”或“Step Period”)Potential step period 采样周期(“Sampling Width”或“Sample Period”)Data sampling width for each point 阶梯波阶跃幅值的大小及时间间隔的长短应根据实验要求而定。
3.稳态过程的特点
稳态系统的特点是由达到稳态的条件决定的。
1. 电极界面状态不变 ( 双电层的荷电状态不变 ) ,通过 电极的电流全部用于电化学反应(即整个体系的净电 流全部为法拉第电流),i=ir
改变界面电荷状态的双电层充电电流ic=0;
吸脱附引起的双电层充电电流i吸=0。
2.电极界面区反应物的浓度只与位置有关,与时间无关。
达到稳态后,电极界面区扩散层内反应物和产物粒子的
浓度分布(扩散层厚度恒定),不在随着时间变化,只是 空间位置的函数,此时物质扩散满足Fick第一定律。
扩散电流id为恒定值。
稳态系统具备的条件:电流、电极电势、电极表面状态和电极界面区的浓度等 均基本不变。 电极双电层的充电状态不变
i充 0
全部电流都用于电化 学反应
i i aj j j cj
三、稳态极化曲线
极化参考资料曲线的测定

实验八极化曲线的测定一、实验目的1、掌握稳态恒电势法测定金属极化曲线的基本原理和测试方法。
2、了解极化曲线的意义和应用。
3、掌握恒电势仪的使用方法。
二、实验原理1、极化现象与极化曲线当电极处于平衡状态,电极上无电流通过时,这时的电极电势称为平衡电势。
当有电流明显地通过电极时,电极的平衡状态被破坏,电极电势偏离平衡值,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大,电极电势将越来越偏离平衡电势。
这种由于有电流存在而造成电极电势偏离平衡电极电势的现象称为电极的极化。
在某一电流密度下,实际发生电解的电极电势与平衡电极电势之间的差值称为超电势。
阳极上由于超电势使电极电势变大,阴极上由于超电势使电极电势变小。
超电势的大小与流经电极的电流密度有关,电极电势(或超电势)与电流密度的关系曲线称为极化曲线,极化曲线的形状和变化规律反映了电化学过程的动力学特征。
除电流密度外,影响超电势的因素还有很多,如电极材料,电极的表面状态,温度,电解质的性质、浓度及溶液中的杂质等。
金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M →M n++ne此过程只有在电极电势正于其热力学电势时才能发生。
阳极的溶解速度(用电流密度表示)随电势变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象。
图3-8-1为钢在硫酸溶液中的阳极极化曲线。
图中曲线表明,从A 点开始,随着电势向正方向移动,电流密度也随之增加,电势超过B点后,电流密度随电势增加迅速减至最小,这是因为在金属表面生产了一层电阻高,耐腐蚀的钝化膜。
B 点对应的电势称为临界钝化电势,对应的电流称为临界钝化电流。
电势到达C 点以后,随着电势的继续增加,电流却保持在一个基本不变的很小的数值上,该电流称为维钝电流,直到电势升到D 点,电流才有随着电势的上升而增大,表示阳极又发生了氧化过程,可能是高价金属离子产生也可能是水分子放电析出氧气,DE 段称为过钝化区。
极化曲线的测定

实验九极化曲线的测定【目的要求】1. 掌握稳态恒电位法测定金属极化曲线的基本原理和测试方法。
2. 了解极化曲线的意义和应用。
3. 掌握恒电位仪的使用方法。
【实验原理】1. 极化现象与极化曲线为了探索电极过程机理及影响电极过程的各种因素,必须对电极过程进行研究,其中极化曲线的测定是重要方法之一。
我们知道在研究可逆电池的电动势和电池反应时,电极上几乎没有电流通过,每个电极反应都是在接近于平衡状态下进行的,因此电极反应是可逆的。
但当有电流明显地通过电池时,电极的平衡状态被破坏,电极电势偏离平衡值,电极反应处于不可逆状态,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大。
由于电流通过电极而导致电极电势偏离平衡值的现象称为电极的极化,描述电流密度与电极电势之间关系的曲线称作极化曲线,如图2-19-1所示。
图2-19-1 极化曲线A-B:活性溶解区;B:临界钝化点B-C:过渡钝化区;C-D:稳定钝化区D-E:超(过)钝化区金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M→M n++n e此过程只有在电极电势正于其热力学电势时才能发生。
阳极的溶解速度随电位变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象。
图2-19-1中曲线表明,从A点开始,随着电位向正方向移动,电流密度也随之增加,电势超过B点后,电流密度随电势增加迅速减至最小,这是因为在金属表面生产了一层电阻高,耐腐蚀的钝化膜。
B点对应的电势称为临界钝化电势,对应的电流称为临界钝化电流。
电势到达C点以后,随着电势的继续增加,电流却保持在一个基本不变的很小的数值上,该电流称为维钝电流,直到电势升到D点,电流才有随着电势的上升而增大,表示阳极又发生了氧化过程,可能是高价金属离子产生也可能是水分子放电析出氧气,DE段称为过钝化区。
稳态测试方法

稳态极化曲线的应用
(1) 在电化学基础研究方面的应用
根据极化曲线, 可以判断电极过程的反应机理和控制步骤 可以查明给定体系可能发生的电极反应的最大反应速率 可从极化曲线测动力学参数,如交换电流密度、传递系数、标准 速率常数和扩散系数等 可以测定Tafel斜率,推算反应级数进而研究反应历程 可以利用极化曲线研究多步骤的复杂反应 研究吸附和表面覆盖度
稳态测量数据的处理
b. 非线性拟合法。利用Origin软件,可直接对Bulter-Volmer公式进行非线性拟 合。在Origin中设置自定义方程,直接输入需拟合的参数,可以直接计算相关 动力学参数。
i i0 exp(
取对数:
nF
RT
)[1 exp(
nF )] RT
1
lg i lg i0
13
14
稳态测量数据的处理
稳态测量数据的处理
在实际测量中,利用强极化电势区测量时会遇到不少困难。 只有在从平衡电势到强极化电势区间电极反应的动力学机制始终没有发生改 变的情况下,才可以用强极化区的测量数据解释电极过程。 由于在强极化区,极化电流密度比较大,这会导致靠近电极表面的溶液层的 成分可能不同于平衡电势条件下的情况。在平衡电势附近传质过程(扩散)对 电极反应速率的影响很小,可以忽略。但在强极化区,传质的影响很大,几 乎得不到一段很好的Tafel直线。 在强极化条件下的电极表面的状况可能会与平衡电势下的表面状况有较大区 别,这种情况较易在阳极极化时发生。
17 18
RT 1 i nF i0
因此,在平衡电势附近的极化曲线为直线,由直线斜率可得电荷传递电阻Rct:
Rct (
交换电流密度:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.1.2 各种类型的稳态极化及其影响因素
电极过程共有三种类型的极化:电化学极化;浓差极化; 欧姆极化。通电时的电位变化=电化学极化+浓差极化+欧姆极 化。
电化学极化 ηa或ηc,由于电荷传递(电子得失)过程迟缓而造 成。 假设电极反应为简单的电荷传递反应,则电化学极化 过电位与电流关系满足Bultler-Volmer方程
第二章 稳态极化曲线的测量
Chapter Ⅱ Measurement of polarization curve at steady state
学习要点major emphasis in learning
稳态法的特点Characteristics of steady state method 稳态极化曲线的形式和特征type and features of polarization
电化学极化:由反应速度决定,与电化学反应本质有关。化学反 应的活化能较高,且各种反应的活化能相差比较悬殊,因此反应 速度的差别是以数量级计。影响因素包括温度、催化剂活性、电 极面积、界面电场、表面吸附成相层等。对于i0很小的不可逆电 极,很小的i0值就能引起较大的极化,
浓差极化:由扩散速度决定。气相扩散很自由,主要决定于分子 量和分子直径。液相扩散不自由,但扩散自由能很低。各种物质 的扩散系数小,都在同一数量级,例如水溶液中一般为10-5cm2/s, 气相中一般在10-1cm2/s数量级,温度对扩散系数的影响小,但扩 散层厚度能大幅度地改变扩散速度。一般在快速旋转的电极或溶 液流速很快的情况下,扩散层厚度能比自然对流的扩散层厚度低 一两个数量级。如果扩散途中有多孔隔膜,则隔膜的厚度、孔率 和曲折系数决定了扩散速度。浓差极化到达稳态需要的时间较长, 当i接近id时浓差极化过电位上升很快,极化曲线上表现为电流平 阶,必须用控制电位的方式才能得到相应的极化曲线。
速度。平衡态是一种特殊的稳态。 绝对的稳态不存在 稳态与暂态的划分以参量变化是否明显为标准,且此标
准也是相对的,与仪器的灵敏度有关。 稳态的全部电流都用于电化学反应
双电层充放电电流为零,电极界面处吸脱附电流为零. 电极界面区的扩散层内反应物和产物粒子的浓度与时间
无关,处于稳态扩散状态。 电极表面处的扩散电流为 id = nFD(dC/dx)x=0 = nFD(Co-Cs)/σ il = nFD Co/σ
旋转圆盘电极及其应用application of rotating disk electrode
本章主要内容
2.1 稳态方法特点 2.2 稳态极化曲线的基本特征 2.3 稳态极化曲线的测量方法 2.4 稳态极化曲线的应用 2.5旋转圆盘电极及其应用
2.1 稳态方法的特点
2.1.1 稳态过程
什么是稳态?
稳态是在指定时间范围内,电化学系统的参量 (如电位、电流、浓度分布、电极表面状态等)变化甚 微,基本上可认为不变时的状态。
如图中锌空电池小电流放电曲线中t1-t2时间段内电 池所处的状态即可以看作为稳态。
V
t1
t2
t
稳态过程的基本特点
稳态不等于平衡态 平衡态时电极反应的净速度为零,稳态时可存在净
10-3cm ,D≈ 10-5cm2/s,故稳态极化曲线不宜于研究
Ks>10-2cm/s的电化学反应。.
cR nF T [ln1(iliR)ln1(iliO)]
不可逆电极(i0/il < < 1, 即Ks < < D/σ) 在不同的过电位范围内表现为不同的极化形式。
当η>RT/αnF,逆反应可略
curve at steady state
稳态极化曲线的正确测量perfect measurement of polarization
curve at steady state
稳态极化曲线在电极过程动力学中的应用
application of polarization curve at steady state to study of electrode process kinetics
电阻极化:与i 成正比;能瞬间跟随i的变化。
2.2 稳态极化曲线的基本特征
2.2.1 极化曲线
以电极电位(或过电位)与电流密度(或电流密度的 对数)之间的关系在平面坐标系内绘图,所得曲线即为极 化曲线。
2.2.2 稳态极化曲线
以电极反应达到稳态时的电极电位(或过电位)与电 流密度(或电流密度的对数)之间的关系在平面坐标系内 绘图,所得曲线即为稳态极化曲线。
i
i0(1
i
nF
)e RT
ilo
则
RnTFlnii0
RTln ilo
nF iloi
k c
k
RT
nF
c
RT
nF
ln
i i0
(i<<ilo)
ln
i lo i lo
i
(i≈ilo)
在平衡电位附近(η<<RT/nF)
将(1)式按泰勒级数展开,略去η的高次项和η•i 项,得:
i i0[(1ilio)(1RnTFk)(1iliR)(1RnTFk)]
ii0(eR nT F eR nT F )
浓差极化 ηc,由于反应物和产物的扩散过程迟缓造成。~
cR nF T [ln1(iliR)ln1 (iliO)]
欧姆极化 ηΩ,由于电子导体和离子导体的欧姆电阻对电流导通 的阻碍造成,符合欧姆定律。一般情况下,离子导体 即溶液的欧姆电阻Rl远大于电子导体的电阻,故欧姆 极化一般为溶液中的欧姆极化。
Rl •i
电极反应可逆性与极化
电化学极化与浓差极化共存的i-η关系式:
ii0[1 (i)eR nT F(1i)eR nT F)](1)
ilo
ilR
可逆电极(i0/il >>1,即Ks>>D/ δ )
过电位完全由浓差极化引起,要想从稳态极化曲线上
ii10
1 ilo
1) ilR
k i(RrRcORcR)
当三种极化不可忽略时,η~i之间的关系曲线如图所示:
总之,稳态电极极化是一个复杂的过程,存在着多种 矛盾,表现为多种极化,其中占主要地位的极化决定着整 个电极的总极化。为了改变极化状况使之有利于生产,必 须进一步弄清各种极化的特点及其影响因素。
