苏教版高中化学选修4同步测训卷化学平衡状态
化学选修4第二章化学反应速率化学平衡测试题

第二章化学反应速率化学平衡测试题1.在可逆反应中,改变下列条件一定能加快反应速率的是()A.增大反应物的量B.升高温度C.增大压强D.使用催化剂2.过程的自发性的作用是()A.判断过程的方向B.确定过程是否一定会发生C.判断过程发生的速率D.判断过程的热效应3.在2A+B3C+4D反应中,表示该反应速率最快的是()A.υ(A)=0.5 mol/(L·s)B.υ(B)=0.3 mol/(L·s)C.υ(C)=0.8 mol/(L·s)D.υ(D)=1 mol/(L·s)4.在2升的密闭容器中,发生以下反应:2A(g)+ B(g) 2C(g)+D(g) 。
若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol5.一定条件下反应2AB(g) A(g)+B2(g)达到平衡状态的标志是( )A.单位时间内生成nmolA2,同时消耗2n molAB B.容器内,3种气体AB、A2、B2共存C.AB的消耗速率等于A2的消耗速率D.容器中各组分的体积分数不随时间变化6.在一定温度不同压强(P1<P2)下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )7.α1和α2分别为A、B在两个恒容容器中平衡体系A(g)2B(g)和2A(g)B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )A.α1、α2均减小B.α1、α2均增大.α1减小,α2增大D.α1增大,α2减小8.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3 B(g) 2 C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )A.平衡不移动B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1C.再达平衡时,C的体积分数增大D.再达平衡时,正反应速率增大,逆反应速率减小9.下列说法正确的是( )①活化分子间的碰撞一定能发生化学反应②普通分子间的碰撞有时也能发生化学反应③活化分子比普通分子具有较高的能量④化学反应的实质是原子的重新组合⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程⑥化学反应的实质是活化分子有合适取向时的有效碰撞A.①③④⑤B.②③⑥C.③④⑤⑥D.②④⑤10.设C+CO 22CO(正反应为吸热反应),反应速率为v 1;N 2+3H 22NH 3(正反应为放热反应),反应速率为v 2。
苏教版高中化学选修四专题2-第三单元-化学平衡的移动-专题综合检测(二)含答案

苏教版高中化学选修四专题2-第三单元-化学平衡的移动-专题综合检测(二)含答案专题综合检测(二)(时间:60分钟,满分:100分)一、选择题(本题包括10小题,每小题6分,共60分)1.在一定条件下发生反应2A(g)===2B(g)+C(g),将2 mol A通入2 L容积恒定的密闭容器甲中,若维持容器内温度不变,5 min末测得A的物质的量为0.8 mol,用B的浓度变化来表示该反应的速率为()A.0.24 mol/(L·min) B.0.08 mol/(L·min)C.0.06 mol/(L·min) D.0.12 mol/(L·min)解析:选D。
根据题中数据首先计算v(A),则v(A)=2 mol-0.8 mol2 L×5 min=0.12 mol/(L·min),再由v(A)∶v(B)=1∶1可得:v(B)=0.12 mol/(L·min)。
2.下列有关化学反应速率的说法中正确的是()A.氢气与氮气能够缓慢地反应生成氨气,使用合适的催化剂可以提高化学反应速率B.等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等C.用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率D.增大反应CO2(g)+H2(g)CO(g)+H2O(g)的压强,反应速率不变解析:选A。
锌粉与盐酸的接触面积大,所以锌粉与盐酸反应产生氢气的速率比锌片快,B 错误;浓硫酸能够使铁钝化,形成的氧化膜隔绝了硫酸与铁的接触,反应停止,C错误;尽管反应前后气体的物质的量不变,但增大压强,体积缩小,反应体系中的有关气体的浓度增大,反应速率增大,D错误。
3.(2017·高考海南卷改编)已知反应CO(g)+H2O(g)催化剂CO2(g)+H2(g)ΔH<0。
在一定温度和压强下于密闭容器中,反应达到平衡。
下列叙述正确的是()A.升高温度,K增大B.减小压强,n(CO2)增加C.更换高效催化剂,α(CO)增大D.充入一定量的氮气,n(H2)不变解析:选D。
2019-2020学年高中化学苏教版选修4同步测训卷:2.2.2化学平衡状态 Word版含答案.doc

2019-2020学年高中化学苏教版选修4同步测训卷2.2.2化学平衡状态1、下图是可逆反应X2 + 3Y22Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )A.t1时,只有正方向反应 B.t2时,反应未到达限度C.t2- t3,反应不再发生 D.t2- t3,各物质的浓度不再发生变化2、在一定条件下的密闭容器中加入2mol SO2和1mol O2,充分反应后能证明2SO2+O2是可逆反应的事实是( )2SOA.O2仍为1moB.SO2仍为2molC.SO2完全转化为SO3D.SO2、O2和SO3同时存在3、可逆反应:N2+3H22NH3的正、逆反应速率可用各反应物或生成物浓度变化来表示。
下列各关系中能说明反应已经达到化学平衡的是( )A.3v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)4、分析各选项中的各组反应,其中互为可逆反应的是( )A.2KHCO3K2CO3+H2O+CO2↑K2CO3+H2O+CO2=2KHCO3B.CO2+H2O=H2CO3H2CO3=CO2↑+H2OC.NH3+HCl=NH4Cl NH4Cl NH3↑+HCl↑D.2NaCl2Na+Cl2↑2Na+Cl22NaCl5、在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(表示混合气体的平均相对分子质量)( )A.B.C.D.6、在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。
则下列有关推断正确的是( )A.该反应的化学方程式为: 3X+2Y2ZB.若两容器中均达到平衡时,两容器的体积V (Ⅰ)< V (Ⅱ), 则容器Ⅱ达到平衡所需时间小于t0C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态D.若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应7、已知热化学方程式:SO2(g)+1/2O2(g)SO3(g) ΔH=-98.32kJ/mol,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量为()A.196.64kJ B.小于98.32kJ C.小于196.64kJ D.大于196.64kJ8、将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )A.2v(NH3)=v(CO2)B.密闭容器中气体密度不变C.密闭容器中混合气体的平均摩尔质量不变D.密闭容器中氨气的体积分数不变9、一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)2C(g)ΔH<0,反应过程中B、C的物质的量随时间变化的关系如左图;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如右图.下列有关说法正确的是()A.反应开始2min内,v(B)=0.1mol/(L·min)B.t1时改变的条件可能是升高温度C.t3时改变的条件可能是加压,此时c(B)不变D.t4时可能是使用了催化剂,此时c(B)不变10、在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)C(g)+D(g)已达平衡的是( )A.混合气体的压强B.混合气体的密度C.混合气体的分子数目D.混合气体的总物质的量11、在一密闭容器中进行反应:催化剂2SO2(g)+O2(g)2SO3(g)。
化学平衡的移动 同步练测(苏教版选修4)(含答案解析)

专题2 化学反应速率与化学平衡第三单元化学平衡的移动一、选择题(本题共20小题,每小题2分,共40分)1.有平衡体系CO(g)+2H2(g)====CH3OH (g)ΔH<0,为增加甲醇的产量,应采取的正确措施是()A.高温、高压B.适宜的温度、高压、催化剂C.低温、低压D.高温、高压、催化剂2.对于X+Y(g)Z的平衡,若增大压强,Y的转化率增大,则X和Z可能的状态是()A.X为气态,Z为固态B.X为固态,Z为气态C.X为气态,Z为气态D.无法确定3.改变反应条件使化学平衡向正反应方向移动,下列判断正确的是()A.生成物浓度一定增大B.生成物的物质的量分数一定增大C.反应物转化率一定提高D.某生成物的产率可能提高4.在密闭容器中,进行反应X(g)+3Y(g)(g)达到平衡后,其他条件不变,只增加X的量,下列叙述中不正确的是()A.正反应速率增大,逆反应速率减小B.X的转化率变大C.Y的转化率变大D.正、逆反应速率都增大5.可逆反应:2A(g)3B(?)+C(?)(正反应是吸热反应),随着温度升高,气体平均相对分子质量有减小趋势,下列判断正确的是()A.B和C可能都是固体B.B和C一定都是气体C.若C为固体,则B一定是气体D.B和C可能都是气体6.反应NH4HS(s)NH3(g)+H2S(g)在一定温度下达到平衡。
下列各种情况下,不能使平衡发生移动的是()A.温度、容积不变时,通入SO2气体B.移走一部分NH4HS固体C.容积不变,充入氮气D.充入氮气,保持压强不变7.在密闭容器中,进行下列反应:2A(g)+B(g)+C(g)D(g)+E(g)(正反应为吸热反应),达到平衡后,下列说法中正确的是( )A.若恒温定容情况下,充入一些稀有气体,压强增大,但平衡不移动B.若恒温定压条件下,加入C(g),则C的转化率将增大C.若定容升温,在新平衡体系中A的质量分数将减小D.温度、压强和容积都相同时,在另一密闭容器中加入2 mol A、1 mol B、1 mol C,平衡时两个容器中D和E的浓度分别相等8.下图中曲线表示一定条件下可逆反应X(g)+Y(g)2Z(g)+W(s)(正反应是放热反应)的反应过程。
(完整版)高中化学选修4化学平衡习题及答案解析

第三节化学平衡练习题一、选择题1.在一个密闭容器中进行反应:2SO 2(g)+O2(g) 2SO3(g)已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是()A.SO2为0.4mol/L,O2为0.2mol/LB.SO2为0.25mol/LC.SO2、SO3(g)均为0.15mol/LD.SO3(g)为0.4mol/L2.在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是()A. C生成的速率与C分解的速率相等B. A、B、C的浓度不再变化C. 单位时间生成n molA,同时生成3n molBD. A、B、C的分子数之比为1:3:23.可逆反应H 2(g)+I2(g) 2HI(g)达到平衡时的标志是()A. 混合气体密度恒定不变B. 混合气体的颜色不再改变C. H2、I2、HI的浓度相等D. I2在混合气体中体积分数不变4.在一定温度下的定容密闭容器中,取一定量的A、B于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)C(g)+D(g)已达平衡的是()A.混合气体的压强B.混合气体的密度C.C、D的物质的量的比值D.气体的总物质的量5.在一真空密闭容器中,通入一定量气体A.在一定条件下,发生如下反应:2A(g) B(g) + x C(g),反应达平衡时,测得容器内压强增大为P%,若此时A的转化率为a%,下列关系正确的是()A.若x=1,则P>a B.若x=2,则P<aC.若x=3,则P=a D.若x=4,则P≥a6.密闭容器中,用等物质的量A和B发生如下反应:A(g)+2B(g) 2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为()A.40%B.50%C.60%D.70%7.在1L的密闭容器中通入2molNH 3,在一定温度下发生下列反应:2NH3N2+3H2,达到平衡时,容器内N2的百分含量为a%。
苏教版高中化学选修4专题2化学平衡移动分类专题练习

化学平衡移动分类专题练习一、等效平衡、等效变换1、在一定温度下,把2 mol SO2和1 mol O2通入一定容积的密闭容器中,发生如下反应,,当此反应进行到一定程度时反应混合物就处于化学平衡状态。
现在该容器中维持温度不变,令a、b、c分别代表初始时加入的的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。
请填空:(1)若a=0,b=0,则c=___________。
(2)若a=0.5,则b=___________,c=___________。
(3)a、b、c的取值必须满足的一般条件是___________,___________。
(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)2、在一固定容积的密闭容器中充入2molX和1molY,发生反应:2X(气)+Y(气)aW(气),达到平衡后,W的体积分数为Φ。
若维持容器体积和温度不变,按0.6molX、0.3molY和1.4molW为起始物质,达到平衡后,W的体积分数仍为Φ,则a值为()A、1 B、4 C、 2 D、33、恒温、恒压下,在一个可变容积的容器中发生发应:A(气)+B(气)C(气)(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C物质的量为mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol 和3a mol,则x=mol,y=mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是。
4、在一个固定体积的密闭容器中,保持一定温度,进行以下反应,H2(气)+Br2(气)2HBr(气),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项),在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号(1)-(3)的状态,填写表中空白:5、在一个盛有催化剂溶剂可变的密闭容器中,保持一定温度和压强进行以下反应N2+3H22NH3。
选修4化学反应速率与化学平衡测试题

选修4化学反应速率与化学平衡测试题1.在-50℃时,液氨的电离跟水的电离相似,存在平衡,2NH34++NH2—,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是( )A.在液氨中加入NaNH2,可使液氨的离子积变大B.在液氨中加入NH4Cl,液氨的离子积不变C.此温度下液氨的离子积K为1×10-30D.在液氨中加入金属钠可能有NaNH2生成【答案】A【解析】试题分析:仔细观察液氨的电离方程式,不难发现液氨的电离类似于水的电离,均属于“质子(H+)转移自电离”,其中NH4+和NH2-分别相当于纯水中水电离出的H3O+和OH-。
由此类比推出,液氨的性质应类似于水,如液氨可以与金属钠反应生成H2和NaNH2;影响液氨电离平衡的因素也类似于水。
液氨的离子积(也应该只是温度的函数)为常数,此温度下会恒等于1×10-30。
故选项A不正确,BCD正确,答案选A。
考点:弱电解质的电离点评:本题考查弱电解质的电离,难度适中,考查学生对已有知识的迁移,应用知识的能力。
2.过程的自发性的作用是A.判断过程的方向B.确定过程是否一定会发生C.判断过程发生的速率D.判断过程的热效应【答案】A【解析】过程的自发性只能判断过程的方向,而不能判断过程是否一定会发生或过程发生的速率,更不能判断过程的热效应,所以只有选项A正确,其余都是错误的,答案选A。
3.下列说法正确的是A.反应:2CO(g)+2NO(g)N2(g)+2CO2(g)在温度为298K时能自发进行,则它的△H>0, △S>0B.0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小C.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭D.反应:2A(g)B(g)+2C(g),增大压强反应速率加快,A的转化率减小【答案】D【解析】A中反应熵值是减小的,不正确。
氯化铵水解,溶于显酸性。
稀释促进水解,但溶液的酸性是降低的,B不正确。
2019-2020学年高中化学苏教版选修4同步测训卷:2.3.2化学平衡图像 Word版含答案.doc
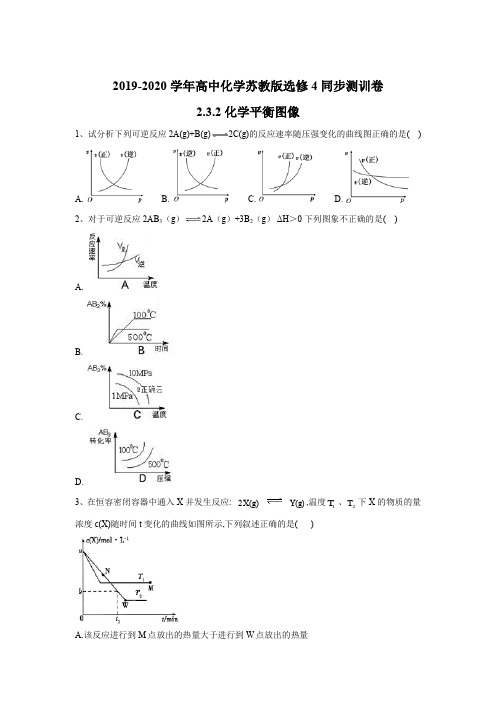
2019-2020学年高中化学苏教版选修4同步测训卷2.3.2化学平衡图像1、试分析下列可逆反应2A(g)+B(g)2C(g)的反应速率随压强变化的曲线图正确的是( )A. B. C. D.2、对于可逆反应2AB 3(g )2A (g )+3B 2(g ) ΔH >0 下列图象不正确的是( )A.B.C.D.3、在恒容密闭容器中通入X 并发生反应: 2X(g)Y(g),温度1T 、2T 下X 的物质的量浓度c (X)随时间t 变化的曲线如图所示,下列叙述正确的是( )A.该反应进行到M 点放出的热量大于进行到W 点放出的热量B.2T 下,在10~t 时间内,-1-11(Y)mol L min a bv t -=⋅⋅ C.M 点的正反应速率v 正大于N 点的逆反应速率v 逆 D.M 点时再加入一定量X,平衡后X 的转化率减小4、下图是合成氨反应的正、逆反应速率随反应时间变化的示意图,有关叙述错误的是( )A.状态I 和状态II 时,反应均处于平衡状态B.状态I 变化为状态II 的过程,称为化学平衡移动C.t 1时刻平衡向正反应方向移动,平衡常数增大D.同一种反应物在状态I 和状态II 时,浓度不相等 5、可逆反应A(?)+aB(g)C(g)+2D(g) (a 为正整数),反应过程中,当其他条件不变时, C 的百分含量(C%)与温度(T)和压强(p)的关系如图所示。
下列说法不正确的是( )A.当压强由p 1变为p 2时,逆反应速率将变大B.该反应的正反应为放热反应C.若a=2,则A 为液态或固体D.恒温恒容条件下,增加B 的物质的量,B 的转化率和该反应的化学平衡常数都将增大 6、H 2O 2分解速率受多种因素影响。
实验测得70 ℃时不同条件下H 2O 2 浓度随时间的变化如图所示。
下列说法正确的是( )A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快C.图丙表明,有少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大7、T°C时气体A与气体B在某容器中反应生成气体C,反应过程中A、B、C浓度变化如图①所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.2.2化学平衡状态1、下图是可逆反应X2 + 3Y22Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )A.t1时,只有正方向反应 B.t2时,反应未到达限度C.t2- t3,反应不再发生 D.t2- t3,各物质的浓度不再发生变化2、在一定条件下的密闭容器中加入2mol SO2和1mol O2,充分反应后能证明2SO2+O22SO 3是可逆反应的事实是( )A.O2仍为1moB.SO2仍为2molC.SO2完全转化为SO3D.SO2、O2和SO3同时存在3、可逆反应:N2+3H22NH3的正、逆反应速率可用各反应物或生成物浓度变化来表示。
下列各关系中能说明反应已经达到化学平衡的是( )A.3v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)4、分析各选项中的各组反应,其中互为可逆反应的是( )A.2KHCO3K2CO3+H2O+CO2↑K2CO3+H2O+CO2=2KHCO3B.CO2+H2O=H2CO3H2CO3=CO2↑+H2OC.NH3+HCl=NH4Cl NH4Cl NH3↑+HCl↑D.2NaCl2Na+Cl2↑2Na+Cl22NaCl5、在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(表示混合气体的平均相对分子质量)( )A.B.C.D.6、在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。
则下列有关推断正确的是( )A.该反应的化学方程式为: 3X+2Y2ZB.若两容器中均达到平衡时,两容器的体积V (Ⅰ)< V (Ⅱ), 则容器Ⅱ达到平衡所需时间小于t0C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态D.若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应7、已知热化学方程式:SO2(g)+1/2O2(g)SO3(g) ΔH=-98.32kJ/mol,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量为()A.196.64kJ B.小于98.32kJ C.小于196.64kJ D.大于196.64kJ8、将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH 2COONH4(s)2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )A.2v(NH3)=v(CO2)B.密闭容器中气体密度不变C.密闭容器中混合气体的平均摩尔质量不变D.密闭容器中氨气的体积分数不变9、一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)2C(g)ΔH<0,反应过程中B、C的物质的量随时间变化的关系如左图;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如右图.下列有关说法正确的是()A.反应开始2min内,v(B)=0.1mol/(L·min)B.t1时改变的条件可能是升高温度C.t3时改变的条件可能是加压,此时c(B)不变D.t4时可能是使用了催化剂,此时c(B)不变10、在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)C(g)+D(g)已达平衡的是( )A.混合气体的压强B.混合气体的密度C.混合气体的分子数目D.混合气体的总物质的量11、在一密闭容器中进行反应:催化剂2SO2(g)+O2(g)2SO3(g)。
已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L。
当反应达到平衡时,可能存在的数据是( )A.SO2为0.8mol/L,O2为0.4mol/LB.SO2为0.5mol/LC.SO3为0.8mol/LD.SO2、SO3均为0.3mol/L12、将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)→2NH3(g)+CO2(g).判断该分解反应已经达到化学平衡的是( )A. 密闭容器中混合气体的密度不变B. 密闭容器中c (NH 3):c (CO 2)=2:1C. 2v (NH 3)=v (CO 2)D. 密闭容器中氨气的体积分数不变13、已知:反应I:4NH 3(g)+5O 2(g) Pt/RuΔ−−−→4NO(g)+6H 2O(g) △H<0 反应II:4NH 3(g)+3O 2(g)2Cu/TiO Δ−−−−→2N 2(g)+6H 2O(g) △H<0①在恒温恒容装置中充入一定量的NH 3 和O 2,在催化剂的作用下进行反应I ,则下列有关叙述中正确的是_______(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数)增大B.若测得容器内3v(NH 3)=2v (H 2O)时,说明反应已达平衡C.通入一定量的氮气,则化学反应速率增大D.达到平衡时体系的压强不再变化14、一定温度下,在恒压容器中发生反应:2SO 2(g )+O 2(g )2SO 3(g )ΔH=-197 kJ•mol -1,下列有关说法正确的是( )A.达到化学平衡状态时,v 正(O 2)= 2v 逆(SO 2)B.容器内的压强不再变化说明反应达到化学平衡状态C.向容器中加入0.2 mol SO 2和0.1 mol O 2,充分反应后放出热量19.7 kJD.向容器中充入二氧化硫,正反应速率增大,逆反应速率减小 15、在密闭容器中充入4mol X ,在一定的温度下4X (g ) 3Y (g) + Z (g),达到平衡时,有30%的发生分解,则平衡时混合气体总物质的量是( ) A .3.4molB .4molC .2.8molD .1.2mol16、100℃时,将0.1mol N 2O 4置于1 L 密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N 2O 4(g) 2NO 2 (g)。
下列结论不能说明上述反应在该条件下已经达到反应限度的是( )①N 2O 4的消耗速率与NO 2的生成速率之比为1∶2; ②NO 2的生成速率与NO 2消耗速率相等; ③烧瓶内气体的压强不再变化; ④烧瓶内气体的质量不再变化; ⑤NO 2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦B.①④⑧C.只有①④D.只有⑦⑧17、氮及其化合物在人们的生活经常出现。
(1)汽车尾气中NO生成过程的能量变化示意图如下:该条件下,N2和O2完全反应生成1molNO,会(填“吸收”或“放出”)kJ能量。
(2)一定温度下,在体积为0.5L的恒容密闭容器中,氮的气态氧化物X和Y之间反应过程中各物质的物质的量与时间的关系如图所示。
①写出该反应的化学反应方程式:。
(用物质的化学式表示)②在0~3min内,用Y表示的反应速率为③下列叙述能说明该反应已达到化学平衡状态的是(填字母)。
a.容器内压强不再发生变化b.X的体积分数不再发生变化c.容器内原子总数不再发生变化d.相同时间内消耗n mol Y的同时生成2n mol X④反应达到平衡后,若降低温度,则v(正) ,v(逆) (填“增大”“减小”或“不变”)。
(3)反应A(g)+3B(g)=2C(g)+3D(g)在四种不同情况下的反应速率分别为:①-1v-=⋅(B)0.09mol(L s)v(A)=0.015mol(L s)⋅②1③-1⋅v(D)=0.045mol(L s)v (C)=2.4mol(L min)⋅④-1该反应在四种不同情况下速率由大到小的顺序为(用序号填空) 。
18、直接排放SO 2、NO 2会危害环境。
工业上常采用化学方法控制污染。
(1)如图是1mol CH 4,完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。
①CH 4完全燃烧的活化能是______kJ/mol 。
②在催化剂作用下,CH 4可以还原SO 2生成单质S(g)、H 2O(g)和CO 2,写出该反应的热化学方程式____________________。
(2)为减少SO 2排放,将含SO 2的烟气通过洗涤剂X ,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收SO 2,同时又可得到化肥。
X 可以是______(填序号)。
a.2Ca(OH) b.23K CO c.24Na SOd.32NH H O(3)对NO 2+SO 2SO 3+NO ΔH < 0反应进行探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定NO 2的平衡转化率。
实验结果如图所示:①能够加快该化学反应速率的外界条件是_____ 降低温度b.增大压强c.升高温度d.减小压强②如果要将图中C 点的平衡状态改变为B 点的平衡状态,应采取的措施是____________________。
③若A 点对应实验中,SO 2(g)的起始浓度为C 0 mol·L -1,经过t min 达到平衡状态,该时段化学反应速率(NO 2)=______ mol·L -1·min -1④图中C 、D 两点对应的实验温度分别为T C 和T D ,计算判断T C ______T D (填“>”“< ” 或“=”)。
答案以及解析1答案及解析:答案:D解析:2答案及解析:答案:D解析:3答案及解析:答案:A解析:4答案及解析:答案:B解析:可逆反应是指同一条件下进行的反应,而A、C、D项中的两反应的反应条件不同,均不属于可逆反应。
5答案及解析:答案:C解析:6答案及解析:答案:C解析:由图可知, Z是反应物, X、Y是生成物,根据t0时刻前物质的量的变化知,该反应的化学方程式为: 3Z3X+2Y,A项错误;Ⅰ中为恒容反应,Ⅱ中为恒压反应,达到平衡后, V (Ⅰ)< V (Ⅱ),说明P (Ⅰ)> P (Ⅱ),压强越大,反应速率越快,则容器Ⅱ中达到平衡所用的时间越长,B 项错误;达到平衡时,两容器中Z的物质的量分数相同,说明Ⅰ、Ⅱ容器中的平衡为等效平衡,恒容恒压的平衡等效,由此确定该反应方程式中反应前后气体的计量系数相等,则X为气态, Y为液态或固态,C项正确;容器Ⅱ为恒压反应,升高温度,气体膨胀,不管平衡向哪个方向移动,其体积一定增大,D项错误。
