小麦基因各生育时期表达预测网址及方法
小麦育种学小麦育种途径和方法

2021/3/10
21
(二)、质核互作雄性不育性恢复的研究和利用
质核互作雄性不育性:CMS,主要通过小麦与异属、 异种间的核置换而产生的。其恢复基因主要来自提供 细胞质不育性的中(同质恢复系),也存在于其亲缘 物种和普通小麦中(异质恢复系)。
其中提莫非维小麦所导致的细胞质雄性不育和其育性 恢复基因,是世界上迄今杂种研究中应用最广泛的。
杂交选育法:利用已有的恢复系与具有所需性状的品种或品系杂交,然 后从其后代中选育结实性良好而且兼具双亲优良性状的新恢复系。此法 比较简单,只需要一次杂交,可以育成多种类型的新恢复系,对所选恢 复系必须多次测交,检测其恢复力。
2021/3/10
27
恢复系的选育方法
测交筛选法:用已有的不育系为母本,广泛选用综合性状良好的许多品 种、品系为父本,进行测交,根据F1的结实率及综合性状表现,从而 选择其中育性恢复力强而综合性状优良的恢复系。用此法需要配制大量 的杂交组合,只有很少数能够达到要求。但也有可能选出个别优异的恢 复系。
2021/3/10
19
目前杂种小麦应该开展的工作
一是开辟新的不育细胞质源的研究; 二是扩大恢复源的研究; 三是杂种优势的研究 四是开拓产生杂种小麦新途径的研究 五是质核杂种的研究 六是雄性不育与育性恢复机理的研究。
2021/3/10
20
杂种小麦的产生途径
一是质核雄性不育和育性恢复; 二是化学杀雄剂诱导雄性不育; 三是核基因不育性 四是核质杂种优势
2021/3/10
尽可能注意双亲的性 状水平,有利于优良品 系的选育。由于小麦许 多性状如产量、抽穗期 等都不同程度上属于数 量遗传的性状,而且它 们主要由许多具有加性 效应的基因控制。
6
小麦种子发育过程中的miRNA及其表达-abc

小RNA测序结果与参考基因组比对
通过SOAP将sRNA定位到基因组,分析sRNA在基因组上的表达和分布情况。 对于某些物种来说,miRNA基因也是成簇存在的,这样根据分布状况,就能方便的 预测新miRNA
程序与参数
使用的为华大基因的SOAP软件,除此之外还有BOWTIE等软件。 ./soap -v 0 -r 2 -s 7 -p 7 -a /home/lhac/clean.fa -d /home/lhac/TGA/split/5.fa -o 5.soap SOAP2使用需要先建立索引文件: ./2bwt-builder /home/lhac/TGA/split/5.fa 然后使用SOAP2 ./soap -a /home/lhac/clean.fa -D /home/lhac/TGA/split/5.fa.index -o 5.soap
+/+ + + + + + + + + -
ref contig00115 contig00106 contig00106 contig00106 contig00106 contig00172 contig00202 contig00002 contig00045 contig00135 contig00046 contig00115 contig00202 contig00172
qual hhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhhhhh hhhhhhhhhhhhhhhhhhhhhhhh
小麦DNA去甲基化酶基因全基因组鉴定及其在籽粒发育中的表达分析

麦类作物学报 2023,43(11):1361-1371J o u r n a l o fT r i t i c e a eC r o ps d o i :10.7606/j.i s s n .1009-1041.2023.11.01网络出版时间:2023-09-28网络出版地址:h t t ps ://l i n k .c n k i .n e t /u r l i d /61.1359.s .20230913.1730.006小麦D N A 去甲基化酶基因全基因组鉴定及其在籽粒发育中的表达分析收稿日期:2022-10-11 修回日期:2023-06-27基金项目:江苏省农业科技自主创新资金项目[C X (21)3009];国家自然科学基金项目(31700163);江苏省农业科学院探索性颠覆性计划项目(Z X (21)1233)第一作者E -m a i l :136********@163.c o m通讯作者:高德荣(E -m a i l :g d r @w h e a t .o r g.c n )蒋正宁,刘大同,张晓,江伟,王玲,李东升,程晓明,高德荣(江苏里下河地区农业科学研究所/农业部长江中下游小麦生物与遗传改良重点实验室,江苏扬州225007)摘 要:D N A 去甲基化酶(d M T a s e)是一种高度保守的表观遗传修饰因子,涉及许多生物学过程,包括生长发育㊁应激反应和次生代谢㊂本研究基于小麦基因组数据,对小麦D N A 去甲基化酶基因(T a d M T a s e )进行了全面鉴定和生物信息学分析㊂结果表明,小麦基因组中包含18个T a d M T a s e 基因,分布于小麦15条染色体上㊂系统进化分析将T a d M T a s e 分为R O S ㊁D M L 3㊁D M L 4和D M L 5等4个亚家族,亚家族之间的T a d -M T a s e 基因序列长度和内含子数量存在差异,但同一个系统进化树分支中的亚族成员具有高度相似的基因结构㊁保守m o t i f s 和结构域,为植物d M T a s e 基因家族的直系同源基因,在进化方面具有保守性㊂亚细胞定位预测T a d M T a s e 均定位于细胞核中;通过与小麦祖先物种的进化及共线性分析,发现在小麦异源六倍体形成过程中存在部分T a d M T a s e 基因丢失;T a d M T a s e 基因家族启动子区域包含大量光信号㊁植物激素㊁胁迫响应和生长发育等相关顺式作用元件;转录组数据分析表明T a d M T a s e 基因在不同组织器官和籽粒发育不同时期表达模式不同,有一定的组织特异性㊂进一步R N A -S e q 和荧光定量P C R 分析表明T a R O S 1b -1A.1和T a R -O S 1a -5A /D 分别在籽粒的种皮和胚乳发育时期显著上调表达,且在强筋和弱筋小麦品种中表达存在差异㊂结果为T a d M T a s e 基因在调控小麦籽粒生长发育及其品质形成中的调控机制提供参考㊂关键词:小麦(T r i t i c u ma e s t i v u m );D N A 去甲基化酶;基因家族;籽粒;表达分析中图分类号:S 512.1;S 330 文献标志码:A 文章编号:1009-1041(2023)11-1361-11G e n o m e -W i d e I n v e s t i g a t i o na n dE x p r e s s i o nA n a l y s i s o fD N AD e m e t h y l a s e G e n e s i n W h e a t (T r i t i c u ma e s t i v u m )d u r i n g t h eG r a i nD e v e l o pm e n t J I A N GZ h e n g n i n g ,L I UD a t o n g ,Z H A N GX i a o ,J I A N G W e i ,W A N GL i n g,L ID o n g s h e n g ,C H E N GX i a o m i n g ,G A OD e r o n g(K e y L a b o r a t o r y o fW h e a tB i o l o g y a n dG e n e t i c I m p r o v e m e n t i nL o w &M i d d l eY a n g t z eR i v e rV a l l e y W i n t e rW h e a tR e gi o n /L i x i a h e I n s t i t u t e o fA g r i c u l t u r eS c i e n c e s ,Y a n g z h o u ,J i a n gs u225007,C h i n a )A b s t r a c t :D N Ad e m e t h y l a s e s (d MT a s e )i s a h i g h l y c o n s e r v e d e p i g e n e t i cm o d i f i e r i n v o l v e d i nm a n y bi o -l o g i c a l p r o c e s s e s ,i n c l u d i n gg r o w t ha n dd e v e l o p m e n t ,s t r e s sr e s p o n s e ,a n ds e c o n d a r y m e t a b o l i s m.B a s e do n t h e a v a i l a b l e g e n o m e d a t a b a s e ,b i o i n f o r m a t i c a n a l y s i sw a su s e d t oc o m p r e h e n s i v e l y i d e n t i f yd MT a se i nw h e a t .At o t a l of 18m e m b e r s o f d MT a s eg e n e f a m i l y w e r e i d e n t i f i e d f r o m wh e a t g e n o m e ,w hi c hw e r eu n e v e n l y d i s t r i b u t e do n15w h e a tc h r o m o s o m e s .B a s e do n p h y l o g e n e t i ca n a l ys i s ,t h e w h e a td MT a s e (T a d MT a s e )g e n e s w e r e d i v i d e di n t of o u rs u b f a m i l i e s ,i n c l u d i n g RO S ,D M L 3,D M L 4,a n dD M L 5.A m o n g f o u r s u b f a m i l i e s ,t h e l e n gt h a n d i n t r o nn u m b e r o f T a d MT a s e g e n e sw e r e d i f f e r e n t ,b u t t h em e m b e r s o f t h e s u b f a m i l y i n t h e s a m e p h y l o g e n e t i c t r e eb r a n c h i n t h e s a m e g r o u ph a dh i g h l y s i m i l a r g e n e s t r u c t u r e s ,pr o t e i n m o t i f s a n dd o m a i n s .S u b c e l l u l a r l o c a l i z a t i o ns h o w e d t h a tt h e s e p r o t e i n sw e r e l o c a t e d i nt h en u c l e u s.P h y l o g e n e t i ca n a l y s i sw i t ha n c e s t r a l s p e c i e so fw h e a t r e-v e a l e d t h a t t h e g e n e l o s se v e n t so f d MT a s e g e n e so c c u r r e dd u r i n g t h ee v o l u t i o no fw h e a t.F u r t h e r-m o r e,m u l t i p l e c i s-a c t i n g e l e m e n t sw e r eo b s e r v e d i n t h e p r o m o t e r o f T a d MT a s e,i n c l u d i n g l i g h t r e-s p o n s i v e n e s s,p h y t o h o r m o n er e s p o n s i v e n e s s,s t r e s sr e s p o n s i v e n e s s,a n d p l a n t g r o w t ha n dd e v e l o p-m e n t-r e l a t e d e l e m e n t s.T h e e x p r e s s i o n p r o f i l e a n a l y s e s r e v e a l e d t h a t T a d MT a s e g e n e s s h o w e dd i f f e r-e n t i a l g e n e e x p r e s s i o n p a t t e r n s i nv a r i o u s t i s s u e s.F u r t h e rR N A-s e q a n d q R T-P C Ra n a l y s e ss h o w e d t h a t T a R O S1b-1A.1a n d T a R O S1a-5A/D w e r e s i g n i f i c a n t l y u p-r e g u l a t e d i ns e e dc o a t a n de n d o s p e r m d e v e l o p m e n t s t a g e s,w i t hd i f f e r e n t e x p r e s s i o n p a t t e r n s b e t w e e n s t r o n g-g l u t e nw h e a t a n dw e a k-g l u t e n w h e a t.I n s u mm a r y,o u r s t u d yp r o v i d e d a r e f e r e n c e f o r e l u c i d a t i n g t h e r e g u l a t o r y m e c h a n i s mo f T a d-MT a s e,e s p e c i a l l y i nw h e a t g r a i nd e v e l o p m e n t a n d q u a l i t y f o r m a t i o n.K e y w o r d s:T r i t i c u ma e s t i v u m;D N Ad e m e t h y l a s e;G e n e f a m i l y;G r a i n;E x p r e s s i o na n a l y s i sD N A甲基化是生物体内一种重要的表观遗传修饰手段,在高等真核生物中,D N A甲基化发生于胞嘧啶第五位碳原子上形成5-甲基胞嘧啶(5-m e t h y l c y t o s i n e,5-m e C)[1],D N A甲基化状态是由甲基化建立㊁维持和主动去甲基化动态调节的结果[2],而D N A去甲基化则是D N A甲基化的相反过程,即5-甲基胞嘧啶被未修饰的胞嘧啶替代的过程[3]㊂在植物中,D N A去甲基化包括D N A主动去甲基化和被动去甲基化2种类型:被动的去甲基化,是由于D N A复制过程中甲基转移酶活性的丧失或甲基供体的缺乏导致甲基化无法维持,从而使整个基因组D N A甲基化水平降低;D N A主动去甲基化,则不依赖于D N A复制,即通过5-甲基胞嘧啶D N A糖基化酶作用,直接去除D N A中甲基化的胞嘧啶[4]㊂D N A去甲基化不仅对于全基因组表观遗传重编程至关重要,在植物发育过程中还介导转录因子或基因座特异性基因激活[4]㊂目前,普遍认为D N A去甲基化的机制有5种:依赖D N A去甲基化酶的碱基切除修复机制㊁碱基切除修复㊁甲基胞苷脱氨基耦合G/T的错配切除修复㊁水解作用去甲基化以及氧化去甲基化[5]㊂在所有的机制中D N A的去甲基化是通过D N A去甲基化酶(d MT a s e)实现的, D N A去甲基化酶含有最保守的D N A糖苷酶(H h H-G P D)结构域,具有糖基化酶和脱嘌呤裂合酶活性的双功能㊂目前,在植物中已鉴定6种d MT a s e,包括转葡萄糖基酶D M E(d e m e t e r)㊁沉默抑制因子R O S1(r e p r e s s o r o f s i l e n c i n g1),以及类转葡萄糖基酶蛋白D M L2(d e m e t e r-l i k e p r o t e i n2)㊁D M L3㊁D M L4和类转葡萄糖基酶D M L5[6]㊂研究表明R O S1和D M L在所有的营养组织中表达,包括根和茎的组织,而D M E主要在种子发育中表达[7]㊂在拟南芥中,D M E是孢子体发育所必需,并在孢子体生命周期中维持干细胞活动起着至关重要的作用[8]㊂此外,R O S1和D M E也参与调控水稻[9]和大麦的种子发育[10]㊂最近,3个水稻d MT a s e基因(D N G702㊁D N G701和D N G704)被证实可以对配子体和合子细胞的D N A去甲基化,是合子基因表达和发育所必需[11];番茄D N A 去甲基化酶基因S l D M L2与其果实成熟过程中D N A甲基化水平普遍降低密切相关[12]㊂上述研究表明,d MT a s e对植物合子发育和果实成熟起到重要的调控作用㊂此外,植物的生物或非生物应激反应也需要D N A主动去甲基化的调控㊂例如,拟南芥可以通过R O S1对R MG1和R L P43基因启动子的去甲基化激活抗病反应[13],而其D N A去甲基酶三重突变体r d d(r o s1/d m l2/d m l3)对镰刀形孢菌表现高度敏感[14];在水稻中,盐敏感品种I R29在盐胁迫下诱导d MT a s e基因(D N G701和D N G710)表达[15];而在烟草中过表达A t R O S1,则增加了类黄酮生物合成途径相关基因和抗氧化途径相关基因的去甲基化水平,激活了这类抗逆基因的表达,从而导致盐胁迫耐受性提高[16];此外,D N A去甲基化也在植物热和干旱胁迫反应的调控中发挥作用[17-18]㊂可以看出,D N A去甲基化酶基因在调节植物的各类生物学过程中发挥重要作用㊂目前,D N A去甲基化酶(d MT a s e)基因在很多物种中被广泛鉴定和分析,这些物种中d MT a s e的数量㊁保守性㊁多态性和功能都存在很大差异㊂作为重要粮食作物的小麦d MT a s e基因家族成员尚未被鉴定㊂本研究基于小麦全基因组测序数据,利用生物信息学方法对小麦d MT a s e㊃2631㊃麦类作物学报第43卷基因家族进行了全基因组鉴定,分析小麦d MT a s e基因核苷酸及编码蛋白的特性及其组织特异性表达模式,并通过转录组测序及q R T-P C R 方法分析小麦d MT a s e基因在籽粒发育中的表达特征,为进一步解析小麦d MT a s e基因功能研究奠定基础㊂1材料与方法1.1小麦d M T a s e基因家族成员的筛选从E n s e m b lP l a n t s数据库(h t t p://p l a n t s.e n s e m b l.o r g/i n d e xt h m l)下载小麦蛋白序列数据㊁基因组序列和注释文件,并建立本地数据库㊂以已知的拟南芥[14]和水稻[19]d MT a s e基因家族成员蛋白序列作为q u e r y序列,与小麦的蛋白序列进行本地B l a s t P比对,筛选阈值设为E<e-10㊂此外在Pf a m数据库(h t t p://p f a m.x f a m.o r g/)中下载H h H-G P D结构域(P F00730)作为搜索模型,通过HMM3.0(h t t p://e d d y l a b.o r g/s o f t w a r e/ h mm e r3/3.0/)搜索小麦蛋白质数据库,阈值设为E<e-10,筛选含有H h H-G P D结构域的蛋白序列㊂整合两种方法筛选到的蛋白序列,去除冗余和不完整的序列㊂利用S MA R T㊁P f a m和N C-B I-C D D数据库对候选蛋白质进行检测,得到最终的小麦d MT a s e蛋白家族氨基酸序列与基因序列㊂1.2小麦d M T a s e蛋白理化性质㊁结构域及保守m o t i f预测分析利用E x P A S y网站(h t t p://e x p a s y.o r g/)对小麦d MT a s e氨基酸序列进行等电点㊁分子量预测等理化性质分析;利用P l a n t-m P L o c(h t t p:// w w w.c s b i o.s j t u.e d u.c n),对小麦d MT a s e进行亚细胞定位分析;根据C D D(h t t p s://w w w.n c-b i.n l m.n i h.g o v/c d d/)所提供的家族成员所含结构域起始位点整理结构域氨基酸序列㊂利用M E M E(h t t p://m e m e-s u i t e.o r g/t o o l s/m e m e)在线预测d MT a s e家族蛋白的保守m o t i f,最大发现数设为12个,其他参数设为默认值㊂使用T B t o o l s[20]软件对结构域及保守m o t i f位点进行可视化显示㊂1.3系统发育树的构建㊁基因结构分析从E n s e m b l P l a n t s数据库中下载拟南芥和水稻d MT a s e的氨基酸序列,使用C l u s t a lW软件进行d MT a s e同源蛋白的氨基酸序列比对㊂利用M E G A11(h t t p s://w w w.m e g a s o f t w a r e.n e t/)软件构建系统进化树,选择邻接法(N e i g h-b o r-j o i n i n g),b o o t s t r a p方法重复采样1000次,其余参数默认,参考拟南芥和水稻d MT a s e基因家族的亚族分类结果对小麦d MT a s e基因家族进行亚族分类,并依据小麦d MT a s e染色体位置进行基因命名㊂利用I T O L(h t t p s://i t o l.e m b l.d e)在线软件对进化树进行美化处理㊂从E n s e m b l P l a n t s数据库中下载的小麦基因信息g f f3文件中提取d MT a s e基因染色体位置和基因结构信息,利用G S D S2.0(h t t p://g s-d s.c b i.p k u.e d u.c n)分析小麦d MT a s e基因的外显子和内含子分布模式㊂从相同数据库中下载小麦基因组(D N A)数据,利用T B t o o l s软件截取小麦d MT a s基因起始密码子上游2000b p的D N A序列,利用P l a n tC A R E(h t t p://b i o i n f o r-m a t i c s.p s b.u g e n t.b e/w e b t o o l s/p l a n t c a r e/h t m l)工具分析启动子顺式作用元件种类㊁数目及功能,并使用T B t o o l s软件进行可视化㊂1.4T a d M T a s e基因染色体定位㊁共线性和基因复制事件分析根据小麦基因组注释g f f3文件获取d MT a s e 基因家族成员的染色体位置信息,利用T B t o o l s 软件的M C S c a n X工具计算并获取小麦d MT a s e 共线性及基因的串联重复信息,并进行对小麦基因的染色体位置信息㊁共线性关系㊁串联重复信息进行可视化㊂利用T B t o o l s软件计算直系同源基因间的同义替换率(K s)和非同义替换率(K a)㊂通过K a/K s值来评估小麦d MT a s e基因在进化过程中受到的选择压力影响,K a/K s>1㊁<1或=1分别表示复制基因对受到正向选择㊁纯化选择和中性进化的影响㊂1.5T a d M T a s e基因组织表达分析从W h e a tE x p数据库(h t t p://w w w.w h e a t-e x p r e s s i o n.c o m)检索小麦R N A-S e q数据,用T P M(t r a n s c r i p t s p e rm i l l i o nr e a d s)值L o g S c a l e 标准化后评估小麦基因的转录本丰度值㊂用T B t o o l s软件绘制小麦T a d MT a s e基因表达热图㊂为分析T a d MT a s e基因在不同品质性状小麦中的表达情况,对小麦籽粒不同发育时期T a d-MT a s e基因进行转录组测序及q R T-P C R分析,选择弱筋小麦品种扬麦15和中强筋小麦品种扬麦16为材料㊂大田采集花后10㊁15㊁20㊁25㊁30和35d穗中部3排籽粒,同时分离获得种皮和胚乳(10㊁20和30d)组织,每个样品3个重复㊂将所㊃3631㊃第11期蒋正宁等:小麦D N A去甲基化酶基因全基因组鉴定及其在籽粒发育中的表达分析有样品液氮速冻后,-80ħ保存备用㊂籽粒发育不同时期转录组测序工种由北京百迈客克生物科技有限公司完成㊂q R T -P C R 分析使用I n v i t r o -g e n 公司的T r i z o l T M R e a ge n t 试剂盒提取总R N A ,参照P r i m e S c r i p t ʻR R Tr e a ge n tK i t 反转录试剂盒[T a K a R a ,宝生物工程(大连)有限公司]说明书反转录合成c D N A 用于基因表达分析㊂根据转录组测序分析获得小麦籽粒发育时期显著表达的3个小麦T a d M T a s e 基因的C D S 序列设计引物(表1),由擎科生物公司(南京)股份有限公司合成,以小麦β-A c t i n 为内参基因(T a A c t i n )㊂使用S Y B RP r e m i xE xT a q T M Ki t [T a K a R a ,宝生物工程(大连)有限公司]进行q R T -P C R 分析㊂P C R 仪为A B I V i i A 7实时荧光定量P C R 仪(L i f eT e c h n o l o gi e s ,美国)㊂反应体系为25μL :2μLc D N A ,上㊁下游引物各0.5μL ,S Y B RP r e m i x E xT a q T M Ki t 10μL ,d d H 2O 补齐㊂反应程序:94ħ预变性3m i n ,94ħ变性10s ,60ħ退火20s ,72ħ延伸30s ,40个循环㊂基因的相对表达量采用2-〠〠C T 计算,利用E x c e l 2019软件计算基因相对表达水平㊂2 结果与分析2.1 T a d M T a s e 基因家族成员的筛选及其蛋白理化性质分析以7个拟南芥和8个水稻d MT a s e 蛋白为参考序列,结合B l a s t P 和HMM 模型P f a m (P F 00730)HMM E R 3.0两种方法搜索小麦d MT a se 蛋白序列,之后进行序列比对,去除冗余序列后合并,利用P f a m 和S MA R T 结构域搜索检验候选基因是否含有E N C O 3c 结构域(E N -C O 3c 包含H h H -G P D ),最终在小麦基因组中共鉴定出18个候选基因,并根据系统进化关系和其染色体位置进行命名㊂在E x P A S y 数据库中对小麦所有d M T a s e 蛋白序列进行理化性质预测分析,结果(表2)表明,小麦d M T a s e 基因家族蛋白氨基酸长度为276~1982个a a ,分子量为30.7~218.4k D a ㊂蛋白等电点为6.0~9.7,均值为7.48,预测大部分为中性蛋白;小麦d MT a s e 蛋白不稳定系数均大于40,为不稳定蛋白;蛋白亲水性(G R A V Y )分析显示小麦所有d MT a s e 蛋白都是亲水性蛋白㊂亚细胞定位预测表明,小麦d MT a se 基因编码蛋白均定位于细胞核中(表2)㊂2.2 T a d M T a s e 基因家族蛋白系统进化树构建及保守结构域分析将检索到的18个小麦d M T a s e 基因的蛋白序列,与已知的7个拟南芥d M T a s e 基因[A t D M L 5b(A T 1G 05900.1)㊁A t D M L 5a (A T 2G 31450.1)㊁A t -R O S 1(A T 2G 36490.1)㊁A t D M L 2(A T 3G 10010.1)㊁A t D M L 4(A T 3G 47830.1)㊁A t D M L 3(A T 4G 34060.3)㊁A t D M E (A T 5G 04560.1)]和8个水稻d M T a s e 基因[O s R O S 1a (O s 01g 11900.1)㊁O s R O S 1d (O s 02g29230.1)㊁O s D M L 3a (O s 02g 29380.1)㊁O s D M L 3b (O s 04g 28860.1)㊁O s R O S 1b (O s 05g 37350.1)㊁O s R O S 1c (O s 05g 37410.1)㊁O s D M L 4(O s 06g 13070.1)㊁O s D M L 5(O s 11g 16580.1)]共计33个d MT a s e 基因的蛋白序列进行比对,并构建系统进化树㊂基于水稻O s d MT a s e 分类,将小麦18个d MT a s e 归属于R O S 1㊁D M L 3㊁D M L 4和D M L 5等4个亚家族㊂其中R O S 1最多,包含9个d MT a s e 基因,其他亚家族各有3个(图1A )㊂利用C D D 对T a d MT a s e 进行保守结构域分析,结果(图1B )表明,所有的T a d MT a s e 均含有E N C O 3c 保守结构域,E N C O 3c 结构域行使糖苷酶功能是d MT a s e 特异性结构域㊂T a d MT a s e 不同亚族所包含的保守结构域种类不同,R O S 1和D M L 3亚族包含3个共同保守结构域:E N -C O 3c (包含H h H -G P Dd o m a i n )㊁F E S 以及R R M_D M E 结构域㊂其中小麦T a R O S 1a -5A /B 与拟南芥A t R O S 1㊁水稻O s R O S 1a 的R O S 1亚家族还包含了一个介导D N A 结合活性的P e r m -C X X C结构域㊂而D M L 5包含E N C O 3c 和F E S2个结构域和D M L 4仅包含1个E N C O 3c 结构域㊂表1 荧光定量分析引物T a b l e 1 P r i m e r s u s e d f o r r e a l -t i m eP C R基因G e n e正向引物F o r w a r d s e qu e n c e (5'-3')反向引物R e v e r s e s e qu e n c e (5'-3')产物长度P r o d u c t l e n g t h /b pT a R O S 1b 41A.1T C T G A A C A T C C A C C A A T A C A G C C A G T G A G G C C A A T T C A T C A G T A 174T a R O S 1a -5A A A G G A A A A C T G T G G G A A T T G G G C C T T G C A T A G A G T G G T C T T G217T a R O S 1a -5D G G C C A T C C G G G A A C G AC C A T G A T C T C T A A C C A A G C G A T 254T a A c t i nA T G C G T G C G C T G T A C T T GC G T C A C A G A G T C C A G T G A A A 177㊃4631㊃麦 类 作 物 学 报 第43卷表2 小麦T a d M T a s e 基因家族的特征T a b l e 1 C h a r a c t e r i s t i c f e a t u r e s o f T a d M T a s e g e n e f a m i l yi nw h e a t 基因名称G e n e n a m e基因序列号G e n e I D外显子数N o .o f e x o n s蛋白分子特征m o l e c u l a r c h a r a c t e r s o f p r o t e i n长度L e n g t h /a a 分子量MW /k D a 等电点p I 不稳定系数I n s t a b i l i t y i n d e x 总平均亲水性G R A V Y 亚细胞定位S u b c e l l u l a r l o c a l i z a t i o n T a R O S 1b -1A.1T r a e s C S 1A 02G 278000.1211765195.47.455.67-0.613细胞核N u c l e a r T a R O S 1b -1B .1T r a e s C S 1B 02G 286900.2221769196.37.055.73-0.608细胞核N u c l e a r T a R O S 1b -1D.1T r a e s C S 1D 02G 277100.1191734192.36.756.51-0.616细胞核N u c l e a r T a R O S 1b -1A.2T r a e s C S 1A 02G 349600.1201595178.06.548.30-0.605细胞核N u c l e a r T a R O S 1b -1B .2T r a e s C S 1B 02G 364100.2191600178.06.550.34-0.575细胞核N u c l e a r T a R O S 1b -1D.2T r a e s C S 1D 02G 352500.2191586176.16.849.07-0.598细胞核N u c l e a r T a D M L 3a -3A T r a e s C S 3A 02G 022500.117989109.66.945.17-0.538细胞核N u c l e a r T a D M L 3a -3B T r a e s C S 3B 02G 023200.1171000110.76.845.31-0.537细胞核N u c l e a r T a D M L 3a -3DT r a e s C S 3D 02G 024100.1171000110.66.945.35-0.511细胞核N u c l e a r T a D M L 5-4A T r a e s C S 4A 02G 232700.21346151.19.748.89-0.502细胞核N u c l e a r T a D M L 5-4B T r a e s C S 4B 02G 083100.11346251.59.744.24-0.498细胞核N u c l e a r T a D M L 5-4D T r a e s C S 4D 02G 081200.11345951.09.744.13-0.480细胞核N u c l e a r T a R O S 1a -5A T r a e s C S 5A 02G 169000.1181975217.36.046.26-0.606细胞核N u c l e a r T a R O S 1a -5B T r a e s C S 5B 02G 165800.2181982218.46.146.95-0.623细胞核N u c l e a r T a R O S 1a -5DT r a e s C S 5D 02G 173300.2181981218.06.146.59-0.617细胞核N u c l e a r T a D M L 4-7A T r a e s C S 7A 02G 194800.1427630.88.747.76-0.209细胞核N u c l e a r T a D M L 4-7B T r a e s C S 7B 02G 100500.1427630.78.553.27-0.257细胞核N u c l e a r T a D M L 4-7D T r a e s C S 7D 02G 196400.1427630.78.747.80-0.249细胞核N u c l e a rMW :M o l e c u l a rw e i g h t ;G R A V Y :G r a n da v e r a g e o f h y d r o p a t h y.图1 T a d M T a s e 进化树(A )和保守结构域(B )分析F i g .1 P h y l o g e n e t i c t r e e s (A )a n d c o n s e r v e dd o m a i n (B )a n a l ys i s o fT a d M T a s e 小麦18个D N A 去甲基化酶的m o t i f 分析如图2A 所示,小麦D N A 去甲基化酶基因包含了12个m o t i f 结构,但不同亚族的所拥有的M o t i f不同,与其保守结构域一致㊂如R O S 1亚家族的m o t i f 组成相同,包含m o t i f 1㊁2㊁3㊁5㊁6㊁7㊁9㊁10和11共9个保守m o t i f ,组成E N D O 3c ㊁F E S ㊁P e r m -C X X C ㊁R R M _D M E 结构域,其中m o t i f 1㊁6㊁7和9共同构成一个保守的E N D O 3c 糖苷酶结构域㊂而D M L 3亚家族包含7个m o t i f,分别是m o t i f 1㊁2㊁3㊁5㊁7㊁9和11,它们构成了E N D O 3c㊁㊃5631㊃第11期蒋正宁等:小麦D N A 去甲基化酶基因全基因组鉴定及其在籽粒发育中的表达分析F E S和R R M_D M E结构域;D M L4亚家族仅包含2个m o t i f结构,分别是m o t i f1和7,它们构成了E N-D O3c结构域;D M L5亚家族包含4个m o t i f结构,即m o t i f1㊁2和9构成了E N D O3c和F E S结构域㊂2.3T a d M T a s e基因家族基因结构和启动子顺式作用元件分析为进一步阐明小麦T a d MT a s e基因的结构特征,利用G S D S2.0研究基因的外显子-内含子结构,分析显示T a d MT a s e亚组间基因结构差异较大,其中R O S1包含18~22个外显子(图2B), D M L3包含17个外显子,D M L5包含13个外显子,而D M L4只包含4个外显子㊂这与已报道的植物d MT a s e基因结构相似,进一步说明虽不同物种在进化过程中发生了分化事件,但其同源基因在分化后仍具有相似结构,进一步说明d MT a s e家族具有其保守性㊂利用P l a n t C A R E数据库对18个T a d-MT a s e基因上游2000b p顺势作用调控元件分析,共预测出34种C R E s顺式作用元件(图3A)㊂这些C R E s除了2种传统的启动子元件(T A T A-b o x,C A A T-b o x)外,其余32种C R E s大致可以分为4组:植物生长发育㊁植物激素响应㊁光响应以及胁迫响应相关的作用元件(图3B)㊂所有已鉴定的小麦T a d M T a s e基因启动子C R E s位点共有460个,其中以光反应因子最多163个(35.43%),其次是激素反应因子144个(31.4%)㊁植物发育相关因子77个(16.74%)和胁迫反应因子76个(16.52%)㊂在T a d MT a s e启动子中发现了10种光响应型C R E s,其中,G-b o x和s p1C R E s较多,普遍存在于T a d MT a s e启动子,且拷贝数较多㊂参与激素信号转导的C R E s包括生长素应答(T G A-b o x)㊁脱落酸反应(A B R E)㊁茉莉酸甲酯反应(C G T C A-m o t i f和T G A C G-m o t i f)㊁赤霉素反应(G A R E-m o t i f和P-b o x)和水杨酸反应(T C A-e l e m e n t)元件㊂在这些C R E s中A B R E㊁C G T-C A㊁T G A C G和T G A基序最为普遍㊂T a d MT a s e启动子还具有多种应激反应调控元件,如参与低温应激的L T R,参与干旱诱导的M B S,涉及防御和应激反应的T C-r i c hr e p e a t s以及响应厌氧诱导的A R E调控元件㊂另外,还确定了一些组织特异性的顺式调控元件,例如参与胚乳特异性表达所需的G C N4_m o t i f和胚乳负调控相关的A A C A_m o t i f,以及与分生组织特异性激活有关的C A T-b o x㊂此外,还发现参与玉米蛋白代谢调控的O2-s i t e㊂总之,小麦T a d M T a s e 启动子中最常见的顺式调节元件主要与生理过程有关,例如光信号㊁激素响应和生长发育㊂2.4T a d M T a s e基因染色体定位和基因复制分析利用小麦基因组注释信息,对18个小麦T a d MT a s e基因进行染色体定位㊂结果表明, T a d MT a s分布于小麦21条染色体上的15条上(图4A),其中1A㊁1B和1D染色体上各有2个,其余3A㊁3B㊁3D,4A㊁4B㊁4D㊁5A㊁5B㊁5D㊁7A㊁7B㊁7D染色体各有1个T a d MT a s e基因㊂在小麦A㊁B和D同源染色体组中,均含有6个基因,说明T a d MT a s e基因在小麦A㊁B和D同源染色体进化过程中比较保守,不同基因在同源染色体的丢失和保留没有明显的偏好现象㊂利用M S C c a nX图2T a d M T a s e基因家族保守基序(A)和基因结构(B)F i g.2C o n s e r v e dm o t i f s(A)a n d g e n e s t r u c t u r e(B)o f T a d M T a s e g e n e s i nw h e a t㊃6631㊃麦类作物学报第43卷软件对小麦全基因组产生的基因复制事件进行分析,结果发现18个T a d MT a s e 基因都存在与其高度相似的同源序列,并构成6个同源基因组,每组均由同源染色体组(A ㊁B ㊁D )上的同源基因组成,且这些同源基因组聚类分析均处于同一进化分支,如:T a D M L 3a -3A ㊁T a D M L 3a -3B 和T a D M L 3a -3D (图1)㊂同时分析了非同源染色体上的基因串联重复,其中在同一染色体上鉴定了3个基因串联重复,分别是T a R O S 1b -1A.1和T a R O S 1b -1A.2,T a R O S 1b -1B .1和T a R O S 1b -1B .2,T a R O S 1b -1D.1和T a R O S 1b -1D.2,而非同源的染色体上未发现基因串联重复(图4A )㊂ A :T a d MT a s e 基因顺式调控元件种类及分布类热图;B :T a d M T a s e 基因顺式调控元件在启动子区域(2000b p )分布㊂A :H e a t m a p s h o w i n g t h e n u m b e r o f C R E s b e l o n g i n g t o t h e f o l l o w i n g f o u r c a t e go r i e s p e r T a d MT a s e g e n e ;B :T h e d i s t r i b u t i o n o f d i f -f e r e n tC R E s i n t h e p r o m o t e r r e g i o n (2000b p)o f d MT a s e g e n e s i nw h e a t .图3 T a d M T a s e 基因启动子顺式调控元件分析F i g .3 C i s -r e g u l a t o r y e l e m e n t s (C R E s )o f d M T a s e s ge n e s i nw h e at 片段复制基因用彩色线条连接;圆形代表A A B B D D (T r i t i c u ma e s t i v u m )㊁菱形代表A A (T r i t i c u m u r a r t u )㊁正方形代表D D (A e -g i l o ps t a u s c h i i )和三角形代表A A B B (T r i t i c u md i c o c c o i d e s )基因组中的d M T a s e 基因㊂G e n e s e g m e n t a l d u p l i c a t i o n g e n e s a r e l i n k e db y co l o r e d l i n e s ;T h e d MT a s e g e n e s i nA A B B D D (T r i t i c u ma e s t i v u m ),A A (T r i t i c u m u r a r t u ),D D (A e g i l o p s t a u s c h i i )a n dA A B B (T r i t i c u md i c o c c o i d e s )g e n o m e sw e r e r e p r e s e n t e db y c i r c l e s ,r h o m b u s ,s q u a r e s a n d t r i a n -g l e s ,r e s p e c t i v e l y.图4 T a d M T a s e 基因家族在小麦染色体上的位置和基因复制(A )及与其祖先种同源基因进化分析(B )F i g .4 C h r o m o s o m e l o c a t i o na n d g e n e d u p l i c a t i o n s o f t h e T a d M T a s e g e n e f a m i l yi nw h e a t (A )a n d e v o l u t i o na n a l y s i s o f T a d M T a s e a n dh o m o l o g o u s g e n e o f i t s a n c e s t o r s pe c i e s (B )㊃7631㊃第11期蒋正宁等:小麦D N A 去甲基化酶基因全基因组鉴定及其在籽粒发育中的表达分析为进一步明确d MT a s e基因在小麦多倍体形成过程中基因扩张情况,利用T a d MT a s e序列分别检索了A A(T r i t i c u mu r a r t u)二倍体㊁D D(A e-g i l o p s t a u s c h i i)二倍体和A A B B(T r i t i c u m d i c-o c c o i d e s)四倍体小麦祖先种基因组㊂结果表明在祖先种的A A㊁D D和A A B B基因组中分别检索到9㊁9和18个高度相似的d MT a s e同源基因,进化树显示T a d MT a s e基因在其祖先物种中均有同源基因并在各自的进化分支,结果揭示在异源六倍体形成过程中存在部分d MT a s e基因丢失现象(图4B)㊂为了进一步研究这些复制基因对受到何种选择,对小麦T a d MT a s e基因K s㊁K a以及K a/K s 比值计算㊂结果发现所有小麦T a d MT a s e基因K a/K s<1,表明在基因扩张过程中经历了强烈的纯化选择,说明这些基因在进化过程中序列并未发生太大改变,相似性较高㊂2.5T a d M T a s e家族基因表达分析为了探讨不同生长发育阶段T a d MT a s e基因在小麦中的组织特异性表达模式,利用小麦基因转录组数据库对18个小麦T a d MT a s e基因进行检索,分析了小麦花药(a n t h)㊁第1叶(l e a_1)㊁胚(e m b)㊁胚乳(e n)㊁旗叶(f l s)㊁颖片(g l u)㊁籽粒(g r a i n)㊁根(r o o t)㊁茎(s t e m)和穗(s p i k e)组织的转录水平,结果表明(图5A),小麦d MT a s e基因在不同组织或器官中的表达模式有明显的差异, T a R O S1a-5A/5B/5D在所有组织中表达活跃,在穗和籽粒中表达量最高,而T a R O S1b-1A.1㊁1B.1在胚组织中表达量较高,在穗和籽粒中也有表达㊂同时分析了T a d MT a s e基因在籽粒不同发育时期(花后15㊁25和35d)及其胚乳(e n)和糊粉层(a l)组织不同时期(花后10㊁20和30d)表达情况,结果表明(图5B)小麦T a d MT a s e基因的R O S1亚家族明显高于D M L亚家族㊂其中T a R O S1b-1A.1㊁T a R O S1a-5A和T a R O S1a-5D在籽粒㊁糊粉层及胚乳中表达量较高㊂在籽粒发育阶段,T a R-O S1b-1A.1㊁T a R O S1a-5A和T a R O S1a-5D表达量均在花后15d最高,后逐渐下降㊂在糊粉层及胚乳发育阶段这3个基因表达量也均是前期高于后期㊂基于小麦转录组数据中T a R O S1a㊁T a R-O S1b和T a D M L3亚家族基因在小麦籽粒发育过程中的表达量较高特征,继续在不同籽粒品质的小麦品种扬麦15(弱筋)和扬麦16(中强筋)进行小麦组织:花药㊁第1叶㊁胚㊁胚乳㊁旗叶㊁颖片㊁籽粒㊁根㊁茎和穗;d p a为籽粒㊁糊粉层㊁胚乳发育时期(花后天数)㊂下同㊂W h e a t t i s s u e:A n t h e r(a n t h),t h e f i s t l e a f(l e a_1),e m b r y o(e m b),e n d o s p e r m(e n),f l a g l e a f(f l s),g l u m e(g l u),g r a i n,r o o t,s t e m, a n d s p i k e;d p a:T h e d e v e l o p m e n t s t a g e o f g r a i n,a l e u r o n e l a y e r(a l)a n de n d o s p e r m(e n)(d a y s p a s t a n t h e s i s).T h e s a m eb e l o w.图5T a d M T a s e基因在小麦不同组织(A)和籽粒发育时期(B)表达分析F i g.5E x p r e s s i o n p r o f i l e s o fw h e a t T a d M T a s e i n t h e d i f f e r e n t t i s s u e s(A)a n d g r a i nd e v e l o p m e n t a l s t a g e s(B)㊃8631㊃麦类作物学报第43卷了转录组测序分析,结果显示(图6),T a R O S 1a ㊁T a R O S 1b 和T a D M L 3亚家族基因在两种小麦籽粒发育中表达模式相似,但不同基因间表达量则发生了明显分化;T a R O S 1a -5A /B /D 表达最为强烈,在弱筋小麦扬麦15中T a R O S 1a -5A /B /D 表达在15d 达峰值后下降较缓慢,并持续至25d 后再迅速下降,而在扬麦16中T a R O S 1a -5A /B /D达峰值后则迅速下降,且T a R O S 1a -5A /B /D 在弱筋小麦品种中表达量高于中强筋扬麦16;T a R -O S 1b 亚家族基因表达发生分化,T a R O S 1b -1A/B /D.1表达量较高,而T a R O S 1b -1A /B /D.2几乎不表达,且T a R O S 1b -1A /B /D.1在扬麦16中的表达则高于扬麦15;T a D M L 3表达量较低,且3个同源基因也发生分化,T a D M L 3-3A /B 有少量表达,而T a D M L 3-3D 则几乎不表达㊂图6 T a d M T a s e 基因在扬麦15(A )和扬麦16(B )籽粒发育过程中的表达分析F i g .6 E x p r e s s i o n p r o f i l e s o f T a d M T a s e i n t h e d i f f e r e n t d e v e l o p m e n t a l s t a g e s o fw h e a t gr a i n 基于T a R O S 1b -1A.1㊁T a R O S 1a -5A 和T a R -O S 1a -5D 基因在小麦籽粒糊粉层和胚乳发育过程中的高表达量特征(图5B ),为了进一步验证转录组的结果,根据获得的T a R O S 1b -1A.1㊁T a R -O S 1a -5A 和T a R O S 1a -5D 序列设计引物(表1),用实时荧光定量P C R 方法分析3个基因在花后10㊁20和30d 籽粒种皮和胚乳组织种的表达情况㊂结果显示(图7)在种皮发育20d 时,T a R -O S 1b -1A.1㊁T a R O S 1a -5A 和T a R O S 1a -5D 表达量均达最高,且T a R O S 1b -1A.1表达量高于T a R -O S 1a -5A ㊁T a R O S 1a -5D ;在胚乳中,T a R O S 1b -1A.1和T a R O S 1a -5A 两基因在20d 时表达量达最高,但T a R O S 1b -1A.1表达量低于T a R O S 1a -5A 和T a R O S 1a -5D ;在花后10和20d,弱筋小麦扬麦15籽粒种皮和胚乳中,3个基因表达量均显著高于中强筋小麦扬麦16㊂字母代表同一时期不同品质小麦显著性差异比较(P <0.05)㊂T h e l e t t e r s r e p r e s e n t t h e c o m p a r i s o no f s i g n i f i c a n t d i f f e r e n c e s o fw h e a t v a r i e t i e sw i t hd i f f e r e n t q u a l i t yt r a i t s i n t h e s a m e p e r i o d (P <0.05).图7 T a R O S 1b -1A .1(A )㊁T a R O S 1a -5A (B )和T a R O S 1a -5D (C )在小麦种皮(s c )和胚乳(e n)组织中的荧光定量表达分析F i g .7 R e l a t i v e e x p r e s s i o n l e v e l o f T a R O S 1b -1A .1(A ),T a R O S 1a -5A (B )a n d T a R O S 1a -5D (C )ge n e s w a s a n a l y z e db yq u a n t i t a t i v eR T -P C Ri nw h e a t s e e d c o a t a n d e n d o s pe r m ㊃9631㊃第11期蒋正宁等:小麦D N A 去甲基化酶基因全基因组鉴定及其在籽粒发育中的表达分析3讨论3.1小麦d M T a s e s的蛋白质结构特征本研究从小麦全基因组数据库中获得了18个d MT a s e基因成员,高于其它已报导物种中的基因家族成员数,结合系统发育分析,将T a d-MT a s e s分为两类(R O S1和D M L),其中D M L 又分为D M L3㊁D M L4和D M L5㊂在小麦中没有发现D M E亚族,这与其他研究发现的D M E亚族基因只在拟南芥等双子叶中,而在单子叶植物中没有的结果一致[21-23]㊂基于双子叶植物中D M E 基因与R O S1基因的高同源性,推测D M E基因是在单㊁双子叶植物分化后由双子叶植物内部R O S1基因复制产生的新基因[9]㊂进化及保守结构域分析表明小麦d MT a s e与聚类关系较近的拟南芥和水稻d MT a s e具有相似的保守结构,如R O S1亚族的A t R O S1㊁O s-R O S1a和T a R O S1a-5A/B/D都含有E N D O3c㊁F E S㊁P e r m-C X X C㊁R R M_D M E4个相同结构域㊂然而不同亚族之间保守结构域的个数和种类差异较大,这是可能是由于物种进化过程中产生基因无功能化㊁新功能化和亚功能化所致,说明d MT a s e基因在进化过程中会更加倾向趋异进化[24]㊂亚细胞定位研究还发现小麦d MT a s e均定位于细胞核,与其他植物物种,如拟南芥㊁水稻㊁番茄㊁花生㊁蓖麻豆㊁茄子㊁茶树和兰花也被证明位于细胞核内的结果一致㊂基于亚细胞定位在确定蛋白质功能中的重要性,植物d MT a s e基因的功能可能是保守的㊂3.2小麦d M T a s e的基因结构特征及进化小麦d MT a s e在每个亚家族中具有相似的外显子-内含子组成,但R O S1和D M L亚家族基因外显子-内含子数目变化有所差异,其中R O S1b亚家族基因的外显子-内含子数目为19~21个,而3个D M L亚家族(D M L3㊁D M L4和D M L5)基因均有相同的外显子-内含子,基因结构更为保守㊂小麦d MT a s e基因上游2000b p启动子序列的顺式作用元件分析发现,小麦d MT a s e的启动子具有光响应㊁植物激素响应㊁胁迫响应和生长发育4类C R E s顺式作用调控元件,类似C R E s已在其他植物如花生[25]㊁猕猴桃[26]㊁山茶花[18]和铁皮石斛[22]的d MT a s e基因启动子区也报道了A B R E㊁C G T C A-m o t i f㊁T G A-e l e m e n t㊁G-b o x㊁s p1㊁A-b o x㊁A R E和C A T-b o x等元件,表明小麦d MT a s e基因可能参与了植物的发育和应激反应调控㊂其中T a R O S1b-1D.2基因启动子中还发现了与种子特异性调控和胚乳特异性表达相关的C R E s,表明T a R O S1b-1D.2基因可能参与小麦胚乳发育的调控㊂进化分析表明小麦d MT a s e基因在A㊁B和D 部分同源基因组中分布均匀,进化一致㊂通过小麦与其祖先物种的d MT a s e基因进化分析发现,小麦d MT a s e与其祖先种在基因数量上存在差异,虽然基因总数可能在小麦异源六倍体形成进化过程中经历了3个二倍体祖先种的两轮自然加倍,使得基因组也经历了2次扩张,造成d MT a s e 基因数目增加,但并非3倍增加,存在部分d MT a s e基因的丢失,其原因可能是由于小麦形成进化过程中染色体重组或基因功能冗余造成㊂共线分析表明小麦d MT a s e基因的R O S1b亚家族存在串联复制,产生新的功能和亚功能化基因,这为进一步研究不同D N A去甲基化酶基因的作用和机制提供了线索㊂3.3小麦d M T a s e基因的表达与生长发育的关系基因表达模式可以提供相关基因功能的重要信息,小麦d MT a s e在组织特异性表达模式分析中,发现T a R O S1a亚家族基因在所有组织中都有较高的表达,在其他植物物种中也发现了类似的结果,如花生中的R O S2[25]和D o DM L3在铁皮石斛[22]在所有组织中都有相对较高的表达㊂而T a R O S1b亚家族基因表达存在基因分化和组织特异性,其中T a R O S1b-1A.1基因在小麦胚和胚乳中有较高的表达,与其启动子胚乳特异性表达元件相一致,而该基因的串联复制基因T a R-O S1b-1A/B/D.2在各组织及发育时期几乎不表达,说明不同小麦d MT a s e基因在植物生长发育过程的在不同发育阶段可能具有独特的功能,也说明D N A去甲基化酶基因在进化过程中会更加倾向趋异进化㊂研究表明水稻O s R O S1a k n o c k-i n突变后导致胚乳早期发育失败和胚发育不完全[12],而O s-R O S1显性负突变导致糊粉层增厚,其调控机制为O s R O S1基因的突变,可导致调控糊粉层发育相关的转录因子R I S B Z1和R P B F超甲基化,抑制其基因表达,从而导致糊粉层细胞层数的增加[27]㊂小麦转录组数据分析表明小麦T a R O S1a-5A/D和T a R O S1b-1A.1在籽粒及其糊粉层和胚乳中高表达,这也被我们采用q R T-P C R方法证㊃0731㊃麦类作物学报第43卷。
一张图看懂小麦的11个生育期,小麦起身拔节期田间管理技术

一张图看懂小麦的11个生育期,小麦起身拔节期田间管理技术1、小麦的生育期划分在我国按照小麦的播种时间,可以将小麦分为秋播小麦和春播小麦,不同的播种时间小麦的生长天数也不一样。
一般来说,秋播小麦大多为230-280天;春播小麦一般为100-120天。
无论生长期是多少天,都要经历从播种到收获的过程,为了便于小麦田间管理,根据小麦不同时期的生长特性,又将整个生长周期划分为多个生育期。
对于生育期的划分,也有多种划分方法,不同方法划分的生育期也略有不同,目前主要的划分方式是将小麦的一生划分为11个生育期,分别为:出苗期、分蘖期、越冬期、返青期、起身期、拔节期、孕穗期、抽穗期、开花期、灌浆期和成熟期。
每个时期的具体形态特点如下图:2、小麦起身拔节期的生长特点小麦进入起身拔节期,最明显的特征是小麦由匍匐状开始直立生长,这也标志着小麦进入营养生长的旺盛期。
经常下地的农户会发现,几乎每天都能看到小麦在长高,我们无法直接看到的是,小麦的穗分化也主要在这个时期。
因此,这个时期小麦对水、肥的需求量也骤增,是小麦田间管理极其重要的一个时期。
3、起身拔节期田间管理重点(1)水肥管理。
小麦进入生长盛期,对水肥需求量较大,结合当地降水量、土壤墒情,适时浇水,并结合降水或浇水进行追肥,此时追肥应以氮肥为主。
(2)病虫防治。
此时需重点关注的病害为小麦的纹枯病、根腐病、锈病等,药剂防治可以选择戊唑醇·咪鲜胺、噻呋酰胺·己唑醇、苯甲·嘧菌酯等;随着温度的升高,虫害也开始发生,重点需关注的是蚜虫、红蜘蛛等,尤其是蚜虫,春季温度适宜,繁殖速度快,若防治不及时则很快开始叠代为害,防治难度增加,应在发生初期及时用药,最好一遍就防治住,药剂可以选择溴氰·吡虫啉、噻虫·高氯氟、联苯菊酯、阿维菌素等。
除了以上两点,还要注意以下几个方面:春季温度不稳定,忽冷忽热,还应预防小麦冻害的发生,打药时可以添加芸苔素、磷酸二氢钾,不仅可以促进小麦的生长发育,还能提高小麦的抗逆性,减小低温、干旱等不良因素的影响;如果小麦群体过大,出现旺长等情况,则需要适当的控旺,但此时不建议再用专门的控旺药剂,可以结合病害防治,选择对生长有一定抑制作用的三唑类杀菌剂(如戊唑醇、己唑醇等)。
小麦的生育时期判定
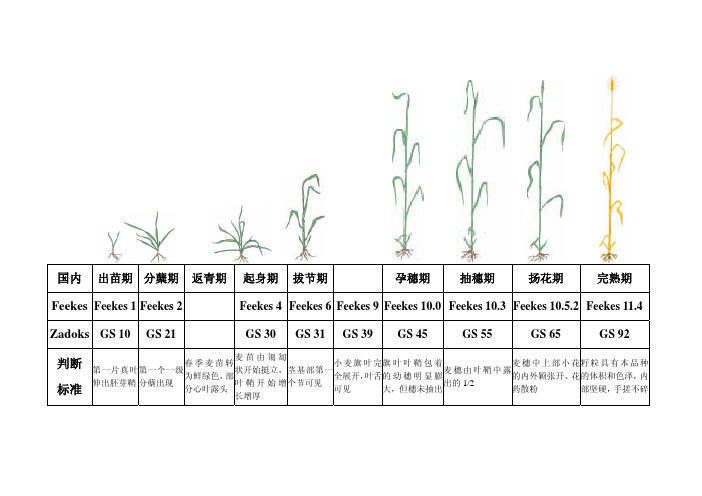
国内 出苗期分蘖期 返青期起身期 拔节期 孕穗期 抽穗期 扬花期 完熟期 Feekes Feekes 1Feekes 2Feekes 4Feekes 6Feekes 9Feekes 10.0Feekes 10.3Feekes 10.5.2Feekes 11.4 Zadoks GS 10GS 21 GS 30 GS 31 GS 39 GS 45 GS 55 GS 65 GS 92 判断标准 第一片真叶伸出胚芽鞘第一个一级分蘖出现 春季麦苗转为鲜绿色,部分心叶露头麦苗由匍匐状开始挺立,叶鞘开始增长增厚茎基部第一个节可见 小麦旗叶完全展开,叶舌可见 旗叶叶鞘包着的幼穗明显膨大,但穗未抽出麦穗由叶鞘中露出的1/2 麦穗中上部小花的内外颖张开、花药散粉 籽粒具有本品种的体积和色泽,内部坚硬,手搓不碎小麦生育时期小麦从出苗到成熟所经历的时间叫全生育期。
全生育期是由各个外部器官的特征时期所组成。
人们为了便于指导生产,把有栽培意义的器官特征,加上首尾农事操作,而将小麦生育全过程,分为以下可记录的生育时期:1.播种期记载播种的年、月、日2.出苗期小麦的第一真叶露出地表2-3厘米时为出苗,田间有50%以上麦苗达到出苗标准时的日期,记为该田块的出苗期。
3.三叶期田间50%以上的麦苗,主茎节三片绿叶伸出2厘米左右的日期,记为三叶期。
4.分蘖期田间有50%以上的麦苗,第一分蘖露出叶鞘2厘米左右时,记为分蘖期。
第三个一级分蘖出现为分蘖盛期。
5.越冬期北方冬麦区冬前平均气温稳定降至0--1℃下,麦苗基本停止生长时,即为越冬期。
6.返青期北方冬麦区翌年春季气温回升时,麦苗叶片由青紫色转为鲜绿色,部分心叶露头时,为返青期。
7.起身期翌年春季麦苗由匍匐状开始挺立,主茎第一叶叶鞘拉长并和年前最后叶叶耳距相差1.5厘米左右,主茎年后第二叶接近定长,内部穗分化达二棱期、基部第一节开始伸长,但尚未伸出地面时,为起身期。
8.拔节期全田50%以上植株茎部第一节露出地面1.5~2厘米时,为拔节期。
小麦研究方法与技术路线

小麦研究方法与技术路线全文共四篇示例,供您参考第一篇示例:小麦是世界上最重要的粮食作物之一,也是我国的主要粮食作物之一。
小麦研究在推动粮食生产、保障粮食安全、提高农业生产效益等方面具有重要意义。
在小麦研究中,应用科学方法和先进技术是至关重要的。
本文将重点介绍小麦研究的方法与技术路线。
一、小麦研究方法1. 田间试验田间试验是小麦研究的重要方法之一。
通过布设试验田、种植不同品种、施用不同肥料、控制不同病虫害等方式,对小麦的生长发育、产量和品质进行观测和研究,以获得相关数据和结论。
2. 实验室分析实验室分析是小麦研究的另一种常用方法。
通过实验室仪器设备,对小麦种子、叶片、茎秆等进行化学成分分析、营养元素测定、基因检测等技术研究,为小麦品种选育和育种改良提供数据支持。
3. 现代遗传学方法现代遗传学方法在小麦研究中得到广泛应用,包括分子标记辅助选择、基因工程技术、基因组学等。
通过对小麦基因组进行分析,揭示其遗传特性和相关基因功能,从而指导小麦的选育和育种改良。
二、小麦研究技术路线1. 小麦品种选育技术路线小麦品种选育是小麦研究的核心内容之一。
技术路线包括通过遗传育种、杂交育种和分子育种等方法,获得优良的小麦品种。
在品种选育的过程中,利用现代遗传学方法对小麦种质资源进行评价和利用,利用分子标记技术筛选抗逆性状、抗病性状和优质性状等,最终培育出适应不同生态环境和需求的小麦品种。
2. 小麦栽培管理技术路线小麦栽培管理技术路线主要包括耕作管理、灌溉施肥、病虫害防治、优质高产栽培技术等方面。
通过合理的栽培管理技术,可以提高小麦的产量和品质,减少病虫害的发生,降低种植成本,提高农民收益。
3. 小麦品质分析技术路线小麦品质分析技术路线主要包括小麦品质检测方法、品质性状评价标准和品质改良技术等方面。
通过对小麦面粉品质、食用价值、加工特性等进行分析和评价,为小麦面粉加工和产品开发提供技术支持。
小麦研究的方法与技术路线是多样化的,涉及田间试验、实验室分析、现代遗传学方法等多个方面。
小麦生长周期详细图解

小麦生长周期详细图解6/18 本期作者:Rui Wang今天本来是打算接着飞哥的那篇PHS的推送来聊聊相关的实验方法,不过由于技术原因,来不及作为这周一的推送了。
今天就临时换一个话题。
幸好小编最近发现一个非常好的总结,是关于小麦生长周期的,今天就拿出来跟大家分享。
虽然网上也有很多根据Zadoks scale, Feekes scale, Haun scale这三个生长scale来介绍小麦生长周期的文章。
但是今天的这个总结有点不一般,它能回答我很多问题,尤其是对产量构成因素RNA-Seq 工作相关的一些问题:麦穗是在哪个时期形成的?(哪个时期对小穗数/籽粒数的影响最大?)哪个时期对分蘖数影响最大?哪个时期对籽粒大小的影响最大?另外,这份总结还包括很多田间管理的注意事项,比如什么时候施肥?什么时候打农药?什么时候该注意冻害?灌溉该在那个时期停止,原因是什么?过了这个时期再浇水有什么危害?等等。
总之,小编仔细阅读这份总结,受益匪浅,希望对大家也有所帮助!对了,这份总结是由 University of Idaho做的,是按每周一张图片来介绍小麦在18周内从一叶期到收获的过程,以下是网址链接:/extension/cereals/scseidaho/growstage/wheatWeek 1 Growth Stage: The plants this week are atapproximately the 1 leaf stage. Seeding depth was approximately 1 inch deep. Wheat normally has 4-5 seminal(seed) roots and barley may have up to 7 seminal roots. The number that develops is dependent on variety, seed vigor, and soil conditions. Zadoks scale:11, Feekes scale: 1, Haun scale: 1.1Week 2 Growth Stage: Plants are at roughly the two leaf stage. They are not finished developing their second leaf. Zadoks scale: 12, Feekes scale: 1, Haun scale:1.8. Pictures were taken April 26.Week 3 Growth Stage: This week the plants are at the two and three leaf stage. They are still developing their 3rd leaf. The alternate leaf pattern is becoming more visible for both wheat and barley plants. Leaves form alternately on cereals with odd-numbered leaves arising from one side of the stem and even numbered leaves arising from the opposite side of the stem. When counting leaves on cereals, the first formed leaf is numbered 1, the second leaf is numbered 2, and so on. Tillers arecounted in the same manner. Tiller 1 arises from the base of leaf 1, tiller 2 arises from the base of tiller 2, etc. Zadoks scale: 13, Feekes scale: 1, Haun scale: 2.5.Growers should begin scouting fields for wild oats at this time. Wild oats develop in a similar manner as wheat and barley. The speed of leaf development is also similar. Because wild oat susceptibility to post-emergence herbicides is influenced by development stage, it is important to properly identify the stages. One can also use the growing degree days (GDD) information to estimate how long it will take wheat, barley or wild oat to reach specific stages. Many wild oat herbicides use seedling growth stages in label recommendations. Pictures were taken May 3.Week 4 Growth Stage: Whitebird has three fully developed leaves and one tiller. Meritbarley is about a full leaf ahead of Whitebird wheat this week. This indicates that Whitebird requires more GDD for each leaf to develop than does Merit. The number of tillers that develop is dependent upon both genetic and environmental factors. Some varieties are more free tillering than others. Barley is generally more free tillering than wheat. Stresses resulting from inclement weather, too little or too much water in the soil, soil compaction, deep seeding, or nutrients out of balance may all cause decreased numbers of tillers to develop.Very high seeding rates will also reduce the number of tillers/plant due to competition between plants. Zadoks scale: 21, Feekes scale: 2, Haun scale: 3.4.Most important this week are things that are happening in the plants but are not yet visible. At this stage of growth, the head in the main stem has started to develop and can be seen under magnification. This is the stage when the maximum number of kernels/head is determined (其实这里说总小穗数应该更合理一些). The maximum number of kernels for the main stem head will likely be finalized during the next two weeks. Head development for tillers follows the same sequence as for the main stem but is delayed in timing just as tiller leaf appearance is.Any stress during this stage will result in reduced yield potential. When temperatures are high through the tillering stage, yield potential is reduced. Moderate temperatures and shorter days (longer nights) will enhance the development of more kernel buds on the head (florets) and gives the potential for more kernels/head.At this point, the developing head is still below ground level. It will not start to rise in the plant until tillering is completed and jointing starts. Also developing at this time but not yet visible in the pictures are the buds for adventitious roots. These roots develop from the crown nodes of the main stem and tillers, not from the seed as the seminal roots have. As adventitious roots develop, the plant will gradually become more dependent on them until they become the predominant root mass. Stress in the seedbed will inhibit development and growth of these important roots. Pictures were taken May 10 at early tillering (3 main stem leaves and 1 tiller).Week 5 Growth Stage: The wheat is fully one leaf behind the barley. (Phyllochron is the term used to describe the interval between the appearance of successive leaves.) Zadoks scale: 21, Feekes scale: 2, Haun scale: 3.3.This plant has a developed T0 tiller, tiller 1 and tiller 2. The main stem has four fully developed leaves and the fifth leaf is about 0.3as long as leaf 4. The heads in the wheat plant are also developing and are slightly behind that of the barley. The adventitious roots are developing and are just visible in the photograph. Neither wheat nor barley has started to joint at this time. They soon will be starting a very rapid growth stage and will need unlimited supplies of water and nutrients to maintain the yield potential that is currently being set.Producers should do everything possible to minimize any stresses during this period. For comparison, a developing head from winter wheat is shown adjacent to a dime (shown below). The winter wheat had four detectable nodes at this stage. Developing winter wheat head at jointing stage(four detectable nodes). Pictures were taken May 17 at tillering (four main stem leaves and two tillers).Week 6 Growth Stage: Whitebird has not yet reached the jointing stage but when examined closely, the first joint was evident but still below the soil level. (Jointing officially starts when the first joint is detectable above the soil level.) This plant has a mainstem tiller, three primary tillers plus the T0tiller. Secondary tillers are not yet developing. The developing heads are not yet visible to the unaided eye. From a physiological stage, the wheat is similar to where the barley was last week. Any moisture, nutrient or other stress will reduce tiller number and/or head size giving a reduced yield. The plants are starting into a very rapid phase of growth (dry matter accumulation). The cooler than normal temperatures that southern Idaho experienced during the period from seeding to present have favored development of additional tillers and larger heads. Warmer temperatures through this period will result in fewer tillers and smaller heads. Recent changes to warmer temperatures will put stress on irrigation systems and the plants will change from one stage to another very rapidly. The picture was taken May 24 at tillering.Week 7 Growth Stage: Early in jointing stage. The plants this week are in a period of rapid growth and dry matter accumulation. The flag leaf will be the last leaf to emerge. Any moisture, nutrient or other stress during this period willreduce yields by forcing the plants to abort tillers or by leaving the lower florets on the heads undeveloped. Zadoks scale: 31, Feekes scale: 6, Haun scale: 7.3. The developing head in the main stem is just above ground level but barely visible at this time (approx. 1/8 to 3/16' in size). Pictures were taken June 1.Week 8 Growth Stage: Late jointing stage. Wheat will soon develop flag leaves. Plants at this stage are quite susceptible to freeze damage. Less severe temperatures can cause damage when the heads are elevated in the plant. Freezes at this stage often cause entire kernels to be aborted. Freezes after flowering may cause kernels to abort but may also cause shriveled kernels. Head emergence through flowering is the most sensitive time for freeze damage. Read 'Spring Freeze Injury to Idaho Cereals' (Bulletin No. 724) for more about freeze damage. Zadoks scale: 34, Feekes scale: 7, Haun scale: 7.9. Developing head fromWhitebird, soft white spring wheat, at late jointing stage. This head (from the main stem) was approximately 4-6 inches above the ground. Pictures were taken June 7 at late jointing.Week 9 Growth Stage: Mid boot stage. The plants this week are in the middle of the fastest phase of dry matter accumulation. They are approaching the stage of maximum water use. On a hot and windy day, the plants will use as much as 0.4inches of water a day and on a hot calm day, they'll use as much as 0.3 inches of water per day. Zadoks scale: 41, Feekes scale: 10, Haun scale:8.5.A producer could still use Tilt and/or Cerone at this stage. Developing head from Whitebird, soft white spring wheat, at mid boot stage. The tip of the awns on this head was approximately 2-3 inches from the flag leaf collar. Pictures were taken June 14.Week 10 Growth Stage: Head emergence. This is when the plants are most susceptible to freeze damage because the heads are partially or fully exposed. Any stress during this time period will affect cell replication within the developing kernels thus reducing overall kernel size. Proper timing of irrigation is crucial during this time. Zadoks scale: 53, Feekes scale: 10.2, Haun scale: 10.4. This head is approximately 4' long(excluding awns) and approximately 1/4 of the head emerged from the boot. Pictures were taken June 21.Week 11 Growth Stage: Flowering stage. Zadoks scale: 65, Feekes scale: 10.5.2, Haun scale: 11.5. This head is approximately 5.5' long (excluding awns). Pictures were taken June 28Week 12 Growth Stage: End of flowering. The next stage will be the soft dough stage of kernel development. Generally, soft dough stage is the time for the last irrigation. This is true for producers with a silt loam soil where the soil profile is full of water. Producers with sandy soil can irrigate beyond the soft dough stage to make up for water loss in the soil. Producers need to remember that excess irrigation will affect test weight and percent plump, increase the chance of lodging and increase the risk of disease problems associated with lodging. Excess irrigation in wheat will lower grain protein. Zadoks scale: 69, Feekes scale: 10.5.2, Haun scale:11.6. This head is approximately 5.5' long (excluding awns). Pictures were taken July 7.Week 13 Growth Stage: Early milk stage of kernel development. Zadoks scale: 73, Feekes scale: 10.5.4, Haun scale: 13.0. This head is approximately 5.5' long (excluding awns). Developing kernel at early milk stage from main stem head. Pictures were taken July 12.Week 14 Growth Stage: Soft dough stage of kernel development. Zadoks scale: 85, Feekes scale: 11.2, Haun scale: 14.0. This head is approximately 5.5' long (excluding awns). Developing kernel at soft dough stage from main stem head. Pictures were taken July 19.Week 15 Growth Stage: Early hard dough stage of kernel development. Zadoks scale: 87,Feekes scale: 11.2, Haun scale: 15.0. This head is approximately 5.5' long (excluding awns). Developing kernel at early hard dough stage from the main stemhead. Pictures were taken July 27.Week 16 Growth Stage: Hard dough stage. Zadoks scale: 87, Feekes scale: 11.2, Haun scale: 15.0. Developing kernel at hard dough stage from main stem head. Pictures were taken Aug. 8.Week 17 Growth Stage: Kernel hard stage of ripening. Zadoks scale: 91, Feekes scale:11.3, Haun scale: 16.0. wheat Kernel atkernel hard stage from main stem head. Pictures were taken Aug.9.Week 18 Growth Stage: Harvest ripe stage. The wheat will be harvested early next week. Zadoks scale: 92, Feekes scale: 11.4, Haun scale: 16.0. Kernel at harvest ripe stage from main stem head. Pictures were taken Aug. 16.。
小麦B-box基因家族全基因组鉴定与表达分析

作物学报ACTA AGRONOMICA SINICA 2021, 47(8): 1437 1449 / ISSN 0496-3490; CN 11-1809/S; CODEN TSHPA9E-mail: zwxb301@DOI: 10.3724/SP.J.1006.2021.01077小麦B-box基因家族全基因组鉴定与表达分析王艳朋凌磊张文睿王丹郭长虹*哈尔滨师范大学生命科学与技术学院 / 黑龙江省分子细胞遗传与遗传育种重点实验室, 黑龙江哈尔滨 150025摘要: B-box (BBX)是一类含有1个或2个B-box结构域的锌指蛋白, 在植物生长发育中起着重要作用。
本研究明确小麦B-box转录因子的数量、基因结构和分类进化关系, 研究各基因成员在不同组织中的特异性表达以及对非生物胁迫的响应。
从小麦全基因组中鉴定得到87个B-box基因家族成员, 所有TaBBXs蛋白均含有B-box结构域。
TaBBXs编码146~489个氨基酸, 理论等电点为4.32~10.42。
染色体定位分析表明, TaBBXs分布在除1A、1B和1D之外的18条小麦染色体上。
通过系统发育分析将TaBBXs划分为5个亚家族, 有0~4个内含子。
在同组内同一个系统进化树分支中的亚族成员具有高度相似的基因结构。
qRT-PCR分析的20个TaBBXs基因, 具有不同的组织表达模式, 16个基因在叶中有较高表达, TaBBX10和TaBBX39仅在叶中有较高表达, 而TaBBX74在穗中表达, TaBBX43在根中特异性表达。
在不同逆境胁迫下, TaBBXs呈现不同表达模式, 11个基因在低温胁迫后上调表达, 12个基因在ABA处理后下调表达, 盐胁迫后10个基因出现上调表达, 干旱胁迫后7个基因出现下调表达, TaBBX10、TaBBX39、TaBBX60、TaBBX67和TaBBX74基因在2种或2种以上胁迫下有显著的上调表达。
