版药典限量检测标准完整版
中国药典2020微生物限度检查

中国药典2020微生物限度检查
中国药典2020中关于微生物限度检查的要求如下:
1. 检查项目:中国药典2020要求对药材、药品和药品制剂的
微生物限度进行检查。
检查项目包括总菌落计数、大肠菌群、金黄色葡萄球菌、霉菌和酵母菌。
2. 检查方法:中国药典2020要求使用适合的方法进行微生物
限度检查。
主要的方法包括菌落计数法、生化鉴定法等。
各种检测方法需要符合相关的国家标准或规范要求。
3. 限度要求:中国药典2020中规定了各种药材、药品和药品
制剂的微生物限度要求。
例如,对于药材和药品制剂,总菌落计数应符合规定的限度要求;大肠菌群应不得检出;金黄色葡萄球菌、霉菌和酵母菌的限度也有具体要求。
4. 检测标准:中国药典2020还制定了微生物限度检查的各种
检测标准。
这些标准包括允许的菌落形态、允许的菌落计数范围、生化鉴定的方法和判断标准等。
总之,中国药典2020对微生物限度检查给出了具体的要求和
标准,保障了药材、药品和药品制剂的质量和安全性。
实际的微生物限度检查工作需要依据中国药典2020的规定进行操作。
国家中药重金属及农药残留残留标准
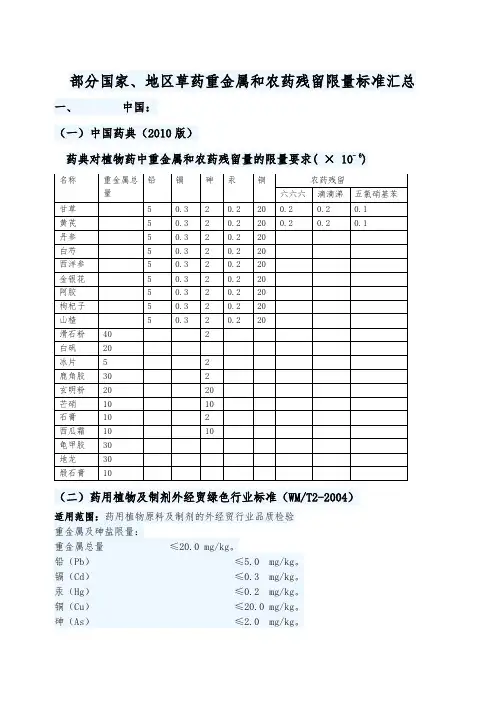
部分国家、地区草药重金属和农药残留限量标准汇总一、中国:(一)中国药典(2010版)药典对植物药中重金属和农药残留量的限量要求( × 10- 6)(二)药用植物及制剂外经贸绿色行业标准(WM/T2-2004)适用范围:药用植物原料及制剂的外经贸行业品质检验重金属及砷盐限量:重金属总量≤20.0 mg/kg。
铅(Pb)≤5.0 mg/kg。
镉(Cd)≤0.3 mg/kg。
汞(Hg)≤0.2 mg/kg。
铜(Cu)≤20.0 mg/kg。
砷(As)≤2.0 mg/kg。
农药残留限量:六六六(BHC) ≤0.1 mg/kg。
DDT ≤0.1 mg/kg。
五氯硝基苯(PCNB) ≤0.1 mg/kg。
艾氏剂(Aldrin) ≤0.02 mg/kg。
二、香港:(香港中药材标准第一册)表1:药材中重金属限度三、澳门:(技術性指示第02/2003號)重金属种类上限砷(无机) 每日1500.00微克镉(水溶性) 每剂3500.00微克铅每日179.00微克汞每日36.00微克重金属种类上限砷 5.00 ppm铜 150.00 ppm铅 20.00 ppm汞 0.50 ppm四、新加坡:(1995年药物决议(禁止销售及供应)(修正案))重金属及砷盐限量:铅(Pb)≤20 mg/kg。
汞(Hg)≤0.5 mg/kg。
铜(Cu)≤150 mg/kg。
砷(As)≤5 mg/kg。
镉(Cd)≤5 mg/kg。
五、马来西亚:重金属及砷盐限量::铅(Pb)≤10 mg/kg。
汞(Hg)≤0.5 mg/kg。
砷(As)≤5 mg/kg。
六、泰国:重金属及砷盐限量:适用范围:草药原料及产品铅(Pb)≤10 mg/kg。
镉(Cd) ≤0.3 mg/kg。
砷(As)≤ 4 mg/kg。
七、韩国:重金属限量(药品安全厅公示第2005-62号):1、植物性生药:铅(Pb)≤5 mg/kg。
汞(Hg ) ≤0.2 mg/kg。
镉 (Cd) ≤0.3 mg/kg。
版《药典》限量检测标准
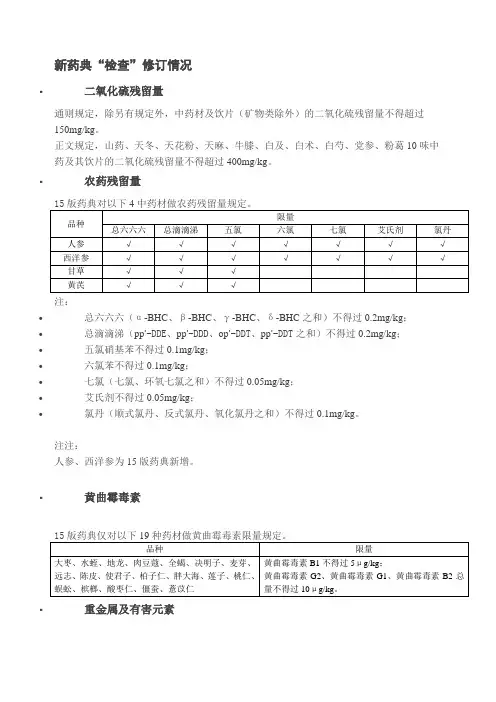
新药典“检查”修订情况
▪二氧化硫残留量
通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
▪农药残留量
注:
•总六六六(α-BHC、β-BHC、γ-BHC、δ-BHC之和)不得过0.2mg/kg;
•总滴滴涕(pp’-DDE、pp’-DDD、op’-DDT、pp’-DDT之和)不得过0.2mg/kg;
•五氯硝基苯不得过0.1mg/kg;
•六氯苯不得过0.1mg/kg;
•七氯(七氯、环氧七氯之和)不得过0.05mg/kg;
•艾氏剂不得过0.05mg/kg;
•氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过0.1mg/kg。
注注:
人参、西洋参为15版药典新增。
▪黄曲霉毒素
▪重金属及有害元素
10版药典原有重金属限量品种:
山楂、丹参、甘草、石膏、煅石膏、白芍、白矾、玄明粉、地龙、芒硝、西瓜霜、西洋参、冰片、龟甲胶、阿胶、金银花、枸杞子、黄芪、鹿角胶、滑石粉。
中国药典2020中药材及饮片二氧化硫残留限量标准

中国药典2020中药材及饮片二氧化硫残留限量标准中国药典2020中药材及饮片二氧化硫残留限量标准全面解析一、引言中国药典作为我国医药行业的标准参考,对于中药材及饮片的质量和安全起着至关重要的作用。
其中,二氧化硫(SO2)是一种常见的食品添加剂,用于防止食品腐败和细菌感染,但过量的二氧化硫使用可能对人体健康造成潜在的风险。
在药物行业中,二氧化硫的残留限量得到了高度重视。
本文将对中国药典2020中药材及饮片中关于二氧化硫残留限量标准的规定进行全面解析。
结合个人观点和理解,旨在为读者提供有价值、深刻和全面的信息。
二、中国药典2020中药材及饮片二氧化硫残留限量标准概述中国药典2020中药材及饮片二氧化硫残留限量标准是根据国家食品药品监督管理局的相关要求和国际接受标准制定的。
该标准对中药材及饮片中二氧化硫残留的最高限量进行了明确规定,通过限制二氧化硫的使用量来保证中药材及饮片的质量和安全。
三、中国药典2020中药材二氧化硫残留限量标准解读根据中国药典2020的规定,以下是中药材中二氧化硫残留的限量标准:1. 高于10%含水量的中药材:- 生草乌:不得超过100ppm;- 炒草乌:不得超过500ppm;- 其他含水量高于10%的中药材:不得超过300ppm。
2. 低于10%含水量的中药材:- 醋制草乌:不得超过2000ppm;- 冬虫夏草:不得超过50ppm;- 其他含水量低于10%的中药材:不得超过500ppm。
四、中国药典2020饮片二氧化硫残留限量标准解读根据中国药典2020的规定,以下是饮片中二氧化硫残留的限量标准:1. 高含水量的饮片:- 草乌片:不得超过1000ppm;- 其他高含水量的饮片:不得超过500ppm。
2. 低含水量的饮片:- 草乌片:不得超过3000ppm;- 其他低含水量的饮片:不得超过1000ppm。
五、个人观点和理解个人认为,中国药典2020中药材及饮片二氧化硫残留限量标准的制定是非常必要和重要的。
版药典三部

15版药典三部含细菌内毒素热原的品种细菌内毒素检查(通则1143)54个品种125个样品Ⅰ预防类A群脑膜炎球菌多糖疫苗P69原液检定细菌内毒素检查应不高于25EU/μg;也可采用热原检查法检查,注射剂量按家兔体重每1kg注射0.05μg多糖。
细菌内毒素检查,每一次人用剂量应不高于1250EU。
稀释剂细菌内毒素检查,应不高于0.25EU/ml.A群C群脑膜炎球菌多糖疫苗P71原液检定细菌内毒素检查A群、C群多糖均应不高于12EU/ug细菌内毒素检查每1次人用剂量应不超过1250EU稀释剂细菌内毒素检查,应不高于0.25EU/ml.A群C群脑膜炎球菌多糖结合疫苗(新增)多糖原液检定细菌内毒素检查,A群、C群多糖均应不高于25EU/ug细菌内毒素检查,每1次人用剂量应不高于500EU。
稀释剂细菌内毒素检查,应不高于0.25EU/ml.ACYW135群脑膜炎球菌多糖疫苗P77(新增)原液检定细菌内毒素检查,A群、C群、Y群、W135群多糖均应不高于12.5EU/μg.细菌内毒素检查,每1次人用剂量应不超过1500EU。
稀释剂细菌内毒素检查,应不高于0.25EU/ml.b型流感嗜血杆菌结合疫苗P81多糖检定细菌内毒素检查,应不高于25EU/μg.结合物原液检定细菌内毒素应不高于5EU/μg。
细菌内毒素检查每1次人用剂量应不超过25EU乙型脑炎减毒活疫苗P124成品检定异常毒性细菌内毒素检查(通则1143凝胶限度试验),应不高于50EU/剂疫苗稀释剂细菌内毒素检查(通则1143凝胶限度试验),应不高于0.25EU/ml。
冻干乙型脑炎灭活疫苗(Vero细胞)P129成品检定异常毒性细菌内毒素检查应不高于50EU/ml(通则1143凝胶限度试验)森林脑炎灭活疫苗P133成品检定异常毒性细菌内毒素检查应不高于100EU/ml(通则1143凝胶限度试验)双价肾综合征出血热灭活疫苗(Vero细胞)P137成品检定异常毒性细菌内毒素检查应不高于50EU/剂(通则1143凝胶限度试验)双价肾综合征出血热灭活疫苗(地鼠肾细胞)P140成品检定异常毒性细菌内毒素检查应小于50EU/剂(通则1143凝胶限度试验)双价肾综合征出血热灭活疫苗(沙鼠肾细胞)P144成品检定异常毒性细菌内毒素检查应小于50EU/ml(通则1143凝胶限度试验)冻干人用狂犬病疫苗(Vero细胞)P147成品检定异常毒性细菌内毒素检查应不高于25EU/剂(通则1143凝胶限度试验)冻干甲型肝炎减毒活疫苗P152成品检定异常毒性细菌内毒素检查应不高于50EU/剂(通则1143凝胶限度试验)甲型肝炎灭活疫苗(人二倍体细胞)P155成品检定异常毒性细菌内毒素检查应不高于10EU/ml(通则1143凝胶限度试验)重组乙型肝炎疫苗(酿酒酵母)P158原液细菌内毒素检查应小于10EU/ml(通则1143凝胶限度试验)半成品检定细菌内毒素检查应小于5EU/ml(通则1143凝胶限度试验)成品检定异常毒性细菌内毒素检查应小于5EU/ml(通则1143凝胶限度试验)重组乙型肝炎疫苗(CHO细胞)P161纯化产物检定细菌内毒素检查每10ug蛋白质应小于10EU。
药典三部(版)-通则-1143细菌内毒素检查法

1143 细菌内毒素检查法本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
本试验操作过程应防止内毒素的污染。
细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)相当。
细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度、标定细菌内毒素工作标准品的效价,干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法),且对内毒素试验无干扰作用。
试验所用的器皿需经处理,以去除可能存在的外源性内毒素。
耐热器皿常用干热灭菌法(250℃、30分钟以上)去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。
若使用塑料器皿,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。
供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲溶液调节pH值。
酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。
内毒素限值的确定药品、生物制品的细菌内毒素限值(L)一般按以下公L=K/M式中L为供试品的细菌内毒素限值,一般以EU/ml、EU/mg或EU/U(活性单位)表示;K为人每千克体重每小时最大可接受的内毒素剂量,以EU/(kg·h)表示,注射剂K=5 EU/(kg·h),放射性药品注射剂K=2.5 EU/(kg·h),鞘内用注射剂K=0.2 EU/(kg·h);M为人用每千克体重每小时的最大供试品剂量,以ml/(kg·h)、mg/(kg·h)或U/(kg·h)表示,人均体重按60kg计算,人体表面积按1.62㎡计算。
2020版药典百部检验操作规程
百部检验操作规程执行标准:《中国药典》2020年版一部规程:1【性状】1.1 直立百部:呈纺锤形,上端较细长,皱缩弯曲,长5~12cm,直径0.5~1cm。
表面黄白色或淡棕黄色,有不规则深纵沟,间或有横皱纹。
质脆,易折断,断面平坦,角质样,淡黄棕色或黄白色,皮部较宽,中柱扁缩。
气微,味甘、苦。
1.2 蔓生百部:两端稍狭细,表面多不规则皱褶及横皱纹。
1.3 对叶百部:呈长纺锤形或长条形,长8~24cm,直径0.8~2cm。
表面浅黄棕色至灰棕色,具浅纵皱纹或不规则纵槽。
质坚实,断面黄白色至暗棕色,中柱较大,髓部类白色。
2【鉴别】2.1鉴别(1)2.1.1仪器与用具:显微镜、玻片。
2.1.2操作步骤:按药材(饮片)及成方制剂显微鉴别法标准操作规程操作。
本品横切面2.1.2.1直立百部:根被为3~4列细胞,壁木栓化及木化,具致密的细条纹。
皮层较宽。
中柱韧皮部束与木质部束各1927个,间隔排列,韧皮部束内侧有少数非木化纤维;木质部束导管2~5个,并有木纤维及管胞,导管类多角形,径向直径约至48µm,偶有导管深入至髓部。
髓部散有少数细小纤维。
2.1.2.2蔓生百部:根被为3~6列细胞,韧皮部纤维木化。
导管径向直径约至184µm,通常深入至髓部,与外侧导管束作2~3轮状排列。
2.1.2.3对叶百部:根被为3列细胞,细胞壁无细条纹,其内层细胞的内壁特厚。
皮层外侧散有纤维,类方形,壁微木化。
中柱韧皮部束与木质部束各36~40个。
木质部束导管圆多角形,直径至107µm,其内侧与木纤维及微木化的薄壁细胞连接成环层。
2.2 鉴别(2)2.2.1 试剂:乙醇、浓氯试液、三氯甲烷、1%盐酸、碘化钾试液、硅钨酸试液。
2.2.2 操作步骤:取本品粉末5g,加70%乙醇50ml,加热回流1小时,滤过,滤液蒸去乙醇,残渣加浓氨试液调节pH值至10~11,再加三氯甲烷5ml振摇提取,分取三氯甲烷层,蒸干,残渣加1%盐酸溶液5ml使溶解,滤过,滤液分为两份:一份中滴加碘化铋钾试液,生成橙红色沉淀;另一份中滴加硅钨酸试液,生成乳白色沉淀。
中国药典二部附录通用限度
(
按 第丸 一数 法服
用
)
0.3g<W≤1g 1g<W≤2g W>2g
第服( 二用按 法)重
量
±9% ±8% ±7% ±6% ±5% ±8% ±7% ±6%
温度℃
5 10 15
20 25 30 35
40
不同温度下各种标准缓冲液 PH 值一览表
草酸盐标准缓 邻苯二甲酸氢 磷酸盐标准缓 硼砂标准缓冲 氢氧化钙标准
二、结果判定
样品
检查用水 V≥100ml V<100ml、静脉注射用无 菌粉末或注射用浓溶液
10um <10(粒/10ml)
≤25(粒/ml)
≤6000(粒/瓶)
25um <2(粒/10ml) ≤3(粒/ml)
≤600(粒/瓶)
供试品(可见异物) 无色溶液 透明塑料容器包装或有色溶液 混悬型溶液
光照度 1000~1500lx 2000~3000lx
4000lx
胶囊剂(二部)
不少于标示装量
V ≥V 标;V≥V 标×97% ±15% ±10% ±7% ±5%
片剂(一部)
W<0.3g W≥0.3g 原粉片 浸膏(半浸膏)、糖衣片 薄膜衣片
±7.5% ±5%
30min 60min 60min
散剂
≤0.1g 0.1g<W≤0.5g 0.5g<W≤1.5g 1.5g<W≤6g >6g
冲液
钾标准缓冲液 冲液(pH6.8)
液
缓冲液(25℃)
1.67 1.67 1.67
1.68 1.68 1.68 1.69
1.69
4.00 4.00 4.00
4.00 4.01 4.02 4.02
4.04
6.95 6.92 6.90
重金属检查法
中药限量检测——重金属检查法2015年版《药典》四部通则0821本法所指的重金属系指在规定实验条件下能与硫代乙酰胺或硫化钠作用显色的金属杂质。
标准铅溶液的制备称取硝酸铅0.1599g,置1000ml量瓶中,加硝酸5ml 与水50ml溶解后,用水稀释至刻度,摇匀,作为贮备液。
精密量取贮备液10ml,置100ml量瓶中,加水稀释至刻度,摇匀,即得(每1ml相当于10μg的Pb)。
本液仅供当日使用。
配制与贮存用的玻璃容器均不得含铅。
第一法除另有规定外,取25ml纳氏比色管三支,甲管中加标准铅溶液一定量与醋酸盐缓冲液(pH3.5)2ml后,加水或各品种项下规定的溶剂稀释成25ml,乙管中加入按各品种项下规定的方法制成的供试品溶液25ml,丙管中加入与乙管相同重量的供试品,加配制供试品溶液的溶剂适量使溶解,再加与甲管相同量的标准铅溶液与醋酸盐缓冲液(pH3.5)2ml后,用溶剂稀释成25ml;若供试品溶液带颜色,可在甲管中滴加少量的稀焦糖溶液或其他无干扰的有色溶液,使之与乙管、丙管一致;再在甲、乙、丙三管中分别加硫代乙酰胺试液各2ml,摇匀,放置2分钟,同置白纸上,自上向下透视,当丙管中显出的颜色不浅于甲管时,乙管中显示的颜色与甲管比较,不得更深。
如丙管中显出的颜色浅于甲管,应取样按第二法重新检查。
如在甲管中滴加稀焦糖溶液或其他无干扰的有色溶液,仍不能使颜色一致时,应取样按第二法检查。
供试品如含高铁盐影响重金属检查时,可在甲、乙、丙三管中分别加入相同量的维生素C 0.5~1.0g,再照上述方法检查。
配制供试品溶液时,如使用的盐酸超过1ml,氨试液超过2ml,或加入其他试剂进行处理者,除另有规定外,甲管溶液应取同样同量的试剂置瓷皿中蒸干后,加醋酸盐缓冲液(pH3.5)2ml与水15ml,微热溶解后,移置纳氏比色管中,加标准铅溶液一定量,再用水或各品种项下规定的溶剂稀释成25ml。
第二法除另有规定外,当需改用第二法检查时,取各品种项下规定量的供试品,按炽灼残渣检查法(通则0841)进行炽灼处理,然后取遗留的残渣;或直接取炽灼残渣项下遗留的残渣;如供试品为溶液,则取各品种项下规定量的溶液,蒸发至干,再按上述方法处理后取遗留的残渣;加硝酸0.5ml,蒸干,至氧化氮蒸气除尽后(或取供试品一定量,缓缓炽灼至完全炭化,放冷,加硫酸0.5~1ml,使恰湿润,用低温加热至硫酸除尽后,加硝酸0.5ml,蒸干,至氧化氮蒸气除尽后,放冷,在500~600℃炽灼使完全灰化),放冷,加盐酸2ml,置水浴上蒸干后加水15ml,滴加氨试液至对酚酞指示液显微粉红色,再加醋酸盐缓冲液(pH3.5)2ml,微热溶解后,移置纳氏比色管中,加水稀释成25ml,作为乙管;另取配制供试品溶液的试剂,置瓷皿中蒸干后,加醋酸盐缓冲液(pH3.5)2ml 与水15ml,微热溶解后,移置纳氏比色管中,加标准铅溶液一定量,再用水稀释成25ml,作为甲管;再在甲、乙两管中分别加硫代乙酰胺试液各2ml,摇匀,放置2分钟,同置白纸上,自上向下透视,乙管中显出的颜色与甲管比较,不得更深。
2020中国药典通则1108
2020年中国药典通则1108是关于中药饮片微生物限度检查的标准,主要包括以下内容:
对中药饮片进行精准分类:新版药典按照服用方式来界定中药材和中药饮片的微生物限度规定。
在通则1107-非无菌药品微生物限度标准中,规定了直接口服及泡服的中药饮片微生物限度标准。
样品取样过程有待进一步明晰:通则1108-中药饮片微生物限度检查法规定,中药饮片抽样参照通则0211-药材和饮片取样法抽取试验样品。
由于中药饮片的取样是拆开包装抽取样品,大包装饮片每批抽取100~500g,混匀;独立小包装饮片安装量抽取100~500g 的包装数。
抽样时存在中药饮片直接接触取样环境空气、抽样工具和包装袋的过程。
药材和饮片取样法只规定了常规理化检验用样品抽样时的原则、步骤、取样比例和取样量,但对于微生物限度检查用样品,在抽取样品过程中对取样环境、取样工具及包装容器等如何防范微生物污染却未有明确说明。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
版药典限量检测标准 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
新药典“检查”修订情况
二氧化硫残留量
通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
农药残留量
15版药典对以下4中药材做农药残留量规定。
品种
限量
总六六六总滴滴涕五氯六氯七氯艾氏剂氯丹
人参√√√√√√√西洋参√√√√√√√甘草√√√
黄芪√√√
注:
总六六六(α-BHC、β-BHC、γ-BHC、δ-BHC之和)不得过kg;
总滴滴涕(pp’-DDE、pp’-DDD、op’-DDT、pp’-DDT之和)不得过kg;
五氯硝基苯不得过kg;
六氯苯不得过kg;
七氯(七氯、环氧七氯之和)不得过kg;
艾氏剂不得过kg;
氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过kg。
注注:
人参、西洋参为15版药典新增。
黄曲霉毒素
15版药典仅对以下19种药材做黄曲霉毒素限量规定。
品种限量
大枣、水蛭、地龙、肉豆蔻、全蝎、决明子、麦芽、远志、陈皮、使君子、柏子仁、胖大海、莲子、桃仁、蜈蚣、槟榔、酸枣仁、僵蚕、薏苡仁黄曲霉毒素B1不得过5μg/kg;
黄曲霉毒素G2、黄曲霉毒素G1、黄曲霉毒素B2总量不得过10μg/kg。
重金属及有害元素
15版药典新增以下8种药材的重金属限量规定。
10版药典原有重金属限量品种:
山楂、丹参、甘草、石膏、煅石膏、白芍、白矾、玄明粉、地龙、芒硝、西瓜霜、西洋参、冰片、龟甲胶、阿胶、金银花、枸杞子、黄芪、鹿角胶、滑石粉。
