化学式书写
化学式书写

化学式的书写单质:Xn1、由原子直接构成的物质:化学式和元素符号一致——X如:铁,铝,氦气,氖气,红磷,石墨。
2、由两个相同原子构成分子,再构成的物质,化学式为:X2 。
如:氟气,氯气,溴,碘,氢气,氧气,氮气。
3、由a个相同原子构成分子,再构成的物质,化学式为:Xn如:臭氧,化合物:(XaYb、XaYbZc …)1、确定元素组成(名称里所含元素,注意常见的原子团)如:四氧化三铁中含和元素,氯化钠中含和元素碳酸钠中含和元素,氢氧化钠中含和元素2、确定元素顺序①先读后写,后读先写;②金氢左,非金右,氧化物中氧在后;③正价前,负价后如:氧化镁,氯化钾,碳酸钠,高锰酸钾。
3、确定原子个数比(角标)⑴名称如:四氧化三铁,五氧化二磷,二氧化碳。
⑵化合价A:最小公倍数法:排序→标价→求最小公倍数→求原子个数→检查如:书写三价铁的氧化物练习:二氧化碳,氯化钾,氯化铁,氧化铝。
B:交叉法:排序→标价→化简→交叉→检查如:氧化铁,氯化铝,氢氧化镁,碳酸钠,练习:二氧化碳,三氧化二铁,氧化铁,氧化铝,氯化铁,氯化亚铁,氯化镁,氟化钠,含硝酸根()硝酸钠,硝酸铜,硝酸铵,含硫酸根()硫酸亚铁,硫酸铁,硫酸铵,含碳酸根()碳酸钾,碳酸钙,碳酸铵,含磷酸根()磷酸钾,磷酸钙,磷酸铵,含铵根()氯化铵,硫化铵,含氢氧根()氢氧化钠,氢氧化铝,氨水,化合价口诀表一价氢锂钠钾银,二价铜钙钡镁锌,三铝四硅五氮磷,元素铜一二铁二三,二四六硫二四碳,二四六七猛全占,负一氟氯溴碘,负二氧硫负三氮,原子团(根):负一硝酸根与氢氧根,负二硫酸根与碳酸根,负三磷酸根,正一价铵根。
化学式的书写规则

化学式的书写规则
[huà xué shì de shūxiěguī zé]
概念:
在书写化学式时,首先可以根据物质的名称判断元素组成,然后根据元素化合价判断下角标。
示例图片:
概念辨析:
【1】单质化学式的写法:首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。
稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。
金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
【2】化合物化学式的写法:首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。
相关词条:
、
例题分析和解答:
下列物质的化学式书写正确的是()
A.三氧化二磷P2O3
B.氢氧化铝Al(OH)2
C.氨气NH4
D.硫酸铁FeSO4
考点:化学式的书写
解析:根据氧化物的读法和写法可知,三氧化二磷的化学式为P2O3;氢氧化铝中,铝元素显+3价,氢氧根显-1价,其化学式为Al(OH)3;氨气中,氮元素显-3价,氢元素显+1价,故氨气的化学式为NH3;硫酸铁中,铁元素的化合价为+3价,硫酸根显-2价,其化学式为Fe2(SO4)3。
答案:A。
化学反应方程式的书写规则

化学反应方程式的书写规则
化学反应方程式是化学反应过程的抽象表达方式,是化学领域中不可或缺的基本概念之一。
规范正确的方程式书写可以确保化学实验结果的准确性和可重复性。
下面是化学反应方程式的书写规则。
1. 反应物与生成物的摆放位置:反应物应该放在箭头的左边,生成物应该放在箭头的右边。
2. 状态标识符的书写:在反应物和生成物的化学式之后,应该用小括号括起来写明状态标识符,例如(s)表示固体,(l)表示液体,
(g)表示气体,(aq)表示溶液。
3. 系数的使用:反应物和生成物前面的系数表示反应的物质量比,必须是最简比例,如果化学式前面没有系数,则默认系数为1。
4. 过程符号的书写:箭头表示反应过程,双箭头表示反应可逆过程,加号“+”表示两个反应物混合在一起,形成一个复合物。
5. 正确书写化学式:在书写化学方程式时,必须按照元素的原子量比例来写,同时要注意化学式的平衡,必须保证反应物与生成物的化学式所包含的元素数量相同。
总之,化学反应方程式是描述化学反应过程的重要工具,正确的书写可以减少误差和不必要的浪费。
在实验和学习化学的过程中,需要掌握方程式书写的规范和技巧,以确保化学实验的成功和化学知识的深化。
【化学知识点】化学式的意义和书写规则

【化学知识点】化学式的意义和书写规则化合物的化学式就是表示该化合物的组成元素以及各组成元素的比例。
下面整理了化学式的意义和书写规则,供参考。
化合物的化学式就是表示该化合物的组成元素以及各组成元素的比例。
化学式可以表示物质的1个分子,以及组成分子的元素种类和原子数量,如果要表示某物质的几个分子,可以在化学式前加上系数.标明该物质的分子数.如2个氧分子可用2O2表示,四氧化三铁可以用Fe3O4表示。
1.单质化学式的写法:首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。
稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。
金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
2.化合物化学式的写法:首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。
一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。
直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
3.注意:当某组成元素原子个数比是1时,1省略不写;氧化物化学式的书写,一般把氧的元素符号写在右方,另一种元素的符号写在左方,如CO2;由金属元素与非金属元素组成的化合物,书写其化学式时,一般把金属元素符号写在左方,非金属元素符号写在右方,如NaCl。
正负化合价代数和为零。
感谢您的阅读,祝您生活愉快。
化学式的书写和读法完整版

化学式的书写和读法集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]化学式的书写和读法1、单质的书写和读法:(1)金属单质和某些非金属单质:直接用元素符号表示化学式;读元素符号的名称。
碳磷硫钾钙钠镁铝锌铁锡铅铜汞银铂金钡钨 CPSKCaNaMgAlZnFeSnPbCuHgAgPtAuBaW (2)稀有气体单质:直接用元素符号表示化学式;读“某气”。
(3)气态非金属单质:在元素符号右下角加上角码“2”;读“某气”。
氢气H 2氮气N 2氧气O 2氯气Cl 22、化合物的书写和读法:①两种元素组成的物质从后向前读为“某化某”。
氯化钾氯化钠(食盐)氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝KClNaClMgCl 2CaCl 2CuCl 2ZnCl 2BaCl 2AlCl 3②由非金属元素与氧元素组成的物质读为“几氧化几某”。
一氧化碳二氧化碳五氧化二磷二氧化氮二氧化硅 COCO 2P 2O 5NO 2SiO 2③氢元素与原子团组成的物质读“某酸”硫酸H 2SO 4盐酸HCl 硝酸HNO 3磷酸H 3PO 4碳酸H 2CO 3 ④金属元素和氢氧根组成的物质读“氢氧化某”氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝NaOHCa(OH)2Ba(OH)2Mg(OH)2Cu(OH)2KOHAl(OH)3⑤金属元素和原子团(除OH -、NH 4+以外)组成的物质读“某酸某”硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁硫酸铝CuSO 4BaSO 4CaSO 4K 2SO 4MgSO 4FeSO 4Fe 2(SO 4)3Al 2(SO 4)3硝酸钠硝酸钾硝酸银硝酸镁硝酸铜硝酸钙碳酸钠碳酸钙碳酸镁碳酸钾 NaNO 3KNO 3AgNO 3Mg(NO 3)2Cu(NO 3)2Ca(NO 3)2Na 2CO 3CaCO 3MgCO 3K 2CO 3⑥Fe :+2、+3;Cu :+1、+2;高价读“铁或铜”低价时读“亚铁或亚铜”氢氧化铁氢氧化亚铁氧化亚铜Fe(OH)3Fe(OH)2Cu 2O 化学式的读法化学式的读法:先写的后读,后写的先读。
化学式的书写和命名
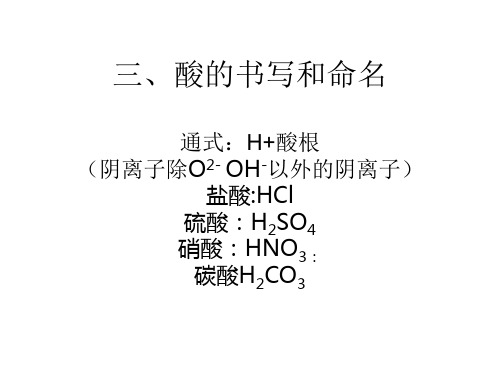
通式:H+酸根 (阴离子除O2- OH-以外的阴离子)
盐酸:HCl 硫酸:H2SO4 硝酸:HNO3: 碳酸H2CO3
四、碱的命名和书写 通式:金属元素符号+OH
命名:氢氧化某
氢氧化钠 氢氧化钾 氢氧化钙 氢氧化钡 氢氧化铜
氢氧化铁 氢氧化镁 氢氧化锌 氢氧化亚铁 氨水
五、盐的书写和命名 通式:金属元素符号+酸根
°⒈盐酸盐(氯化物) 通式:金属元素符号+Cl 命名:氯化某
NaCl KCl
CaCl2 MaCl2 ZaCl2
AlCl3 FeCl2
FeCl3 NH4Cl
五、盐的书写和命名 通式:金属元素符号+酸根
• ⒉硫酸盐 通式:金属元素符号+SO4
命名:硫酸某
Na2SO4
CuSO4 MgSO4Leabharlann ZaSO4 Al2(SO4)3
Fe2(SO4)3 CaSO4 (NH)4SO4 FeSO4
五、盐的书写和命名 通式:金属元素符号+酸根
• ⒊碳酸盐
通式:金属元素符号+CO3 命名:碳酸某
Na2CO3
CaCO3 BaCO3
K2CO3 MgCO3
(NH4)2CO3 NH4HCO3 NaHCO3 FeCO3
五、盐的书写和命名 通式:金属元素符号+酸根
• ⒋硝酸盐
通式:金属元素符号+NO3
命名:硝酸某
硝酸钾 硝酸钠 硝酸铜 硝酸银 硝酸锌 硝酸镁
硝酸钡 硝酸钙 硝酸铝 硝酸铵 硝酸亚铁
六、化合价的记忆和书写
• 记忆 • 一价氢氯钠钾银,二价氧钙钡镁锌; • 三五氮磷铝正三,铜有一二铁二三。 • 书写;最简交叉法 • 正价在前负价后,化合价值标上头; • 约分交叉右下写,根式非一加括号。
各种化学式的书写

各种化学式的书写一、单质化学式的书写1. 金属单质- 金属单质由原子直接构成,其化学式直接用元素符号表示。
例如:- 铁:Fe。
铁原子直接构成铁这种物质,所以其化学式为Fe。
- 铜:Cu。
同理,铜原子构成铜单质,化学式为Cu。
- 镁:Mg。
镁单质由镁原子组成,化学式为Mg。
2. 稀有气体单质- 稀有气体也是由原子直接构成的,其化学式也用元素符号表示。
例如:- 氦气:He。
氦气由氦原子组成,化学式为He。
- 氖气:Ne。
氖气分子就是氖原子,化学式为Ne。
- 氩气:Ar。
氩气由氩原子构成,化学式为Ar。
3. 部分固态非金属单质- 像碳、硅等固态非金属单质由原子直接构成,化学式用元素符号表示。
- 碳:C。
有金刚石、石墨等不同形态,但都是由碳原子构成,化学式为C。
- 硅:Si。
硅单质由硅原子组成,化学式为Si。
4. 气态非金属单质(除稀有气体外)- 一般是双原子分子,在元素符号右下角写上“2”。
- 氢气:H₂。
氢气分子由两个氢原子组成,所以化学式为H₂。
- 氧气:O₂。
氧气分子是由两个氧原子构成的,化学式为O₂。
- 氮气:N₂。
氮气分子由两个氮原子组成,化学式为N₂。
二、化合物化学式的书写1. 氧化物- 氧化物是由两种元素组成,其中一种是氧元素的化合物。
书写时,一般氧元素写在右边。
- 氧化镁:MgO。
镁元素显 + 2价,氧元素显 - 2价,根据化合物中正负化合价代数和为零的原则,化学式为MgO。
- 二氧化碳:CO₂。
碳元素显+4价,氧元素显 - 2价,为了使化合价代数和为零,一个碳原子和两个氧原子结合,化学式为CO₂。
- 四氧化三铁:Fe₃O₄。
其中铁元素有+2价和+3价两种价态,根据化合价规则得出其化学式为Fe₃O₄。
2. 酸- 酸是在水溶液中电离出的阳离子全部是氢离子(H⁺)的化合物。
- 盐酸:HCl。
盐酸在水中电离出H⁺和Cl⁻,化学式为HCl。
- 硫酸:H₂SO₄。
硫酸根离子(SO₄²⁻)显 - 2价,氢离子显+1价,为了使化合价代数和为零,需要两个氢离子,所以化学式为H₂SO₄。
化学式顺序

化学式顺序在化学式中,元素的顺序通常遵循一定的规则。
这些规则主要是基于元素的性质和在化合物中的作用。
以下是一些常见的化学式顺序规则:1.金属元素在前,非金属元素在后:在大多数无机化合物中,金属元素通常写在化学式的前面,而非金属元素写在后面。
例如,氯化钠(NaCl)中,钠(Na)是金属元素,氯(Cl)是非金属元素。
2.正价元素在前,负价元素在后:在离子化合物中,正价的离子(通常是金属元素或带正电荷的非金属元素)写在前面,负价的离子(通常是带负电荷的非金属元素)写在后面。
例如,硫酸铜(CuSO₄)中,铜(Cu)是正价元素,硫酸根(SO₄²⁻)是负价元素。
3.氢元素通常写在其他非金属元素的前面:例如,水(H₂O)中,氢(H)元素写在氧(O)元素的前面。
4.当有多种相同的元素时,通常按照它们在化合物中的比例顺序写出:例如,二氧化碳(CO₂)中,碳(C)和氧(O)的原子个数比为1:2,所以碳元素写在前面,氧元素写在后面,并且氧元素的右下角有一个数字2表示其原子个数。
在继续讲解化学式顺序的规则时,我们还可以提到以下几点:氧化物的书写顺序:对于氧化物,通常氧元素写在后面,而前面的元素按照金属活动性顺序排列。
金属活动性顺序是基于金属在水溶液里发生氧化反应的难易程度从易到难排列的。
例如,铝的氧化物是Al₂O₃,铁的氧化物可以是FeO(氧化亚铁)、Fe₂O₃(三氧化二铁)或Fe₃O₄(四氧化三铁),这里铁的氧化物中,铁元素的价态不同,但氧元素都写在后面。
酸、碱、盐的化学式书写:1.酸:氢元素通常写在前面,后面跟着酸根离子。
例如,硫酸(H₂SO₄)中,氢元素和硫酸根离子分别写在前面和后面。
2.碱:金属元素或铵根离子写在前面,氢氧根离子(OH⁻)写在后面。
例如,氢氧化钠(NaOH)中,钠元素和氢氧根离子分别写在前面和后面。
3.盐:金属元素或铵根离子写在前面,后面跟着酸根离子。
例如,氯化钠(NaCl)中,钠元素和氯离子分别写在前面和后面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学式书写 第 2 页 共 15 页 2010年10月27日 一、 化学式书写 1、化合物 阴离子 阳离子 OH- 氢氧根 NO3- 硝酸根 Cl- 氯离子 SO42- 硫酸根 CO32- 碳酸根 分 类 O2- 氧离子
H+ H2O HNO3、↑ HCl、↑ H2SO4 H2CO3、↑ → 酸 H2O 氢离子 水 硝酸 盐酸 硫酸 碳酸 水
NH4+ NH4·H2O↑ NH4NO3 NH4Cl (NH4)2SO4 (NH4)2CO3 ↓ 盐 _ 铵根离子 氨水 硝酸铵 氯化铵 硫酸铵 碳酸铵 _
K+ KOH KNO3 KCl K2SO4 K2CO3 K2O 钾离子 氢氧化钾 硝酸钾 氯化钾 硫酸钾 碳酸钾 氧化钾 第 3 页 共 15 页 2010年10月27日
Na+ NaOH NaNO3 NaCl Na2SO4 Na2CO3 Na2
O
钠离子 氢氧化钠 硝酸钠 氯化钠 硫酸钠 碳酸钠 氧化钠 Ba2+ Ba(OH)2 Ba(NO3)2 BaCl2 BaSO4↓ BaCO3↓ BaO
钡离子 氢氧化钡 硝酸钡 氯化钡 硫酸钡 碳酸钡 氧化钡 Ca2+ Ca(OH)2 Ca(NO3)2 CaCl2 CaSO4微 CaCO3↓ CaO
钙离子 氢氧化钙 硝酸钙 氯化钙 硫酸钙 碳酸钙 氧化钙 Mg2+ Mg(OH)2↓ Mg(NO3)2 MgCl2 MgSO4 MgCO3微 MgO
镁离子 氢氧化镁 硝酸镁 氯化镁 硫酸镁 碳酸镁 氧化镁 Mn2+ Mn(OH)2↓ Mn(NO3)2 MnCl2 MnSO4 MnCO3↓ MnO
锰氢氧硝酸氯硫酸碳酸氧 第 4 页 共 15 页 2010年10月27日
离子 化锰 锰 化锰 锰 锰 化锰 Zn2+ Zn(OH)2↓ Zn(NO3)2 ZnCl2 ZnSO4 ZnCO3↓ ZnO
锌离子 氢氧化锌 硝酸锌 氯化锌 硫酸锌 碳酸锌 氧化锌 Al3+ Al(OH)3↓ Al(NO3)3 AlCl3 Al2(SO4)3 _ Al2
O3
铝离子 氢氧化铝 硝酸铝 氯化铝 硫酸铝 _ 氧化铝 Cu2+ Cu(OH)2↓ Cu (NO3)2 CuCl2 CuSO4 CuCO3↓ CuO
铜离子 氢氧化铜 硝酸铜 氯化铜 硫酸铜 碳酸铜 氧化铜 Fe2+ Fe(OH)2↓ Fe(NO3)2 FeCl2 FeSO4 FeCO3↓ FeO
亚铁离子 氢氧化亚铁 硝酸亚铁 氯化亚铁 硫酸亚铁 碳酸亚铁 氧化亚铁 第 5 页 共 15 页 2010年10月27日
Fe3+ Fe(OH)3↓ Fe(NO3)3 FeCl3 Fe2(SO4)3 _ Fe2
O3
铁离子 氢氧化铁 硝酸铁 氯化铁 硫酸铁 _ 氧化铁 Ag+ _ AgNO3 AgCl ↓ Ag2SO4微 Ag2CO3↓ Ag2
O
银离子 _ 硝酸银 氯化银 硫酸银 碳酸银 氧化银 分类 碱 →盐 氧化物 (注:表中“↑”表示挥发性,“↓”表示不溶于水,“微”表示微溶于水,“_”表示物质不存在或遇到水就会分解了,其余的全是易溶于水。)
2 、金
属单质
K Ca Na Mg Al Zn Fe Sn 钾 钙 钠 镁 铝 锌 铁 锡 Pb Cu Hg Ag Pt Au Mn Ni 铅 铜 汞 银 铂 金 锰 镍 第 6 页 共 15 页 2010年10月27日
单质 非
金属单质
H2 O2 N2 F2 Cl2 Br2 I2 O3
氢气 氧气 氮气 氟气 氯气 溴 碘 臭
氧 P S C Si B
磷 硫 碳 硅 硼 稀有气体 He Ne Ar Kr Xe
氦 氖 氩 氪 氙
二、 化学方程式、反应现象、应用 1. 2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟 白色信号弹 2. 2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体 拉瓦锡实验 3. 4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体 4. 3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放出大量热 5. C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊 6. S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰 第 7 页 共 15 页 2010年10月27日
7. 2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 高能燃料 8. 4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量 9. CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 甲烷和天然气的燃烧 10. 2KClO3 MnO2 Δ 2KCl +3O2↑ 生成使带火星的木条复燃的气体 实验室制备氧气 11. 2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验室制备氧气 12. 2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体 拉瓦锡实验 13. 2H2O通电 2H2↑+O2↑ 水通电分解为氢气和氧气 电解水 14. Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 铜绿加热 第 8 页 共 15 页 2010年10月27日
15. NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体 碳酸氢铵长期暴露空气中会消失 16. Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气 17. Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解 18. Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解 19. 2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解 20. Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性 21. 2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、 22. H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸 第 9 页 共 15 页 2010年10月27日
23. CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验 24. 2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因 25. 2CO+O2点燃2CO2 蓝色火焰 煤气燃烧 26. C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属 27. 2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属 Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属 28. C + CO2 高温2CO 29. CO2 + H2O = H2CO3 碳酸使石蕊变红 证明碳酸的酸性 30. H2CO3 ΔCO2↑+ H2O 石蕊红色褪去 31. Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁 32. CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化 第 10 页 共 15 页 2010年10月27日
33. Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.钟乳石的形成 34. 2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头 35. CaCO3 高温 CaO+ CO2↑ 工业制备二氧化碳和生石灰 36. CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢 37. Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理 38. Na2CO3+2HCl=2NaCl+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理 39. CuO +CO Δ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体 冶炼金属 40. Fe2O3+3CO高温 2Fe+3CO2 冶炼金属原理
