基础化学第三版习题答案1-8章
武汉大学化学工程基础课后习题答案(第3版)

第一章 流体力学习题
1-1试将下列物理量换算成指定的单位 质量:1.5 kgf·s2/m =_______kg; 密度:13.6 g/cm3 =_______kg/m3; 压强:35 kgf/cm2 =_______Pa; 4.7atm =________Pa; 670mmHg =_______Pa; 功率:10马力=_______kW; 比热容:2 Btu/(Ib·℉) =______J/(kg·K); 3 kcal/(kg·℃) =_______ J/(kg·K); 流量:2.5 L/s =_______m3/h; 表面张力:70 dyn/cm =_______N/m; 5 kgf/m =_______N/m。
22pu2pu2pauapbubaabbz???z???habfz???z???ha?g2gb?g2gf?g2g?g2g2pplu2abppluab??z?z??ba??z?z???g?gbad2g?g?gd2g2dppab2dppabu?2g????z?zbau?2g????z?zl??g?gbal??g?gp?p?????gr???g?6abhgh2oh2op?p?????gr???g?6abhgh2oh2op?p????r???6hgh2oh2oab????r???6p?phgh2oh2oab???g?h2oh2o?g?h2oh2od????r???6hgh2oh2od????r???6u?2g??hgh2oh2o?6u?2g???6l??h2ol??h2o005?1?2g?005?0504?203m?s?1?2g?6?002?0504?203m?s6?002?225?203??005?100043p??0976kw1024根据静力学基本方程式
1-22用离心泵从井中抽水(如右图),吸水量为20m3/h,吸水管直径为φ108 mm×4 mm,吸水管路阻力损 失为4904 Pa,求泵入口处的真空度为多少?
基础化学第三版习题答案18章

(2) (18.7g·L-1NaC3H5O3)+(生理盐水)
(3) (12.5g·L—1NaHCO3)+(生理盐水)
试通过计算回答上述三种混合液就是等渗、低渗还就是高渗溶液?
解:
(1)
(2)
(3)
上述三种混合溶液得渗透浓度均在等渗溶液浓度范围之内,故都就是等渗溶液、
第三章电解质溶液与离子平衡
课后习题
1。
2。
化学式
HS—
HCO3-
CO32—
ClO-
OH—
H2O
NH3
[Cu(H2O)4]2+
性质
两性
两性
碱性
碱性
碱性
两性
两性
酸性
共轭酸
H2S
H2CO3
HCO3—
HClO
H2O
H3O3—
NH4+
共轭碱
S2-
CO32-
OH—
NH2—
[Cu(H2O)4OH]+
3.
(1) ;
解:
8、欲配制pH=5。00得缓冲溶液500mL,现有6mol·L-1得HAc34.0mL,问需加入NaAc·3H2O(M=136。1g·mol-1)多少克?如何配制?
解:(1)
m =49.38g
(2)加入水得体积
9、临床检验得知甲、乙、丙三人血浆中HCO3—与溶解得CO2浓度分别为:
甲[HCO3-]=24.0m mol·L-1[CO2]溶解=1、2m mol·L—1
n(Ca2+)== 5、0(mol)
(3)m(Na2CO3) = 0。10kgM(Na2CO3)= 53g·mol-1
邢其毅《基础有机化学》(第3版)(上册)配套题库【课后习题】第1章~第3章【圣才出品】

圣才电子书 十万种考研考证电子书、题库视频学习平台
(ii)哪些化合物分子中的原子都在一条直线上? (iii)哪些化合物分子中的原子处在两个相互垂直的平面中? (iv)哪些化合物分子中的碳原子都是 sp3 杂化轨道? 解:(i)乙炔、乙烯、苯分子中的原子都在同一平面中。 (ii)乙炔分子中的原子都在同一直线上。 (iii)丙二烯分子中的原子处在两个相互垂直的平面中。 (iv)甲烷、环己烷分子中的原子都是 sp3 杂化。
;极性化合物为:
;非极性化合
物为:
。
习题 1-6 结合教材(P18)表 1-3 中的数据回答下列问题:
(i)甲烷、乙烯、乙炔中的C—H键键长为什么不同?
(ii)乙烷、乙烯、乙炔中碳碳键键长为什么不同?
(iii)卤甲烷中的碳卤键的键长为什么不同?
解:(i)甲烷、乙烯、乙炔中,碳原子的杂化方式不同,甲烷中碳为 sp3 杂化,乙烯中
习题 1-8 将下列各组化合物按键解离能(只考虑下划线的键)由大到小排列成序。 (i)
(ii) (iii)
解:参考教材表(P19)1-5 中的一些常见键的解离能,可知:
(i)
>
>
>
>
5 / 76
圣才电子书 十万种考研考证电子书、题库视频学习平台
>
>
>
(ii)
>
>
>
(iii) > >
>
>
>
>
>
>
习题 1-9 按酸碱的质子论,下列化合物哪些为酸?哪些为碱?哪些既能为酸,又能为 碱?
HI NH2OH SO42- H2O HCO3- NH4+ HClO4 HS- I- CN- 解:根据酸碱质子论,酸是质子的给予体,碱是质子的接受体。根据该理论,所以:
基础化学习题解答(第一章)

习题解答(第一章物质结构基础)思考与习题1.填空题(1)原子核外电子运动具有波粒二象性、能量变化不连续的特征,其运动规律可用量子力学来描述。
(2)当主量子数为3时,包含有3s 、3p 、3d 三个亚层,各亚层为分别包含 1 、 3 、 5 个轨道,分别能容纳 2 、 6 、10 个电子。
(3)同时用n、l、m和m s四个量子数可表示原子核外某电子的运动状态;用n、l、m 三个量子数表示核外电子运动的一个轨道;而n、l两个量子数确定原子轨道的能级。
(4)改错的现象称为能级交错。
3d4S(6)原子序数为35的元素,其基态原子的核外电子分布式为1s22s22p63s23p63d104s24p5,用原子实表示为[Ar]3d104s24p5,其价电子构型为4s24p5,价电子构型的轨道表示式为;该元素位于元素周期表的第ⅦA 族,第四周期,元素符号是Br 。
(7)等价轨道处于全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空(p0、d0、f0)状态时,具有较低的能量,比较稳定。
这一规律通常又称为洪德规则的特例。
(8)原子间通过共用电子对而形成的化学键,叫做共价键。
共价键的本质是原子轨道的重叠,其形成条件是两个具有自旋相反单电子的原子轨道,尽可能达到最大重叠。
(9)表征化学键性质的物理量,统称为键参数,常用的有键能、键长、键角。
(10)H2S分子的构型为V 形,中心原子S采取sp3不等性杂化,键角∠HSH<109°28′(提示:填写>,=或<)。
(11)完成下表2.选择题(1)下列原子轨道中,属于等价轨道的一组是( C )。
A .2s ,3sB .2p x ,3p xC .2p x ,2p yD .3d xy ,4d xy(2)下列用一套量子数表示的电子运动状态中,能量最高的是( B )。
A .4,1,-1,-12B .4,2,0,-12C .4,0,0,+12D .3,1,1,+12(3)下列不存在的能级是( C )。
《基础化学》课后习题参考答案(无机部分)
⑵
-2
⑶
-4
⑺ 1.1×10
1
⑻ 5.0×10-15
+
5.0×10
6.3×10
1.8×10
-5
1.1×10
-11
6.3×10
-8
1.0
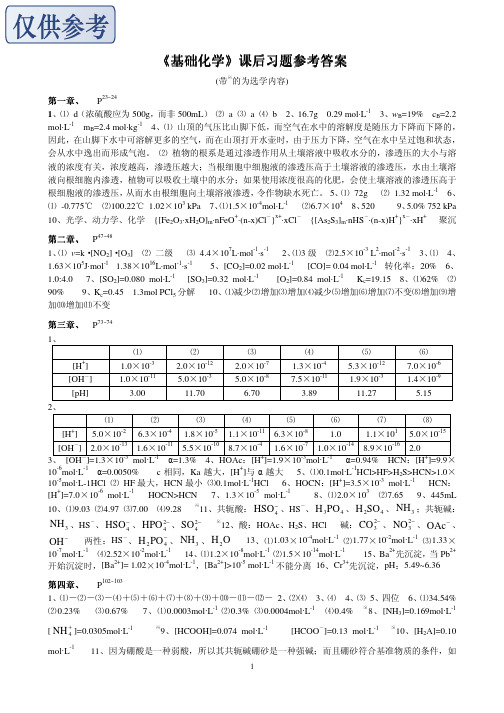
[OH ] 2.0×10-13 1.6×10-11 5.5×10-10 8.7×10-4 1.6×10-7 1.0×10-14 8.9×10-16 2.0 3、 [OH-]=1.3×10-3 mol·L-1 α=1.3% 4、HOAc:[H+]=1.9×10-3mol·L-1 α=0.94% HCN:[H+]=9.9× -6 -1 + 10 mol·L α=0.0050% c 相同,Ka 越大,[H ]与 α 越大 5、⑴0.1mol·L-1HCl>HF>H2S>HCN>1.0× 10-5mol·L-1HCl ⑵ HF 最大,HCN 最小 ⑶0.1mol·L-1HCl 6、HOCN:[H+]=3.5×10-3 mol·L-1 HCN: + -6 -1 -5 -1 3 [H ]=7.0×10 mol·L HOCN>HCN 7、1.3×10 mol·L 8、⑴2.0×10 ⑵7.65 9、445mL 10、⑴9.03 ⑵4.97 ⑶7.00 ⑷9.28
2
1 ⑷m = 0 2
5、 n ≥ 3 、 l = 0,1 、 l = 0 、 m = 0 、 m s = ±
2
1 2
2s
n 2 2
m 0 0
ms +1/2 -1/2
2p3
※
2 2 2
1 1 1
0 +1 -1
+1/2 +1/2 +1/2
化学基础第三版课后答案

化学基础第三版课后答案【篇一:1现代基础化学(第二版) 课后答案(第三版也可用) 化学工业出版社】44-46 1. e = -b/n2 (b= 2.18? 10-18 j?e = -b/52 + b/22 = 4.58 ? 10-19 j hv = ?e, ?? = c ? = c ? h ? ?e= 434 nm 3.①②不存在;③④存在4.ni 3s2 3p6 3d8 4s2的四个量子数是:3s2: n= 3, l=0, m=0, ms = +1/2; n= 3 , l=0, m=0, ms = -1/23p6: n= 3, l=1, m=-1, ms = +1/2; n= 3, 1=1, m=-1, ms = -1/2; n= 3, 1=1, m=0, ms = +1/2n= 3, 1=1, m=0, ms = -1/2; n= 3, 1=1, m=1, ms = +1/2; n= 3, 1=1, m=1, ms = -1/2 3d8: n= 3, 1=2, m=-2, ms = +1/2; n= 3, 1=2, m=-2, ms = -1/2; n= 3, 1=2, m=-1, ms = +1/2n= 3, 1=2, m=-1, ms = -1/2; n= 3, 1=2, m=0, ms = +1/2; n= 3, 1=2, m=0, ms = -1/2 n= 3, 1=2, m=1, ms = +1/2; n= 3, 1=2, m=2, ms =+1/2 4s2: n= 4, 1=0, m=0, ms = +1/2; n= 4, 1=0, m=0, ms = -1/25.① 3d ②4f ③2s ④3d ⑤1s ⑥3p; 结果:⑤③⑥① = ④②6.①n=4;②l=1;③m=0;④ms=1/2 或-1/2 7.8.① n3;3d ②l = 1;2p ③m= -1 /0/+1; 3p ④ ms = +1/2 或-1/2,4s 9.48cd 4s24p64d105s2. 10.①有三个19k;24cr;29cu②均第四周期, k: s区,,ia族;cr: d区vib族;cu: ds区ib族11.(1) ar: 1s22s22p63s23p6 (2)fe: 1s22s22p63s23p64s23d6 (3) i:1s22s22p63s23p63d104s24p64d105s25p5 ; (4) ag:1s22s22p63s23p63d104s24p64d105s112.①(1)ca: s区, 第四周期,iia族;(2) cl: p区,第三周期,viia; 1(3) ti: d区,第四周期,ivb;(4) hg: ds区, 第六周期, iib族② ca:+2,cl: +7,ti: +4,hg: +2 ③ (1)(3)(4)(2) 13.铁原子3d64s2;26fe14.48;[kr]4d105s2, iib族;48cd15.甲:3s23p5,viia,非金属,电负性高;乙:3d24s2,ivb,金属,电负性低。
基础化学习题解答(8)

习题解答(第八章)一、选择题1. 下列反应中,属于氧化还原反应的是( C )A.硫酸与氢氧化钡溶液的反应B.石灰石与稀盐酸的反应C.二氧化锰与浓盐酸在加热条件下反应D.醋酸钠的水解反应2. 单质A和单质B化合成AB(其中A显正价),下列说法正确的是( C )A. B被氧化B. A是氧化剂C. A发生氧化反应D. B具有还原性3. 对于原电池的电极名称,叙述中有错误的是( B )A.电子流入的一极为正极B.发生氧化反应的一极是正极C.电子流出的一极为负极D.比较不活泼的金属构成的一极为正极4. 根据下列反应:2FeCl3+Cu→2FeCl2+CuCl22Fe3++Fe→3Fe2+2KMnO4+10FeSO4+8H2SO4→2MnSO4+5Fe2(SO4)3+K2SO4+8H2O 判断电极电势最大的电对为( C )A.Fe3+/Fe2+B.Cu2+/CuC.MnO4-/Mn2+D.Fe2+/Feϕ5. 在含有Cl-,Br-,I-离子的混合溶液中,欲使I-氧化成I2,而Br-,Cl-不被氧化,根据φ值大小,应选择下列氧化剂中的( B )A.KMnO4B.K2Cr2O7C.(NH4)2S2O8D.FeCl36. 在酸性溶液中和标准状态下,下列各组离子可以共存的是( D )A.MnO4- 和Cl-B.Fe3+ 和Sn2+C.NO3- 和Fe2+D.I- 和Sn4+7. 利用标准电极电势表判断氧化反应进行的方向,正确的说法是( B )A.氧化态物质与还原态物质起反应;ϕ较大电对的氧化态物质与φϕ较小电对的还原态物质起反应;B. φC.氧化性强的物质与氧化性弱的物质起反应;D.还原性强的物质屯还原性弱的物质起反应。
二、是非题(下列叙述中对的打“√”,错的打“×”)1. MnO4-离子中,Mn和O的化合价分别为+8和-2。
( ×)2. 根据标准电极电势判定SnCl2 + HgCl2 =SnCl4 + Hg反应能自发向右进行。
基础化学第三版习题解答

基础化学(第3版) 思考题和练习题解析第一章 绪 论1. 为什么说化学和医学的关系密切,医学专业学生必须学好化学? 答:(略)2. “1 mol 硫酸的质量是98.0g ”,对吗?答:错误!未指明基本单元,正确说法是1 mol H 2SO 4的质量是98.0g 或1 mol [(1/2) (H 2SO 4)]的质量是49.0g 。
3. 0.4 mol H 2SO 4溶解于水,配成500 m L 溶液,其浓度表示正确的是 A. c (H 2SO 4) = 0.8 mol·L -1B. c [21(H 2SO 4)] = 0.8 mol·L -1C. c [21(H 2SO 4) ]= 0.4 mol·L -1 D. 硫酸的浓度为0.8 mol·L -1 答;正确的是A 。
根据定义,1L 溶液中含有0.8 mol H 2SO 4,c (H 2SO 4) = 0.8 mol·L -1。
4. 下列说法正确的是A. “1 mol O ”可以说成“1 mol 原子O ”B. 1摩尔碳C 原子等于12gC. 1 L 溶液中含有H 2SO 4 98 g ,该溶液的摩尔浓度是1 mol·L -1D. 基本单元不仅可以是构成物质的任何自然存在的粒子或粒子的组合,也可以是想象的或根据需要假设的种种粒子或其分割与组合答:正确的是D 。
A 应说成“1 mol 氧原子”;B 应为“1摩尔碳C 原子的质量等于12g ”; C 不应该使用“摩尔浓度”,此术语已被废除。
5. 求0.100kg (21Ca 2+)的物质的量。
解:M (21Ca 2+) =(40.08 / 2)= 20.04 (g · mol -1), n (21Ca 2+) = [ m / M (21Ca 2+) ] = (0.100×103)/20.04 = 4.99 (mol) 6. 每100m L 血浆含K +为20mg ,计算K +的物质的量浓度,单位用mmol·L -1表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
习 题 答 案 第一章 绪论 1、求0.010kgNaOH、0.100kg(21Ca2+)、0.10kg(21Na2CO3)的物质的量。 解:(1)m(NaOH) = 0.010kg M(NaOH) = 40g·mol-1 n(NaOH) = 4010 = 0.25 (mol) (2)m(21Ca2+) = 0.100kg M(21Ca2+) = 40g·mol-1
n(21Ca2+) = 20100 = 5.0(mol) (3)m(21Na2CO3) = 0.10kg M(2
1
Na2CO3) = 53g·mol-1
n(Na2CO3) = 53100 = 1.89 (mol) 2、下列数值各有几位有效数字? (1)1.026 4位 (2)0.0208 3位 (3)0.003 1位 (4)23.40 4位 (5)3000 无数位 (6)1.0×10-3 2位 3、应用有效数字计算规则,计算下列各式: (1)21.10 - 0.263 + 2.3 = 23.1 (2)3.20×23.45×8.912 = 667
(3)31026.117.2322.3
= 5.93×10-3 (4)15.2325.21032.44.524.6×10-2
4、(1) 以H2SO4为基本单元,M(H2SO4)=98g/mol; (2) 以HSO4-为基本单元,M(HSO4-)=97g/mol; (3) 以3H2SO4为基本单元,M(3H2SO4)=294g/mol。 5、答:甲的报告更为合理,百分比小数点后保留两位有效数字。 第二章 溶液与胶体 1、在25oC时,质量分数为0.0947的稀硫酸溶液的密度为1.06g·L-1,在该温度下纯水的密度为0.997 g·L-1。计算H2SO4的物质的量分数、物质的量浓度和质量摩尔浓度。 解:设取稀硫酸溶液1L,则
n(H2SO4) = 980947.0100006.1 = 1.02 (mol) n(H2O) = 18)0947.01(100006.1 = 53.31(mol)
c(H2SO4) = Vn)SOH(42 = 1.02 (mol·l-1) x(H2SO4) = )OH()SOH()SOH(24242nnn =31.5302.102.1= 0.0188
b(H2SO4) = )OH()SOH(242mn =)0947.01(06.1100002.1= 0.106(mol·kg-1) 2、醚的正常沸点为34.5℃,在40℃时往100g乙醚中至少加入多少摩尔不挥发溶质才能防止乙醚沸腾? 解: Bbb•=ΔbKT
0.12.0234.5)-(40n n = 0.22mol 3、苯的凝固点为5.50℃, Kf = 5.12 K·kg·mol-1。现测得1.00g单质砷溶于86.0g苯所得溶液的凝固点为5.30℃,通过计算推算砷在苯中的分子式。
解:g/mol7.2971086)3.55.5(112.53fABfB•TmmKM
4757.297AsBMMn 4、有两种溶液在同一温度时结冰,已知其中一种溶液为1.5g尿素[CO(NH2)2]溶于200g水中,另一种溶液为4.28g某未知物溶于100g水中,求该未知物 的摩尔质量(尿素的摩尔质量为60g·mol-1)。 解:由BffbKT•可得两种溶液的质量摩尔浓度相等。
122kgmol125.0200.0605.1))CO(NH(•b
1kgmol125.0100.028.4•Mb
M=342.4 g·mol-1 5、测得泪水的凝固点为 - 0.52℃,求泪水的渗透浓度及在310 K时的渗透压力。 解:BffbkT• 0.52 = 1.86×Bb
稀水溶液中BBbc mol28.0Bc KPaRTcB7.721310314.828.0 6、排出下列稀溶液在310 K时,渗透压力由大到小的顺序 (1) c(C6H12O6) = 0.20mol·L-1 (2) c(NaCl) = 0.20mol·L-1 (3) c(Na2CO3) = 0.20mol·L-1 解:(1) Cos = c(C6H12O6) = 0.20mol·L-1 (2) Cos = ic(NaCl) = 2×0.20 = 0.40mol·L-1 (3) Cos = ic(Na2CO3) = 3×0.20 = 0.6mol·L-1 渗透压大小:(3)>(2)>(1) 7、生理盐水、50g·L-1的葡萄糖(C6H12O6)溶液、12.5g·L-1的碳酸氢钠(NaHCO3)溶液和18.7g·L-1的乳酸钠(NaC3H5O3)溶液均为临床上常用的等渗溶液。现取其体积,按下列配方配成三种混合液: (1) 21(50g·L-1C6H12O6) +21(生理盐水) (2) 31(18.7g·L-1NaC3H5O3) +32(生理盐水) (3) 31(12.5g·L-1NaHCO3) +32(生理盐水) 试通过计算回答上述三种混合液是等渗、低渗还是高渗溶液? 解: 16126Lmol278.018050 )OHCos(C • 1353Lmol333.01127.182 )OHCos(NaC •
13Lmol298.0845.122 )Cos(NaHCO •
1Lmol308.05.580.92 Cos(NaCl) •
(1) 1-6126L293mmol2Vc(NaCl)2V)OHC( Cos•c (2) 1-353Lmmol7.1633V2Vc(NaCl)2V)OHNaC(2 Cos•c (3) 1-Lmmol5.3043V2Vc(NaCl)2VNaHCO3)(2 Cos•c 上述三种混合溶液的渗透浓度均在等渗溶液浓度范围之内,故都是等渗溶液。 8、将1.01g胰岛素溶于适量水中配制成100ml溶液,测得298K时该溶液的渗透压力为4.34kPa,试问该胰岛素的摩尔质量为多少?
解:RTVMmRTcBBB 298314.81010001.134.43BM
mol/kg5766BM
9、什么是分散系?根据分散相粒子的大小,液体分散系可分为哪几种类型? 答:由一种或几种物质以较小的颗粒分散在另一种物质中所形成的系统,这种系统称为分散系统,简称分散系(dispersed system)。 液体分散系按其分散相直径的大小不同可分为真溶液、胶体分散系和粗分散系三类。(1-100nm) 10、0.05 mol·L-1的KBr溶液50ml和0.01 mol·L-1的AgNO3溶液30ml混合以制备AgBr溶胶,试写出此溶胶的胶团结构式,并比较下述电解质溶液AlCl3、MgSO4、K3[Fe(CN)6]对此溶胶的聚沉能力。
解:mol105.2050.005.03KBrn
mol100.3030.001.04AgNO3n KBr过量,故溶胶是负溶胶。 胶团结构:[(AgBr)m·nBr -·(n-x)K+]x-·xK+ 聚沉能力:AlCl3>MgSO4>K3[Fe(CN)6] 11、什么是凝胶?产生凝胶的条件有哪些? 答:大分子溶液(明胶、琼脂等)或某些溶胶(H2SiO3溶胶、Al(OH)3溶胶)在适当条件下形成外观均匀并具有一定形状的弹性半固体。这种半固体称为凝胶。 产生凝胶的条件:①浓度达到一定程度;②温度低到一定程度;③加入少量的电解质。 12、溶胶具有稳定性的原因有哪些?用什么方法可破坏其稳定性。 答:溶胶相对稳定的原因有如下方面:(1)动力学稳定性 (2)胶粒表面水化层的保护作用(3)胶粒的带电。 引起溶胶聚沉的因素很多,例如加入电解质、溶胶的相互作用、加热、溶胶的浓度等。 第三章 电解质溶液与离子平衡 课后习题 1. 221iizbI60.0)31.01310.0(2122I
2. 化学式 HS- HCO3- CO32- ClO- OH- H2O NH3 [Cu(H2O)4]2+ 性 质 两性 两性 碱性 碱性 碱性 两性 两性 酸性 共轭酸 H2S H2CO3 HCO3- HClO H2O H3O3- NH4+ 共轭碱 S2- CO32- OH- NH2- [Cu(H2O)4OH] + 3. (1) 1610100.710.0109.4][HLmolcKa;07.5100.7lg]Hlg[6pH
(2) 131014a-10429.110.0109.410][OHLmolcKKcKwb;15.1110429.1lg14]OHlg[143pH (3) 16514a10333.3020.0108.110][HLmolcKKcKbw;48.510333.3lg]Hlg[6pH。
(4)102.010005001717.0-LmolVMmc;
145-100.602.0108.1][OHLmolcK
b;
78.01100.6lg14]OHlg[144pH 4.
