exosomes外泌体实验方案
一个试剂盒搞定外泌体研究:磁珠法纯化,流式分析
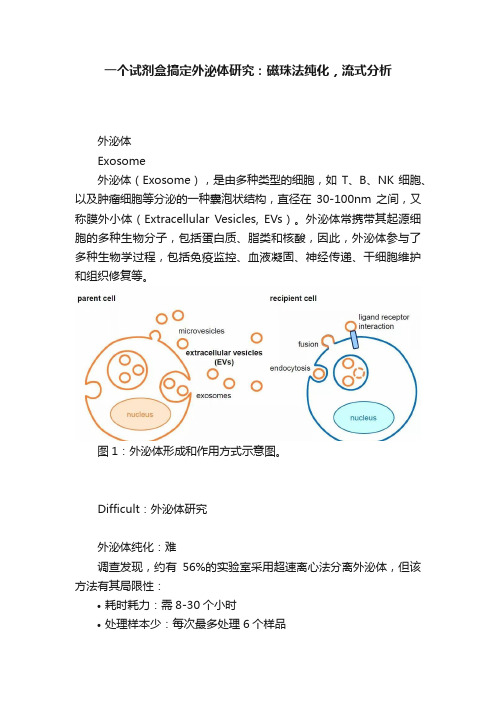
一个试剂盒搞定外泌体研究:磁珠法纯化,流式分析外泌体Exosome外泌体(Exosome),是由多种类型的细胞,如T、B、NK细胞、以及肿瘤细胞等分泌的一种囊泡状结构,直径在30-100nm之间,又称膜外小体(Extracellular Vesicles, EVs)。
外泌体常携带其起源细胞的多种生物分子,包括蛋白质、脂类和核酸,因此,外泌体参与了多种生物学过程,包括免疫监控、血液凝固、神经传递、干细胞维护和组织修复等。
图1:外泌体形成和作用方式示意图。
Difficult:外泌体研究外泌体纯化:难调查发现,约有56%的实验室采用超速离心法分离外泌体,但该方法有其局限性:•耗时耗力:需8-30个小时•处理样本少:每次最多处理6个样品•需要大量的起始材料•产量不高外泌体分析:难由于外泌体体积小(直径30-100nm),流式检测也是一大难题。
图2:由于外泌体体积小,很难用流式检测到单个的外泌体。
检测到的颗粒更像是外泌体群或聚集体。
遇到困难不用怕,超人小旎来帮忙!美天旎为外泌体研究而专门研发了相应的试剂盒,Exosome isolation kit和MACSPlex Exosome Kit,分别用于外泌体的富集和分析。
外泌体磁珠纯化基于美天旎的MACS技术,利用外泌体表面常见的四次跨膜蛋白CD9、CD63和CD81,分别研发了四款磁珠试剂盒,用于阳性分选外泌体,简单三步(磁珠孵育、磁场分离、洗脱,如图3),省时省力,无需进行超速离心,且样本体积最小可至0.5mL。
图3:利用美天旎Exosome isolation kit,简单三步(磁珠孵育、磁场分离、洗脱),1.5h内完成外泌体的纯化。
外泌体流式分析分析外泌体蛋白的传统方法有western blot、质谱分析、扫描电镜和流式分析。
由于外泌体的直径太小(30-100nm),很难通过标准的流式检测方法对其进行分析。
为此,美天旎研发了MACSPlex Exosome Kit, human(#130-108-813)试剂盒,用于简单、快速的分析外泌体表面37种潜在蛋白。
外泌体研究概述Exosome

案例2
Exosome-Mediated miR-155 Transfer from Smooth Muscle Cells to Endothelial Cells Induces Endothelial Injuryr Therapy (2017)
1. 外泌体概述
2. 外泌体分离方法
(1)超速离心:
2000 g for 20 min to eliminate dead cells; 10,000 g for 30 min to remove debris; filtrated though 0.22 μm filter; 100,000 g for 70 min.
密度梯度超速离心:
蔗糖、碘克沙醇 1.15-1.19 g / mL
案例1
Adipose Tissue Macrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro Insulin Sensitivity, Cell (2017)
/
EXOCARTA
/
VESICLEPEDIA
/
EVPEDIA
HTTP://STUDENT4.POSTECH.AC.KR/EVPEDIA2_XE/XE/
外泌体研究概述
exosome
| 1. 外泌体概述 | 2. 外泌体分离方法 | 3. 外泌体检测方法 | 4. 外泌体常用数据库
外泌体是细胞向胞外分泌的囊泡类小体,具有脂质双层膜结构, 可存在于细胞培养上清液、血浆、血清、唾液、尿液、羊水和恶 性腹水以及其它生物体液中。
外泌体携带特异性的蛋白质、脂质以及功能性的 mRNA、 ncRNA等生物活性物质,在体内参与细胞通讯、细胞迁移、促 血管新生和抗肿瘤免疫等生理过程,与多种疾病的发生和进程密 切相关。由于外泌体的特殊结构和功能, 使得它具有潜在的应用 价值,一方面可以作为诊断多种疾病的生物指标,另一方面也可 以作为治疗手段,未来有可能作为药物的天然载体用于临床治疗。
细胞培养基的Exosome提取方案

细胞培养基上清提取外泌体外泌体产生细胞(Exosome源细胞)的选取:293T细胞:常用于基因改造外泌体;Mouse immature dendritic cells(imDCs):小鼠未成熟的树突细胞,常用于小鼠in vivo 体内反应使用,产生的外泌体引起的免疫反应极小;Mouse lymphoma cell line(EL-4):小鼠淋巴细胞;各类癌细胞系:常用于研究各个癌产生的外泌体本身特性研究:……不同实验的需求不同, Exosome源细胞的细胞选择不同,例如:需要基因改造就选择较容易感染的293T,体内实验就要避免机体的免疫反应,要充分了解实验要求和各个细胞系背景。
Exosome源细胞用量:以293T为例,2个15cm盘=4.5个10cm 盘=4*107 cells,最终的Exosome 20ul/20ul 可用于体内原位癌3*104/1ul注射给药,15ul/50ul 可用于105 受体细胞培养加药。
P S: 王红阳方法1ug Exosome=5*106 cells,原位癌注射用量5ug,105细胞培养用量1ug。
我约莫算了一下,差不多。
楼上的方法不要定量,更简单方便,以楼上为主。
以293T细胞为例制备Exosome:1.2盘10cm 盘在60-70%进行病毒感染,1盘感染GFP(control病毒),1盘感染plv-cs2.0-myc-PD1,病毒感染后16-18h后换液;2.36-48h后进行传代:准备10盘10cm盘,每盘加入15ml Exosome-free的10%血清的DMEM,放入37°C培养箱备用。
取出2感染好的2盘细胞,迅速用5ml PBS/遍洗涤3遍,加入1ml胰酶,摇匀使每个细胞都孵育胰酶,37°C静置消化1min,加入4ml Exosome-free 的10%血清的DMEM静置,获得5ml细胞悬液,加入到准备好的10盘10cm盘中,获得5盘GFP、5盘plv-cs2.0-myc-PD1稳转293T 细胞系,37°C培养48h;3.取4根灭菌处理过的50ml管,收集细胞培养基,分装成37.5ml GFP、plv-cs2.0-myc-PD1各两管,进行三步法离心:✓4°C离心200-300g,5min去细胞,分别小心吸取上清34ml入新的灭菌50ml 管;✓4°C离心12,000-16,000g,45min去碎片,分别吸取31ml上清入新的灭菌50ml 管,0.22um滤膜(Millipore)过滤,最后62ml左右汇入一管Beckman快速密封管Beckman Quick seal tubes;✓Beckman 70Ti 转子4°C超离100,000-110,000g,90-120min,弃上清,用50ul PBS重悬exoxome。
外泌体检测丨流式细胞术分析

外泌体检测丨流式细胞术分析传统的外泌体研究,基本都是用WB之类来检测和表征外泌体,比如用SDS-PAGE电泳可分析Exosome中蛋白的大致含量及种类(通过条带的位置和条带的粗细);2-DE等蛋白组学分析可以知道Exosome中不同蛋白的表达和数量等情况;透射电镜可分析Exosome的大小和形态等,如果想要知道表达部位在哪,就可以结合免疫标记实验进行定位,通过定量PCR可以分析所研究的指标的表达量等。
那么今天就来说说,用于流式细胞仪检测外泌体的强大试剂——Exostep。
Exostep外泌体检测试剂盒是一种简单的免疫珠检测外泌体的方法,使用的是与珠子结合的捕获抗体和与荧光染料偶联的检测抗体。
Exostep外泌体检测试剂盒可提供可重复的结果,可与外泌体免疫免疫分型同时进行。
Immunostep ExoStep用于从生物液体(血浆,血清,尿液)或细胞培养基中预富集的人类(也有动物哟)外泌体的流式细胞术分析。
一起来看看它的特点吧~1.需要的样品量非常少;可重复性;灵敏度更高;动态范围更广;明确的检测;定量分析;直接检测细胞培养上清液和生物液中的外泌体;无需分离或沉淀;允许外泌体捕获细胞群的同时进行免疫表型分析2.操作步骤简易(如下:)预富集外泌体——50ul外泌体悬浮液+50ul捕获磁珠——常温过夜孵育——加入1x Assay Buffer 1ml ——加入5ul 检测抗体孵育——加入1x Assay Buffer 1ml ——加入1x Assay Buffer 350ul——洗完后就获得了需要的外泌体——上机检测。
怎么样,是不是很简单,很清晰,很明了?3.有适用各种样本的试剂盒产品,适用的样本有细胞培养样品、血浆、尿液等。
4.可单独提供高效能的外泌体捕获磁珠从一种细胞类型中纯化特定的外泌体或外泌体亚群表征仍然是一个挑战。
Immunostep的人类捕获珠,无需事先进行样品富集程序,就可以从生物体液(血清,血浆,CSF,唾液,尿液等)中分离出特定的外泌体。
Exosome 外泌体
蔗糖、碘克沙醇 1.15-1.19 g / mL
案例1
Adipose Tissue Macrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro Insulin Sensitivity, Cell (2017)
案例2
Exosome-Mediated miR-155 Transfer from Smooth Muscle Cells to Endothelial Cells Induces Endothelial Injury and Promotes Atherosclerosis, Molecular Therapy (2017)
(2)超滤:
Vivaspin 20,100 kDa MWCO (GE Life sciences)
Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney international(2012).
Non-coding RNA 2017, 3, 10; doi:10.3390/ncrna3010010
1. 外泌体概述
2. 外泌体分离方法
(1)超速离心:
2000 g for 20 min to eliminate dead cells; 10,000 g for 30 min to remove debris; filtrated though 0.22 μm filter; 100,000 g for 70 min.
外泌体 Exosome
Exosome简介,提取,分析(全)一,Exosome简介最近几年,一种叫做Exosome的小囊泡正受到大家广泛的关注。
Exosome 是直径约为30-150nm,密度在1.13-1.21g/m1的小囊泡。
Exosome天然存在于体液中,包括血液、唾液、尿液和母乳,外泌体(Exosome)是活细胞分泌的来源于晚期核内体(也称为多囊泡体)的膜性囊泡。
Exosome在30年前被人们所发现。
早期的研究认为,exosome执行蛋白运输功能,特异靶定受体细胞,交换蛋白和脂类或引发下游信号事件。
直到2007年,研究人员发现exosome也运输核酸,参与细胞间通讯。
总之,其蛋白、RNA 和脂肪成分特异,且携带了一些重要的信号分子,有望在多种疾病的早期诊断中发挥作用,这使得exosome的市场也在快速扩展,并成为热门的研究对象。
不同组织细胞来源exosome由于携带的蛋白质不同,而能够发挥不同的生物学功能。
例如,肿瘤细胞分泌的exosome能够介导血管再生肿瘤细胞增殖及免疫逃逸;而树突状细胞源性exosome则能够引起机体有效的抗肿瘤免疫应答。
目前研究发现,Exosome内含有与细胞来源相关的蛋白质rRNA和microRNA,并且exosome 能够通过生物屏障,在细胞间传递功能性核酸分子,从而发挥各种生物学功能,故exosome有望成为一种新型给药途径及基因治疗载体。
Exosome携带蛋白质包括源细胞非特异性和源细胞特异性两类蛋白分子。
前者可能与exosome的生物发生和生物学作用有关,主要包括:细胞溶质蛋白、参与细胞内信号转导的蛋白、各种代谢酶、热休克蛋白和四跨膜蛋白;另一类是特殊蛋白质,这类蛋白质只存在于某种特殊的细胞分泌的exosome,而这些特定细胞源的exosome与其生物学功能有着密切联系,例如分子来源的Exosome上含有MHCII类分子。
二,Exosome提取Exosome是由活细胞分泌的,它是一种亚细胞成分,组要成分是磷脂双分子和携带的膜性分子,其界定依据形态学和生物化学及提取方式不同细胞源的exosome是不同的,这些不同的理化性质有利于exosome的提取。
外泌体(Exosome)知识与检测方法

外泌体(Exosome)知识与检测⽅法⼀、 Exosome 简介最近⼏年,⼀种叫做Exosome的⼩囊泡正受到⼤家⼴泛的关注。
Exosome是直径约为30-150nm,密度在1.13-1.21g/m1的⼩囊泡。
Exosome天然存在于体液中,包括⾎液、唾液、尿液和母乳,外泌体(Exosome)是活细胞分泌的来源于晚期核内体(也称为多囊泡体 )的膜性囊泡。
Exosome在30年前被⼈们所发现。
早期的研究认为,exosome执⾏蛋⽩运输功能,特异靶定受体细胞,交换蛋⽩和脂类或引发下游信号事件。
直到2007年,研究⼈员发现exosome也运输核酸,参与细胞间通讯。
总之,其蛋⽩、RNA和脂肪成分特异,且携带了⼀些重要的信号分⼦,有望在多种疾病的早期诊断中发挥作⽤,这使得exosome的市场也在快速扩展,并成为热门的研究对象。
不同组织细胞来源exosome由于携带的蛋⽩质不同,⽽能够发挥不同的⽣物学功能。
例如,肿瘤细胞分泌的exosome能够介导⾎管再⽣肿瘤细胞增殖及免疫逃逸;⽽树突状细胞源性exosome则能够引起机体有效的抗肿瘤免疫应答。
⽬前研究发现,Exosome内含有与细胞来源相关的蛋⽩质rRNA和microRNA,并且exosome能够通过⽣物屏障,在细胞间传递功能性核酸分⼦,从⽽发挥各种⽣物学功能,故exosome有望成为⼀种新型给药途径及基因治疗载体。
Exosome携带蛋⽩质包括源细胞⾮特异性和源细胞特异性两类蛋⽩分⼦。
前者可能与exosome的⽣物发⽣和⽣物学作⽤有关,主要包括:细胞溶质蛋⽩、参与细胞内信号转导的蛋⽩、各种代谢酶、热休克蛋⽩和四跨膜蛋⽩;另⼀类是特殊蛋⽩质,这类蛋⽩质只存在于某种特殊的细胞分泌的exosome,⽽这些特定细胞源的exosome与其⽣物学功能有着密切联系,例如分⼦来源的Exosome上含有MHCII类分⼦。
⼆, Exosome 提取Exosome是由活细胞分泌的,它是⼀种亚细胞成分,组要成分是磷脂双分⼦和携带的膜性分⼦,其界定依据形态学和⽣物化学及提取⽅式不同细胞源的exosome是不同的,这些不同的理化性质有利于exosome的提取。
人骨髓来源间充质干细胞分泌外泌体特性研究

人骨髓来源间充质干细胞分泌外泌体特性研究一、本文概述Overview of this article随着生物医学领域的快速发展,干细胞及其分泌产物的研究已成为当前生命科学领域的热点之一。
人骨髓来源间充质干细胞(hMSCs)作为一种具有多向分化潜能的成体干细胞,其在组织工程、再生医学以及疾病治疗等领域的应用潜力备受关注。
近年来,随着对外泌体(Exosomes)研究的深入,人们发现hMSCs分泌的外泌体在细胞间的信息传递、免疫调节以及组织修复等方面发挥着重要作用。
因此,本文旨在深入研究人骨髓来源间充质干细胞分泌外泌体的特性,以期为hMSCs在医学领域的临床应用提供新的思路和方法。
With the rapid development of the biomedical field, research on stem cells and their secreted products has become one of the hotspots in the current field of life sciences. Human bone marrow-derived mesenchymal stem cells (hMSCs), as an adult stem cell with multi-directional differentiation potential, have attracted much attention for their potential applications in tissue engineering, regenerative medicine, and diseasetreatment. In recent years, with the deepening of research on exosomes, it has been found that exosomes secreted by hMSCs play important roles in intercellular information transmission, immune regulation, and tissue repair. Therefore, this article aims to investigate in depth the characteristics of human bone marrow-derived mesenchymal stem cells secreting exosomes, in order to provide new ideas and methods for the clinical application of hMSCs in the medical field.本文将首先介绍hMSCs的基本生物学特性及其在组织工程和再生医学中的应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
外泌体分离提纯草案
By 朱旭峰
一、以超高速离心的方法来分离外泌体(细胞上清)
1.1细胞培养液(CM)是来自无菌的80%-90%的培植细胞,并用浓度比
1:1.000的蛋白酶抑制剂混合。
(sigma)
1.2快速地将CM用0.22μm 的过滤筛(Millipore)过滤,来分离完整地
细胞和残渣。
超速离心于120,000_g (Sorvall WX ULTRA SERIES, rotor
A-641) 4 ℃. 2 小时
1.3用1mL 冷的PBS 重悬和清洗小囊泡,再次超速离心120,000_g
(Sorvall WX ULTRA SERIES, rotor A-641) 4 ℃. 2 小时
1.4再用100μL 冷的PBS 重悬后转移到低粘附的管中
1.5快速地使用或置于-80℃中待用为检测外泌体的蛋白浓度,取2μL
的样品置于卡上,用Direct Detect™(Millipore)
2材料
a)细胞培养液
b)蛋白酶抑制(Sigma)
c)过滤筛(Millipore)
d)冷的PBS
e)低粘附的管
f)Direct Detect™(Millipore)
二、以超高速离心的方法来分离外泌体(人血浆)
1.1在提取外泌体之前应该向血浆里添加1;500浓度比的蛋白酶抑制剂
(Sigma)
1.2将上清液移至一个新的管中离心200*g 20分钟4℃
1.3小心地再将上清液移至新的管中离心10000*g 30分钟于4℃来
去除较大的囊泡、
1.4此阶段的样品可以
1.5将样品用0.22μm的注射器滤筛(Millipore)过滤并且离心110000g
(Sorvall WX ULTRA SERIES, rotor F65L) 2小时4℃
1.6用冷的PBS重悬后再次超速离心(110,000g, 1 h, 4 ℃).,
1.7将外泌体小心干燥并且用冷的PBS重悬
1.8外泌体应该立即使用或-80摄氏度冷藏
2.材料
a)蛋白酶抑制(Sigma)
b)过滤筛(Millipore)
c)冷的PBS
d)低粘附的管
e)Direct Detect™(Millipore)
三、ExoQuick TM化学沉淀法
1.1ExoQuick TM的使用要按照厂家提供的说明书来实行
1.2该试剂盒可以简单地提取CM,人血浆,和血清里的外泌体,只需用
倒相管按照所指示的量来加入ExoQuick TM试剂盒里的溶液
1.3溶液孵化过夜,在4℃温和的摇晃
1.4在流式细胞仪缓冲液中洗涤
1.5试剂盒里的带荧光的免疫磁珠已经被绑定,用流式细胞仪鉴定即可
(BD Biosciences) 配合使用CellQuest 的软件。
2材料
a)ExoQuick TM试剂盒
b)流式细胞仪
四、用ME TM分离外泌体
1.1样品(CM或人血清)要按照商品说明书(New England Peptide –
NEP)稀释
1.2样品要事先处理好,17,000g 7分钟来去除微粒物质
1.3然后用ME TM试剂来孵化样品(NEP peptide)并且用旋转震荡在室温
混合15分钟
1.4孵化完的样品要室温离心10000g 7分钟
1.5所有的样品要用PBS洗三次
1.6最后小囊泡要用合适的KIT缓冲液重悬
五、抗体
以下的外泌体有关的一抗和二抗是用作:Westen Blot,ELISA和FACS(流式细胞术)
1.1mAb aCD9, mAb aCD63, mAb aCD81, mAb aCD63-FITC, aCD81-PE, 来
自于Beckton Dickinson,
1.2mAb aCD63-biotin (BioLegend),
1.3mAb aAlix (Santa Cruz),
1.4mAb aTsg101 (Abcam),
1.5pAb aRab5 (Santa Cruz),
1.6mrAb aRab5 (Epitomics),
1.7mAb aCalnexin (Abcam),
1.8二抗是anti-Mouse和anti-Rabbit HRP-conjugated (Dako). 专门的
肿瘤外泌体(HBM1 and HBM2) 结合抗体由HansaBioMed R&D
team.提供
六、用Westen Blot 探测外泌体的蛋白
1.1将样品用合适容积的蛋白loading Buffer(Lonza)重悬在合适的浓度
下
1.2用SDS-page分离外泌体的蛋白质
1.3把蛋白转到硝酸纤维素膜上(GE Healthcare)
1.4一二抗体孵化
1.5信号要在暗室里用ECL附加
七、外泌体免疫捕捉和蛋白定量ELISA
1.1从已经加了不同抗体的96孔板(Nunc)里的细胞上清或者人血浆为
免疫捕捉而筛选外泌体结合抗体(96孔板的抗体用碳酸氢盐缓冲
液PH=9.6稀释,用0.5%BSA固定和1%的蔗糖稳定)
1.2PBS加入0.05% Tween-20(PBST)作为洗涤缓冲液,但如果有提示
说明,应该用PBS稀释样品
1.3将外泌体样本,CM,人血浆样本加入96板孔内(最终容积为100
μl),孵化4℃过夜或者室温2小时(可以使用商业化的exosomes
捕捉平板(HansaBioMed))
1.4传统上的protocol包含使用主要的抗体(aCD9或aCD63)在样品缓
冲液(0.5%BSA PBS)中稀释2小时于4℃。
1.5在大量的冲洗后,用辣根过氧化物酶二抗(BioRad),在需要的地方
用样品缓冲液1小时于4℃。
基于BM Blue POD Substrate辣根过氧化物酶的底物(Roche)反应的
光密度反应,在450nm的酶标仪下记录Infinite_M1000 (TECAN)
a)QuantaBlu Fluorogenic Peroxidase Substrate(Thermo Scientific)要用连
续的激发光束在325/425nm
b)SuperSignal West Femto Chemiluminescent Substrate (Thermo
Scientific)要先孵化1分钟然后在酶标仪化学发光模式读数
2.材料
a)96孔板
b)碳酸氢盐缓冲液PH=9.6
c)BSA PBS Tween-20 蔗糖
d)辣根过氧化物酶二抗
e)辣根过氧化物酶的底物
f)酶标仪
八、磁珠捕获外泌体
1.商业化的预包裹的乳胶微球
1.1根据商品说明书(HansaBioMed)来分离外泌体
1.2每个样品先用1ml的PBS来稀释
1.3选用合适的珠子去孵化4℃过夜,旋转震荡。
1.4之后可以用离心的方法来分离(5000个,10分钟),再用PBST洗涤3
次。
2.磁珠分离法
2.1比较了“1μm大小的链霉亲和素磁珠”(Thermo Scientific, 88816)
和“亚显微大小的超磁力珠”(内部订购)
2.2先用PBST洗涤磁珠然后加入1.2μg的抗体(外泌体结合的同种抗体,
CD9抗体(Beckton Dickinson))
2.3生物素化的抗体用于链霉亲和素磁珠,然后用PBST洗三次,再用合
适的固定剂固定(干酪素,BSA或人血清)室温1小时
2.4重悬于PBS,然后加入样品(CM或人血浆)
2.5为了最终可以富集磁珠到近108/ml,将其孵化过夜4摄氏度旋转
rotation
2.6用电磁分离磁珠,在量化外泌体蛋白或提取外泌体RNA之前用PBST
洗三次
2.7磁珠也会溶解于Laemmli buffer,所以在做为westen bolt先将其煮沸
或者可以选择做bead-based ELISA
3.免疫珠分离法
3.1用主要的抗体孵化免疫磁珠2小时于室温,用ELISA缓冲液冲洗
3.2再加入二抗(辣根过氧化物酶)孵化1小时,然后大量的冲洗之
3.3为了可以被侦测到,需加入底物BM Blue POD Substrate (Roche),孵
化10分钟为了终止反应,加入硫酸,并在450nm波长下读数
4.材料
a)商品化的磁珠
b)辣根过氧化物酶二抗
c)辣根过氧化物酶的底物
d)酶标仪
e)PBST。
