王光信第三版物理化学章节总结
物理学教程第三版知识点总结

物理学教程第三版知识点总结前言物理学教程第三版是一本经典的物理学教材,对于学习物理学的学生和研究人员来说都具有重要的参考价值。
本文将对该教程的知识点进行总结,希望能够帮助读者更好地理解和掌握物理学的基础知识。
正文1. 力学•牛顿定律–第一定律:惯性原理–第二定律:动量定理–第三定律:作用-反作用定律•力的合成与分解•弹性力学–胡克定律–弹簧振子•物体在重力场中的运动–自由落体运动–斜抛运动•圆周运动–离心力–向心力–匀速圆周运动2. 热学•温度与热量•热传递–热传导–热辐射–对流传热•热力学定律–第一、第二定律–熵的概念与热力学过程3. 电磁学•静电学–库仑定律–电场与电势–电场中带电粒子的运动•电流–电阻与电导–欧姆定律•磁学–磁感应强度–安培定律–磁场中带电粒子的运动•电磁感应–法拉第定律–楞次定律•电磁波–麦克斯韦方程组–光的电磁波性质4. 光学•几何光学–光的传播与反射–光的折射与透镜•波动光学–杨氏实验–干涉与衍射•光的电磁波性质–光的波粒二象性–光的偏振与干涉5. 原子物理与核物理•原子结构–波尔模型–量子力学–原子光谱•核物理–放射性衰变–原子核的稳定性–核反应与核能结尾通过对物理学教程第三版知识点的总结,我们了解到了物理学的基础内容和重要概念。
这些知识点对于我们理解自然界的运行规律和应用物理学的实践具有重要意义。
希望读者通过本文的阅读能够对物理学有更深入的了解,并能够在学习和研究中运用这些知识,推动科学的发展。
物理化学第六章知识总结

1、单组份系统 C=1 P=1 g l F=2(T,P) s l-g l-s F=1(T 或 P) s-g P=3 g-l-s (0.0098℃ ,610.5Pa)
P=>
P=2
F=0
2、双组份系统(C=2) 组分数增多,自由度数增多 F 随 C 增大,随 P 减小,F=C-P+2 三、吉布斯相律 相律的形式 F=C-P+N N:包含所有处界影响因素(含温度、压力)的数目,则相律的形式应为 F=C-P+N (电场、磁场、重力场等) N=2 时,表示系统整体的温度,压力皆相同,即有 F=C-P+2。 对于只由液相和固相形成的凝聚系统来说, 压力对平衡影响小, 所以不考虑, 故常压下, 凝聚系统相律的形成为 F=C-P+1(N=1) 第二节、杠杆规律
m α w b −w b
β
= mβ w
α b −w b
(m总 = mα + mβ )
如下图:
第三节、单组份系统相图 相图:以 T,P,x 为坐标作图,成为相图能直观地表达系统的状态随温度、压力、组成等强度 性质变化的图形。 相图的绘制:由实验数据具体描绘 1、 以水系统为例,应用相律非分析相图的基本构成 G P=1 l S g-l g-s l-s g-l-s F=0 Fmax=2 三个区域
如上图所示:点 a、b 称为相点,连线 ab 为结线,M 为系统点。 Xm -----系统总组成 Xb -----液相组成 Yb -----气象组成
Xb>Xm>yB
(B 是难挥发物质)
Xg<xm<xl(此时,液相中含量大于气相中含量) 有杠杆规则,
n g x B −x m n l x m −y B
=
《物理化学》(电化学)知识点汇总

Cu
2
/ Cu
RT 2F
ln
aCu aCu2
H / H2
RT 2F
ln
aH2 a2
H
Cu2 / Cu
Cu2 /Cu
RT 2F
ln
aCu aCu2
H / H2
H /H2
RT 2F
ln
aH2 a2
H
氧化态 ze 还原态
= RT ln a还原态
zF a氧化态
了解电极的分类及浓差电池
)
1 2
四、离子独立运动规律
在无限稀释溶液中,每种离子独立移动,不受其它离 子影响,电解质的无限稀释摩尔电导率可认为是两种 离子无限稀释摩尔电导率之和。
m
m,
m,
弱电解质的极限摩尔电导率的计算:
m
(HAc)
m,
(H
)
m,
(
Ac
)
[m,
(H
)
m,
(Cl
)]
[m,
(
Na
)
m,
(
Ac
)]
[m,
2. 离子迁移数
定义:当电流通过电解质溶液时,某种离子迁移 的电量与通过溶液的总电量的比称为该离子的迁 移数。
t
Q Q
Q Q Q-
= r r r-
Q- Q- Q Q-
t Q
r r r-
2. 摩尔电导率
是把含有1mol电解质的溶液置于相距1m的两个平行 电极之间,溶液所具有的电导。
H / H2
H / H2
RT F
1 ln
aH
H2 Pt
0 8.314 298 ln1107 0.29 0.704V 96500
物理化学第三版第十章_复合反应动力学及反应速率理论资料

何谓链式反应?
用热、光、辐射等方法使反应引发,反应便能通过活性 组分相继发生一系列的连续反应,像链条一样使反应自动发 展下去,这类反应称之为链式反应,又称为链锁反应。
(1)链引发(chain initiation)
处于稳定态的分子吸收了外界的能量,如加热、光照 或加引发剂,使它分解成自由原子或自由基等活性传递物。 活化能相当于所断键的键能。
k1 cB k2 cC 若各平行反应的级数不同,则无此特点。
cA,0
cA
cB
c
cC
0
t
一级平行反应的c-t图(k1=2k2)
§10.2 对峙(对行)反应
不是热力学可逆过程!
以1-1型反应为例说明对峙反应的动力学特征
A
k1
B
t 0
a
k-1
0
t t
ax
x
t te
a xe
A
dCA dt
dx dt
dc c c0 c1 dx x x 菲克第一定律可以简化为:
dn DA c0 c1
dt
x
J D c0 c1 x
菲克第二定律
如果物质流入扩散层和流出扩散层的速率不同, 则扩散层内将有物质积累,浓度梯度就会随时间 和距离发生变化,这种扩散称为非稳态扩散,其 服从菲克第二定律。
c 2c t D x2
有效的,所以绝大部分的碰撞是无效的。
要在碰撞频率项上乘以有效碰撞分数q。
q exp( Ec ) RT
速率方程
A B P
有
dcA dt
Ec
ZABe RT
dcA dt
(rA
rB
)2
(
8 kBT
)1/
物理化学---知识点总结
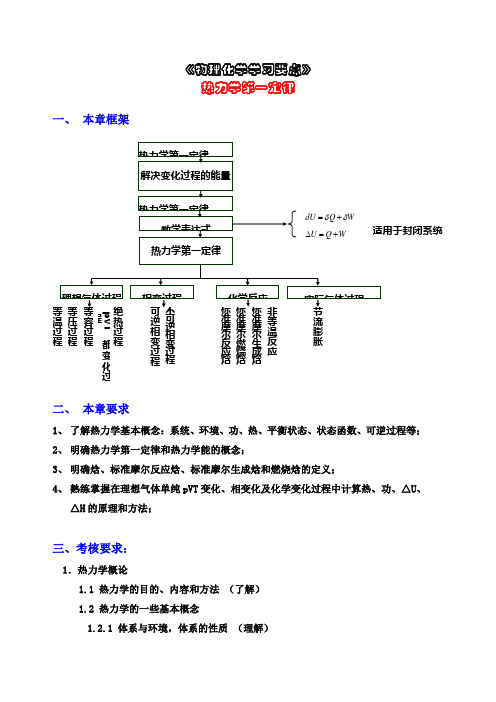
《物理化学学习要点》热力学第一定律一、 本章框架二、 本章要求1、 了解热力学基本概念:系统、环境、功、热、平衡状态、状态函数、可逆过程等;2、 明确热力学第一定律和热力学能的概念;3、 明确焓、标准摩尔反应焓、标准摩尔生成焓和燃烧焓的定义;4、 熟练掌握在理想气体单纯pVT 变化、相变化及化学变化过程中计算热、功、△U 、△H 的原理和方法;三、考核要求:1.热力学概论1.1 热力学的目的、内容和方法 (了解) 1.2 热力学的一些基本概念1.2.1 体系与环境,体系的性质 (理解)温过程 压过程 容过程 pVT 都变化过程热过程逆相变过程 可逆相变过程准摩尔反应焓 准摩尔燃烧焓 准摩尔生成焓等温反应 流膨胀1.2.2 热力学平衡态和状态函数(理解)2.热力学第一定律2.1 热和功(掌握)2.2 热力学能(掌握)2.3 热力学第一定律的表述与数学表达式(应用)3.体积功与可逆过程3.1 等温过程的体积功(应用)3.2 可逆过程与最大功(理解)4.焓与热容4.1 焓的定义(了解)4.2 焓变与等压热的关系(应用)4.3 等压热容和等容热容(理解)5.热力学第一定律对理想气体的应用5.1 理想气体的热力学能和焓(掌握)5.2 理想气体的C p与C v之差(理解)5.3 理想气体的绝热过程(掌握)6.热力学第一定律对实际气体的应用6.1 节流膨胀与焦耳-汤姆逊效应(了解)7.热力学第一定律对相变过程的应用(掌握)8.化学热力学8.1 化学反应热效应8.1.1 等压热效应与等容热效应(掌握)8.1.2 反应进度(了解)8.2 赫斯定律与常温下反应热效应的计算8.2.1 赫斯定律(应用)8.2.2 标准摩尔生成焓与标准摩尔燃烧焓(掌握)8.3 标准反应焓变与温度的关系—基尔霍夫定律(应用)四、重要概念1、系统与环境;2、 隔离系统、封闭系统、敞开系统;注意:隔离系统Q=0,W=03、 广度性质(加和性:V ,U ,H ,S ,A ,G )强度性质(物质的量,T ,p ); 4、 功W 和热Q ;注意W 与Q 的符号;W 与Q 均为途径函数(非状态函数) 5、 热力学能; 6、 焓; 7、 热容;8、 状态与状态函数; 9、 平衡态; 10、可逆过程;11、 节流过程; 12、 真空膨胀过程; 13、 标准态;14、标准摩尔反应焓,标准摩尔生成焓,标准摩尔燃烧焓五、重要公式与适用条件1. 体积功:W = -p 外dV (封闭系统,计算体积功)2. 热力学第一定律:∆ U = Q +W , d U =Q +W (封闭系统) 3.焓的定义: H =U + pV4.热容:定容摩尔热容 C V ,m =Q V /dT =(∂ U m /∂ T )V 定压摩尔热容 C p ,m = Q p /dT =(∂ H m /∂ T )P 理想气体:C p ,m - C V ,m =R ;凝聚态:C p ,m - C V ,m ≈0理想单原子气体C V ,m =3R /2,C p ,m = C V ,m +R =5R /2 5. 标准摩尔反应焓:由标准摩尔生成焓∆f H B (T )或标准摩尔燃烧焓∆c H B (T )计算 ∆ r H m = ∑ v B ∆ f H B (T )= -∑ v B ∆ c H B (T )6. 基希霍夫公式(适用于相变和化学反应过程)∆ r H m(T 2)= ∆ r H m(T 1)+21T r pm T C dT∆⎰7. 等压摩尔反应热与等容摩尔反应热的关系式Q p -Q V = ∆ r H m (T )-∆ r U m (T )=∑ v B (g )RT 8. 理想气体的可逆绝热过程方程:γγ2211V P V P = 122111--=γγV T V T γγγγ/)1(22/)1(11-=-P T P Tγ=Cvm Cpm /六、各种过程Q 、W 、∆ U 、∆ H 的计算1、 理想气体:等温过程dT =0, ∆ U =∆ H =0, Q =W ;非等温过程,∆ U = n C V ,m ∆ T , ∆ H = n C p ,m ∆ T , 单原子气体C V ,m =3R /2,C p ,m = C V ,m +R = 5R /22、对于凝聚相,状态函数通常近似认为与温度有关,而与压力或体积无关,即 ∆ U ≈∆ H = n C p ,m ∆ T3. 等压过程:p 外=p =常数,非体积功为零W '=0 (1) W = -p 外(V 2-V 1), ∆ H = Q p =dTnC T Tm p ⎰2,, ∆ U =∆ H -∆(pV ),Q =∆ U -W(2) 真空膨胀过程p 外=0,W =0,Q =∆ U理想气体结果:d T =0,W =0,Q =∆ U =0,∆ H =0 (3) 等外压过程:W = -p 外(V 2-V 1) 4. 等容过程 :d V =0 W =0,Q V =∆ U =dTnC T Tm v ⎰2,, ∆ H =∆ U +V ∆ p5.绝热过程:Q =0 (1)绝热可逆过程 W =dVp T T ⎰2= ∆ U =dTnC T Tm v ⎰2,,∆ H =∆ U +∆ pV理想气体:γγ2211V P V P = 122111--=γγV T V T γγγγ/)1(22/)1(11-=-P T P T(2)绝热一般过程:由方程WdVp T T外⎰2= ∆ U = dTnC T Tm v ⎰2, 建立方程求解。
(物理化学)第三章 化学反应热力学总结

第三章 化学反应热力学总结本章主要是运用热力学的基本概念、原理和方法研究化学反应的能量变化,引入反应焓与温度的关系式——Kirchhoff 公式,建立热力学第三定律以求算化学反应的熵变,引入化学热力学重要关系式——Gibbs-Helmholtz 方程。
一、 基本概念1、化学反应进度 ()/B B d dn ξξν= B B n /∆ξ=∆ν 或 B B n /ξ=∆ν2、盖斯定律3、标准生成热4、标准燃烧热5、热力学第三定律6、规定熵与标准熵 二、化学反应焓变的计算公式1、恒压反应焓与恒容反应焓的关系 p,m V,m BBQ Q (g)RT =+ν∑或 p ,m V ,mB BH U(g )RT ∆=∆+ν∑ 简写为: m m B BH U (g)RT ∆=∆+ν∑ 2、用f B H ∆$计算r m H ∆$: r m H ∆$(298K)=Bf B BH (298K)ν∆∑$3、由标准燃烧焓c m H ∆!的数据计算任一化学反应的标准反应焓r m H ∆!()r m H 298K ∆=$()B C m,B BH 298K -ν∆∑$4、计算任意温度下的r m H ∆!——基尔霍夫公式(1)微分式 r m B p,m p,m Bp H (T)C (B)C T ⎡⎤∂∆=ν=∆⎢⎥∂⎣⎦∑$(2)已知()r m H 298K ∆$求任意温度下的r m H ∆!当(),p m C B 表示式为形式: ()2,p m C B a bT cT =++ 时()()T2r mr m298K HTK H 298K (a bT cT )dT ∆=∆+∆+∆+∆⎰$$,积分得:()()()()2233r m r m b c H TK H 298K a T 298T 298(T 298)23∆∆∆=∆+∆-+-+-$$若令:230r m b c H H (298k)a 29829829823∆∆∆=∆-∆⨯-⨯-⨯$则: 23r m 0b C H (TK)H aT T T 23∆∆∆=∆+∆++$三、化学反应熵变的计算1、知道某一物质B 在298K 时的标准熵值,求该物质在任一温度时的标准熵值的公式()()(),,,298298TKm Bm Bp m K dT STK S K C B T=+⎰$$ 2、已知(),298m B S K $计算标准反应熵变r m S ∆$(298K)r m B m,B S (298k)S (298K)∆=ν∑$$3、任意温度 TK 时的标准反应熵变值r m S ∆$(TK )的计算r m S ∆$(TK )=r mS ∆$ (298K)+TKp,m 298KC dT T∆⎰式中,p m C ∆ 为产物与反应物的热容差, ,p m C ∆=(),Bp m BC B ν∑四、任意温度下化学反应吉布斯自由能的计算1、微分式 m m 2PG ()H T T T ⎡⎤∆∂⎢⎥∆=-⎢⎥∂⎢⎥⎢⎥⎣⎦$$2、不定积分式 'mm 2G H dT I T T∆∆=-+⎰$$ ('I 为积分常数) (1)、m H ∆$为常数时m mG H I T T∆∆=+$$或 m G ∆$=m H ∆$ +IT (2)、m H ∆$表示为温度的函数,且符合Kirchhoff 定律的形式:23m 0b c H (TK)H aT T T 23∆∆∆=∆+∆++$ 式中0H ∆为积分常数 20mH G 11a ln T bT cT I T T 26∆∆=-∆-∆-∆+$ 即 23m 011G (TK)H aT ln T bT cT IT 26∆=∆-∆-∆-∆+$。
大学课程《物理化学》各章节知识点汇总

G
S,
p
T ,ni
V
dG SdT VdP BdnB
B
30
U f (S,V , n1, n2,)
dU
U S
V ,ni
dS
U V
S ,ni
dV
U n1
S ,V ,n j1
dn1
U n2
S ,V ,n j2
dn2
dU TdS pdV
U
nB
dnB
S ,V ,n j B
p2 dp
压缩
p1
p1
p2 , V2
p1, V1
p2
V1
V2
W
V1 V2
pedV
( p V1
V2
i
dp)dV
V1 V2
pi dV
三、可逆过程
某系统经一系列的过程后,如果系统回到初始状态叫做 系统的复原;环境在经历一些的变化后,如果既没有功 的得失也没有热的得失就叫做环境的复原。
某系统经一过程由状态1变为状态2之后,如果能使系统 和环境都完全复原,则该过程为可逆过程。
p1
p p1
p1
可逆相变过程的ΔG
dG SdT Vdp
G 0
不可逆相变过程的ΔG
H2O(g,T , p1) G H2O(l,T , p1)
GG G1 G2 G3 1
G3
H2O(g,T , p2 ) G2 H2O(l,T , p2 )
25
偏摩尔量的集合公式
i
X nB X B,m B1
(
U V
)T
0
U ( p )T
0
(
H V
)T
0
H ( p )T
物理化学各章概念总结、公式总结电子版1___电化学

7.1 重要概念、方法及注意事项
1.关于物质的量的基本单元 物质B的物质的量nB正比于B的特定单元的数目NB,即nB=(1/L)NB,其中L为阿伏加德 罗(Avogadro)常数。这种特定单元叫做基本单元,它可以是分子、原子、离子、原子团、电 子、光子及其他粒子或这些粒子的任意特定组合。在讨论电解质溶液导电性质时,为了讨论
问题方便,使公式表示形式简单,人们常以一个元电荷为基础指定物质的基本单元,这样,
相同物质的量的不同物质便具有相同的电关系。例如,1 mo1 的Na+,Cl-,
1 2
Ca
2+
,
1 3
PO43−
等,它们都带有 96500C 的电量。若某强电解质依下式电离
Mν + Aν − → ν + M z+ +ν − Az−
和Λm来计算离子的λB。应用这些公式时,均应以一个元电荷为基础来指定电解质和离子的 基本单元。
13.
α = Λm Λ∞m
式中。是弱电解质的电离度,Λm和Λm∞分别为弱电解质溶液的实际摩尔电导率和极限摩尔电
导率。此式是用电导法测定弱电解质电离常数的依据。它表明,可通过测定弱电解质溶液的
t+ = u+
t− u−
在多电解质溶液中,任意两种离子 i 和 j 的迁移数,不仅取决于它们的电迁移率,而且与它
们的浓度有关,
ti = uici
t j ujcj
其中ci和cj分别代表i和j的浓度,它们的基本单元应以一个元电荷为基础来指定。
4.
n(电解质↓)=n(离子迁出)
或
n(电解质↑)=n(离子迁入)
指定电解质和离子的基本单元。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学热力学基础总结1.概念:系统与环境、相、广度性质和强度性质、状态与状态函数(定,变,数学处理)、平衡态(热、力、相、化学平衡)过程:dT=0、dp=0、dV=0、δQ=0、循环、对抗恒外压、真空膨胀、可逆与不可逆过程2.热力学函数及其增量:W 、Q 、ΔU 、ΔH 、C pm 、C vm 、ΔS 、ΔA 、ΔG 、T 、P ;理想气体模型及U 、H 特点————真实气体及对应状态原理;3.功——系环之间因粒子的有序运动而交换的能量,与途径有关,非状态函数 体积功计算:⎰∑−==21V V dV p W W 外δ,符号规定:系统对环境作功 W<0(1)等容过程 dV=0 W=0 (2)自由膨胀 p 外=0 W=0(3)对抗恒外压 V p dV p W V V ∆−=−=⎰外外21(4)可逆过程⎰⎰⎰−=+−=−=212121)(V V V V V V pdV dV dp p dV p W 外(5)等温可逆理想气体 1221ln ln21p pnRT V V nRT dV p W V V ==−=⎰外 (6)理想气体绝热过程)1/()()(112212,−−=−=∆=γV P V P T T nC U W m V ,其中)1/(−=γR C Vm (7)等温等压、理想气体摩尔反应∑−=RT v W g B ,(8)等温等压相变过程α(液或固)→β(理想气体) W= -P(V β-V α)≈ -PV β = -nRT 4.热——系环之间因粒子无规则运动而交换的能量,与途径有关,非状态函数(1)等温、可逆、理想气体——dT=0、0=∆U 、2112ln ln p pnRT V V nRT W Q ==−= (2)等压过程(dp=0, W’=0) ⎰=∆=21,T T m p p dT nC H Q(3)等容过程(dV=0, W’=0) )1/()(1122,21−−==∆=⎰γV P V P dT nC U Q T T m V V(4)绝热过程 Q=0(5)dT=0、dP=0、W ’=0、可逆相变——m pc p H n H Q ∆=∆=不可逆相变—— ⎰∆+∆=∆=21)(1T T p p dT C T H H Q 正常相变点,其中m p p nC C ,∆=∆5.热力学第一定律及其应用能量守恒 W Q U +=∆(封闭系统)与热容关系式 ⎰=∆21T T Vm dT nC U , ⎰=∆21T T Pm dT nC H , )(pV U H +∆=∆热一律应用: (1)PVT 变化a 理想气体等温可逆 0=∆U 0=∆H 1221ln lnp pnRT V V nRT W r == r W Q −= b 理想气体等温不可逆 0=∆U 0=∆H )(1221V V p dV p W V V −−⇒−=⎰外外 W Q −=c 理想气体绝热可逆 Q=0 11122,212121−−==∆=−=−=⎰⎰⎰γV p V p dT nC U pdV dV p W T T m V V V V V 外⎰=∆21,T T m p dT nC H ;m V m p C C ,,/=γ; RR R R C C PmVm 5.35.25.25.1双原子单原子;)1/(−=γR C Vm关键点:T 2求解,依据———理想气体绝热可逆过程方程31211,,C p T C TVC pV ===−−γγγγd 理想气体绝热不可逆 Q=0, ⎰−−==∆=11122,21γV p V p dT nC U W m V T T ,⎰=∆21,T T m p dT nC H关键点:T 2求解,依据———理想气体状态方程和热力学第一定律e 真实气体节流膨胀 0=∆H (2)相变化 dT=0 dP=0 W ’=0 βα⇔可逆相变化 H W p ∆=, nRT pV V p W −=−≈∆−=理气βnRT H pV H W Q U p −∆=−∆=+=∆β不可逆相变=可逆相变+物理升降温过程 (3)化学变化∑∑∆−=∆=∆θθθm c B m f B m r H v H v H盖斯定律——各反应的线性组合反应焓与温度的关系 ⎰∆+∆=∆T Kp m r mr dT C K H T H 298)298()(θθ6. 热力学第二定律 反应的方向与限度(1)卡诺循环:a 热仅能部分地转化为功,可逆膨胀对外做功Wmax,可逆压缩,外对系统做功Wminb 热机效率与工质无关121T T T −=η c 可逆热机效率最高,循环过程热温商之和等于0,可逆不可逆ηη<,可逆不可逆02211≤+T Q T Q(2)熵(状态函数)——熵变(可逆过程热温商) TQ TQ dS dS dS irn r δδ>==== 1可逆 0=r Q , 则0==TQ dS rδ,是等熵过程。
绝热过程:不可逆 ,即dS>0 ,是熵增过程。
推广:虚拟孤立系统(系统+环境)(3)熵判据:T Q dS /δ≥ ⎰≥∆21TQS δ 0≥∆+∆=∆环系总S S S(4)熵本质:混乱度7. S ∆计算与应用 (1)单纯PVT 变化理气等温过程 pg, dT=0 ⎰=⇒==∆212112ln ln p p nR V V nR T Q TQ S r rδ 理气等压过程 pg, dP=0 ⎰⎰===∆2112,,21lnT T nC TdT nC TQ S m p m p rδ 理气等容过程 pg, dV=0 ⎰⎰===∆2112,,21lnT T nC TdT nC TQ S m V m V rδ 理气PVT 同时改变,过程设计组合 理想气体绝热,可逆过程 0=∆S ,不可逆过程 根据状态函数法进行过程设计,关键点:T 2求解,依据——理想气体状态方程和热力学第一定律(2)相变化可逆:T H n S m pc /∆=∆不可逆:虚拟过程:可逆相变+可逆PVT 过程 (3)化学变化∑=∆mB B m r S v S mB S 为标准熵(即以0,0(*=完美晶体)K S 为基准的相对熵)热力学第三定律:0K 各纯物质完美晶体的熵为零 0,0(*=完美晶体)K S8. 亥姆赫兹函数、吉布斯函数及判据A = U - TS pdV SdT dA −−= 00,,'≤=W V T dA 00,,'≤∆=W V T A 0=dTG = H - TS Vdp SdT dG +−= 00,,'≤=W V T dG 00,,'≤∆=W V T G 0=dTG ∆计算:a 封闭系统 任何过程 )(TS H G ∆−∆=∆b 封闭系统 等温过程 S T H G ∆−∆=∆c 封闭系统 绝热可逆 T S H G ∆−∆=∆d PVT 变化,dT=0, W ’=0, 2112ln ln21V V nRT p p nRT Vdp G p p ===∆⎰ e 不可逆相变化,过程虚拟 可逆变化+pVT 变化9. 麦克斯韦关系式pdV TdS dU −= Vdp TdS dH += pdV sdT dA −−= Vdp sdT dG +−= 微分前面的系数为一阶偏导数;二阶偏导数与微分次序无关化学平衡 总结1. 偏摩尔量 )(,,)(B A n p T BB n X X ≠∂∂=,数量极大的多组分系统中,1molB 对系统容量性质X 的贡献。
2. 化学势 B n P T BB G n GB A =∂∂=≠,,)(μ 自发性判据:ΔS(总)、ΔA 、ΔG ;化学势判据:单组分系统 00,,'≤=W P T dG ,若)(αμA >)(βμA ,则A 自发由α相→β相 多组分系统00,,'≤=∑=B B B W P T dn dG μ (相变化、化学变化) 3. 理想气体化学势 (G 绝对值不可知,选基准P ө、T 下纯理想气体化学势μө,μ*=G m *)p RTd dp pRTdp V dG d m mln ***====μ ;⎰⎰=*ln *μμθθμp p p RTd d ;纯组分θθμμp p RT ln*+=; 多组分θθμμp p RT T B B+=)( 4. 化学反应的方向、限度与标准平衡常数∑=B v B 0; ;ξd G dG m r ∆=;00≤∆⇔≤m r G dGB m B v B r v B B B B B B B B m r p p RT G p p RT v p p RT v v G )(ln )(ln )ln(θθθθθθμμμ∏+∆=∏+=+==∆∑∑∑ 平衡时m r G ∆=0 θθθp defv e B m r k RT p p RT G Bln )(ln ,−=∏−=∆θθθθθθpp p p v B mr m r k J RT J RT k RT p p RT G G B ln ln ln )(ln =+−=∏+∆=∆;分压商判据: θθp p m r k J G ≤⇔≤∆0BP P RTRTG K eB BB mr P υθθθθμυ⎪⎪⎭⎫ ⎝⎛∏=−=−∆=∑,ln ln 5. 标准平衡常数计算 ∏∑−∆=−==B mr BB B v e B p RTG RTT v p p T K B]exp[])(exp[)/()(,θθθθμ)()()(T S T T H T G m r m r m r θθθ∆−∆=∆)298,()298(K B G v K G m f B m r θθ∆=∆∑由有关化学反应关联计算θm r G ∆电动势 )(ln T k RT ZFE G p m r θθθ−=−=∆应用:根据θm r G ∆、)(T k p θ计算平衡组成及转化率θm r G ∆→θp k RT ln −→B v e B pp P k )/(,θθ∏=6. 温度对)(T k p θ的影响——范特荷夫等压方程2ln RTH dTk d m r p ∆=θ;C RT H k m r p +−∆=θln ; )11(ln 2112T T R H k k m r p p −∆=ϑϑ m r H ∆符号性质dTk d p θln 符号性质7. 各种因素对化学平衡的影响——定性与定量分析分压、浓度 ()θθp p m r k J RT G ln =∆B B Bv e y v e B v e B p p P K p P y p P T k ∑=∏=∏=)/()/()/()(,θθθθ , K y 随P e 的变化趋势取决于B υ∑的符号∑=∑=∏=∑∑∏B BBB B vBee n v B eB e B v e B v e B p n p p k n p p n p P T K )())(()/()(,,,θθθθP e 恒定,K n 随∑Be n 的变化趋势取决于B υ∑的符号8. 同时反应:若反应 <3>= <1>+ <2>,则 θθθ2,1,3,m r m r m r G G G ∆+∆=∆,θθθ2,1,3,p p p k k k ⋅=若反应 <4>= <1>- <2>,则 θθθ2,1,4,m r m r m r G G G ∆−∆=∆,θθθ2,1,4,/p p p k k k =9. 实际气体化学势对压力进行校正——逸度与逸度因子 B B B p f ϕ=,对比状态原理, 牛顿图,)()/()/()/()(T k k p p p p p f T k p v B v B v B B v B f B B B B θϕθθθθϕϕ=∏⨯∏=∏=∏=B v B p p P k )/(θθ∏= ),(P T f k p =θ非常数, ⇒θp k 平衡组成,转化率等获取θm r G ∆相平衡 总结1. 多组分系统: 混合物——理想混合物;溶液——稀溶液——理想稀溶液;2. 多组分系统热力学性质:理想体系: 溶剂——拉乌尔定律;溶质——亨利定律;均是蒸汽压-液相组成关系 稀溶液性质:四个依数性——蒸汽压降低、沸点升高、凝固点降低、渗透压; 化学势:已知理想气体化学势)/ln()()(θθμμp P RT B B +=,l g ⇔相平衡, 则)()(l g B B μμ=,代入与液相组成相关的压力P(拉、亨),求解各组分的化学势。
