二氧化硫化学性质
二氧化硫的性质

活性炭
Na2O2、HClO、O3、 H2O2
SO2
上述漂白剂中,哪种漂白剂的漂白过程中没有发生化学变化?
活性炭(吸附型漂白剂) 原理 实质 实例 效果 范围 氧化型 氧化还原型
Na2O2、O3、 HClO、H2O2 永久型, 不可逆 可使大多数有色 物质褪色,也可以 使指示剂褪色
结合型 非氧化还原型 SO2
2.2 漂白性 可使品红溶液褪色,但加热后,又会恢复至原来颜色 褪色原理:SO2可与有色物质结合成一种不稳定的 无色物质,当对其加热时,无色物质受热分解,因 此又会恢复原来颜色 SO2是一种结合型漂白剂 注 意
SO2不能使酸碱指示剂褪色
思 考 从初中到现在,我们已经学习了哪些漂白剂
?
Na2O2、 HClO、 O3、 H2O2、 活性炭、SO2等 请分析一下它们的漂白原理,从而将其归类到下列哪种 类型的漂白剂? A、吸附型 B、氧化型 C、结合型
若是向其中滴加几滴NaOH溶液,振荡,又会有何现象?
SO2 + 2NaOH ==== Na2SO3 + H2O 产生白色沉淀 Na2SO3 + BaCl2 ==== BaSO3↓ + 2NaCl
2SO2 + O2
催化剂
2SO3
常见氧化剂有:H2O2、O2、Na2O2、氯水、溴水、酸性KMnO4等
SO2会使氯水(黄绿色)、 酸性高锰酸钾溶液(紫红色)褪色 SO2 + Cl2 + 2H2O ==== 2HCl + H2SO4 Br2 HBr 思 考
SO2的物理性质
无色,有刺激性气味的气体,有毒,易溶于水, 密度大于空气 二. SO2的化学性质 2.1 酸性氧化物 类似于CO2
二氧化硫的性质教案设计

二氧化硫的性质教案设计一、教学目标1.知识目标:了解二氧化硫的基本性质,包括化学性质、物理性质和常见用途。
2.能力目标:能够描述二氧化硫的化学反应,并能够解释其常见用途的原理。
3.情感目标:培养学生对环境保护的意识,使其明白二氧化硫的排放对环境的危害。
二、教学内容1.二氧化硫的化学性质:酸性、氧化性、还原性、稳定性以及与水和碱的反应等。
2.二氧化硫的物理性质:无色无味的气体、可溶于水、冰点较低等。
3.二氧化硫的常见用途:工业用途、农业用途和生活用途。
三、教学过程设计1.导入(5分钟)引导学生回顾上一节课学习的相关知识,例如基本气体的性质和特点,以及化学反应中的酸碱反应和氧化还原反应。
2.概念讲解(15分钟)介绍二氧化硫的化学性质、物理性质和常见用途。
结合示意图或实验观察结果,向学生简单解释相关概念,例如二氧化硫的酸性反应、氧化反应和还原反应等。
3.实验演示(15分钟)展示一些与二氧化硫相关的实验,如二氧化硫与水和碱的反应、二氧化硫与金属的反应等。
通过实验演示,让学生亲眼观察到二氧化硫的性质和反应过程。
4.学生练习(20分钟)分发练习册,让学生完成相关的练习题。
练习题可以包括选择题、填空题和解答题等不同难度的题目,以检验学生对二氧化硫性质的理解和掌握程度。
5.拓展延伸(20分钟)让学生自主查阅资料,了解二氧化硫在工业、农业和生活中的具体应用。
学生可以以小组报告的形式展示他们所了解的相关知识。
同时,引导学生思考二氧化硫的排放对环境的影响,从而培养他们的环境保护意识。
6.归纳总结(10分钟)向学生提供一个归纳总结的机会,回顾本节课所学的知识点,并梳理二氧化硫的性质和应用。
7.课堂小结(5分钟)教师进行课堂小结,概括本节课的重点和难点,并预告下一节课的内容。
四、教学评价方法1.课堂表现评价:根据学生在课堂上的积极参与程度、回答问题的准确性和实验操作的规范性等指标进行评价。
2.练习题评价:根据学生在练习册上的答题情况,评估学生对二氧化硫性质的理解和掌握程度。
二氧化硫的性质及应用

二氧化硫的性质及应用二氧化硫,化学式为SO2,是一种无色、有刺激性气味的气体。
它广泛存在于自然界中,并在许多工业和商业应用中发挥着关键作用。
然而,由于其具有某些有害特性,二氧化硫的排放也引起了环境和健康问题。
一、二氧化硫的性质二氧化硫是由硫和氧组成的化合物,化学式为SO2。
它是一种无色、有刺激性的气体,在常温下易溶于水。
二氧化硫的分子结构使其具有多种化学性质,包括氧化性、还原性和酸性。
二、二氧化硫的应用1、工业用途二氧化硫在工业中应用广泛。
首先,它被广泛用于纸浆和纸张的漂白。
其次,二氧化硫也是制造硫酸和其他化学物质的重要原料。
此外,二氧化硫还用于制造肥料、橡胶制品和食品加工。
2、食品添加剂在食品工业中,二氧化硫被用作防腐剂和抗氧化剂,以延长食品的保质期。
它还被用于制作一些特定的食品,如葡萄酒和啤酒,以保持其口感和质量。
3、生物医学应用在生物医学领域,二氧化硫也被用于多种应用。
例如,它被用于制作一些药物和生物试剂,以及用于治疗某些疾病。
此外,二氧化硫也被用于消毒和清洁医疗设备。
三、二氧化硫的排放和环境影响尽管二氧化硫在某些应用中具有重要作用,但其排放也带来了环境和健康问题。
二氧化硫的排放主要来自燃煤和石油燃烧,以及一些工业过程。
这些排放可能导致酸雨和其他环境问题。
因此,许多国家和地区都实施了严格的环保法规,以限制二氧化硫的排放。
四、结论二氧化硫是一种具有重要应用的有害气体。
尽管其应用广泛,但其排放也带来了环境和健康问题。
因此,我们需要继续研究和开发更环保的替代品和技术,以减少二氧化硫的排放和对环境的影响。
对于现有的二氧化硫应用,我们也需要采取适当的措施来减少其对环境和人类健康的影响。
“二氧化硫的性质”教学设计一、教材分析二氧化硫是高中化学硫及其化合物的性质一节中安排的重要内容之一,是高中化学重要的基本概念和理论的重要组成部分,也是高考必考的重要内容之一。
本节课不仅具有很强的基础性,而且其理论性和实用性都很强,对于强化学生的环境保护意识,加强对大气污染的防治有着重要的意义。
二氧化硫的化学性质
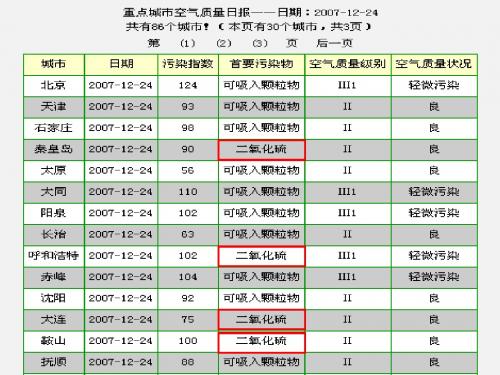
SO2+2Fe3++2H2O = 2Fe2+ +SO42-+4H+ SO2+I2+2H2O = H2SO4+2HI
3.氧化性
如何证明二氧化硫的氧化性?
SO2 + 2H2S = 3S + 2H2O
4.漂白性
SO2
在品红溶液通入SO2气体
SO2能使品红褪 色,是SO2的特 品红溶液 征反应,常被 用来鉴别SO2。
S通常显-2、0、+4、+6等 化合价,SO2中的S是几价, 从氧化还原角度, SO2可能 具有的性质?
9
2.还原性
2SO2+O2
如何证明二氧化硫的还原性?
SO2
催化剂 高温
2SO3
酸性KMnO4
SO3是一种无色固体,熔点(16.8。C),沸点 (44.8。C),SO3与H2O反应生成H2SO4,同时放出 大量的热。工业上常用这两个反应制造硫酸。 5SO2+2MnO4-+2H2O= 2Mn2++ 5SO42-+4H+
同学们:每天,当你阅读报纸、收听广播或 收看电视节目时,经常可以获得关于空气质 量的信息。空气质量报告各项指标中,有二 氧化硫的指数.为什么要有二氧化硫呢?它有 什么危害呢?
二氧化硫的化学性质
SO2有哪些化学性质?
从物质分类角度, SO2可归为哪一类? 和哪种气体可与之归为一类? 根据 所属类别,推测SO2可能与哪些物质 发生反应?
SO2+Na2SO3 +H2O=2NaHSO3
(CO2+Na2CO3 +H2O=2NaHCO3 ) SO2+NaOH=NaHSO3
(CO2+NaOH=NaHCO3 )
h2s与二氧化硫

H2S(硫化氢)和SO2(二氧化硫)都是常见的气体,它们在化学性质和环境影响方面有所不同。
硫化氢(H2S):
- 是一种无色、有臭鸡蛋味的气体。
- 在水中溶解性高,可以形成酸性溶液。
- 是一种弱酸,其酸性弱于硫酸(H2SO4)和盐酸(HCl)。
- 在高温高压下可以转化为液态或固态。
- 是一种有毒气体,对人体和环境都有害。
高浓度的硫化氢对人体有致命危险,可以导致窒息和严重的健康问题。
二氧化硫(SO2):
- 是一种无味、有刺激性气味的气体,在较高浓度下有刺鼻的味道。
- 在水中溶解性较好,可以形成亚硫酸(H2SO3)。
- 是一种弱酸,其酸性弱于硫酸和盐酸。
- 在常温常压下以气态存在。
- 也是有毒气体,对人体和环境有害。
长期暴露于高浓度的二氧化硫可能导致呼吸问题和其他健康问题。
在环境污染方面,硫化氢和二氧化硫都是污染物,它们可以来自于工业过程,如石油和天然气的提取、加工,以及金属的提炼。
这两种气体都有严格的排放标准,以减少对环境和人类健康的危害。
在工业应用中,硫化氢常用作还原剂,而二氧化硫则用于脱硫过程,以减少燃烧过程中产生的酸性气体排放。
在处理这些气体时,需要采取适当的安全措施,以防止人员伤害和环境污染。
二氧化硫燃点

二氧化硫燃点二氧化硫是一种常见的气体,具有刺激性气味和剧毒性。
它在工业生产和日常生活中都有广泛的应用,但同时也带来了一些安全隐患。
本文将从不同角度介绍二氧化硫的燃点及相关内容。
一、二氧化硫的基本性质和应用二氧化硫(SO2)是一种无色、刺激性气味的气体,密度大于空气。
它具有较好的溶解性,在水中可以形成亚硫酸(H2SO3),具有一定的酸性。
二氧化硫是燃烧过程中产生的一种气体,也是工业生产中重要的原料之一。
它广泛应用于制造硫酸、漂白剂、杀菌剂等,并被用于食品、纸张、化工等行业。
二、二氧化硫的燃点及相关安全性问题二氧化硫的燃点是指其能够燃烧的最低温度。
由于二氧化硫是一种易燃气体,其燃点较低,只需达到315摄氏度即可引发燃烧。
二氧化硫的燃烧产生的火焰呈蓝色,燃烧时会产生大量的热量和有毒气体,对人体和环境都具有一定的危害。
三、二氧化硫燃烧的影响因素二氧化硫的燃烧受到多种因素的影响,包括温度、氧气浓度、燃烧物质等。
其中,温度是影响二氧化硫燃烧的最主要因素。
一般来说,温度越高,燃烧速率越快。
此外,燃烧物质的种类和浓度也会对燃烧产生影响,不同的物质在燃烧过程中会产生不同的反应。
四、二氧化硫燃烧的安全措施由于二氧化硫燃烧产生的热量和有毒气体对人体和环境都具有一定的危害,因此在使用和储存二氧化硫时需要采取一定的安全措施。
首先,要确保存储环境通风良好,避免二氧化硫积聚;其次,要避免二氧化硫与易燃物质接触,以防止燃烧事故的发生;同时,在生产过程中应加强安全培训,提高员工的安全意识。
五、二氧化硫燃烧事故的防范和应对在工业生产和日常生活中,燃烧事故是一种常见的安全隐患。
为了防范和应对二氧化硫燃烧事故,需要采取一系列的措施。
首先,要建立健全的安全管理制度,加强对二氧化硫的储存和使用的监管;其次,在生产过程中要进行严格的操作控制,确保操作人员的安全;同时,要加强事故应急演练,提高应急处理的能力。
六、二氧化硫燃烧对环境的影响二氧化硫燃烧产生的烟尘和有毒气体对环境会产生一定的影响。
so2和so3物理化学性质

so2和so3物理化学性质⼆氧化硫的物理和化学性质⼀、物理性质1、⼆氧化硫是⼀种具有强烈刺激性的⽆⾊⽓体⽆⾊⽓体。
其液化点(或沸点)在常压下为-10.1°C;临界温度为157。
2°C;临界压⼒为764.92×104Pa。
其他性质相见下表:项⽬单位数值(条件)分⼦量64.06⽐重 2.264(空⽓=1)密度g/L 2.9266(0°C)冰点°C -75.48沸点°C -10.02熔化点J/mol 7.3986蒸发热J/mol 24.9128分⼦容积ml 44(沸点)介电常数13.8(14.5°C)电导率S 4×10-8(-10°C)粘度Pa·s0.0399(0°C)溶解度g SO2/100gH2O(20°C)10.552、在不同温度下,⼆氧化硫的溶解度:22 g/100ml (0°C)15 g/100ml (10°C)11 g/100ml (20°C)9.4 g/100 ml (25 °C)8 g/100ml (30°C)6.5 g/100ml (40 °C)5 g/100ml (50°C)4 g/100ml (60°C)3.5 g/100ml (70 °C)3.4 g/100ml (80 °C)3.5 g/100ml (90 °C)3.7 g/100ml (100 °C)3、⼆氧化硫⽓体对⼈体是有害的。
吸⼊⼆氧化硫会刺激呼吸道、引起⿐咽腔发炎、⽓管炎、⽀⽓管炎。
⼆、化学性质1、SO2和H2的混合加热,则⽣成S、H2S和H2O。
SO2+ 3H2=2H2O+H2S+216.9KJH2S同SO2作⽤⽣成S。
2H2S + SO2=2H2O+3S2、⼆氧化硫可以在硫磺燃烧的条件下⽣成:S(s) +O2(g) = SO2(g)3、硫化氢可以燃烧⽣成⼆氧化硫2H2S(g) + 3O2(g) = 2H2O(g) + 2SO2(g)4、加热硫铁矿,闪锌矿,硫化汞,可以⽣成⼆氧化硫4FeS2(s) + 11O2(g) = 2Fe2O3(s) + 8SO2(g)2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g)HgS(s) + O2(g) = Hg(g) + SO2(g)5、SO2和O2在完全⼲燥的状态下是很难以起反应的。
二氧化硫的结构与性质
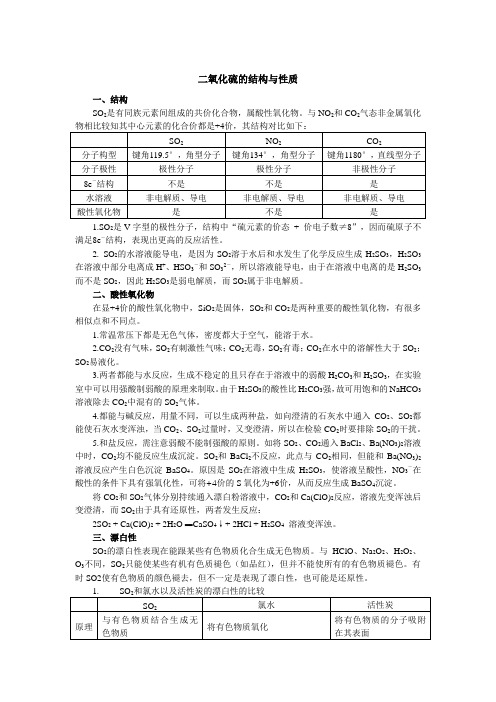
二氧化硫的结构与性质一、结构SO2是有同族元素间组成的共价化合物,属酸性氧化物。
与NO2和CO2气态非金属氧化物相比较知其中心元素的化合价都是+4价,其结构对比如下:SO2NO2CO2分子构型键角119.5°,角型分子键角134°,角型分子键角1180°,直线型分子分子极性极性分子极性分子非极性分子8e-结构不是不是是水溶液非电解质、导电非电解质、导电非电解质、导电酸性氧化物是不是是1.SO2是V字型的极性分子,结构中“硫元素的价态+ 价电子数≠8”,因而硫原子不满足8e-结构,表现出更高的反应活性。
2. SO2的水溶液能导电,是因为SO2溶于水后和水发生了化学反应生成H2SO3,H2SO3在溶液中部分电离成H+、HSO3-和SO32-,所以溶液能导电,由于在溶液中电离的是H2SO3而不是SO2,因此H2SO3是弱电解质,而SO2属于非电解质。
二、酸性氧化物在显+4价的酸性氧化物中,SiO2是固体,SO2和CO2是两种重要的酸性氧化物,有很多相似点和不同点。
1.常温常压下都是无色气体,密度都大于空气,能溶于水。
2.CO2没有气味,SO2有刺激性气味;CO2无毒,SO2有毒;CO2在水中的溶解性大于SO2;SO2易液化。
3.两者都能与水反应,生成不稳定的且只存在于溶液中的弱酸H2CO3和H2SO3,在实验室中可以用强酸制弱酸的原理来制取。
由于H2SO3的酸性比H2CO3强,故可用饱和的NaHCO3溶液除去CO2中混有的SO2气体。
4.都能与碱反应,用量不同,可以生成两种盐,如向澄清的石灰水中通入CO2、SO2都能使石灰水变浑浊,当CO2、SO2过量时,又变澄清,所以在检验CO2时要排除SO2的干扰。
5.和盐反应,需注意弱酸不能制强酸的原则。
如将SO2、CO2通入BaCl2、Ba(NO3)2溶液中时,CO2均不能反应生成沉淀。
SO2和BaCl2不反应,此点与CO2相同,但能和Ba(NO3)2溶液反应产生白色沉淀BaSO4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.漂白性:能使品红褪色
某些有机色素 △
SO2
无色的物质
经SO2漂白的物质长时间光照或受热后,会恢 复原来的颜色,因此,其漂白作用不持久。
【思考】
氯水和SO2都具有漂白作用,则将1molSO2通入 含1molCl2的氯水中,所得溶液的漂白作用强吗?
SO2+Cl2+2H2O=H2SO4+2HCl
〖பைடு நூலகம்考〗具有漂白作用的物质有哪些? 其漂白原理如何?
0
1
2
3
4
8、用下图所示装置进行浓硫酸和铜片的反应, 试管内有一小片铜片和浓硫酸,试管内发生的 反应的化学方程式为 ▲ ;装置中品红试纸 的作用是 ▲ ,导管口蘸有碳酸钠溶液的棉 花的作用是 ▲ 。相关的化学方程式是 ▲ 。
象郁金香这样的鲜花两天左右就会凋谢。怎样能使鲜花保持的时间长一些呢? 首先鲜花的根部要斜着剪口,这样吸水的部位大,能够更多地吸收水分; 其次,要每天剪去一些,保证能够更好的吸收水分; 还有,花的叶子不要泡在水里,这样叶子会烂掉,所以一定要把浸在水里的叶子摘掉; ; / 鲜花速递 jah42kbf 每天要换水。如果是夏天,为了保持水温不升高,还可以往花瓶里放几块冰;同时,花瓶里的水最好放满,这样不仅能使水的温度保持得长久 些,还可以增加花瓶底部的重量,保证花瓶的稳定性。 为了使鲜花开的时间长一些,还可以往花瓶里放少许啤酒,或者将两片阿司匹林研成末放进去。可延长鲜花的寿命。 在一般家庭常买的几种鲜花中,郁金香的寿命最短,康乃馨的寿命最长。如果你的主人是又想漂亮又比较节约的人,你就要少买郁金香,多买 康乃馨。尤其是夏天,郁金香很快就会枯萎。 还要注意一点,家庭中一般不要买菊花。因为菊花一般是用来上供的。 买几支绢花,与鲜花混合插入花瓶中,会使鲜花显得多而豪华。不同的绢花可与不同的鲜花相配反复使用。 板,来几床褥子,这么趴着要生病的!”重脚步往她这边来?咦,“兄弟”要亲自来抱她?这个待遇她经不起呀!宝音赶忙要坐起来,发出用 操心了。”宝音忍不住好奇,苏小横能有什么办法?苏小横莞尔。宝音知道有的男人好男风,但不知道七王爷只好男风,真到不可分解时,但 说出真相,宝音就不必担心被强抢了去罢!以七王爷一惯品性,听说宝音女扮男装,最多也只是一笑置之。苏小横想,宝音再聪敏,到底只是 个足不出户的小女孩子哎!这点都想不到。这个时候他才真正放下心来:这个六孙女儿,从前就阴郁自闭、我行我素,大病忽痊之后,又太过 明达稳妥,他总怀疑她是不是脱出了苏府掌控,这会儿,言谈之间,证明了她的坦白、看清了她的局限,他不怕了。“你跟你奶奶多聊聊罢。” 苏小横这样对宝音说罢,立起身来。宝音抬头,老太太给封嫂搀着,走过来,把宝音揽在怀中,埋怨得俨然温馨:“你这孩子,叫人拿你怎么 办哟„„”第九十章 那夜笙蝶初相见(1)苏府有荣华,也有温情。只要你值得,它都不吝于给你。但你若不值得,所有的荣华与温情,像金 雨般洒在你身边,你沾不上一星半点。尤五姨娘生产,生了一个夜晚,连一个上午,二老爷没来、老太爷没来、老太太更没来。只是一个姨娘 生产罢了!他们有更重要的事情要做。二太太好些,早晨来看了她,接生的诸人们劝阻:“里头肮脏,太太外头等罢?”二太太听了听屋里尤 五姨娘一声递一声的惨叫,道:“也好。”她走出一扇门,又走出一扇门,直到离尤五姨娘屋子半个院落之外的“外头”,正巧大太太也来探 望了,带了些表礼,二太太替尤五姨娘接了,陪大太太坐着说话儿,议论些妯娌之间的小话题,说到宝音和福珞,就都识趣的绕开去,还是讨 论明秀比较安全。大太太抱怨:“哦哟,我们那姑娘,麻烦也是真麻烦!梳头娘姨,怕不给她换过百多十件样式了,她总定不下来,我看着, 好是都好的,要给大日子用呢,也说不上哪里总有点不好。还是配着凤冠红裙来定头式罢?凤冠珠子左镶又不对、右镶又不对。连裙上绣的线 色儿都能差池,还得令他们重做去,你说气不气人?”“那些工匠也实实的能淘气,拿片子送去打一顿就好了!”二太太凑趣道,“姑娘出阁, 大事呢!哪能叫他们耽误了?对了,我新得了匹蝴蝶花的雪缎子,花色倒新鲜,嫂子看看,给四姑娘压箱子充得过不?”大太太欢喜道:“多 承弟妹费心!”就起身去看。尤五姨娘一个人在屋里——不不,屋中还有那么多接生的婆娘们,送热水的、递剪子的、帮她掰腿的、揉她胸口 劝她深呼吸的,那么多那么多人。可她觉着是一个人。她是一个人在疼痛的海洋上颠簸,呼一下子,掀到浪尖上,哗一下子,又落到谷底,沉 沉沉沉的往下跌,没有底,一直要跌到死亡里,被漩涡嚼一圈,又再吐上来,抛到浪尖上的某一刻,疼痛很轻了,几乎可以消失了,她受的罪 好像可以
SO2 + 2H2S = 2H2O + 3S
氧化剂 还原剂 得4e-
+4 被氧化 +6
S
S
4.还原性
2SO2 + SO3 + H2O
+4
+4 催化剂 +6 O2 △ 2SO3
H2SO4
工业制硫酸
H2SO3露置在空气中
2H2SO3+O2
Na2SO3露置在空气中
2H2SO4 2Na2SO4
+6
+6
2Na2SO3+O2
+4
SO2 还可被Cl2、Br2、I2、 KMnO4、HNO3等氧化
SO2+2H2O+Cl2=H2SO4+2HCl SO2+2H2O+Br2=H2SO4+2HBr SO2+2H2O+I2 =H2SO4+2HI 5SO2+2H2O+2KMnO4 = 2H2SO4+ K2SO4 +2 MnSO4
SO2可以使氯水、溴水、碘水、高锰酸钾溶液褪色。
①Na2O2(氧化漂白)、
②HClO(氧化漂白);
③H2O2(氧化漂白)
④O3 (氧化漂白)
⑤SO2(与有色物化合成无色物)
⑥活性炭(物理吸附有色物质)。
【思考】硫有哪些常见化合价?根据有关理论推 测 SO2除具有酸的通性外,可能还具有的性质。
0
S
被还原
+4
S
被氧化
+6
S
0
3、氧化性
失4e+4 -2
A、通入澄清石灰水中
B、先通入澄清石灰水中,再通入品红溶 液中
C、先通入足量酸性高锰酸钾溶液中,再通 入澄清石灰水中 入澄清石灰水中
D、通入品红溶液
6、已知下列氧化剂均能氧化+4价的硫元 素,为除去稀硫酸中混有的亚硫酸,以得 到纯净的稀硫酸,应选用最合理的氧化剂 是:
A、KMnO4;
C、H2O2;
4、有关二氧化硫叙述正确的是:
A、二氧化硫能使溴水、酸性高锰酸钾溶液
褪色;
B、实验室可用启普发生器制二氧化硫;
C、用澄清的石灰水很容易区分CO2与SO2;
D、SO2的漂白性与Cl2、HClO、Na2O2、O3 的漂白性的漂白原理不同;
5.为检验SO2中是否混有少量的CO2气体 C ) 杂质,以下方法正确的是 (
B、Ca(ClO)2;
D、Cl2;
7、现有雨水样品1份,每隔一段时间测定该雨水 样品的pH,所得数据如下: 测试时间/h 雨水的 pH 4.73 4.62 4.56 4.55 4.55 分析数据,回答下列问题: ①雨水样品的pH变化的原因是(用化学方程式 表示)________ ▲________。 ②如果将刚取样的上述雨水和自来水(用氯气 消毒)相混合,pH将__▲ _(填“增大” 、 “减小”或”不变“),原因是(用化学方 程式
3、2003年5月12日,杭州富阳某造纸厂一名工人 在生产作业时不慎跌入纸浆池中,3名工人见状后 相继下池救助,均被有毒气体毒倒,造成3人因抢 救无效死亡。经查,此有毒气体主要是二氧化硫, 下列有关叙述不正确的是 A、作用可能是为了漂白纸浆 B、池中的二氧化硫可能是由亚硫酸盐反应后产 生的 C、二氧化硫是一种没有气味、没有颜色、不易 被觉察的气体 D、二氧化硫在池中能达到较大浓度,是由于二 氧化硫的密度比空气大。
二氧化硫化学性质
1:具有酸性氧化物的通性
(1) 与H2O反应: SO2+H2O H2SO3(亚硫酸) *亚硫酸是一种中强酸,在水中部分电离:
H2SO3
H+ +HSO3-
HSO3-
H+ +SO3 2-
(2) 与碱性氧化物反应:SO2+Na2O=Na2SO3 (3) 与碱反应 SO2(少量)+2NaOH=Na2SO3+H2O SO2(过量)+NaOH=NaHSO3 (SO2与澄清石灰水反应,有与CO2类似的现象) 【思考】怎样区别 SO2与CO2 ?
2、将下列环境问题所对应的主要原因(A—F)填在相应 的空格中(每格中只填一个字母)。 环境问题 产生原因 酸雨 ▲ A、CO2浓度不断上升 水土流失 ▲ B、大量使用塑料包装袋和塑料 农用地膜 温室效应 ▲ C、工业上大量排放SO2 臭氧层被破坏 ▲ D、大量使用农药和化肥 白色污染 ▲ E、乱砍滥伐森林 土壤污染 ▲ F、大量使用氟利昂制品 水体富营养化 ▲ 。 G、生活污水的大量排放 (赤潮)
11
环境保护
二氧化硫的污染——空气中的二氧化硫主要 来自于化石燃料(如煤与石油)的燃烧。 *钙基固硫:(煤中加入适量生石灰) CaO+SO2=CaSO3 2CaSO3+O2=2CaSO4 (CaSO4与水作用生成生石膏CaSO4· 2H2O)
【练习】 1、下列物质不属于“城市空气质量日报”报道 的是 A 二氧化硫 B 氮氧化物 C 二氧化碳 D 悬浮颗粒
