第三章 红外光谱法2--本科生
合集下载
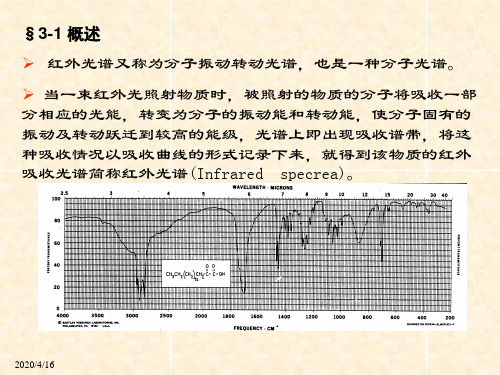
红外光谱(IR)分析

4. 空间效应: (1)环状化合物的环张力效应:环张力越大,羰 基C=O频率越高。 环张力 四元环 五元环 六元环 (2)空间位阻效应:空间位阻使羰基与双键之间 的共轭受限制,故使C=O频率增高。 5. 氢键效应:氢键的形成,通常可使伸缩振动 频 率向低波数方向移动。
6. 振动偶合效应:当两个基团靠得很近时,产 生振动相互作用,使吸收峰发生分裂。
第三章 红 外 吸 收 光 谱 法
Infrared Absorption Spectrometry
§1 关于红外光谱
红外光谱在可见光区域微波区之间,其波长范 围约为0.75~1000m。
分为三个区: ◆近红外区 0.75~2.5m; ◆中红外区 2.5~25 m; ◆远红外区 25~1000 m
若分子由N个原子组成,则 需3N个坐标(自由度)确定N个原子位置; 分子自由度总数=平动、振动、转动自由度 总和 故 3N=平动自由度+转动自由度+振动自由度 即 振动自由度=3N-(平度自由度+转动自由度) 问题:怎样确定一个分子的平动自由度和 转动自由度?
(1) 平动自由度:分子的质心可沿x、y、z三 个坐标轴方向移动,故平动自由度=3。
2. 共轭效应(C效应):该效应使共轭体系具有 共平面性,电子云密度平均化,造成双键略有 伸长,单键略有缩短。故双键的吸收峰频率向 低波数方向移动。
例. C=O C=O 1715 cm-1 1685~1665 cm-1
3. 中介效应(M效应): 例. C=O 在1680cm-1附近。 若用诱导效应看,则电负性大的N原子应使 C=O键力常数增加,吸收峰位应大于1715cm-1; 但实际情况相反,这是因中介效应造成的。 即N原子上的孤对电子与C=O的电子发生重 叠(p- 共轭),使电子云密度平均化,造成C=O 键力常数降低,故使吸收峰频率移向低波数。
第3章红外光谱法1共26页文档
2020/4/16
二、红外光谱法的特点 1、任何气态、液态和固态样品均可进行测定; 2、红外光谱可用来鉴定未知物的分子结构或确定其 化学基团; 3、样品用量少。
2020/4/16
§3-2 红外光谱法的基本原理 一、产生红外吸收的条件 1. 振动的偶极距必须发生变化
首先我们介绍一下偶极距的概念: 分子是由原子构成的,如果组成一个分子的原子的电负性不 同,此分子将表现出极性,如HCl,由于H与Cl的电负性不同, H带部分正电荷,Cl带部分负电荷。HCl的一端显“+”,一端 显“-”,在物理学上这种状态称为偶极子。 分子极性的大小,用偶极距描述,如HCl
H带正电荷+q,Cl带负电荷-q,两 原子中心距离为d,则偶极距为:
=qd
2020/4/16
当偶极子处在电磁辐射的电磁场中时,该电场做周期性反转, 偶极子将经受交替的作用力。如下图:
-
+
-
+
+
+
+
+
—
-
-
-
+
-
+
-
偶极子具有一定的原有振动频率,当辐射的频率与偶极子原 有频率匹配时,分子振动在电场作用下被加强,分子由低能 态跃向高能态。此时分子振动幅度增大,偶极距发生变化。 辐射能通过电场将能量传给分子,自身光强减弱,从宏观上 讲分子产生了吸收,致使光强减弱。
1 En(n 2)h ν n0,12 , 3 , .....
n为振动量子数
在常温下,绝大多数分子处于基态(n=0),接受能量后跃迁到 第一振动激发态(n=1),此时跃迁能差为
E(11)h(01)hh
2
2
吸收光子的能量为ha ,则 E= hν=ha
二、红外光谱法的特点 1、任何气态、液态和固态样品均可进行测定; 2、红外光谱可用来鉴定未知物的分子结构或确定其 化学基团; 3、样品用量少。
2020/4/16
§3-2 红外光谱法的基本原理 一、产生红外吸收的条件 1. 振动的偶极距必须发生变化
首先我们介绍一下偶极距的概念: 分子是由原子构成的,如果组成一个分子的原子的电负性不 同,此分子将表现出极性,如HCl,由于H与Cl的电负性不同, H带部分正电荷,Cl带部分负电荷。HCl的一端显“+”,一端 显“-”,在物理学上这种状态称为偶极子。 分子极性的大小,用偶极距描述,如HCl
H带正电荷+q,Cl带负电荷-q,两 原子中心距离为d,则偶极距为:
=qd
2020/4/16
当偶极子处在电磁辐射的电磁场中时,该电场做周期性反转, 偶极子将经受交替的作用力。如下图:
-
+
-
+
+
+
+
+
—
-
-
-
+
-
+
-
偶极子具有一定的原有振动频率,当辐射的频率与偶极子原 有频率匹配时,分子振动在电场作用下被加强,分子由低能 态跃向高能态。此时分子振动幅度增大,偶极距发生变化。 辐射能通过电场将能量传给分子,自身光强减弱,从宏观上 讲分子产生了吸收,致使光强减弱。
1 En(n 2)h ν n0,12 , 3 , .....
n为振动量子数
在常温下,绝大多数分子处于基态(n=0),接受能量后跃迁到 第一振动激发态(n=1),此时跃迁能差为
E(11)h(01)hh
2
2
吸收光子的能量为ha ,则 E= hν=ha
第三章红外光谱IR
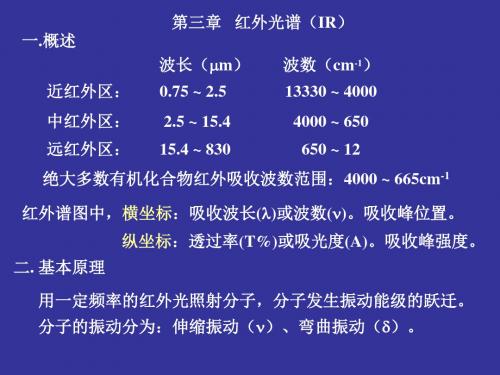
烷烃吸收峰
正己烷的红外光谱图
2,2,4-三甲基戊烷的红外光谱图
2、不饱和烃
• 烯烃 • 炔烃 • 芳香烃
2、1 烯烃 烯烃双键的特征吸收
影响双键碳碳伸缩振动吸收的因素
• 对称性:对称性越高,吸收强度越低。 • 与吸电子基团相连,振动波数下降,吸
收强度增加。 • 取代基的质量效应:双键上的氢被氘取
代后,波数下降10-20厘米-1。质量效应 • 共轭效应:使波数下降约30厘米-1 。
1-己烯的红外光谱图
~3060cm-1: 烯烃C—H伸缩振动;~1820:910cm-1倍频; ~1650cm-1: C=C伸缩振动;~995,905cm-1: C=CH2 非平面摇摆振动
顺式和反式2,2,5,5-四甲基己烯红外光谱 a 顺式 b 反式
v~
=
1
——
K
2C M
M = m1 m2 m1 + m2
双原子分子红外吸收的频率决定于折合质量和键力常数。
C-H C-C C-O C-Cl C-Br C-I
-1 cm
3000
1200 1100
800
550
500
v cm-1
力常数/g.s-2
CC 2200~2100
12~18105
C=C 1680~1620
C-H面外弯曲振动吸收峰位置(cm-1) 670
770-730,710-690 770-735
810-750,710-690 833-810
780-760,745-705 885-870,825-805 865-810,730-675
810-800 850-840 870-855
870
各类取代苯的倍频吸收和面外弯曲振动吸收
有机波谱解析-第三章_红外光谱

由于红外光谱吸收强度受狭缝宽度、温度和溶剂等因素影 响,故不易精确测定,在实际分析中,只是通过与羰基等强吸 收峰对比来定性研究。
谱带强度与振动时偶极矩变化有关,偶极矩变化愈 基团极性 大,谱带强度愈大;偶极矩不发生变化,谱带强度为0, 即为红外非活性。 电子效应
红外吸收强度 偶极距变化幅度 振动偶合
伸缩振动(
as
)两种形式。
弯曲振动:原子垂直于化学键方向的运动。又可以分
它们还可以细分为摇摆、卷曲等振动形式。
为面内弯曲振动()和面外弯曲振动( )两种形式,
+和-表示垂直于纸面方向的前后振动。
亚甲基的振动形式
三、分子振动与红外吸收峰的关系
理论上具有特定频率的每一种振动都能吸收相应 频率的红外光,在光谱图对应位臵上出现一个吸收 峰。实际上,因种种原因分子振动的数目与谱图中
纵坐标为: 百分透过率(%) 横坐标为: 波长(µ m)或波 数(cm-1)。
环戊烷
也可用文字形式表示为:2955cm-1(s)为CH2的反对称伸缩振动 (υasCH2),2870cm-1(m)为CH2的对称伸缩振动(υsCH2) 1458cm-1(m) 为CH2的面内弯曲振动(δ面内CH2),895cm-1(m)为CH2的面外弯曲振动 (面外CH2)
诱导效应大于共轭效应, C=O 蓝移至 1735 cm-1
三、空间效应
(1)空间位阻 破坏共轭体系的共平面性,使共
轭效应减弱,双键的振动频率蓝移(增大)。
CH(CH3)2 O O O
CH3 CH3
CH3 CH(CH3)2
CH3
1663cm-1
1686cm-1
1693cm-1
(2)环的张力:环的大小影响环上有关基 团的频率。
第三章 红外吸收光谱-2

氢键区 叁键区 双键区 C≡C C-H C=C 伸缩 C≡N O-H C=O 振动 N-H 苯 ν C-H ——C-H键的伸缩振动 δC-H ——C-H键的弯曲振动
一、氢键区:4000~2500cm-1
X-H 伸缩振动吸收范围。X代表O、N、C、 S, 对应醇、酚、羧酸、胺、亚胺、炔烃、烯 烃、芳烃 及饱和烃类的 O-H、N-H、C-H 伸缩振动。 1. O-H
3000
2000
-CC-H ~2120 ~1370 ~1550 -NO2 >C=O ~1715 C=C ~1630
1000
游离OH ~3600 缔合OH ~3300
-NH2 3300~ 3500 -NHR C=C-H
COOH ~3000 -SH 2600~2550 -CHO 2820,2720
C-O-C 1300~1020 苯 指 纹 区
OH伸缩: NH伸缩: CH伸缩: 3200-3650cm-1 3300-3500cm-1 3000cm-1
饱和<的CH: <3000cm-1
不饱和C的CH:>3000cm-1
醛基的CH:
二、叁键区(2500-2000 cm-1)
叁键、累积双键(-C≡C-、-C≡N、 >C=C=C<、 -N=C=O、-N=C=S) 谱带为中等强度吸收或弱吸收。 干扰少,容易识别。
770~730cm-1 vs 710~690cm-1 s 5个相邻H
770~735cm-1 4个相邻H 900~860cm-1 810~750cm-1 725~680cm-1 3个相邻H 860~800cm-1 2个相邻H
vs m vs m vs
退 回
-(CH2)n- 平面摇摆δ
n≥4
IR-1第三章红外光谱-波谱分析课程

光栅型分辨率:0.2cm-1重现性好 扫描速度快(<0.1s),可作快速反应动力学研究
, 并可与GC、LC联用。色散型:只能观测较窄的扫 描 一次需8、15、30s等。 杂散光不影响检测。 对温度湿度要求不高。 光学部件简单,不易磨损。
3.3 试样的处理和制备
3.3a 红外光谱法对试样的要求
薄膜法
高分子化合物可直接加热熔融后涂制或压制成膜。也可 将试样溶解在低沸点的易挥发溶剂中,涂在盐片上,待溶 剂挥发后成膜测定。
4 基团频率和特征吸收
1. 基团频率区和指纹区 2. 红外光谱的区域划分 3. 影响基团频率的因素
4.1基团频率区和指纹区 指纹区:1300 cm-1-600 cm-1
基团频率区 (官能团区或 特征区)
试样:液体、固体或气体
1 试样
– 单一组份的纯物质:纯度>95%或符合商业规格,便于与 纯物质的标准光谱进行对照
– 多组份混合试样:测定前先用分馏、萃取、重结晶或色谱 法进行分离提纯,否则各组份光谱相互重叠,难于判断
A-2 试样中不应含水分: 水有红外吸收(3500及 1640cm-1),严重干扰谱图;腐蚀吸收池的盐窗。
转动能级
△ E电子 △ E振动 △ E转动 红外吸收光谱由分子振动-转动能级跃迁引起的
1.2 红外光区的划分
红外光谱在可见光区和微波光区之间,波长范 围约为 0.75 ~ 1000µm,
1.3 红外光谱的测定过程
当样品受到频率连续变化的红外光照射时,分子 吸收了某些频率的辐射,并由其振动或转动运动 引起瞬时偶极矩的变化,产生分子振动和转动能 级从基态到激发态的跃迁,使相应吸收红外光区域 的透射光强度减弱。记录百分透射率与波数(或 波长)关系曲线,就得到红外光谱。
, 并可与GC、LC联用。色散型:只能观测较窄的扫 描 一次需8、15、30s等。 杂散光不影响检测。 对温度湿度要求不高。 光学部件简单,不易磨损。
3.3 试样的处理和制备
3.3a 红外光谱法对试样的要求
薄膜法
高分子化合物可直接加热熔融后涂制或压制成膜。也可 将试样溶解在低沸点的易挥发溶剂中,涂在盐片上,待溶 剂挥发后成膜测定。
4 基团频率和特征吸收
1. 基团频率区和指纹区 2. 红外光谱的区域划分 3. 影响基团频率的因素
4.1基团频率区和指纹区 指纹区:1300 cm-1-600 cm-1
基团频率区 (官能团区或 特征区)
试样:液体、固体或气体
1 试样
– 单一组份的纯物质:纯度>95%或符合商业规格,便于与 纯物质的标准光谱进行对照
– 多组份混合试样:测定前先用分馏、萃取、重结晶或色谱 法进行分离提纯,否则各组份光谱相互重叠,难于判断
A-2 试样中不应含水分: 水有红外吸收(3500及 1640cm-1),严重干扰谱图;腐蚀吸收池的盐窗。
转动能级
△ E电子 △ E振动 △ E转动 红外吸收光谱由分子振动-转动能级跃迁引起的
1.2 红外光区的划分
红外光谱在可见光区和微波光区之间,波长范 围约为 0.75 ~ 1000µm,
1.3 红外光谱的测定过程
当样品受到频率连续变化的红外光照射时,分子 吸收了某些频率的辐射,并由其振动或转动运动 引起瞬时偶极矩的变化,产生分子振动和转动能 级从基态到激发态的跃迁,使相应吸收红外光区域 的透射光强度减弱。记录百分透射率与波数(或 波长)关系曲线,就得到红外光谱。
红外光谱_2

大
振动能 小
能级差 (eV) 1-20
0.05-1
吸收的辐射能 光谱
可见光和紫外 电子光 谱
11 中红外区
振动光
三、红外吸收产生的原理
辐射 分子振动能级跃迁 红外光谱 官能团 分子结构 分子的振动所需的能量远大于分子的转动所需的 能量,因此对应的红外吸收频率也有差异:
远红外区:波长长,能量低,对应分子的转动吸收
一个整体,其运动状态可分为平动、 f总=f振+f平+f转=3N
转动、振动三类。分子总自由度应
该等于平动、转动和振动自由度的 f振=3N -f平-f转
总和,即:
26
三、红外吸收产生的原理
每一种振动形式都会产生一个基频峰,即一个 多原子分子所产生的基频峰的数目应该等于分子所 具有的振动形式的数目。无论是线形分子还是非线 形分子其平动的自由度都等于3。
2
dx 则 m d t2 = - kx(1)
c c
1k
v = 2π m
(3)
x = A cos (2π v t + Ф) (2) 1k
用波数表示 = 2πc m
(波数)与K成 正比; 与原子质量成反比
对双原子分子来说,约合质量
m1 m2 μ=
代替m: =
m1+m2
1 2πc
k μ
发生振动能级跃迁需要的能量的大小取决于键两端原
样品吸收红外辐射的主要原因是: 分子中的化学键
因此, IR可用于鉴别化合物中的化学键类型,可 对分子结构进行推测。既适用于结晶质物质,也 适用于非晶质物质。 应用:有机化合物的结构解析 定性:基团的特征吸收频率 定理:特征峰的强度
6
二、红外光区的划分
第三章 红外光谱法--本科生

1. 红外辐射光的频率与分子振动的频率相 当,才能满足分子振动能级跃迁所需的能 量,而产生吸收光谱。 2. 必须是能引起分子偶极矩变化的振动才能 产生红外吸收光谱。
4 吸收谱带的强度
红外光谱的吸收带强度即可用于定量分析,也是 化合物定性分析的重要依据。 基态分子中的很小一部分,吸收某种频率的红外 光,产生振动的能级跃迁而处于激发态。激发态分子 通过与周围基态分子的碰撞等原因,损失能量而回到 基态,它们之间形成动态平衡。跃迁过程中激发态分 子占总分子的百分数,称为跃迁几率,谱带的强度即 跃迁几率的量度。跃迁几率与振动过程中偶极矩的变 化(△μ)有关,△μ越大,跃迁几率越大,谱带强度 越强。
特征区(官能团区)分为三个区域:
(2)2500~1900 为叁键和累积双键区。 主要包括-CC、 -CN等等叁键的伸缩振动,以及-C =C=C、C=C=O等累积双键的不对称性伸缩振动。 对于炔烃类化合物,可以分成R-CCH和R-C C-R两种类型, RCCH的伸缩振动出现在2100~2140 cm-1附近; R-C C-R出现在 2190~2260 cm-1附近;-C N基的 伸缩振动在非共轭的情况下出现在 2240~2260 cm-1附近。当与不饱和键或芳香核共轭时,该峰位移到 2220~2230 cm-1附近。
k /N.cm
7.7 6.4
折合质量μ :μ ↓,(v)↑,红外吸收信号将出现在 高波数区。
v
振 σ
1 k 2 c
吸收峰的峰位:化学键的力常数k越大,原子的折 合质量越小,振动频率越大,吸收峰将出现在高波数 区(短波长区);反之,出现在低波数区(高波长区)
v
v
ቤተ መጻሕፍቲ ባይዱ
结论:
产生红外光谱的必要条件是:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.5.2 试样的处理和制备
要获得一张高质量红外光谱图,除了仪器本身的因素外, 还必须有良好的红外光谱测定技术。红外光谱测定技术分为 两类。 一类是指检测方法 如透射、衰减全反射、漫反射、 光声及红外发射等。 通常测定的都是透射光谱 一类是指制样技术 采用的制样技术主要有压片法、 糊法、膜法、溶液法、衰减全反射 和气体吸收池法等。
应用红外光谱进行定性分析的一般过程:
(1)试样的分离和精制 (2)了解试样来源及性质
计算不饱和度U的经验式为:
U =1+n4+1/2(n3-n1)
式中n1, n3, 和n4分别为分子式中 一价,三价和四价
原子的数目。通常规定双键(C=C、C=O)和饱和 环状结构的不饱和度为1,三键(C≡C、C≡N等) 的不饱和度为2,苯环的不饱和度为4(可理解为 一个环加三个双键)。链状饱和烃的不饱和度为零。
示例
水分子——非线性分子
F 3 3 6 3
吸收谱带的强度
红外吸收谱带的强度取决于分子振动时偶极矩的变化, 而偶极矩与分子结构的对称性有关。振动的对称性越高, 振动中分子偶极矩变化越小,谱带强度也就越弱。 一般地,极性较强的基团(如C=0,C-X等)振动,吸收
强度较大;极性较弱的基团(如C=C、C-C、N=N等)振动, 吸收较弱。
固体试样
(3)薄膜法 主要用于高分子化合物的测定。可将它们直接加热熔 融后涂制或压制成膜。也可将试样溶解在低沸点的易挥发溶 剂中,涂在盐片上,待溶剂挥发后成膜测定。 (4) 衰减全发射法(ATR) 当样品量特别少或样品面积特别小时,采用光束聚光 器,并配有微量液体池、微量固体池和微量气体池,采用全 反射系统或用带有卤化碱透镜的反射系统进行测量。
1 928cm-1
(ii)共轭效应(C效应)。共轭效应使共轭体系中的 电子云密度平均化,结果使原来的双键略有伸长(即 电子云密度降低),力常数减小,使其吸收频率往往 向低波数方向移动。
R
C O
R
C O
R
C O
1 665cm-1
1 715cm-1
1 680cm-1
(iii)中介效应(M效应)。当含有孤对 电子的原子(O、N、S等)与具有多重键 的原子相连时,也可起类似的共轭作用, 成为中介效应。例如,酰胺、酯
举例:
例1:由元素分析某化合物的分子式为C4H6O2,测 得红外光谱如图2.16,试推测其结构。
解: 由分子式计算不饱和度U = 4-6/2+1= 2 特征区:3 070cm-1有弱的不饱和C—H伸缩振动吸收, 与1 650cm-1的vc=c 谱带对应表明有烯键存在,谱带较 弱,是被极化了的烯键。 1 765cm-1强吸收谱带表明有羰基存在,结合最强吸收 谱带1 230cm-1和1 140cm-1的C-O-C吸收应为酯基。 这个化合物属不饱和酯,根据分子式有如下结构: (1) CH2=CH-COO-CH3 丙烯酸甲酯 (2) Biblioteka H3-COO-CH=CH2 醋酸乙烯酯
红外光谱法对试样的要求
红外光谱的试样可以是液体、固体或气体,一般应要求:
(1)单一组份的纯物质,纯度应>98%或符合药典规格 (多组分抗生素不列入红外光谱鉴别) (2)试样应适当干燥。水本身有红外吸收,会严重干扰样品 谱,而且会侵蚀吸收池的盐窗。
(3)试样的浓度和测试厚度应选择适当,以使光谱图中的大 多数吸收峰的透射比处于10%~80%范围内。
吸收峰的数量与振动的自由度有关。振动的自由度 指分子独立的振动数目或基本的振动数目.
分子自由度 平动自由度 转动自由度 振动自由度 3N
分子振动自由度 3N (平动自由度 转动自由度)
非线性分子: 3N 6 F
线性分子: 3N 5 F
• • •
注: 振动自由度反映吸收峰数量 并非每个振动都产生基频峰 吸收峰数常少于振动自由度数
R C O
1 650cm-1
NH2
R
C O
OR'
1 735cm-1
(2)氢键的影响
氢键的形成使电子云密度平均化,从而使伸缩 振动频率降低。
O......H RCOOH (游离) R C O H......O O C R(二聚体)
1 760cm-1
1 700cm-1
(3)振动偶合
当两个振动频率相同或相近的基团相邻并具有一公共 原子时,由于一个键的振动通过公共原子使另一个键 的长度发生改变,产生一个“微扰”,从而形成了强 烈的振动相互作用。其结果是使振动频率发生变化, 一个向高频移动,一个向低频移动,谱带裂分。
红外光谱的吸收强度一般定性地用很强(vs)、强(s)、中(m)、 弱(w)和很弱(vw)等表示。
3.4 影响基团频率位移的因素
1 外部因素 试样状态、测定条件的不同及溶剂极性的影响等 外部因素都会引起频率位移。一般气态时C=O伸缩振 动频率最高,非极性溶剂的稀溶液次之,而液态或固 态的振动频率最低。 同一化合物的气态和液态光谱或固态光谱有较大 的差异,因此在查阅标准图谱时,要注意试样状态及 制样方法等。
制样的方法
1 .气体样品 气态样品可在玻璃气槽内进行测定,它的两端粘有红外透光的NaCl或 KBr窗片。先将气槽抽真空,再将试样注入。
2 . 液体和溶液试样
(1)液体池法 沸点较低,挥发性较大的试样,可注入封闭液体池中,液层厚度一般为 0.01~1mm。 (2)液膜法 沸点较高的试样,直接滴在两片盐片之间,形成液膜。 对于一些吸收很强的液体,当用调整厚度的方法仍然得不到满意的谱图 时,可用适当的溶剂配成稀溶液进行测定。 常用的红外光谱溶剂应在所测光谱区内本身没有强烈的吸收,不侵蚀盐 窗,有CCl4 、 CCl3 、CS2、C6H12等。
2 内部因素
1)电子效应 (i)诱导效应(I效应)。由于取代基具有不同的电 负性,通过静电诱导作用,引起分子中电子分布的 变化,从而改变了键力常数,使基团的特征频率发 生位移。
δ-
O
O R' R C Cl Cl
O C Cl F
O C F
R
C
δ
+
1 715cm-1
1 800cm-1
1 828cm-1
FTIR光谱仪具有以下优点:
a 光学部件简单,只有一个动镜在实验中转动, 不易磨损。 b 测量范围宽,其波数范围可达到45 000~6cm-1 c 精度高,光通量大,所有频率同时测量,检 测灵敏度高。 d 扫描速度快,可作快速反应动力学研究,并 可与气相色谱GC、液相色谱LC联用。 e 杂散光不影响检测。
测量操作注意事项
环境条件:红外实验室的室温应控制在15~30℃,相对 湿度应小于65%,适当通风换气,以避免积聚过量的二 氧化碳和有机溶剂蒸汽。 采用压片法时,以溴化钾最常用。若供试品为盐酸盐, 可比较氯化钾压片和溴化钾压片法的光谱,若二者没有 区别,则使用溴化钾。 供试品研磨应适度,通常以粒度2~5μ m为宜。供试品过 度研磨有时会导致晶格结构的破坏或晶型的转化。 压片模具及液体吸收池等红外附件,使用完后应及时擦 拭干净,必要时清洗,保存在干燥器中,以免锈蚀。
3.5 红外光谱仪及样品制备技术
3.5.1红外光谱仪
分为色散型和付里叶变换型两种。
1.色散型红外光谱仪
3.5 红外光谱仪及样品制备技术
2.Fourier变换红外光谱仪(FTIR)
红外光谱仪
Fourier变换红外光谱仪的特点:
(1)扫描速度极快 (2)具有很高的分辨率
(3)灵敏度高
指纹区 a 作为化合物含有什么基团的旁证,指纹区许多吸收 峰都是特征区吸收峰的相关峰。 b 确定化合物的细微结构
总的图谱解析可归纳为:先特征,后指纹;先最 强峰,后次强峰;先粗查,后细找;先否定,后肯定。 一抓一组相关峰。光谱解析先从特征区第一强峰入手, 确认可能的归属,然后找出与第一强峰相关的峰。第 一强峰确认后,再依次解析特征区第二强峰、第三强 峰,方法同上。对于简单的光谱,一般解析一、两组 相关峰即可确定未知物的分子结构。对于复杂化合物 的光谱由于官能团的相互影响,解析困难,可粗略解 析后,查对标准光谱或进行综合光谱解析。
O R R C O C O
~1 820cm-1
O R R C O C O
~1 760cm-1
(4)Fermi共振
当一振动的倍频与另一振动的基频接近时,由 于发生相互作用而产生很强的吸收峰或发生裂 分,这种现象叫Fermi共振。
COCI
1 773cm-1和1 736 cm-1出现两个C=O吸收峰。
3.5 红外光谱仪及样品制备技术
固体试样
(1)压片法 将1~2mg试样与200mg纯KBr研细均匀,置于模具 中,用(5~10)107Pa压力在油压机上压成透明薄片,即 可用于测定。试样和KBr都应经干燥处理,研磨到粒度小于 2微米,以免散射光影响。 (2)石蜡糊法 将干燥处理后的试样研细,与液体石蜡或全氟代烃混 合,调成糊状,夹在盐片中测定。
3.6 红外吸收光谱法的应用
1 定性分析
红外光谱对有机化合物的定性分析具有鲜明的特征性。因为 每一化合物都具有特征的红外吸收光谱,其谱带数目、位置、形 状、和相对强度均随化合物及其聚集态的不同而不同,因此根据 化合物的光谱,就像辨认人的指纹一样,确定化合物或其官能团 是否存在。 红外光谱定性分析,大致可分为官能团定性和结构分析两个 方面。官能团定性是根据化合物的红外光谱的特征基团频率来检 定物质含有哪些基团,从而确定有关化合物的类别。结构分析或 称结构剖析,则需要由化合物的红外光谱并结合其它实验资料 (如相对分子量、物理常数、紫外光谱、核磁共振波谱、质谱等) 来推断有关化合物的化学结构。
这两种结构的烯键都受到邻近基团的极化,吸收强度较高。
普通酯的vC=O在1 745cm-1附近,结构(1)由于共轭效应vC=O频 率较低,估计在1700cm-1左右,且甲基的对称变形振动频率在1 440cm-1处,与谱图不符。谱图的特点与结构(2)一致,vC=O频 率较高以及甲基对称变形振动吸收向低频位移(1 365cm-1), 强度增加,表明有CH3COC-结构单元。vsC-O-C升高至1 140cm-1 处。且强度增加,表明不饱和酯。 指纹区:δ=CH 出现在955和880cm-1,由于烯键受到极化,比正 常的乙烯基δ=CH位置(990和910cm-1)稍低。 由上图谱分析,化合物的结构为(2),可与标准图谱对照
