第十四章过渡元素分析
第十四章过渡元素ⅣB-ⅦBⅧ-资料

( n=0 )
( n=2 )
(不稳定)
Fe2+ Fe3+无此配合物
.
无机化学
Thank you
1–3. 过渡元素的氧化态.
由于d电子的部分或全部参加成键,所以过渡 元素的氧化态一般从+Ⅱ~与族数
相同的最高氧化态.见p1049 表21–8. 同一周期.从左→右 氧化态↑ ⅦB 最高,然后
↓. 同一族.自上而下,高氧化态比较稳定,而主族
低氧化态比较稳定;
无机化学
六、资产配置
• 资产配置的定义、类别 • 战略资产配置:主要针对各资产大类 • 战术资产配置:主要针对各资产子类、行业
与酸反应 Cr( 无氧化膜 ), 可溶于稀 HN Mo、W可溶于HNO3+HF 与非金属反应. 易形成合金
无机化学
3-2.重要化合物
1.CrO3 2.Cr2O3 3.重铬酸盐 4.铬酸盐(CrO24- ) 5.钼酸盐.
无机化学
4-2.
Hale Waihona Puke .1.Mn(Ⅱ)2.MnO2 3.KMnO4
1.Mn(Ⅱ)
Mn(Ⅱ)具有还原性
2Mn2++5S2O
2Mn(OH)2+O2=2MnO(OH)2↓
白色
棕褐色
2.MnO2
MnO2黑色粉末具有氧化性 MnO2+4HCl D= MnCl2+Cl2+2H2O 2MnO2+4KOH+O2=2K2MnO4+2H2O pH>14预定
3MnO +4H+=2MnO+MnO2+H2O
无机化学
1-1. 过渡元素的价电子层结构.
(n-1)d1~10ns1~2 (Pd:4d105s0) d电子数较多.d电子可部分或全部成键. d轨道未充满可接受孤电子
无机化学区过渡元素优秀课件

造成这种两峰一谷的原因有三个:
其一为电子的精细结构, 即由于具有半充满 f 层(f7)的 Eu 和全充满 f 层(f14)的Yb 只用2个 6s2 电子形成金属键, 因 而键较弱、核间距较大, 故在Eu和Yb处出现两个峰值, 而Ce 平均用3.1个电子成键, 金属键较强, 其半径略小于Pr, 故在 Ce处微凹成一小谷。其余镧系元素均以三个电子成键, 故随 原子序数的增大, 半径均匀减小。
由于La到Lu的15个元素在物理性质、化学性质上的相 似性和连续性, 人们习惯上把La(4f0)到Lu(4f14)的15个元素 统称为镧系元素(简写为Ln),
同样地, 把Ac(5f0)到Lr(5f14)的15个元素统称为锕系 元素(简写为An)。这样, f区元素包含了由4f0到4f14的15 个镧系元素和由5f0到5f14的15个锕系元素。
La、Gd、Lu的构型可以 用f0、f7、f14(全空、半满和全 全满)的洪特规则来解释, 但Ce的结构尚不能得到满意的解释, 有 人认为是接近全空的缓故。
这两种电子结构可以用来说明镧系元素化学
性质的差异。
这些元素在参加化学反应时需要失去价电子, 由于4f轨道被外层电子有效地屏蔽着, 且由于 E4fE5d, 因而在结构为4fn6s2 的情况下, f电子要参 与反应, 必须先得由4f 轨道跃迁到 5d 轨道。这样, 由于电子构型不同, 所需激发能不同, 元素的化学 活泼性就有了差异。
10.1.1 镧系元素的价电子层结构
下表列出镧系元素在气态时和在固态时原子的电子层结构。
镧系元素气态原子的4f轨 道的充填呈现两种构型, 即4fn-1 5d16s2和4fn6s2, 这两种电子构型 的相对能量如左图所示。
过渡元素的结构特点与基本性质

过渡元素的结构特点与基本性质元素周期表中第四、五、六七周期元素中,第ⅢB~ⅤⅢ族,共25种元素,统称为过渡元素。
过渡元素的单质都是金属,所以也称为过渡金属元素。
见表16.1.5s0,是一种例外的电子排布)。
镧系、锕系的元素的电子排布,增加的电子填入(n-2)f亚层,例如:57La 4f 05d1 6s 2,在结构上,它们最外层二个电子层都是未充满的,因此在元素周期表的划分上不属于过渡金属元素,而属于内过渡元素。
也称之为镧系、锕系元素。
镧系57La ~ 71Lu (15种元素) 4f 0~145d0-1 6s2锕系89Ac~103Lr铹(15种元素)5f 0~146d0~1 7s216.1.1 价电子构型过渡金属价电子构型的通式为:(n-1)d1~9 ns1~2。
原子核外电子排布遵循能量最低原理、保里不相容原理和洪特规则。
L. Pauling 原子轨道近似能级图如下:1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d也有一些电子排布例外的情况,例如:Z = 24,41 ~ 46:Nb 铌4d45s1不是4d35s241W 钨 5d46s2不是4d55s142Ru 钌4d75s1不是4d65s244Rh 铑4d85s1不是4d75s245Pd 钯4d105s0 不是4d85s24616.1.2 氧化态的规律过渡金属元素常表现为多种氧化态,其根本原因在于内层电子的排布,过渡金属外层电子排布为:(n-1)d1~9 ns1~2 ,(n-1)d轨道与ns轨道能量相近,部分(n-1)d电子参与成键。
例:Mn:+2 ~ +7均出现,主要+2,+3,+4,+6,+7.Fe:+2 ~ +6均出现,主要+2,+3,+6.过渡金属元素的最高氧化态与所在的族相等,最高氧化态= 所处的族数例:Sc +3 Ⅲ3d14s2Cr +6 Ⅵ3d54s1Mn +7 Ⅶ3d54s1但Ⅷ族:多数最高氧化态小于其族数,是因为随着有效核电荷的增加(Z *↑),不是所有(n-1)d 电子都参与成键。
BChap过渡元素全解

橙黄色;强碱性下无色
36
Ti(III)化合物
TiO2和TiCl4用H2或活泼金属还原,可得 Ti2O3和TiCl3
Ti(III)化合物一般均有色
[Ti(H2O)6]3+紫,[TiCl2(H2O)6]+绿
Nb和Ta存在镧系收 缩效应
V易形成多酸(类似 于Si、P)
39
氧化态和存在形式
氧化态
V
Nb
Ta
+2、+3
+4、+5
+5
+5
自然界存在形式
钒铅矿Pb5(VO4)3Cl、钒铀矿K(UO2)VO4、 绿硫钒石VS2
铌铁矿、钽钛矿FeM2O6
40
1. 单质
物理性质
均为银白色,熔沸点高,有较大的熔化热和 气化热
可降低Ti(IV)/Ti电极电势(次要原因) 破环氧化膜:TiO2+6HF=H2TiF6+2H2O 氧化膜破坏后,Ti极易溶解 Ti易溶于很稀的HF+HAc混酸中
26
化学性质
高温下Ti等很活泼 TiCl4
TiH2
600K
1000K
500K
Ti
TiO2
பைடு நூலகம்
1300K
TiB
1300K
TiC
TiN
精炼
Ti + 2I2 ~100oC TiI4,TiI4 >700oC Ti + 2I2
28
2. 化合物
+4
TiO2、TiOSO4、TiO32 TiCl4 TiF62-、TiCl62-、Ti(NH3)64+、Ti(NO3)4 ZrO2、HfO2、ZrF62-、ZrF73-
第14章-1过渡金属元素通性分析
Mn
Fe
717.4
759.4
1509.1
1561
3259
2957.4
Co
Ni Cu
758
736.7 746
1646
1753.0 1958
3232
3393 3554
二、电离能与氧化态
元素的电离能是衡量元素化学活泼性和说明元素 氧化态特征的参数之一:
1. 过渡金属的电离能随离子电荷的增加没有发生突变, 只是逐渐增大,(n-1)d电子与ns电子能量接近,都能起价 电子的作用,所以过渡金属表现出多种氧化态; 2. Fe3+离子的价电子构型为半充满的 3d5 稳定结构,所以 Fe具有比较小的第三电离能, Fe可直接氯化生成 FeCl3, 而 Fe 后的Co、Ni 由于第三电离能较大,直接氯化不能生 成三氯化物;
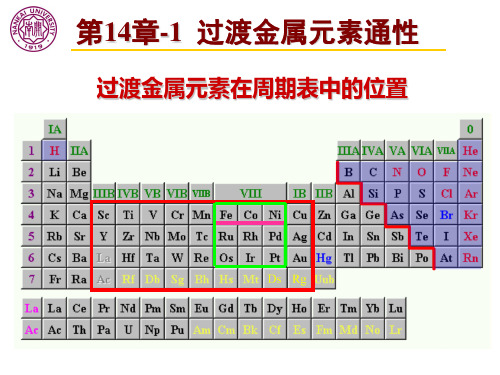
第14章-1 过渡金属元素通性
过渡金属元素在周期表中的位置
第14章-1 过渡金属元素通性
过渡元素占据长周期的第4、5、6、7周期;从 第ⅢB 族的钪族开始,到第ⅠB 族的铜族为止, 共9个直列36个元素,不包括镧系和锕系元素; 填充d电子,亦称d区元素; 1. 单质相似性,同一周期金属性递变不明显; 2. 可变的氧化态,d电子可以参与成键;
二、电离能与氧化态
第一过渡系元素的电离能 (kJ· mol-1)
元素 K Ca Sc Ti V Cr 第一电离能 418.9 589.8 631 658 650 652.8 第二电离能 3051.4 1145.4 1235 1310 1414 1496 第三电离能 4411 4912.0 2389 2652.5 2828.0 2987
3. 易形成配合物,配离子大多有颜色;
4. 单质或化合物往往具有磁性和催化性;
过渡元素化学知识点总结

过渡元素化学知识点总结过渡元素具有以下特点:1. 电子结构:过渡元素的电子结构特点主要是d轨道的填充,使得它们的化学性质发生变化。
具体来说,过渡元素通常有一个未填满的d轨道,这使得它们的化学性质具有多样性和复杂性。
2. 氧化态:过渡元素通常能够显示多种氧化态,这与其未填满的d轨道有关。
例如,铁元素可以显示+2和+3的氧化态,铜元素可以显示+1和+2的氧化态,这种性质使过渡元素在形成化合物时具有很大的灵活性。
3. 彩色化合物:由于过渡元素的未填满的d轨道和多重氧化态,它们通常能形成彩色的化合物。
这些彩色化合物在生活中有很多应用,比如颜料、染料、陶瓷等,彩色化合物也是化学研究和实验室实验中的常见物质。
4. 催化性质:过渡元素在催化反应中起着重要的作用。
由于其不规则的电子填充和氧化态变化,使得其化合物在催化反应中具有活性和选择性。
比如钯、铑、铂等催化剂在工业上有重要的应用,如有机合成、汽车尾气处理等领域。
5. 锂离子电池:锂离子电池作为一种重要的储能装置,过渡元素在其中起着关键作用。
比如正极材料主要由过渡金属氧化物和磷酸盐组成,其中含有镍、钴、锰等过渡元素,它们的电化学性能决定了电池的容量和循环寿命。
6. 过渡金属配合物:过渡元素通常能够形成配合物,即与配体形成稳定的化合物。
这些配合物具有多种性质,如颜色、磁性、光谱性质等,具有多样的应用。
比如金刚石、钟亭草碱等药物中都含有过渡金属配合物。
过渡元素化学知识点总结:1. 电子结构:过渡元素的电子结构特点是d轨道的填充,未填满的d轨道决定了过渡元素的化学性质的复杂性和多样性。
2. 氧化态:过渡元素通常能够显示多种氧化态,这与其未填满的d轨道有关,使得过渡元素具有很大的化学活性和灵活性。
3. 彩色化合物:过渡元素的多重氧化态和未填满的d轨道使得其形成的化合物通常具有彩色,这些彩色化合物在生活中有很多应用。
4. 催化性质:过渡元素在催化反应中有重要的应用,其化合物在催化反应中具有活性和选择性。
元素周期表中过渡元素的性质与应用

元素周期表中过渡元素的性质与应用元素周期表是化学家们总结和分类元素的重要工具,其中过渡元素是指周期表中第3-12组元素,包括3d、4d、5d轨道上的元素。
过渡元素具有独特的性质和广泛的应用,对于理解物质的组成和性质变化有着重要的意义。
本文将讨论过渡元素的性质以及它们在不同领域的应用。
一、过渡元素的性质1. 多价性和化合价变化:过渡元素具有多个氧化态,即多价性。
这是由于过渡元素具有既能失去电子形成正离子,也能获得电子形成负离子的能力。
因此,它们能够形成不同的化合价,参与到多种反应中。
2. 颜色和吸收光谱:许多过渡元素及其化合物具有鲜明的颜色,这是由于它们能够吸收一定波长的光,在可见光区域发生电子跃迁。
例如,铜的化合物呈现蓝绿色、钴的化合物呈现鲜艳的红色等。
这一性质使得过渡元素在颜料、染料等方面有重要应用。
3. 催化活性:许多过渡元素及其化合物具有良好的催化活性。
它们可以在反应中降低活化能,加速反应速率。
常见的过渡金属催化剂包括钯、铂、镍等,它们在有机合成、能源转化等领域发挥着重要作用。
4. 形成强稳络合物:过渡元素常常形成稳定的配合物。
它们能够与配体发生配位键,形成配位化合物。
这些络合物具有丰富的结构和性质,广泛应用于催化、荧光材料、生物医学等领域。
5. 磁性行为:过渡元素和其化合物具有丰富的磁性行为。
其中,具有未被填满的d轨道的过渡金属离子更容易表现出明显的磁性。
这一性质使得它们在磁性材料、数据存储等领域有广泛应用。
二、过渡元素的应用1. 工业催化剂:许多过渡金属催化剂被广泛应用于化工生产中。
例如,钯催化剂可用于加氢反应、芳香化反应等;铑催化剂可用于氧化反应等。
这些催化剂能够提高反应速率、选择性和产率,降低生产成本。
2. 电子材料:过渡元素及其化合物在电子材料领域发挥着重要作用。
铜、铝、铁等过渡金属被广泛应用于电线、电缆等导电材料中。
同时,过渡金属氧化物也是光电子器件、可见光催化剂等的重要组成部分。
过渡族主要元素性质的测定课件

2.01
58℃, 200~230℃ 部分分解出 HCl ,无水 MnCl2 红色 片状,熔点为
650℃
60(10℃)
72
⑴ Mn(OH)2 (白色)
Mn 2 2OH 无O2 Mn(OH)2 (s,白)
Mn(OH)2
1 2
O2
MnO(OH)2 (s,棕黄色)
二羟氧锰
MnO(OH)2 (x 1)H2O MnO2 xH2O(s,黑褐色) Mn(OH)2 2H Mn2 2H2O
过渡族主要元素性质的测定
1
过渡族主要元素介绍
2
铬 、锰、 铁
3
铜、银
4
汞
一、过渡族主要元素概述
1. 过渡族主要元素的原子半径和电离能 2. 过渡族主要元素的物理性质 3. 过渡族主要元素的化学性质 4. 过渡族主要元素的氧化态 5. 过渡族主要元素离子的颜色 注:过渡族元素也叫d区元素
d区元素的原子半径和电离能
Δ 3Mn 2O2 Mn3O4 Mn X2 MnX2 (X F) Mn F2 MnF4和MnF3
•在氧化剂存在下与熔融的碱作用:
熔融
2Mn 4KOH 3O2 2K2MnO4 2H2O
3、锰的化合物 Mn的价电子构型:3d54s2
可形成多种氧化值:从-2~+7, 最高氧化值=价电子数
淡绿色晶体
硫酸亚铁铵 (Mohr 盐) (NH4)2Fe
(SO4)2·6H2O
绿色晶体
1.895~1.893
1.87 -
在空气中风 化变为白色 粉末,热至 73 ℃时变白,90 ℃时熔融, 250℃时开始 分解,失去
SO3
100℃左右失 去结晶水
26.5,能溶于 甘油,不溶 于乙醇,水 溶液易被氧
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13-6 铜族元素13-6-1 铜族元素概述一、铜族元素通性1.价层电子构型为(n-1)d10n s1,氧化数有+1、+2、+3,铜、银、金最常见的氧化数分别为+2、+1、+3 。
2.铜族金属离子具有较强的极化力,本身变形性又大,所以它们的二元化合物一般有相当程度的共价性。
3.与其它过渡元素类似,易形成配合物。
二、铜族元素单质1.它们的密度大,都是重金属,其中金的密度最大,为19.3g·cm-3。
2.硬度小、有极好的延展性和可塑性,金更为突出,3.导热、导电能力极强,尤以银为最,铜是最通用的导体。
4.铜、银、金能与许多金属形成合金。
5.铜、银、金的化学活泼性较差。
铜:在干燥空气中铜很稳定,有二氧化碳及湿气存在,则表面上生成绿色的碱式碳酸铜2Cu + O2 + H2O + CO2─→ Cu2(OH)2CO3金:在高温下唯一不与氧气起反应的金属,在自然界中仅与碲形成天然化合物(碲化金)。
银:在室温下不与氧气、水作用,即使在高温下也不与氢、氮或碳作用,与卤素反应较慢,但即使在室温下与含有H2S的空气接触时,表面因蒙上一层Ag2S而发暗,这是银币和银首饰变暗的原因。
4Ag + 2H2S + O2─→ 2Ag2S + 2H2O铜、银不溶于非氧化性稀酸,能与硝酸、热的浓硫酸作用:Cu + 4HNO3(浓)─→ Cu(NO3)2 + NO2↑+ 2H2O3Cu + 8HNO3(稀)─→ 3Cu(NO3)2 + 2NO↑+ 4H2OCu + 2H2SO4(浓) ─→ CuSO4 + SO2↑+ 2H2O2Ag + 2H2SO4(浓) ─→ Ag2SO4 + SO2↑ + 2H2OAg + 2HNO3(65%) ─→ AgNO3 + NO2↑+ H2O金不溶于单一的无机酸中,但金能溶于王水(浓HCl:浓HNO3 = 3:1的混合液)中:Au + HNO3+ 4HCl ─→ H[AuCl4] + NO↑ + 2H2O而银遇王水因表面生成AgCl薄膜而阻止反应继续进行。
13-6-2 铜的重要化合物一、氧化物和氢氧化物1. CuO和Cu(OH)2CuO它不溶于水,但可溶于酸。
CuO的热稳定性很高,加热到1000℃才开始分解为暗红色的Cu2O:4CuO2Cu2O +O2Cu2+ + 2OH-─→ Cu(OH)2↓Cu(OH)2CuO + H2OCu(OH)2显两性(但以弱碱性为主),Cu(OH)2 + 2H+─→ Cu2+ + 2H2OCu(OH)2 + 2OH-─→ [Cu(OH)4]2-[Cu(OH)4]2-配离子可被葡萄糖还原为暗红色的Cu2O:[Cu(OH)4]2- + C6H12O6─→ Cu2O↓ + C6H12O7 + 4OH- + 2H2O(葡萄糖)(葡萄糖酸)医学上用此反应来检查糖尿病。
Cu(OH)2也易溶与氨水,生成深蓝色的[Cu(NH3)4]2+。
2.Cu2O对热很稳定,在1235℃熔化也不分解,难溶于水,但易溶于稀酸,并立即歧化为Cu和Cu2+:Cu2O + 2H+─→ 2Cu++ Cu↓+ H2O与盐酸反应形成难溶于水的CuCl:Cu2O + 2HCl ─→ 2CuCl↓(白色)+ H2O此外,它还能溶于氨水形成无色配离子[Cu(NH3)2]+Cu2O + 4NH3 + H2O → 2[Cu(NH3)2]+ + 2OH-但[Cu(NH3)2]+遇到空气则被氧化为深蓝色的[Cu(NH3)4]2+:4[Cu(NH3)2]+ + O2 + 8NH3 + 2H2O → 4[Cu(NH3)4]2+ + 4OH-Cu2O主要用作玻璃、搪瓷工业的红色颜料。
此外,由于Cu2O具有半导体性质,可用它和铜制造亚铜整流器。
CuOH极不稳定,至今尚未制得CuOH。
1.盐类(1)氯化亚铜(CuCl)在热的浓盐酸溶液中,用铜粉还原CuCl2,生成[CuCl2]-,用水稀释即可得到难溶于水的白色CuCl沉淀:Cu2+ + Cu + 4 Cl-─→ 2[CuCl2]-(无色)2[CuCl2]-2CuCl↓ + 2Cl-总反应为:Cu2+ + Cu + 2Cl-─→ 2CuCl↓CuCl的盐酸溶液能吸收CO,形成氯化羰基亚铜[CuCl(CO)]·H2O,此反应在气体分析中可用于测定混合气体中CO的含量。
在有机合成中CuCl用作催化剂和还原剂。
(2) 氯化铜铜(Ⅱ)的卤化物中,只有氯化铜较重要。
无水氯化铜(CuCl2)为棕黄色固体,可由单质直接化合而成,它是共价化合物,其结构为由CuCl4平面组成的长链(如图13-8 所示):CuCl2不但易溶于水,而且易溶于一些有机溶剂(如乙醇、丙酮)中。
在CuCl2很浓的水溶液中,可形成黄色的[CuCl4]2-:Cu2+ + 4Cl-─→ [CuCl4]2而CuCl2的稀溶液为浅蓝色,原因是水分子取代了[CuCl4]2-中的Cl-,形成[Cu(H2O)4]2+:[CuCl4]2-(黄) + 4H2O ─→[Cu(H2O)4]2+(浅蓝)+ 4Cl-CuCl2的浓溶液通常为黄绿色或绿色,这是由于溶液中同时含有[CuCl4]2-和[Cu(H2O)4]2+之故。
氯化铜用于制造玻璃、陶瓷用颜料、消毒剂、媒染剂和催化剂。
(3) 硫酸铜无水硫酸铜(CuSO4)为白色粉末,但从水溶液中结晶时,得到的是蓝色五水合硫酸铜(CuSO4·5H2O)晶体,俗称胆矾,其结构式为[Cu(H2O)4]SO4·H2O。
无水CuSO4易溶于水,吸水性强,吸水后即显出特征的蓝色,可利用这一性质检验有机液体中的微量水分,也可用作干燥剂,从有机液体中除去水分。
CuSO4溶液由于Cu2+水解而显酸性。
CuSO4为制取其它铜盐的重要原料,在电解或电镀中用作电解液和配制电镀液、纺织工业中用作媒染剂。
CuSO4由于具有杀菌能力,用于蓄水池、游泳池中可防止藻类生长。
硫酸铜和石灰乳混合而成的“波尔多液”可用于消灭植物病虫害。
3. 配合物(1) Cu(I)配合物常见的Cu(I)配离子有:配离子[CuCl2]-[Cu(SCN)2]-[Cu(NH3)2]+[Cu(S2O3)2]3-[Cu(CN)2]-3.16×105 1.51×105 7.24×1010 1.66×1012 1.0×1024多数Cu(I)配合物的溶液具有吸收烯烃、炔烃和CO 的能力,例如:[Cu(NH 2CH 2CH 2OH)2]+ + C 2H 4[Cu(NH 2CH 2CH 2OH)2(C 2H 4)]+; <0[Cu(NH 3)2]+ + CO [[Cu(NH 3)2(CO)]+; <0 上述反应是可逆的,受热时放出C 2H 4和CO,前一反应用于从石油气中分离出C 2H 4;后一反应用于合成氨工业铜洗工段吸收可使催化剂中毒的CO 气体。
(2) Cu(Ⅱ)配合物Cu 2+与单齿配体一般形成配位数为4的正方形配合物。
例如已介绍过的[Cu(H 2O)4]2+,[CuCl 4]2-,[Cu(NH 3)4]2+等。
我们熟悉的深蓝色的[Cu(NH 3)4]2+,它是由过量氨水与Cu(Ⅱ)盐溶液反应而形成: [Cu(H 2O)4]2+(浅蓝) + 4NH 3 ─→ [Cu(NH 3)4]2+(深蓝) + 4H 2O此外,Cu 2+还可和一些有机配合剂(如乙二胺等)形成稳定的螯合物。
2. 铜(Ⅰ)和铜(Ⅱ)的相互转化从Cu +的价层电子结构(3d 10)看,Cu(Ⅰ)化合物应该是稳定的,自然界中也确有含Cu 2O 和Cu 2S 的矿物存在。
但在水溶液中,Cu +易发生歧化反应,生成Cu 2+和Cu 。
由于Cu 2+所带的电荷比Cu +多,半径比Cu +小,Cu 2+ 的水合焓(-2100 kJ ·mol -1)比Cu +(-593 kJ ·mol -1)的代数值小得多,因此在水溶液中Cu +不如Cu 2+稳定。
由铜的电势图可知,在酸性溶液中,Cu +易发生歧化反应:2Cu + ss Cu 2+ +CuK θ=)Cu (c )Cu (c 22++= 2×106 Cu +歧化反应的平衡常数相当大,反应进行得很彻底。
为使Cu(Ⅱ)转化为Cu(Ⅰ),必须有还原剂存在;同时要降低溶液中的Cu +的浓度,使之成为难溶物或难解离的配合物。
前面提到的CuCl 的制备就是其中一例,由下列电势图:Cu 2+(aq) +0.559 CuCl(s) +0.12 Cu(s)可知E θ(Cu 2+/CuCl)大于E θ(CuCl/Cu),故Cu 2+可将Cu 氧化为CuCl 。
若用SO 2代替铜作还原剂,则可发生下列反应:2Cu 2+ + SO 2 + 2Cl - + 2H 2O ─→ 2CuCl↓+ SO 42- + 4H +2Cu 2+ + 4I- ─→ 2CuI↓+ I 22Cu2+ + 4CN- ─→ 2CuCN↓+ (CN)2↑CuCN + (x-1)CN-─→ [Cu(CN)x]1-x (x=2~4)总之,在水溶液中凡能使Cu+生成难溶盐或稳定Cu(I)配离子时,则可使Cu(Ⅱ)转化为Cu(I)化合物。
在水溶液中,Cu+的化合物除了不溶解或配离子外都是不稳定的,但在固体中Cu+的化合物比Cu(Ⅱ)的化合物稳定。
13-6-3 银的重要化合物1.卤化银卤化银中只有AgF易溶于水,其余的卤化银均难溶于水。
硝酸银与可溶性卤化物反应,生成不同颜色的卤化银沉淀。
卤化银的颜色依Cl一Br—I的顺序加深,溶解度依次降低。
卤化银有感光性。
在光照下被分解为单质(先变为紫色,最后变为黑色):2AgX 2Ag + X2基于卤化银的感光性,可用它作照相底片上的感光物质。
例如照相底片上敷有一层含有AgBr胶体粒子的明胶,在光照下,AgBr被分解为“银核”(银原子):AgBr Ag + Br 然后用显影剂(主要含有有机还原剂如对苯二酚)处理,使含有银核的AgBr粒子被还原为金属而变为黑色,最后在定影液(主要含有Na2S2O3)作用下,使未感光的AgBr形成[Ag(S2O3)2]3-而溶解,晾干后就得到“负像”(俗称底片):AgBr + 2S2O32-─→ [Ag(S2O3)2]3- + Br印相时,将负像放在照相纸上再进行曝光,经显影、定影,即得“正像”。
AgI在人工降雨中用作冰核形成剂。
作为快离子导体(固体电解质),AgI已用于固体电解质电池和电化学器件中。
2.硝酸银AgNO3是最重要的可溶性银盐。
将Ag溶于热的65%硝酸,蒸发、结晶,制得无色菱片状硝酸银晶体。
AgNO3受热不稳定,加热到713K,按下式分解:2AgNO32Ag + 2NO2 + O2在日光照射下,AgNO3也会按上式缓慢地分解,因此必须保存在棕色瓶中。
