表示物质组成的化学式
化学式与化学方程式

化学式与化学方程式化学式和化学方程式是化学领域中常用的表示方法,用以描述物质的组成、反应过程和化学变化。
本文将介绍化学式和化学方程式的定义、基本原则以及常见的应用。
一、化学式化学式是用化学符号表示物质元素组成和相对原子比例的一种简化表示方法。
化学式可以分为分子式和离子式两种。
1. 分子式分子式用于表示分子物质的化学组成。
以分子为单位,通过化学元素符号和下标来表示化学物质中各种元素的相对原子数目。
例如,水的分子式是H2O,表示其中含有2个氢原子和1个氧原子。
2. 离子式离子式用于表示离子物质的化学组成。
以离子为单位,用化学元素符号和电荷数来表示离子的组成。
正离子在前,负离子在后,两者之间用逗号隔开。
例如,氯化钠的离子式是Na+Cl-,表示其中有一个钠离子和一个氯离子。
二、化学方程式化学方程式是描述化学反应过程的符号表示方法,用化学式表示反应物和产物之间的关系。
化学方程式由反应物、箭头和产物组成,反应物在箭头前面,产物在箭头后面。
化学方程式中的化学式要满足以下几个基本原则:1. 质量守恒原则化学方程式中的反应物质的质量总和必须等于产物的质量总和,即质量守恒。
这是因为在化学反应中,物质的质量不会凭空消失或增加。
2. 电荷守恒原则化学方程式中的反应物质的电荷总和必须等于产物的电荷总和,即电荷守恒。
这是因为在化学反应中,正负电荷不会凭空产生或消失。
3. 原子数量守恒原则化学方程式中的反应物质中各种元素的原子数必须等于产物中相应元素的原子数,即原子数量守恒。
这是因为在化学反应中,元素的原子数不会凭空增加或减少。
化学方程式可以分为平衡方程式和不平衡方程式两种。
1. 平衡方程式平衡方程式是指化学反应中反应物和产物之间的摩尔比例已经达到最简整数比例,且满足质量守恒、电荷守恒和原子数量守恒的要求。
平衡方程式中的反应物和产物之间用化学符号“+”表示。
例如,氢气与氧气反应生成水的平衡方程式为:2H2 + O2 -> 2H2O这个方程式表示了2个氢气分子与1个氧气分子反应生成2个水分子,且满足质量守恒、电荷守恒和原子数量守恒。
物质组成的表示

物质组成的表示一、水的组成水是一种由氢原子和氧原子组成的化合物,化学式为H2O。
在常温常压下,水以液体形式存在。
水的分子结构中,一个氧原子与两个氢原子通过共价键相连,形成一个角度为104.5度的V型分子。
水是地球上最常见的物质之一,也是生命存在的基础。
二、空气的组成空气是地球大气层中的混合气体,主要由氮气、氧气、水蒸气、二氧化碳等成分组成。
其中,氮气占空气的体积的78%,氧气占21%,其他成分占1%。
空气的成分对地球上的生命和气候起到重要的影响。
氧气是动物呼吸所需的气体,而二氧化碳则是植物进行光合作用所产生的气体。
三、岩石的组成岩石是地壳中最基本的构成单位,由矿物颗粒或矿物团聚而成。
岩石的组成可以分为三类:火成岩、沉积岩和变质岩。
火成岩是由地下岩浆冷却凝固形成的,如花岗岩、玄武岩等。
沉积岩是由岩屑、化学沉积物等经过沉积和压实形成的,如砂岩、石灰岩等。
变质岩是在高温高压下由原有岩石经过变质作用形成的,如片麻岩、云母片岩等。
四、植物的组成植物是由细胞构成的多细胞有机体,主要由细胞壁、细胞质、细胞核等部分组成。
细胞是植物的基本结构和功能单位,包括原生质、细胞膜、细胞壁、细胞器等。
植物细胞壁由纤维素和其他多糖组成,为植物提供支持和保护。
细胞质是细胞内各种物质的载体,包括细胞器、细胞溶液等。
细胞核则负责控制细胞的生命活动。
五、人体的组成人体是由细胞组成的复杂有机体,主要由细胞、组织、器官和系统等部分组成。
细胞是人体的基本结构和功能单位,包括细胞膜、细胞质、细胞核等。
组织是由一类或多类细胞按一定方式组织而成的结构,如肌肉组织、神经组织等。
器官是由多个组织结合而成,具有特定的形态和功能,如心脏、肺等。
系统是由多个器官协同工作而成,完成特定的生理功能,如呼吸系统、循环系统等。
六、金属的组成金属是一类具有良好导电性、导热性和延展性的材料,主要由金属元素组成。
金属元素的原子具有较少的价电子,容易失去电子形成阳离子。
化学式与分子式的表示方法

化学式与分子式的表示方法化学式和分子式是化学中常用的表示方法,用于表示化学物质的组成和结构。
化学式是用化学符号表示的,分子式是描述分子组成的式子。
本文将介绍化学式和分子式的基本概念、表示方法以及应用。
一、化学式的表示方法化学式是用元素符号和下标表示元素的种类和数量。
化学式可以分为分子式、离子式和结构式等不同形式。
1. 分子式分子式用于表示分子物质的化学式。
在分子式中,元素符号用于表示元素的种类,下标用于表示元素的原子数目。
分子式可以用元素符号和下标组成的组合式表示。
例如,二氧化碳的分子式为CO2,表示其中含有一个碳原子和两个氧原子。
2. 离子式离子式用于表示离子化合物的化学式。
在离子式中,正离子和负离子以化学符号的形式写在一起,中间用加号或减号连接。
例如,氯化钠的离子式为Na+Cl-,表示其中含有一个钠阳离子和一个氯阴离子。
3. 结构式结构式用于表示有机化合物和某些无机化合物的化学结构。
在结构式中,用线段表示化学键,原子用化学符号表示,通过化学键连接。
例如,乙醇的结构式为CH3CH2OH,表示其中一个碳原子与三个氢原子、一个羟基团连接。
二、分子式的表示方法分子式是指分子中原子的种类和相对数目,用于表示分子组成。
分子式与化学式有所不同,不考虑化学键的连接情况,只关注分子中各种元素的相对数目。
1. 组成式分子式组成式分子式是用元素符号和下标表示分子中各种元素的相对数目。
分子式中不考虑化学键的连接,只关注分子中各元素的个数。
例如,丙酮的分子式为C3H6O,表示其中含有3个碳原子、6个氢原子和一个氧原子。
2. 百分数分子式百分数分子式是指在分子式中,以百分数表示各种元素的相对含量。
例如,水的化学式可以用H2O表示,也可以用H2O(2:1)表示,表示其中氢和氧的相对比例为2:1。
三、化学式与分子式的应用化学式和分子式在化学中具有广泛的应用,可用于描述化学反应、计算物质的摩尔质量以及预测物质的性质等。
1. 描述化学反应化学式和分子式可用于描述化学反应中反应物和生成物的组成变化。
物质组成的表示式

表示一个水 分子由2个 氢原子和1 个氧原子构 成
2O、O2、2O2、2CO2中 “2” 表示什么意义?
① 2个氧原子。 ② 一个氧分子中含有2个氧原子。 ③ 2个氧分子;每个氧分子由2个氧原子 构成。 ④ 两个二氧化碳分子;每个二氧化碳分子 中含有2个氧原子。
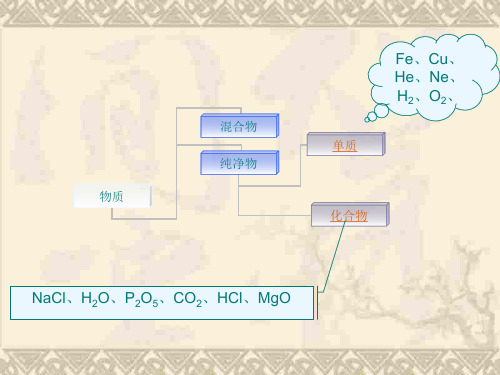
3.单质化学式的写法与读法
金属单质: Cu Fe Hg Mg
由原子 构成 单 质
直接用元 部分固态非金属单质: 素符号表 C P S Si 示化学式 稀有气体单质: He Ne Ar
由分子构成: H2 O2 N2 Cl2 O3 用元素符号及其右下角的数字表示
一些物质组成元素的原子个数比
物质 原子个数比 HCl H2O NaCl Fe2O3
1: 1
2: 1
1: 1
2: 3
二、化合价
不同元素间形成化合物时,它们的原子个
数比是不同的,显示了这些元素的某种特 性,即元素的化合价。化学上用“化合价 ” 来表示原子之间相互化合的数目。
一些常见元素化合价口诀
一价钾钠氯氢银 三铝四硅五价磷 二价氧钙钡镁锌 铜汞二价最常见
为了便于确定化合物中元素的化合价,需要注意以 下几点: 1、化合价有正价和负价。 (1)氧元素通常显-2价。 (2)氢元素通常显+1价。 (3)金属元素跟非金属元素化合时,金属元素 显正价,非金属元素显负价。 (4)一些元素在不同种物质中可显不同的化合价。 2.在化合物里正负化合价的代数和为0. 3.元素的化合价是元素的原子在形成化合物时表现 出来的一种性质,因此,在单质中,元素的化合价 为0.
原子团:作为一个整体参加反应的原子集团,
又叫根。一些常见原子团的化合价 根的名称 氢氧根 根的符号 OH 常见化合价 -1
表示物质组成的化学式【3】

K2MnO4
四氧化三铁
氧化铁(三氧化二铁)
Fe2O3
Fe3O4
写出下列物质的化学式:
氧气
O2
氢气
H2
氮气
N2
氦气
He
氖气
Ne
氩气
Ar
Cu Fe
铜 铁
Hg
汞
MgO
氧化镁
P2O5
五氧化二磷
H2O
水
HCl
氯化氢
NaCl
氯化钠
MgCl2
氯化镁
其中属于单质的有 属于化合物的有
O2~Hg MgO ~MgCl2
练习
1、写出化学式“CO2”的意义:
表示二氧化碳这种物质 表示二氧化碳是由碳元素和氧元素组成 表示1个二氧化碳分子 表示1个二氧化碳分子是由1个碳原子和2个氧原子构成
2、写出“2H2O”意义:
表示2个水分子
当化学式前有数字时,只表示微观意义
2. 化学式中数字的含义
2O
O2 H2 O
2+ Mg
2CO CaCl2
(2)由分子直接构成的物质:在相应的元素符号 的右下角写出分子中所含原子的数目。
H2 N2 O2 O3 C60
写出下列物质的化学式
氧气、氮气、氢气、红磷、镁条、 铁、铜、铝、木炭、硫磺、
O2 、 N2 、 H2 、 P 、 Mg 、
Fe 、 Cu 、 Al 、 C 、 S
它们都属于 单质
化合价
化学上用“化合价”来表示原子 之间相互化合的数目
(3)由分子构成的物质,化学式表示该 物质的一个分子 (4)表示物质的分子构成(或组成物质 的元素的原子个数比) (5)表示物质的式量
H2O可表示:
初三化学物质组成的表示方法
+1
-1
-1
-2
-2
NH4
OH
NO3
CO3 SO4
练一练
+1 NH4
-1
-1
OH NO3
❖ 判断下列化学式是否正确
❖ Zn(SO4)2 Na(OH)3 BaCO3
-2
-2
CO3 SO4
Al2(SO4)3
ZnSO4
NaOH BaCO3 Al2(SO4)3
五、化合价应用
化学式
化合价
例1、试确定NH4Cl中各元素的化合价
见识一些元素的化合价
元素名称 氢
钠
镁
钾
钙
锌
元素符号 H
Na
Mg
K
Ca
Zn
常见化合价 +1
+1
+2
+1
+2
+2
元素名称 氧 氯 硫 氮 磷 碳
元素符号 O Cl S N P C
常见化合价
-2 -1、+1、+5、+7 -2、+4、+6 -3、+2、+4、+5 -3、+3、+5 +2、+4
1、在离子化合物中,元素化合价的数值等于这种元素的一个原 子得失电子的数目,化合价的正负与离子所带的电荷一致
化合物化学式的元素位置
1、写氧化物的化学式时,一般要把氧的元素符 号写在右边,另一种元素符号写在左边如 HgO、H2O
2、在写金属元素和非金属元素组成的化合物的 化学式时,一般把金属的元素符号写在左边, 非金属元素符号写在右边如:NaCl、MgCl、 Na2S
三、化合价
物质组成的表示知识点-九年级化学鲁教版上册

9、 计算物质的化学式量、各元素质量比、物质中某元素的质量分数
化学式量=(元素的相对原子质量×原子个数)之和;
各元素的质量比=(元素的相对原子质量×原子个数)之比;
物质中某元素的质量分数=×100%
②正前方的数值:表示该微粒的个数(2H2O:两个水分子);
4、化合价口诀:
一价:H、Cl、K、Na、Ag;二价:O、Ca、Ba、Mg、Zn;
O、Cl为负要记心;三Al四Si五N、P;二三Fe二四C;
二四六S都齐全;Cu、Hg二价最常见;
负一OH、NO3;负二CO3、SO4;负三记住PO4;正一价的是NH4;
1、化学式
化学式:由元素符号和数字表示物质的组成的式子;
注:(1)任何纯净物都有固定组成,可以用来化学式来表示
(2)一种纯净物,只能用一个化学式来表示;
(3)混合物没有固定组成,所以混合物没有化学式;
2、化学式的意义:
3、化学式中的数字:
①右下角的数字:表示一个分子中有几个该微粒
(H2O:一个水分子中有两个氢原子);
三、约最简:将元素的原子个数约成最简整数比;
四、交叉:交叉化合价,写在右下角;
五、检查:检查正负化合价代数和是否为零。
(3)当原子团右下角数字≥2时,原子团需加括号。
(4)原子团不是一种物质,所以原子团中各元素的化合价代数和不为零;原子团中各元素的化合价代数和就是原子团的化合价。
7、由化学式求化合价
单子价态永为零。
5、化合价的表示方法:
(1)写在元素符号的正上方。
(2)“+”“-”符号在前,数值在后。
(3)“1”不能省略。
6、由化合价书写化学式
(1)依据:在化合物中,各元素的正负化合价之和为零。
物质组成的表示方法

九年级化学(上册)第三章 物质构成的奥秘
下列化学符号表示什么意义?并 指出数字的含义。 O O2 2O2 CO2
2-
+ Na
2+ 2Mg
2SO4
4H2CO3
讨论:
(1)2O (4)O2(2)O2 (3)2O2 ( 5) O
-2
写出在下列符号中,数字“2”的的意义:
2、计算下列物质中划线元素的 化合价 KClO4 KClO3
33、电解水的实验可证明:①水是由 组成的;②在化学 变化中, 再分,而原子 。 电解水中正极产生 , 负极产生 ,体积比(分子个数比) 为 ,质量比为 , 在实验中常加稀H2SO4和NaOH 目的是 。通的是直流电。 净水时用明矾 ,用 除臭。 除去液体中的固体用 法。 水主要消耗在 。
38、酒精灯的火焰分为三部分: 其中 温度最高。 39、取用药品有“三不”原则( ) 40、煤干馏(化学变化)的三种产物:
氯化亚铁 氢氧化铁
Fe(OH)3 Fe 2 (SO4) 3
填空:
下列化学式如有错误请改在横线上:
FeCl3, 氧化钙Ca2O2 ______ CaO ,氯化铁 FeCl2 ______
ZnCl2, 氯化铝 AlCl2 AlCl 氯化锌 ZnCl ______ ______ 3 , NaCl
Cu(OH)2 ,氯化钠ClNa ______, 氢氧化铜CuOH __________
2.在化合物里正负化合价的代数和为0. 3. 单质元素的化合价为0.
例题:写出氧化铝、氢氧化铝 的化学式
练习1:写出下列物质的化学式。 氧化钾 K2O 氧化钙 CaO 氧化铁 Fe2O3 氯化钾 KCl 氯化钙 CaCl2 FeCl2 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 硫酸钾 K2SO4 硫酸钙 Ca SO4 硫酸铁
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表示物质组成的化学式
4.4表示物质组成的化学式教案
(2时)
第一时:化学式和化合价
一、主要内容
①化学式及其意义;②化合价概念及常见元素的化合价;③化合价与化学式的关系及化学式的读法。
二、学习目标要求
(一)知识与技能
1.了解化学式的含义(理解)。
2.能用化学式表示某些常见化合物的组成(理解)。
3.能说出常见元素的化合价(了解)。
4.能根据化合价写简单物质的化学式,能根据化学式推断元素的化合价,能正确读写简单物质的化学式(理解)。
(二)过程与方法
通过化学式、化合价等有关知识的学习过程,发展学生比较、归纳、概括、推理能力。
培养学生良好的学习习惯和学习方法。
(三)情感态度与价值观
通过化学式的书写及有关计算等内容的学习活动,发展学生善于合作、勤于思考、严谨求实的科学精神。
三、教学设计思路
重点:化学式的意义,常见元素的化合价,化合价与化学式
难点:化合价与化学式
关键:元素符号及元素符号的意义
本时教学的基本思路:由物质组成的表示提出化学式→探究化学式的意义→ 化学式的书写→ 由化合物化学式的书写提出化合价问题→ 根据化合价写化学式或根据化学式推断化合价。
本时教学内容宜采取分析、比较、归纳、概括,并以练为主的学习方式。
新导入可采取问题导入方式,提问学生板演几种常见物质的化学符号(如H2、2、H2、H22、2、Hl、Fe、u、Nal、u、P2、l3等),为了后面教学需要,教师还要补充介绍几种化学式,如H2S4、NH3等(每个化学式板演的位置根据教学需要,应有所指定)。
教师直接告诉学生,这些符号就是对应物质的化学式,给出题。
给出题后,让学生给出化学式的定义,若学生有困难,教师给予启发。
采取讨论式的、探究式的引导学生分析、比较H2、2、H2、H22四个化学式的相同点、不同点、各符号、数字的含义等,归纳、概括出化学式的意义。
接下进行化学式意义练习,教材中硫酸化学式的意义可作为练习
如何书写化学式?仍然采取讨论式的、探究式的引导学生分析、比较板演的那些化学式,归纳、概括书写化学式一般规律:单质和化合物化学式的写法(金属单质、非金属单质、双原子单质分子、简单化
合物)。
然后适当进行练习。
让学生观察Hl、H2、NH3等化学式,分析、比较,并说出它们的相同点和不同点,激发学生的问题意识,为什么同样都是一个原子,l、、N与氢原子化合时,结合的氢原子个数各不相同,提出化合价问题。
教师启发学生概括化合价的概念。
认识常见元素(或根)的化合价,总结元素化合价规律(正价、负价、变价等),练习记忆几种元素的化合价。
(元素化合价规律一定由学生总结,培养学生发现问题、收集、处理信息能力)
引导学生从化学式中发现“化合物中元素正负化合价代数和等于零”的规律,总结书写化合物化学式的方法、步骤和化合物化学式的读法,然后进行练习。
第二时:有关化学式的计算
一、主要内容
①根据化学式的简单计算;②学习读商品标签。
二、学习目标要求
(一)知识与技能
1.能进行有关化学式的简单计算(应用)。
2.能看懂某些商品标签上标示的物质成分及其含量(理解)。
(二)过程与方法
1.通过有关化学式的计算,初步培养学生用数学方法解决化学简单问题的能力,培养学生良好的学习习惯和学习方法。
2.通过读商品标签和探究虚假化肥广告活动,培养学生收集、处理、
运用信息的能力,发展学生科学探究能力。
(三)情感态度与价值观
1.通过有关化学式的计算内容的学习活动,发展学生善于合作、勤于思考、严谨求实的科学精神。
2.通过化肥有效成分计算的练习,培养学生合理使用化学物质的观念。
3.通过探究虚假坑农化肥广告活动,培养学生关注社会问题的意识。
三、教学设计思路
重点:相对分子质量、有关化学式的计算
难点:对相对分子质量的理解、有关化学式的计算
关键:化学式、化学式的意义
本时教学的基本思路:分子的质量总和等于组成分子的各原子的质量总和→ 相对分子质量的计算(定义)→ 通过例题总结计算元素质量比、元素质量分数一般思路、方法、格式等→ 练习。
教学宜采取总结、概括,以练为主的方式,通过例题,总结计算方法、规律,通过练习加深理解、得以巩固。
这是本节的第二时,需要复习前一时有关内容,特别是化学式的意义。
新可采取问题导入法,学生思考并讨论:分子由原子构成,分子的质量与原子质量有什么关系?原子的质量通常用什么表示?分子也很小,如何表示分子的质量?由学生在相对原子质量的基础上,提出用
相对分子质量衡量分子的质量,并说明计算方法,教师加以规范,形成相对分子质量概念,总结出计算相对分子质量的方法,进行练习。
有了计算相对分子质量的基础,后两种类型计算不难学习。
教师引导,通过例题总结方法、规律,进行训练。
教材p111的探究活动,是一个具有探究性的训练,是一个局部的探究活动,属于资料探究,培养学生收集、加工、运用信息的能力。
建议补充给商品标签,进行有关计算的练习。
