《环境化学》第二章
合集下载
环境化学第2章 大气环境化学-4-转化

NOX在大气光化学过程起着重要的作用, NO 、NO2、
O3之间存在的光化学循环是大气光化学过程的基础。
NO2 + hv → NO + · O · + O2 + M → O3 + M O O3 + NO → NO2 +O2
★ 3.3.3氮氧化物的气相转化
(1)NO的氧化:
O3为氧化剂: NO+O3 → NO2 + O2
3.3.1 大气中的含氮化合物
大气中主要含氮化合物有N2O、NO、NO2、HNO2、HNO3、 亚硝酸酯、硝酸酯、亚硝酸盐等。 ①氧化亚氮(N2O):是无色气体,是清洁空气的组分,
是低层大气中含量最高的含氮化合物。
来源:主要来自天然源,即环境中的含氮化合物在微生物 作用下分解而产生的。土壤中的含氮化肥经微生物分解可 产生N2O,这是人为产生N2O的原因之一。 性质: N2O在对流层中十分稳定,几乎不参与任何化学反
· 如果是环已烯,HO· 和NO3 可加成到它的双键上。O3 与 环烯烃反应迅速,最终可生成小分子化合物和自由基。
(4)单环芳烃的反应:
大气中的单环芳烃有:如苯、甲苯以及其他化合物。它们 能与芳烃反应的主要是HO· , 主要来源于矿物燃料的燃烧以及一些工业生产过程。 其反应机制主要是加成反应和
氢原子摘除反应。
应,进入平流层后,由于吸收来自太阳的紫外光而光解产
生NO,会对臭氧层起破坏作用。
大气污染化学中的
②一氧化氮和二氧化氮(用NOX表示) 天然来源:
氮氧化物
主要是生物有机体腐败过程中微生物将有机氮转化成
为NO,NO继续被氧化成N2O。另外,有机体中的氨基 酸分解产生的氨也可被HO· 氧化成为NOX。
《环境化学》第二章.ppt

平流层 -56 -2 17 55 O3
中层
-2 -92 55 85 O2+、NO+
热层
-92 1200 85 500 O2+、NO+、NO+
大气稳定度
大气中污染物的迁移
• 污染物在大气的迁移是指由污染源排放 出来的污染物由于空气的运动使其传输 和分散的过程。
• 影响大气污染物迁移的因素: (1)风和大气湍流的影响 (2)天气形势和地理形势的影响
(随时间累积) 5~10a
(随时间累积) 107a
(随时间累积) (随时间累积)
4~7a 0.2~0.5a
4~8a 2.5~4a 0.3~2a 0.5~4d 2~4d 5~6d 8~11d
性质
永 久 性 气不 体可
变 成 半分 永 久 气 体
可 变 成 分
大气各成分的作用
大气组成
主要作用
干
主要 N2 生物体的基本成分
(2)污染物体积与气样总体积的比值(体 积—体积浓度),常用单位为ppm或 ppb。适用于气态或蒸气态物质。
ppm系指在100万体积空气中含有害气体或蒸 气的体积数,表示百万分之一;ppb是ppm的 1/1000。
大气中污 染物的转
化
第三节 大气中重要的光 化学反应
自由基化学基础
• 自由基也称游离基,是指由于共价键均裂 而生成的带有未成对电子的碎片。
• 人为源是指人类的生产活动和生活活动 产生的污染物。
(1)工业污染源 (2)交通污染源 (3)农业污染源 (4)居民生活污染源
大气污染物组成分类
• 使大气产生污染的物质称为大气污染物。 物理状态
形成过程 化学组成
大气污染物浓度表示方法
《环境化学》课件第二章-2

稳定性: C2H5 > (CH3) 3CCH2 > CH2=CH > C6H5 和 CH3 > CF3 D/kJ· mol-1:410 415 431 435 435 443
2-7
《环境化学》 第二章 大气环境化学
(2)自由基的结构和活性 (Structure and Reactivity of Free Radicals) 卤原子夺氢的活性是:F•>Cl•>Br•
增长
终止
2-11
《环境化学》 第二章 大气环境化学
第三节
大气中污染物的转化
(2.3 Transformation of Atmospheric Pollutants)
一、自由基化学基础 (Chemical Foundation for Free Radicals) 二、光化学反应基础 (Foundation for Photochemical Reactions) 三、大气中重要自由基来源 (Source for Important Free Radicals in the
Atmosphere)
四、氮氧化物的转化 (Transformation of NOx) 五、碳氢化合物的转化 (Transformation of Hydrocarbons) 六、光化学烟雾 (Photochemical Smog) 七、硫氧化物的转化及硫酸烟雾型污染 (Transformation of
光化学过程 A* → B1 + B2 +… A* + C → D1 + D2 +… 光解,即激发 态物种解离成 为两个或两个 以上新物种。
2-14
A*与其他分子反应生成新的物种。
《环境化学》 第二章 大气环境化学
环境化学课件第二章

汇:
四、含卤素化合物
〔1〕简单的卤代烃
源:CH3Cl、CH3Br、CH3I等卤代甲烷来自 天然源,主要是来自海洋,其余含卤素化合物都 是由于人类活动产生的.
CH3Cl和CH3Br寿命较长,可以扩散进入平流层 .而CH3I在对流层大气中,主要是在太阳光作 用下发生光解,产生原子碘:
CH3I+hv→CH3·+I·
▪ 1.气块的绝热过程和干绝热递减率
湿沉降是其重要的消除方式193燃烧生成nox的机理一般认为有两种途径含氮化合物o极快nohnoh极快no12o203影响nox形成的因素温度温度越高形成的nox越多4nox环境浓度nox环境背景值随地理位置不同有明显差异且浓度nono21三含碳化合物1co1来源co是由含碳燃料的不完全燃烧而产生或者是在内燃机的高温高压的燃烧条件下产生约80的co均由汽车排放co的天然源主要来自海洋中生物的作用植物叶绿素的分解森林中放出萜的氧化森林大火以及大气中ch另外放电作用引起云层中有机物的光氧化作用二氧化碳的轻微解离作用种子发芽籽苗生长及人和动物新陈代谢过程中都会产生co
* 以城市空气中SO2、NO2和可吸入颗粒物<PM10>的浓度为依据换算成空气污染 指数即API和空气质量级别
大气的主要污染物分类
害
大气污染物
一次污染物——从不同污染源直接向大气排放的有 气体和粉尘等.
二次污染物——大气污染物之间相互作
用或污染物与大气
主要大气污染物
分类
成 中的正分常成分作用或因太
从18世纪末至20世纪初,是大气污染的形成时期. 上世纪50年代至70年代,工业发达国家石油、化石燃料使用 量迅速上升,大气污染物含量迅速上升,致使大气污染加剧. 80年代以来,由于酸雨、臭氧层的破坏和温室效应等问题的 加剧,大气污染问题已成为全球性环境问题,严重威胁着人类 生存和发展.
四、含卤素化合物
〔1〕简单的卤代烃
源:CH3Cl、CH3Br、CH3I等卤代甲烷来自 天然源,主要是来自海洋,其余含卤素化合物都 是由于人类活动产生的.
CH3Cl和CH3Br寿命较长,可以扩散进入平流层 .而CH3I在对流层大气中,主要是在太阳光作 用下发生光解,产生原子碘:
CH3I+hv→CH3·+I·
▪ 1.气块的绝热过程和干绝热递减率
湿沉降是其重要的消除方式193燃烧生成nox的机理一般认为有两种途径含氮化合物o极快nohnoh极快no12o203影响nox形成的因素温度温度越高形成的nox越多4nox环境浓度nox环境背景值随地理位置不同有明显差异且浓度nono21三含碳化合物1co1来源co是由含碳燃料的不完全燃烧而产生或者是在内燃机的高温高压的燃烧条件下产生约80的co均由汽车排放co的天然源主要来自海洋中生物的作用植物叶绿素的分解森林中放出萜的氧化森林大火以及大气中ch另外放电作用引起云层中有机物的光氧化作用二氧化碳的轻微解离作用种子发芽籽苗生长及人和动物新陈代谢过程中都会产生co
* 以城市空气中SO2、NO2和可吸入颗粒物<PM10>的浓度为依据换算成空气污染 指数即API和空气质量级别
大气的主要污染物分类
害
大气污染物
一次污染物——从不同污染源直接向大气排放的有 气体和粉尘等.
二次污染物——大气污染物之间相互作
用或污染物与大气
主要大气污染物
分类
成 中的正分常成分作用或因太
从18世纪末至20世纪初,是大气污染的形成时期. 上世纪50年代至70年代,工业发达国家石油、化石燃料使用 量迅速上升,大气污染物含量迅速上升,致使大气污染加剧. 80年代以来,由于酸雨、臭氧层的破坏和温室效应等问题的 加剧,大气污染问题已成为全球性环境问题,严重威胁着人类 生存和发展.
《环境化学》课件——2 水污染

第二章 水环境化学
第八节 水污染
一、水体的概念
1、描述性定义:
水体系河流、湖泊、沼泽、水库、地下水、冰 川、海洋等“地表贮水体”的总称。水体不仅包括水, 还包括水中的悬浮物、底泥及水生生物等。从自然地 理角度,水体是指地表被水覆盖的自然综合体。
2、划分:
Ø按类型
海洋水体 陆地水体
Ø按区域
地表水体
在光化反应中有些反应物不能直接吸收某波长的光进 行反应。但如果有光敏剂存在,它能吸收这种波长的光 ,并把光能传递给反应物而发生光化反应。如叶绿素就 是一种天然光敏剂,它能够吸收阳光中的可见光,并将 光能传递给水和二氧化碳来合成糖和氧气,如果没有叶 绿素,植物就不能利用水和二氧化碳吸收可见光来完成 光合作用。
农药的水解反应例如: 有机磷农药较易水解,故作为 农药使用,可减轻对环境的影响。
如敌敌畏在酸性下可逐渐水解,而在中性,尤其在碱 性下水解更快,其反应式如下:
四、洗涤剂
肥皂和合成洗涤剂的去污原理主要是由于胶束的乳化 作用。为了说明其原理,先考察一下肥皂的结构,作为 肥皂主要成分的硬脂酸钠具有一个羧基头和长长的碳氢 尾巴,头亲水,尾巴憎水:
农药进入水体以后与水体中各类物质接触,发生一系 列的物理、化学和生化反应,它们的行为可归纳为以下 几个方面:被水体颗粒物质吸附、被生物吸附并积累、发 生降解反应,使农药含量逐渐降低。
农药的降解可以通过光化反应、氧化还原反应、水解 反应和生化反应等实现。
影响环境物质光化反应的因素除了光的波长、强度外 ,还与天然光敏剂的存在与否有关。
q底质中的自净:底质中的微生物使底质中的有机污染 物发生分解
三、水体污染
定义:当水中的污染物进入河流、湖泊、海洋或地 下水体后,其含量超过了水体的自然净化能力,使水 体的水质和水体底质的物理、化学性质或生物群落组 成发生变化,从而降低了水体的使用价值和使用功能 的现象,被称为水体污染。
第八节 水污染
一、水体的概念
1、描述性定义:
水体系河流、湖泊、沼泽、水库、地下水、冰 川、海洋等“地表贮水体”的总称。水体不仅包括水, 还包括水中的悬浮物、底泥及水生生物等。从自然地 理角度,水体是指地表被水覆盖的自然综合体。
2、划分:
Ø按类型
海洋水体 陆地水体
Ø按区域
地表水体
在光化反应中有些反应物不能直接吸收某波长的光进 行反应。但如果有光敏剂存在,它能吸收这种波长的光 ,并把光能传递给反应物而发生光化反应。如叶绿素就 是一种天然光敏剂,它能够吸收阳光中的可见光,并将 光能传递给水和二氧化碳来合成糖和氧气,如果没有叶 绿素,植物就不能利用水和二氧化碳吸收可见光来完成 光合作用。
农药的水解反应例如: 有机磷农药较易水解,故作为 农药使用,可减轻对环境的影响。
如敌敌畏在酸性下可逐渐水解,而在中性,尤其在碱 性下水解更快,其反应式如下:
四、洗涤剂
肥皂和合成洗涤剂的去污原理主要是由于胶束的乳化 作用。为了说明其原理,先考察一下肥皂的结构,作为 肥皂主要成分的硬脂酸钠具有一个羧基头和长长的碳氢 尾巴,头亲水,尾巴憎水:
农药进入水体以后与水体中各类物质接触,发生一系 列的物理、化学和生化反应,它们的行为可归纳为以下 几个方面:被水体颗粒物质吸附、被生物吸附并积累、发 生降解反应,使农药含量逐渐降低。
农药的降解可以通过光化反应、氧化还原反应、水解 反应和生化反应等实现。
影响环境物质光化反应的因素除了光的波长、强度外 ,还与天然光敏剂的存在与否有关。
q底质中的自净:底质中的微生物使底质中的有机污染 物发生分解
三、水体污染
定义:当水中的污染物进入河流、湖泊、海洋或地 下水体后,其含量超过了水体的自然净化能力,使水 体的水质和水体底质的物理、化学性质或生物群落组 成发生变化,从而降低了水体的使用价值和使用功能 的现象,被称为水体污染。
环境化学:第二章大气环境化学 3
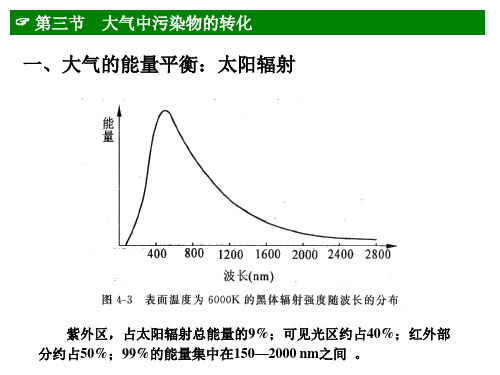
-4
λ < 120 nm
N2 + hν
N+N
120 160 200 240
λ (nm)
图2-29 O2吸收光谱(R. A. Bailey, 1978)
第三节 大气中污染物的转化
(2)臭氧的光离解
O + O2 + M 低碰于撞1反00应0 km的大气中,O3 + M
臭氧吸收1180 nm以下的光就可以离解,但主要 吸收290 nm以下的光,较长波长的光可以进入对流 层和地面。
A :B 能量 A+ + BA :B 能量 A·+B·
不对称裂解 对称裂解
自由基——由对称裂解生成的带单电子的原子或原子 团称为自由基。
第三节 大气中污染物的转化
2、自由基反应(free radical reaction)
凡是有自由基生成或由自由基诱发的反应都 叫做自由基反应。
CCl3F + hγ(175~220nm)
c. H2O2 + hν 2·OH
第三节 大气中污染物的转化
1、 HO 自由基的来源
HO最高含量出现在热带,因为那里温度高,太阳辐射强。
第三节 大气中污染物的转化
2、 HO2自由基的来源
a. 甲醛光解(主要来源):
HCHO + hν
H + HCO
H+O2 + M HCO+O2
HO2 + M HO2+CO
第三节 大气中污染物的转化
3、大气中重要吸光物质的光离解 4
(1) O2和N2的光离解
3
2
O2键能493.8KJ/mol。相
1
应波长为243nm。在紫外区 lgε
环境化学 第二章 大气环境化学

大气中重要吸光物质的光离解
4 3
(1) O2和N2的光离解
2
1 O2键能493.8KJ/mol。相 应波长为243nm。在紫外区 lgε 0 120-240nm有吸收。
O2 + hν
λ < 240 nm
-1 -2
O· + O·
N2键能:939.4KJ/mol。 对应的波长为127nm。
-3
-4
HNO
3
h ν HO NO
2
2
HO CO CO
H
2
H O 2 M HO 2HO
2
M
(有CO存在时)
H 2O 2 O 2
产生过氧自由基和过氧化氢
(5) SO2对光的吸收
SO2的键能为545.1kJ/mol, 吸收光谱 中呈现三条吸收带,键能大,240 - 400 nm 的光不能使其离解,只能生成激发态:
思考题:
太阳的发射光谱 和地面测得的太阳光 谱是否相同?为什么?
3.3大气中重要自由基来源
自由基 由于在其电子壳层的外层有
一个不成对的电子,因而有很高的活 性,具有强氧化作用。如:
CH 3 C(O)H hv H 3 C HCO
由于高层大气十分稀薄,自由基的半 衰期可以是几分钟或更长时间。自由基参 加反应,每次反应的产物之一是自由基, 最后通过另一个自由基反应使链终止,如:
SO 2 h SO 2
*
240 400 nm
SO2*在污染大气中可参与许多光化学反应。
( P73,图2-32)
(6) 甲醛的光离解
HCHO中H-CHO的键能为 356.5 kJ/mol, 它对 240 – 360 nm 范围内的光有吸收, 吸光后的光解反应为:
中国农业大学_807环境化学与环境监测_《环境化学》课件_第二章 水环境化学

表面张力 溶解能力 介电常数 电离度 密 度 透明度 热传导 氢键 偶极矩 存在状态
2. 3 水质标准和水质指标
2.3 水质标准和水质指标
一、水质标准 水质标准是环境质量标准的重要组成部分。所谓环境质 量标准就是环境中的污染物具有法律效力的限量。包括 环境水质标准和污水排放标准两大类。前者又分为饮用 水质标准、渔业用水质标准,工业用水质标准等多种; 后者如工业“三废”排放标准等。理论上讲,排放标准 首要应当以保障环境水质标准为基本目标。 水质标准的确定是以保护人体健康和生态平衡为目的, 用客观的科学数据表示各污染物在适合于一种较高要求 的生态系统生存的水体中所允许的限量。同时还要考虑 具体的自然条件和国家的经济技术条件等因素。所以各 国的水质标准有明显的差异
凝固点 (摄氏度) 沸 点 (摄氏度) 偶极矩 (德 拜 ) 汽化热 (千焦/摩) 融化热 (千焦/摩) 生成热 (千焦/摩)
化合物
H2O H2O推测 H2S H2Se H2Te
0 (-95) -85.2 -65.7 -51
100 (-80) -60.3 -41.3 -2.2
1.84 (2.58) 1.10 0.40 <0.20
2.1 水在地球上的分布及水循环
一、天然水的分布 二、水循环
三、我国水资源状况
2.1
水在地球上的分布及水循环
全 球 水 量 分 布 比 例
2.1 水在地球上的分布及水循环
表2-1 地球上各种水的储量
序 号 类 别 水储量 (万亿m3)
1338000 23400 12870 10530 16.5 24064.1 300.0 176.4 85.4 91.0 11.47 2.12 1.12 12.9 1385984.61 35029.21
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
光化学反应的初级过程和次级过程
• 初级过程中的反应物、生成物之间进一 步发生的反应称为次级过程。 举例:大气中氯化氢的光化学过程 • HCl+hv→H· +Cl·(初级过程,光化学反应, 光分解) • H· +HCl→H2+Cl· (次级过程,热化学反应) • Cl· →Cl2(次级过程,热化学反应) +Cl·
大气污染物的转化—硫氧化物的转化
SO2可以被O3、H2O2等氧化生成H2SO4 SO2· 2O+O3→2H++SO42-+O2 H HSO3-+O3→H++SO42-+O2 SO32-+O3→SO42-+O2 HSO3-+H2O2→SO2OOH-+H2O SO2OOH-+H+→ H2SO4 (4) SO2在固体颗粒表面上的氧化 (5)硫酸型烟雾
大气稳定度
第二节 大气污染和大气 污染物
大气污染
• 大气污染是指进入大气中的污染物超过 了大气环境的容许量,直接或间接地对 人类生活、生产和身体健康等方面产生 不良影响的现象。 • 大气污染所波及的范围很广,按大气污 染的影响程度可以分为局部性污染、地 方性污染、广域性污染和全球性污染。
大气污染源
• 大气污染物浓度表示方法: (1)单位体积气体内所含污染物的质量数 (质量—体积浓度),常用单位为mg/m3 或㎍/m3;对任何状态的污染物都适用。 (2)污染物体积与气样总体积的比值(体 积—体积浓度),常用单位为ppm或ppb。 适用于气态或蒸气态物质。
ppm系指在100万体积空气中含有害气体或蒸气的 体积数,表示百万分之一;ppb是ppm的1/1000。
大气中重要的光化学反应
(5)二氧化硫对光的吸收 • SO2+hv→SO2* (6)甲醛的光离解 • HCHO+hv→H· +HCO· • HCHO+hv→H2+CO • H· +HCO· 2+CO →H • 2H· +M→H2+M • 2HCO· →2CO+H2
大气中重要的光化学反应
• H· 2→HO2· +O • HCO· 2→ HO2· +O +CO (7)过氧化物的光离解 • ROOR'+hv→RO· +R'O· (8)卤代烃的光离解 • CH3X+hv→· 3+X· CH
大气中重要自由基的来源
• • • • • RH+O· +HO· →R· RH+HO· +H2O →R· CH3ONO+hv→CH3O· +NO CH3ONO2+hv→CH3O· +NO2 R· 2 →RO2· +O
第五节 大气污染物的转化
大气污染物的转化—硫氧化物的转化
1、大气中二氧化硫的氧化途径 (1)SO2直接光氧化 3SO +O →SO →SO +O 2 2 4 3 或 SO4 +SO2→2SO3 3SO +O→SO SO3+H2O→H2SO4 2 3 (2)SO2的均相气相氧化 HO· +SO2→HOSO2· HOSO2· 2→ HO2· SO3 +O +
(4)亚硝酸和硝酸的光离解 • HNO2+hv→HO· +NO • HNO2+hv→H· +NO2 • HO· +NO →HNO2 • HNO2+ HO· 2O+NO2 →H • NO2 +HO· HNO3 → • HNO3+hv→HO· +NO2
大气中重要的光化学反应
• 如果有CO存在,HO· +CO →H· +CO2 • 上述反应得到的氢自由基引发反应: H· 2→HO2· +O 2HO2· 2O2 +O2 →H • 可见,大气中亚硝酸和硝酸的光解能够 导致HNO3、NO2、 CO2、 H2O2 等的产 生。
第二章 大气环境化学
以化学为基础,研究大气中化学污染物的存在形态、迁移、转化和 归宿,为大气污染的控制、治理及大气质量的评价提供理论依据。
第一节 大气组成及大气 层的结构
大气的组成
干洁空气的组成
大气各成分的作用
大 干 洁 空 气 气 组 成 N2 O2 CO2 O3 主 要 作 用 主要 成分 次要 成分 生物体的基本成分 维持生物活动的必要物质 植物光合作用的原料;对地面保温 吸收紫外线,使地球上的生物免遭过量 紫外线的伤害 汽 固体杂质 成云致雨的必要条件;对地面保温 成云致雨的必要条件
大气污染物的转化—硫氧化物的转化
• 硫酸烟雾也称为伦敦 烟雾,因为其最早发 生在英国伦敦。 • 是还原型烟雾,主要 是由于燃煤排放的二 氧化硫、颗粒物、以 及由于二氧化硫氧化 生成的硫酸盐颗粒物 所造成的大气污染现 象。
大气污染物的转化—氮氧化物的转化
2、大气中氮氧化合物的转化 (1)大气中的氮氧化物N2O、NO和NO2 • N2O是无色气体,是低层大气中含量最 高的含氮化合物。 • N2O的主要天然来源是土壤中硝酸盐在 微生物的作用下的还原过程。 • 2NO3-+4H2+2H+→N2O+5H2O
• 初级过程主要指化学物质吸收光量子后 形成激发态物质,其基本步骤为: A(某种化学物质)+hv(一定波长的光量子) →A*(激发态物质) • 激发态的物质有四种命运(Fates): (1) A*→A+hv(辐射跃迁,发生荧光, 失去能量,回到基态,光物理)
光化学反应的初级过程和次级过程
(2) A*+M(其它分子)→A+M(无辐射跃 迁,碰撞消耗活化能,回到基态,光物 理) (3) A*→B1+B2+……(光分解,发生离 解,光化学) (4) A*+C→D1+D2+……(光合成,直接 与其他物质发生反应,光化学)
• OH· 在大气化学反应过程中是十分活泼的 氧化剂。 • 根据研究,HO自由基的全球平均值为 7×105个/cm3,理论计算南半球比北半球 多约20%。 • 一般高温有利于HO自由基的形成,所以 HO自由基的是空分布是:南半球多于北 半球,夏天多于冬天,白天多于夜间。
大气中重要自由基的来源
• 大气中HO2· 自由基的来源: (1)大气中甲醛的光离解 • HCHO+hv→H· +HCO· • H· 2→HO2· +O • HCO· 2→HO2· +O +CO (2) HO· 自由基对CO的氧化作用、 H2O2的光离解
• 自然源是来自自然界的生命活动或其他 自然现象的变化而产生的污染。 • 人为源是指人类的生产活动和生活活动 产生的污染物。 (1)工业污染源 (2)交通污染源 (3)农业污染源 (4)居民生活污染源
大气污染物组成分类
• 使大气产生污染的物质称为大气污染物。
物理状态 形成过程 化学组成
大气污染物浓度表示方法
第四节 大气中重要自由 基的来源及转化
大气中重要的自由基
• 自由基在其电子壳层的外层有一个不成对 电子,倾向于得到一个电子以达到稳定结 构,因而具有很高的化学活性,具有强氧 化作用。 • 大气中存在的比较重要的自由基:RO· (烷 氧自由基)、HO·、HO2· 、R·(烷基自由 基)、RO2· (过氧烷基自由基)、RCO· (羰基自 由基)、H·(氢基自由基)。其中以HO· 和 HO2· 数量较多,参与反应也较多,成为两个 最重要的自由基。
大气层的结构
大气主要层次及其特征 层次 对流层 平流层 中层 热层 温度范围( C) 高度范围(km) 主要化学形态 15 -56 -56 -2 -2 -92 -92 1200 0 17 17 55 55 85 85 500 N2、O2、CO2、H2O O3 + + O2 、NO O2 、NO 、NO
光化学基本定律
(1)光化学第一定律 • 只有被体系内分子吸收的光,才能有效 地引起该体系的分子发生光化学反应。 不被吸收的光(透过的光和反射的光) 则不能引起光化学反应。 (2)光化学第二定律 • 每一由光活化的原子或分子,只吸收一 个引起它活化的光量子,即A+hv→A*。
光量子能量与化学键之间的关系
+ + + 0
大气组成的滞留时间
成分 N2 多量成分 O2 Ar CO2 Ne He Kr Xe 少量成分 CH4 CO H2 N 2O O3 H 2S 微量成分 SO 2 NH3 NO2 浓 度 (1 0
-6
体积分数)
大 气 中 滞 留 时 间 (估 计 值 ) 10 ~2 10 a 510 ~10 a (随 时 间 累 积 ) 5~10a (随 时 间 累 积 ) 10 a (随 时 间 累 积 ) (随 时 间 累 积 ) 4~7a 0 .2 ~ 0 .5 a 4~8a 2 .5 ~ 4 a 0 .3 ~ 2 a 0 .5 ~ 4 d 2~4d 5~6d 8~11d
7 3 4 6 7
性质
780840 209460 9300 360 18 5 1 0 .0 9 1 .7 0 .1 0 .5 0 .3 1 0 .0 0 5 ~ 0 .0 5 0 .0 0 0 2 0 .0 0 0 2 0 .0 0 6 0 .0 0 1
永 久 性 气 体 不 可 变 成 半 永 久 气 体 可 变 成 分 分
大气中重要的光化学反应
(1)氧分子的光离解 • O2+hv→O· O· + (2)臭氧的光离解 • O· O2+M→ O3+M(平流层中O3的主要来源) + • O3+ hv→O· O2 + (3)二氧化氮的光离解 • NO2+ hv→O· NO + • O· O2+M→ O3+M +
