第2节氧气和氧化H
第七章 生物氧化-2

3、呼吸链各组分在体外重组:
NADH可以使NADH脱氢酶(FMN)还原,但不能 直接还原b ,c1 ,c, aa3
NADH呼吸链:大多数代谢产物
FADH2呼吸链:琥珀酸、脂酰辅酶A
三、线粒体外NADH的氧化
线粒体外NADH不能穿过线粒体膜,要借助穿
梭作用才能参加呼吸链。
线粒体外的NADH将所带的H交给某种能穿过线
(2)氧化磷酸化偶联机理: 化学渗透假说
1961年英国生物化学家P.Mitchell首先提 出,1974年P.Mitchell与Moyle又作了修改。 电子传递的结果使H+从线粒体内膜基质 “泵”到膜外液体中,形成一个跨内膜的H+ 离子梯度,这梯度所含的势能促使ATP生成。
设想:
在完整的线粒体膜中, 呼吸
OH CH 3 CH 3 CH 3O CH 3O OH CH 3 CH 3
泛醌
O CH 3O CH 3O O
(CH 2CH=CCH 2)nH
(CH 2CH=CCH 2)nH
5、细胞色素类
只存在需氧生物中,以铁卟啉作为辅基,递电子体
铁离子的氧化与还原
Fe3+ + e Fe2+
b,c1,c,a,a3: 辅基结构不同,与蛋白质的连接方式 也不同。
在结构完整的线粒体中,氧化(底物脱氢或失电子) 与磷酸化(ADP与Pi合成ATP)这两个过程是紧密地 偶联在一起的,即氧化释放的能量用于ATP合成,这 个过程就是氧化磷酸化。
依靠呼吸链上的电子传递体系完成-----电子 传递体系磷酸化。
(1)氧化磷酸化偶联部位的确定
A、自由能变化值
八年级化学第二章 第1节-第3节了解组成空气的各主要成分的体积分数浙江版知识精讲

八年级化学第二章第1节-第3节了解组成空气的各主要成分的体积分数浙江版【本讲教育信息】一. 教学内容:第二章第1节-第3节二. 重点、难点:第一节空气[学习目标]1. 了解空气的主要成分,了解组成空气的各主要成分的体积分数;2. 了解空气中氧气、氮气、二氧化碳、稀有气体等的作用和利用。
[重点知识]一、空气里有什么空气是客观存在的物质,很多现象能证明空气是客观存在的。
举例说明:倒立在水中的瓶子水不能充满全瓶。
空气中存在二氧化碳和氧气:1. 收集二瓶气体,一瓶为洁净的空气,另一瓶为人呼出的气体;用实验证明人呼出的气体中含有二氧化碳。
证明的方法是用澄清的石灰水,石灰水变浑浊。
2. 氧气在空气中占的体积分数实验证明的方法。
燃烧磷的方法。
二、空气的成分按体积计算空气中含量最多的是氮气,占78%;其次是氧气,占21%;其它占1%(稀有气体占0.94%;二氧化碳占0.03%;其它气体和杂质占0.03%)三、空气中各物质的作用氧气与人的生活及生产的关系最为密切,它的作用有:(1)冶金工业中有广泛的应用:炼钢过程中吹入高纯度的氧气,可以缩短冶炼时间,同时提高了钢的质量。
(2)氧气在金属切割及焊接等方面也有广泛的用途;(3)液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂;(4)氧气还用于急救、潜水、登山等。
氮气的作用:(1)氮是生命的基础,它不仅是农作物制造叶绿素的原料,而且是农作物制造蛋白质的原料;(2)在国民经济和日常生活中,氮气有广泛的用途。
如:延长灯泡的使用寿命;博物馆内保存珍贵的图书;真空充氮贮粮;保存农产品等。
(3)液态氮给手术刀降温;液态氮作致冷剂;液态氮保存人体细胞组织。
(4)氮气还是一种重要的化工原料,可用来制取多种化肥,炸药等。
二氧化碳的作用:(1)二氧化碳是植物的重要营养物质。
借助于二氧化碳,绿色植物将光能转化为生物能(即光合作用)。
生物能也称化学能。
(2)二氧化碳不能帮助燃烧,因此可用于灭火。
第七章_催化氧化 (第二节)(共40张PPT)

催化剂活性较高、选择性较好 反应条件不太苛刻,反应比较平稳 设备简单,容积较小,生产能力较高 反应温度通常不太高,反应热利用率较低 在腐蚀性较强的体系时要采用特殊材质 催化剂多为贵金属,必须分离回收
一、催化自氧化
具有自由基链式反响特征,能自动加速 的氧化反响。使用催化剂加速链的引发 ,称为催化自氧化。 工业上生产有机酸、过氧化物
主反响:以乙烯和氧气〔或空气〕为原料,在由氯化钯、氯化铜、盐酸组成的催化剂水溶液中,进行液相氧化生产乙醛。
氯化钯是催化剂,氯化铜氧化剂,没有氯化铜的存在,是不能完成催化过程的。
具有自由基链式反响特征,能自动加速的氧化反响。
3其、结工构艺简条单件,影检响修及工很选方择业便 生产中对催化剂溶液的控制指标主要有:钯含量、铜含量、
副反响:
络合催化氧化
① 平行副反响:主要生成氯乙烷、氯乙醇 等 副产物;
② 连串副反响:主要生成氯代乙醛、醋酸、氯代醋酸、 丁烯醛、草酸及深度氧化产物等。
副产品虽然种类繁多,但它们的量甚少, 一般除一氯乙醛外,均无别离回收价值。通常将气体副产 物通入火炬燃烧,液体副产物作生化处理后排放。
络合催化氧化
优点
原料廉价,本钱低及乙醛收率高,副反响少等
目前被认为是生产乙醛最经济的方法,世界上约有70 %的乙醛是采用此法来进行生产的
缺点
氯化钯、氯化铜的盐酸溶液作催化剂,对设备的腐蚀极为 严重。贵金属钛等特殊材料。
2、反响原理
1〕根本反响过程:
主反响:以乙烯和氧气〔或空气〕为原料, 在由氯化钯、氯化铜、盐酸组成的催化剂水溶液中, 进行液相氧化生产乙醛。
④ 氧化度:氧化度——指在总铜中Cu2+所占比
例,即[Cu2+]/{[Cu2+]+[Cu+]}。氧化度过
第2节 氧化法
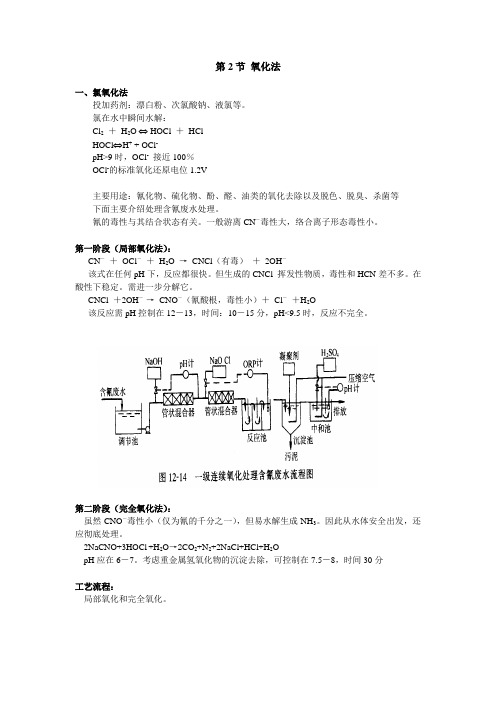
第2节氧化法一、氯氧化法投加药剂:漂白粉、次氯酸钠、液氯等。
氯在水中瞬间水解:Cl2+H2O ⇔ HOCl +HClHOCl⇔H+ + OCl-pH>9时,OCl-接近100%OCl-的标准氧化还原电位1.2V主要用途:氰化物、硫化物、酚、醛、油类的氧化去除以及脱色、脱臭、杀菌等下面主要介绍处理含氰废水处理。
氰的毒性与其结合状态有关。
一般游离CN-毒性大,络合离子形态毒性小。
第一阶段(局部氧化法):CN-+OCl-+H2O →CNCl(有毒)+2OH-该式在任何pH下,反应都很快。
但生成的CNCl 挥发性物质,毒性和HCN差不多。
在酸性下稳定。
需进一步分解它。
CNCl +2OH-→CNO-(氰酸根,毒性小)+Cl-+H2O该反应需pH控制在12-13,时间:10-15分,pH<9.5时,反应不完全。
第二阶段(完全氧化法):虽然CNO-毒性小(仅为氰的千分之一),但易水解生成NH3。
因此从水体安全出发,还应彻底处理。
2NaCNO+3HOCl+H2O→2CO2+N2+2NaCl+HCl+H2OpH应在6-7。
考虑重金属氢氧化物的沉淀去除,可控制在7.5-8,时间30分工艺流程:局部氧化和完全氧化。
二、臭氧氧化法1.臭氧的特点●强氧化剂:氧化还原电位与pH有关,在酸性溶液中为2.07V, 仅次于氟(3.06),在碱性溶液中为1.24V。
●在水中的溶解度较低,只有3-7mg/L(25度时)。
臭氧化空气中臭氧只占0.6-1.2%●会自行分解为氧气。
水中的分解速度比在空气中的快。
如水中的臭氧浓度为3mg/L 时,在常温常压下,其半衰期仅5-30分。
●有毒气体,对肺功能有影响,工作场所规定的最大允许浓度为0.1mg/L。
●具有腐蚀性。
除金和铂以外,臭氧化空气对所有的金属材料都有腐蚀,一般采用不锈钢材料对非金属材料也有强烈的腐蚀作用,不能用普通橡胶作密封材料。
2.臭氧的制备1〕原理:无声放电法(气相中放电和液相中放电两种),水处理中多采用气相中放电。
第二单元课题化合反应与氧化反应-九年级化学人教版上册

1.下列反应不属于缓慢氧化的是( B )
A.动植物呼吸
B.木材燃烧
C.食物腐烂
D.酱油的酿造
2.化学概念间有包含、并列、交叉等不同关系。 符合如图所示关系的选项是( A )
选项 A
B
C
D
X 化合反应 纯净物 物理变化 化学反应
Y 氧化反应 混合物 化学变化 化合反应
3.下列反应中属于化合反应的有__A__B____,属于 氧化反应的有__A__B_C___,既是化合反应又是氧化反应的 有___A_B___,是氧化反应但不是化合反应的有___C____。
(2)乙实验进行时,能观察到的现象是_红__磷__燃__烧__,__产__ __生__大__量__白__烟__,__并__放__出__大__量__的__热____________。
,溶剂是
。
①__反__应__物__都__有__氧__气__________; ②__反__应__物__都__是__两__种__________; ③__生__成__物__都__是__一__种__________; ④_反__应__条__件__都__是__点__燃__(_或__都__是__化__合__反__应__;__都__是___氧__化__ __反__应__;__生__成__物__都__是__氧__化__物__)___________________。
(填“升高”或“降低”),其原因是
点燃 。
乙_磷__+__氧__气__―__―__→__五__氧__化__二__磷__; 7
日常生活中应用最广泛的金属是铁
8
最简单的有机物是甲烷
解析:若加入H2SO4,则Li与H2SO4发生反应,A错误;放电时,原电池内部阳离子向正极移动,阴离子向负极移动,B错误;放电时
第二章 好氧生物处理(原理与工艺)

异氧微生物 第二章 好氧生物处理(原理与工艺)2. 1基本概念2. 1。
1好氧生物处理的基本生物过程 所谓“好氧”:是指这类生物必须在有分子态氧气(O 2)的存在下,才能进行正常的生理生化反应,主要包括大部分微生物、动物以及我们人类;所谓“厌氧”:是能在无分子态氧存在的条件下,能进行正常的生理生化反应的生物,如厌氧细菌、酵母菌等。
好氧生物处理过程的生化反应方程式:● 分解反应(又称氧化反应、异化代谢、分解代谢)(占1/3)CHONS + O 2 CO 2 + H 2O + NH 3 + SO 42- +⋯+能量 (有机物的组成元素)● 合成反应(也称合成代谢、同化作用)(占2/3) ● C 、H 、O 、N 、 + 能量 C 5H 7NO 2● 内源呼吸(也称细胞物质的自身氧化)(endogenous respiration )C 5H 7NO 2 + O 2 CO 2 + H 2O + NH 3 +⋯+能量在正常情况下,各类微生物细胞物质的成分是相对稳定的,一般可用下列实验式来表示: 细菌: C 5H 7NO 2; 真菌: C 16H 17NO 6; 藻类: C 5H 8NO 2;原生动物: C 7H 14NO 3 分解与合成的相互关系:1) 二者不可分,而是相互依赖的;a . 分解过程为合成提供能量和前物,而合成则给分解提供物质基础;b .分解过程是一个产能过程,合成过程则是一个耗能过程。
2)对有机物的去除,二者都有重要贡献;3)合成量的大小,对于后续污泥的处理有直接影响(污泥的处理费用一般占整个污水处理厂的40~50%)。
不同形式的有机物被生物降解的历程也不同: 一方面:● 结构简单、小分子、可溶性物质,直接进入细胞壁;● 结构复杂、大分子、胶体状或颗粒状的物质,则首先被微生物吸附,随后在胞外酶的作用下被水解液化成小分子有机物,再进入细胞内。
另一方面:有机物的化学结构不同,其降解过程也会不同:2. 1。
运动生理学——第六章 物质和能量代谢

磷酸酶只存在于肝脏,其他组织缺乏这种磷 酸酶,故其他组织中的糖元如肌糖元,就不能直 接分解为葡萄糖.
(三)糖在体内的氧化
两种形式:
A.缺氧条件下,糖元和葡萄糖 分解为HL释放能量极少.
第二节 能量代谢
有机体的一切生命活动,如呼 吸循环神经活动,肌肉活动等都 要消耗能量,所消耗的能量来自 糖,脂肪,蛋白质的氧化.1克 糖或1克蛋白质在体内完全氧化 能释放4千卡热量.
1克脂肪在体内完全氧化能释放出 9千卡的热量.一般说来,分解代 谢是释放能量的过程,而合成代谢 则是吸能过程.通常把物质代谢过 程中所伴随的能量释放、转化和利 用称为能量代谢.
(二)蛋白质代谢的动态平衡
蛋白质的主要功用是构成新的组织蛋白, 另一方面旧的组织蛋白又不断分解最后产 生水,二氧化碳和一些含氮的最终产物排 出体外,那么体内蛋白质(合成占优势) 还是消减(分解占优势),要解答这得从 氮平衡来得出结果.
什么是氮平衡?(食物中的含氮物质主 要是蛋白质)蛋白氮.
而且蛋白质分子中的含氮量约为16%
1.甘油的氧化利用:A.在肝脏中甘油 可转变成磷酸丙糖,经糖的有氧氧化途径 参加三羧循环,氧化释放能量 B.甘油 亦根据生理需要经糖元异生途径合成糖元 或葡萄糖.
2.脂肪酸的氧化:脂肪酸在 体内彻底氧化成二氧化碳和水, 同时释放出大量能量的全过程.
三 蛋白质代谢
蛋白质是生命的物质基础,一切生命活 动都与蛋白质联系在一起.导师恩格斯他 在十九世纪七十年代时提出“生命是蛋白 体的存在方式”他这一科学的定义说明了 两个问题:A.蛋白体是生命最重要的物 质基础B.蛋白体的新陈代谢是生命活动 的基本特征.
第2课时化合反应与氧化反应-九年级化学人教版上册精品课件

(3)说明反应③是化学变化的主要现象是_生__成__一__种__黑_ _色__固__体__。
(4)反应④的生成物为___白___色___固___体。
第二单元 我们周围的空气
课题2 氧气
第2课时 化合反应与氧化反应
1.(2020·丹东月考)下列说法中,正确的是( C ) A.有氧气参加的反应一定都是化合反应 B.发生氧化反应时都会发光放热 C.燃烧属于氧化反应 D.氧化反应一定是化合反应
2.下列各组变化,前者一定包含后者的是( B ) A.物理变化,化学变化 B.化学反应,化合反应 C.氧化反应,化合反应 D.氧化反应,化学反应
3.下列说法不正确的是( A ) A.有氧气参加的反应都是化合反应 B.氧化反应不一定是化合反应 C.氧化反应一定是化学变化 D.不论是否有氧气参加,只要由两种或两种以上的 物质生成另一种物质的反应,就属于化合反应
4.下列关于氧化反应的说法不正确的是( B )
A.物质与氧气发生的反应属于氧化反应 B.氧化反应都是剧烈的燃烧 C.农家肥料的腐熟、跑步后的急促呼吸属于缓慢氧化 D.缓慢氧化进行得很慢,不易被察觉,不发光,会放热
置E收集H2,气体应从短管进入,因为氢气的密度比空气小。(4)①实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙 和盐酸反应生成氯化钙、水和二氧化碳;②装置F、H中溶液变浑浊,G中溶液不变浑浊,则原石灰水未变浑浊的原因是二氧化碳中含有氯化
点燃 氢气体;③装置G的作用是检验氯化氢气体是否被除尽。 乙_磷__+__氧__气__―__―__→__五__氧__化__二__磷__; (62)氯化钠溶液和硝酸银溶液:NaCl+AgNO3 AgCl↓+NaNO3(生成不溶于稀硝酸的白色沉淀;其他可溶性盐酸盐与硝酸银溶液也有类似
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
讲述:象呼吸作用、铁生锈、橡胶的老化等,这些氧化反应是缓慢发生、不易觉察的,叫做缓慢氧化。燃烧则是快速的氧化,是可燃物跟氧气发生的一种发光、发热、剧烈的氧化反应。
教师指出:燃烧和缓慢氧化都是属于氧化反应,都会放出大量的热。
讲述:如果燃烧以极快的速率在有限的空间里发生,瞬间内累积大量的热,使气体体积急剧地膨胀,就会引起爆炸。
结论:可燃物燃烧必须同时满足两个条件:一、有充足的氧气;二、达到一定的温度。
讲述:一般情况下,物质着火燃烧所需要的最低温度叫着火点。每种物质的着火点是不同的,如白磷的着火点是40℃。
讲述:物质在缓慢氧化过程中产生的热量如不及时散失,就会使温度逐渐升高,达到着火点时,不经点火,物质也会自发地燃烧起来,这种由缓慢氧化而引起的自发燃烧叫自燃。如枯叶自燃、煤炭、麦杆等自燃。
6、初步懂得用实验来研究物质性质及其变化的科学方法。学会观察和分析实验现象,培养观察能力和分析综合能力。
教学重点和难点:
1、氧气的物理和化学性质
2、氧气的实验室制法及其检验
课时安排:3课时
教学准备:实验室制取、收集、检验氧气的仪器,燃烧匙,镊子,水槽,药匙,硫粉,铁丝,木炭,白磷等。
教学过程:
出示:一瓶生锈的铁钉
实验:用吸管向澄清石灰水中吹气,石灰水变白色浑浊。(学生完成)
问:这个实验说明了什么?
(人呼吸时产生了二氧化碳气体)
问:为什么人通过呼吸会消耗氧气、产生大量的二氧化碳气体呢?
(人体内发生了氧化反应)
讲述:呼吸时,人体细胞内的有机物与氧气发生了氧化反应。如有机物为葡萄糖,呼吸作用的反应全过程可以表示为:
2、用手轻轻在瓶口扇动,使少量氧气飘进鼻孔。
学生描述氧气是一种无色无气味的气体。
教师强调氧气(其他气体)的观察和闻气体的方法。
问:鱼生活在水里,它们是需要氧气吗?它们从哪里获得氧气?(水中)
师:常温下1升水中大约能溶解30毫升的氧气。氧气在水中的溶解能力比较小,属于不易溶解,但这些氧气却是水生生物得以生存的必要条件之一。
说明:氧气能支持燃烧。
教师强调氧气的检验方法。
实验1:木炭在氧气中的燃烧
步骤和现象:用镊子夹住木炭在酒精灯上烧红后放在燃烧匙上,伸入充满氧气的集气瓶中,木炭剧烈燃烧发出白光,燃烧后将澄清石灰水倒入集气瓶中摇晃,石灰水变白色浑浊。
教师指出:能使澄清石灰水变浑浊是二氧化碳气体的性质,也常用此方法来检验二氧化碳的存在。
第2节氧气和氧化
教学目标:Байду номын сангаас
1、了解氧气是空气中最活跃的成分。
2、了解氧气的主要物理性质和化学性质,理解氧气的广泛用途。
3、认识“氧化”现象在自然界的存在,了解氧化反应及其概念。
4、了解氧气的实验室制取方法、仪器、装置的连接、检验气密性的方法、收集方法和检验氧气的方法等,了解工业制法。
5、了解燃烧的条件,了解剧烈氧化和缓慢氧化,具有安全意识。了解灭火和火灾自救的一般方法。
教师指出:爆炸的实质和燃烧是一样的。
问题:1、森林中的枯枝落叶长期堆积后,有时会自己燃烧起来,你知道原因吗?
2、由此可知,燃烧需要什么条件?
实验:图2-23
步骤:1、取一只铁质啤酒瓶盖固定在一水槽中,瓶盖中装入一小粒白磷,立即用钟罩罩住。
2、用一根弯曲的玻璃导管从钟罩下部伸入罩内,通入氧气。
3、小心地向水槽中加60~80℃左右的热水,白磷燃烧。
步骤和现象:取一根光亮的铁丝绕成螺旋状,一端系上一根火柴,另一端系在一根粗铁丝上,点燃火柴,待火柴快烧完时将铁丝伸入氧气瓶中(底部留少量水或铺一层细砂),铁丝剧烈燃烧、火星四射,并放出大量的热,生成一种黑色固体(四氧化三铁)。
教师指出:刚生成的四氧化三铁处于熔化状态,温度很高,容易将集气瓶炸裂,所以在瓶底留少量的水或铺一些细砂就是为了防止瓶底被炸裂。
实验2:硫在氧气中燃烧
步骤和现象:在铺有细沙的燃烧匙里放入少量的硫粉,在酒精灯上加热,直至燃烧,发出淡蓝色的火焰。把燃烧匙伸进充满氧气的集气瓶里,产生蓝紫色火焰,产生了一种有刺激性气味的气体(二氧化硫)。
教师指出:二氧化硫是一种有毒的气体,不能轻易去闻气味,要保持教室的通风。
实验3:铁丝在氧气中燃烧
学生活动:三个实验中
1、学生描述实验现象。
2、用文字表达化学反应中的反应物和生成物。
3、 用化学式表示反应物和生成物。
碳+氧气 二氧化碳
C O2CO2
硫+氧气 二氧化硫
S O2SO2
铁+氧气 四氧化三铁
Fe O2Fe3O4
小结:从以上的反应可以看出,氧气是一种化学性质比较活泼的气体。
问:二氧化碳、二氧化硫、四氧化三铁这三种物质在组成上有什么共同点?
(都是由氧元素和另一种元素组成)
讲述:由两种元素组成,其中一种是氧元素的化合物叫氧化物。
问题:1、你还知道哪些物质属于氧化物?
2、氧化物是不是就是含氧化合物?
二、氧化反应
师:自然界还有很多物质能与氧气起反应,如铁生锈、铜生锈、塑料和橡胶制品的老化等。
讲述:物质跟氧发生的反应叫做氧化反应。
教师指出:如木炭、硫、铁与氧气的反应就属于氧化反应,但氧化反应并不仅仅局限与跟氧气的反应,也包括与氧的化合物的反应。在氧化反应中氧气具有氧化性。
氧气的其他性质:标准状况下氧气的密度为1.429克/升,比空气密度(1.29克/升)略大;在标准大气压下-183℃时液化成淡蓝色的液体,在-218℃时凝结成雪花状的蓝色固体。
举例:氧气瓶中的氧气
问:以上氧气的性质属于物理性质还是化学性质?(物理性质)
2、化学性质
演示:将一根带火星的木条伸进充满氧气的集气瓶里,观察并描述产生的现象。
葡萄糖+氧气 二氧化碳+水+能量
C6H12O6O2CO2H2O
讲述:人体细胞内的有机物与氧反应,最终产生二氧化碳、水或其他产物,同时把有机物中的能量释放出来,供生命活动的需要。这个过程是一个复杂的、多步骤的过程,称为呼吸作用。植物和微生物等其他生物也有呼吸作用,呼吸作用对于生命活动来说十分重要。
问题:木炭、硫、铁在与氧气的反应和呼吸作用有什么共同点和不同点吗?
引出:在我们的生活中,常可以见到金属制品的生锈,你们知道是什么物质让这些金属发生了这样的变化吗?(氧气)
回顾:氧气的宏观组成和微观构成。
师:氧气是空气中最活跃的气体,它能跟很多物质起反应,也是供我们呼吸,使我们得以生存的气体。
一、氧气的性质
1、物理性质
出示:一瓶氧气
1、学生观察氧气的颜色和状态并用自己的语言描述。
