上海高中化学有机化学方程式
高中有机化合物的化学性质及反应方程式汇总

甲烷(烷烃)−→−乙烯(烯烃) −→−苯(苯的同系物)−→−乙醇(醇类)−→−乙酸(羧酸)−→−糖类、油脂、蛋白质 高中有机化合物的化学性质及反应方程式汇总1、甲烷(烷烃):取代反应CH 4+Cl 2−→−光 CH 3—CH 2—CH 3+Cl 2−→−光 2、乙烯(烯烃):加成反应、加聚反应、被酸性KMnO 4溶液的氧化反应CH 2=CH 2+H 2−−→−催化剂 CH 2=CH 2+HCI ∆−−→−催化剂CH 2=CH 2+Br 2−→− CH 2=CH 2+H 2O −−→−催化剂 nCH 2=CH 2−−→−催化剂 nCH 3—CH=CH 2−−→−催化剂 CH 3—CH=CH 2−−−−−→−酸性高锰酸钾溶液酸性高锰酸钾溶液 3、苯(苯的同系物):取代反应(比烷烃难)、加成反应(比烯烃难)+ Br 2−→−Fe+HNO 3−−−→−H 42SO 浓+3HNO 3−−−→−H 42SO 浓+ 3H 2−→−N i+ 3H 2−→−N i4、乙醇(醇类):置换反应、氧化反应、酯化反应CH 3CH 2OH+ Na → CH 3CH 2CH 2OH+ Ca →−→−+OHOHOHH Na CH CH C 22||CH 3CH 2OH+ O 2CH 3COOH+CH 3CH 2425、乙酸(羧酸):酸性反应、酯化反应CH 3COOH+K 2CO 3−→− CH 3CH 2CH 2COOH+ MgO −→−CH 3CH 2CH 2COOH+ Zn −→−CH 3COOH+CH 3CH 2OH 42 6、糖类、油脂、蛋白质:水解反应、葡萄糖的弱氧化反应(C 6H 10O 5)n (淀粉或纤维素)+nH 2O −−−→−H 42SO 浓 C 12H 22O 11(蔗糖)+H 2O −−−→−H 42SO 稀 CH 2OH (CHOH )CHO (葡萄糖)+2Ag(NH 3)2OH −→−∆ CH 2OH (CHOH )CHO (葡萄糖)+2Cu(OH)2−→−∆→+H H H OO OO OONaOH C3C C C ||CCH ||| CCH ||| CH 35173517351722→+H H H OO OO OOO H C 2351735173517223C C C ||CCH ||| CCH ||| CH特征反应:取代 加成、加聚、酸性KMnO 4氧化 取代、加成 置换、氧化、酯化 酸性、酯化 水解 ∆−−→− AgCu 或CH 3CH 2CH 2OH + CuO−→−∆−−−→−H NO+OH OHOHH O H 423223||S CH CH C 浓蛋白质最终的水解产物是。
高三化学有机方程式汇总

学习好资料欢迎下载
高三有机方程式汇总
、烷烃反应类型反应方程式
取代反应
匕%+% " 9凡⑦+十方同时生成CH2c^、CHC^、CCl4
二、烯烃
反应类型反应方程式
加成反应
①能与H2、
HX、X2、
H2O加成 2 ②与X2加
成不需要
催化剂CH2=也+凡:、%巩
CHEHbErL CH2- CH2 Br B L
=强 + HX 催可剂》CHW% X
CH2 = CH2 + H20 催7剂1 CH3CH2OH
吗~CH= CH2 +期催?剂》风照萍或CH^CHCH^ X M
CHkCH —CH=CH2+E门-C1H2-CH-CH=CH3(1, 2 加成)
Er Br
CH L CH CH-CH2+Br2^ CH2 CH-CH /(L 4 加成)
Br Br
一吒CH,C也士聚乙烯
加聚反应
催化剂
“CH- - CH = CH^ -- 受上工——H CH—CH2七
3 2加蛰、加压 | "
匕*
的为=CH—CH= CH2催化剂、y H「UA=CH—C%上
三、芳香烃
四、炔烃
五、卤代烃
六、醇
七、苯酚
八、醛
九、酮
十、羧酸
十一、酯
十二、油脂
十三、糖类
十四、氨基酸
十五、蛋白质。
高中化学所有有机物的反应方程式

高中化学所有有机物的反应方程式甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl(条件都为光照。
实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO加热乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH(条件为催化剂乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3(条件为催化剂乙烯聚合nCH2=CH2→-[-CH2-CH2-]n-(条件为催化剂氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n-(条件为催化剂实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O(条件为加热,浓H2SO4乙炔燃烧C2H2+3O2→2CO2+H2O(条件为点燃乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6(条件为催化剂实验室制乙炔CaC2+2H2O→Ca(OH2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3===CaO+CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH 2C+H2O===CO+H2-----高温C2H2+H2→C2H4----乙炔加成生成乙烯C2H4可聚合苯燃烧2C6H6+15O2→12CO2+6H2O(条件为点燃苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O(条件为浓硫酸苯和氢气C6H6+3H2→C6H12(条件为催化剂乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O(条件为点燃乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CH O+2H2O(条件为催化剂(这是总方程式乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O(条件为浓硫酸170摄氏度两分子乙醇发生分子间脱水2CH3CH2OH→C H3CH2OCH2CH3+H2O(条件为催化剂浓硫酸140摄氏度乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→(CH3COO2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2 2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜HCHO+4Cu(OH2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3CHO+2Cu(OH 2→Cu2O(沉淀+CH3COOH+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温烯烃是指含有C=C键的碳氢化合物。
(完整版)(完美版)高中有机化学方程式总结
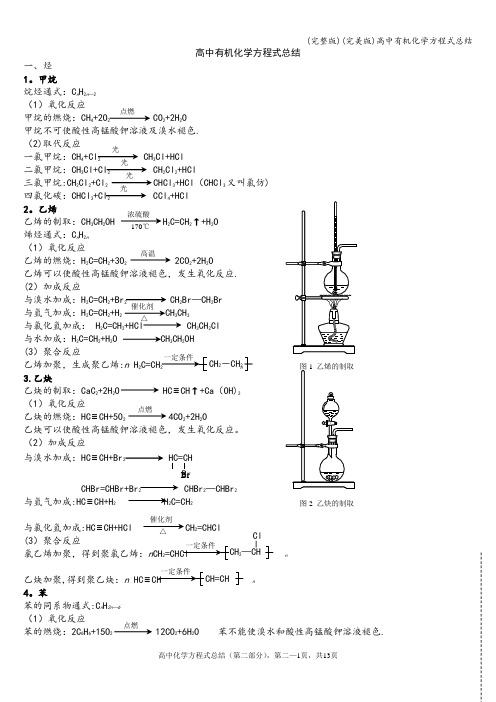
高中有机化学方程式总结一、烃 1。
甲烷烷烃通式:C n H 2n —2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色. (2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2。
乙烯 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应. (2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2n 3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca (OH)2 (1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC ≡CH n4。
苯苯的同系物通式:C n H 2n —6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色.点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHCl点燃(2)取代反应 ①苯与溴反应(溴苯)②硝化反应+HO-NO +H 2O (硝基苯) (3)加成反应(环己烷)。
高中有机化学方程式汇总(全)(已免费)

光照 光照 光照 光照 高温 CaO△ 催化剂加热、加压 催化剂催化剂△ 催化剂 △ 催化剂 催化剂催化剂 催化剂△ 催化剂催化剂浓硫酸△ △CH 3 NO 2O 2N CH 3催化剂△高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n14. 2CH 2 = CH 2 + O 2 2CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)221. + Br 2 Br + HBr22. + HO -NO 2 NO 2 +H 2O23. + HO -SO 3H SO 3H+H 2O24. + 3H 2催化剂NaOH H 2O 醇△ 催化剂 △ 浓硫酸 170℃ 浓硫酸140℃OH Br Br OH 催化剂 △ 催化剂△△ △ 浓硫酸△ Br25. +3HO -NO 2 +3H 2O26. 3CH ≡CH →27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. OH+NaOH ONa+H 2O35. OH+H 2O O -+H 3O +36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓ +3HBr 38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH 40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC — CO OCH2-CH249. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O6 (s)+ 6O2 (g)6CO2 (g)+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH2 57. C17H35COO-CH2 CH2-OH C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OHC17H35COO-CH2 CH2-OH 58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
(完整版)高中有机化学方程式归纳
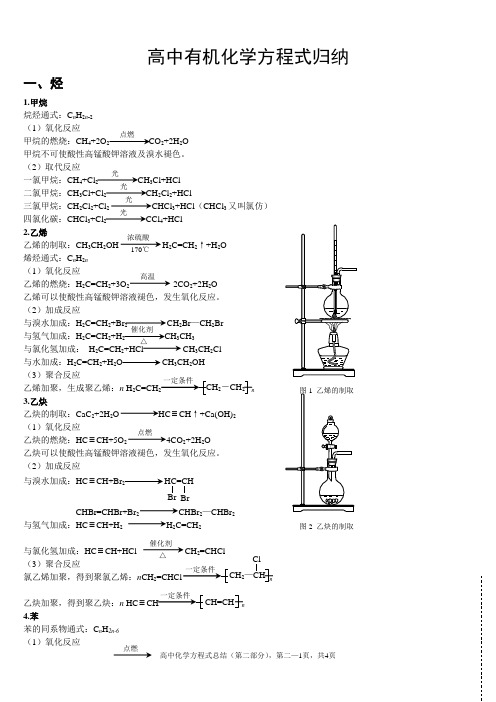
高中有机化学方程式归纳一、烃1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中有机化学方程式总结(高三总复习)
8 乙 醇 分 子 间 脱 水 成 C2H5OH+HOC2H5 浓硫酸 C2H5OC2H5+H2O
醚
140C
9
乙醇与浓氢卤酸的 取代
CH3CH2OH+HBr CH3CH2Br+H2O
10
乙醇与酸的酯化反 应
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
3 乙烯能使酸性高锰 5CH2=CH2 + 12KMnO4 + 18H2SO4―→10CO2 + 12MnSO4 + 6K2SO4 +
酸钾褪色
28H2O
4
乙烯与溴水加成 CH2==CH2+Br2 CCl4 CH2Br—CH2Br
5
乙烯与水加成
CH2==CH2+H2O 催化剂 CH3CH2OH
加热、加压
2CH3CH2OH+O2 Cu /Ag 2CH3CHO+2H2O
5 正丙醇催化氧化
2CH3CH2CH2OH+O2 Cu /Ag 2CH3CH2CHO+2H2O
6 异丙醇催化氧化
2
+O2 Cu /Ag 2
+2H2O
7
乙醇直接被氧化成 乙酸
CH3CH2OH 酸性高锰酸钾/酸性重铬酸钾 CH3COOH
C16H34 高温 C14H30+C2H4
C16H34 高温 C12H26+C4H8
第 1 页 共 14 页
2、乙烯及烯烃 (易氧化、能使酸性高锰酸钾褪色、易加成、易加聚)
1
乙烯的制备
CH3CH2OH 浓硫酸 CH2===CH2↑+H2O 170C
2
乙烯的燃烧反应 CH2=CH2+3O2 点燃 2CO2+2H2O
有机化学方程式汇总
1、甲烷及烷烃 (易燃烧、易取代、可裂解)
高中化学有机方程式总结
高中有机化学方程式总结一、烃及烃的衍生物1、甲烷烷烃通式:C n H 2n +2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl(3)分解反应甲烷分解:CH 4 C+2H 22、乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br—CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成:H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应点燃光 光 光光 高温浓硫酸170℃ 点燃催化剂 △乙烯加聚,生成聚乙烯:n H 2C=CH 23、乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH↑+Ca(OH)2炔烃的通式:C n H 2n-2 (1)氧化反应乙炔的燃烧:2HC ≡CH+5O 2 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2CHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC ≡CH n 4、苯苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O苯不能使溴水和酸性高锰酸钾溶液褪色。
上海杨浦高级中学高中化学必修二第七章《有机化合物》知识点总结(培优练)
一、选择题1.关于同分异构体和同系物,下列说法中不正确的是A.具有相同分子式,但结构不同的化合物互为同分异构体B.C6H5CH2OH和C6H5OH在分子组成上相差一个CH2原子团,故两者互为同系物C.同分异构体之间的转化属于化学变化D.组成元素的质量分数相同,且相对分子质量也相同的不同化合物,互为同分异构体2.下列说法正确的是()A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为C n H2n B.一种烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积C.某气态烃C x H y与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;否则y<4D.相同质量的烃,完全燃烧,消耗O2越多,烃中含氢元素的质量分数就越高3.下列说法正确的是A.C240和C540互为同素异形体B.氕、氘、氚是氢元素的三种核素,其中子数相同C.CH3COOH与HCOOCH2CH3互为同系物D.C3H8的一氯取代物有3种4.设阿伏伽德罗常数的值为N A,则下列说法正确的是A.标准状况下,22.4L氯仿中含有的氯原子数目为3N AB.7.8g苯分子中碳碳双键的数目为0.3N AC.17.6g丙烷中所含的极性共价键为4N AD.常温常压下,4.2gC2H4和C9H18混合物中含有的碳原子数为0.3N A5.下列各组有机物以任意比混合,若总物质的量一定,完全燃烧时生成水的质量和消耗氧气的质量不变的是A.C3H8、C4H6B.C3H6、C4H6O2C.C2H2、C6H6D.CH4O、C4H4O5 6.下列有关说法错误的是()A.煤焦油是煤的干馏产物之一B.硬化油不易被空气氧化变质,方便储存C.淀粉、纤维素均可在人体内水解生成葡萄糖D.羊毛、蚕丝、牛胰岛素等的主要成分都是蛋白质7.下列关于乙醇(CH3CH2OH)的说法不正确的是A.与乙烯互为同系物B.可与酸性高锰酸钾溶液反应C.与乙酸(CH3COOH)在一定条件能发生酯化反应D.分子中含有羟基8.医用一次性口罩的结构如图所示,过滤层所用的材料是聚丙烯,具有阻隔病毒和细菌的作用。
高中有机化学方程式汇总(全)(已免费)
Ca催化催催化催化催催催高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2 + H 2O CH 3CH 2OH 10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 12. nCH 2 = CH 2 [ CH 2—CH 2 ] n 13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n 14. 2CH 2 = CH 2 + O 2 2CH 3CHO催化催NaO催化15. CH≡CH + Br2 CHBr = CHBr16. CHBr = CHBr+ Br2 CHBr2-CHBr217. CH≡CH + HCl H2C = CHCl18. nCH2 = CH [ CH2-CH ] nCl Cl19. CH≡CH + H2O CH3CHO20. CaC2 + 2H2O CH≡CH↑+ Ca(OH)2-2 +H2O-SO33H+H2O225. +3HO-NO22O26. 3CH≡H醇催化浓硫浓硫BrOH催化催化△27. CH3CH2Br + H2O CH3CH2OH + HBr28. CH3CH2Br + NaOH CH3CH2OH + NaBr29. CH3CH2Br+ NaOH CH2 = CH2 + NaBr +H2O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O+C2H5OH C2H5OC2H5+H2O34. OH+NaOH ONa+H2O2O O-+H3O+233738. CH3CHO + H2 CH3CH2OH39. 2CH3CHO + O2 2CH3COOH△催催催40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ +Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑ 45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 33COO)2Cu + 2H 2O+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 49. nOHCH 2CH 2COOH → [ OCH 2CH 2C ] n +H 2O50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 51. C 6H 12O 6 2CH 3CH 2OH + 2CO 252. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖 53. C 12H 22O 11 + H 2O 2C 6H 12O 6催催化催化+浓硫+ 2H O O C —O OCH -麦芽唐 葡萄糖 54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖 55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 C 17H 35COO-CHC 17H 33COO-CH 2 C 17H 35COO-CH 2 57. C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3C 17H 35COONa+ CH-OH C 17H 35COO-CH 2 CH 2-OH58. CH 2OH COOH CH 2OH COOH1.HCl Cl CH Cl CH +−→−+324光HCl Cl CH Cl Cl CH +−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+ O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、烃1.甲烷烷烃通式:C n H 2n -2(n ≥1) ⑴氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
⑵取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O实验室制取乙烯的副反应:2CH 3CH 2OH CH 3CH 2OCH 2CH 3烯烃通式:C n H 2n (n ≥2) ⑴氧化反应乙烯的燃烧:C 2H 4 +3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色。
⑵加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH ⑶聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2(电石的制备:CaO+3C CaC 2+CO↑)烯烃通式:C n H 2n-2 (n ≥2) ⑴氧化反应乙炔的燃烧:C 2H 2+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色。
⑵加成反应与溴水加成:HC ≡CH+Br 2 HC=CH BrCHBr=CHBr+Br 2 CHBr 2—CHBr 2点燃光照光照光照光照浓硫酸170℃ 点燃催化剂△ 一定条件2-CH 2 图1 乙烯的制取点燃图2 乙炔的制取Br浓硫酸140℃一定条件2500℃~3000℃电炉与氢气加成:HC ≡CH+H 2H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl⑶聚合反应氯乙烯加聚,得到聚氯乙烯:n CH n乙炔加聚,得到聚乙炔:n HC ≡ n 4.苯苯的同系物通式:C n H 2n-6(n ≥6) ⑴氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O苯不能使酸性高锰酸钾溶液褪色,也不能使溴水因化学反应而褪色。
⑵取代反应①苯与液溴反应(溴苯) ②硝化反应+HO —NO 2 +H 2O (硝基苯) ⑶加成反应(环己烷)。
5.甲苯 ⑴氧化反应甲苯的燃烧:C 7H 8+9O 2 7CO 2+4H 2O甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
⑵取代反应 2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT ), 6.石油和石油产品概述二、含氧有机物 催化剂△ 2—CH Cl CH=CH 点燃点燃+Br +HBrBr浓H 2SO 4 60℃—NO 2+3H CH 3 |+3HNO 3 浓硫酸 O 2N — CH 3 |—NO 2| NO 2 +3H 2O ||||一定条件7.乙醇饱和一元醇通式:C n H 2n+2O (n ≥1) ⑴与钠反应乙醇与钠反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑(乙醇钠) ⑵氧化反应乙醇的燃烧:2C 2H 6O+3O 2 4CO 2+6H 2O乙醇的催化氧化:2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O (乙醛)⑶消除反应乙醇在浓硫酸做催化剂的条件下,加热到170℃生成乙烯。
注意:该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚。
2C 2H 5OH C 2H 5—O —C 2H 5+H 2O (乙醚)8.甲醛饱和一元醛通式:C n H 2n O (n ≥1)甲醛是无色,具有刺激性气味的气体,易溶于水。
⑴加成反应甲醛与氢气反应: H —C —H+H 2 CH 3OH ⑵氧化反应甲醛与氧气反应: 2H —C —H+O 2 2HCOOH (甲酸)甲醛的燃烧:2CH 2O+2O 2 2CO 2+2H 2O 甲醛的银镜反应:HCHO +2Ag(NH 3)2OH HCOONH 4+2Ag+3NH 3+H 2O (甲酸铵) 注意:硝酸银与氨水配制而成的银氨溶液中含有Ag(NH 3)2OH (氢氧化二氨合银), 这是一种弱氧化剂,可以氧化乙醛,生成Ag 。
有关制备的方程式: Ag ++NH 3·H 2O →AgOH ↓++4NH AgOH+2NH 3·H 2O →[Ag(NH 3)2]OH+2H 2O甲醛与新制氢氧化铜的反应:HCHO+2Cu(OH)2 HCOOH+Cu 2O ↓+2H 2O 9.乙醛乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发。
催化剂△浓硫酸140℃O || 催化剂 △O || 催化剂 △水浴加热△点燃O ||点燃⑴加成反应乙醛与氢气反应:CH 3—C —H+H 2 CH 3CH 2OH⑵氧化反应乙醛与氧气反应:2CH 3—C —H+O 2 2CH 3COOH (乙酸)乙醛的银镜反应:CH 3CHO +2Ag(NH 3)2OH CH 3COONH 4+2Ag+3NH 3+H 2O (乙酸铵)乙醛与新制氢氧化铜反应:CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 10.乙酸饱和一元羧酸通式:C n H 2n O 2(n ≥1) ⑴乙酸的酸性乙酸的电离:CH 3COOHCH 3COO -+H +2CH 3COOH +Mg (CH 3COO)2Mg +H 2↑2CH 3COOH +CaCO 3 (CH 3COO)2Ca +H 2O +CO 2↑ CH 3COOH +NaOH CH 3COONa +H 2O ⑵酯化反应CH 3—C —OH+C 2H 5—OH CH 3—C —OC 2H 5+H 2O (乙酸乙酯)注意:酸和醇起作用,生成酯和水的反应叫做酯化反应。
11.乙酸乙酯乙酸乙酯是一种带有香味的物色油状液体。
⑴水解反应CH 3COOC 2H 5+H 2O CH 3COOH+C 2H 5OH ⑵中和反应CH 3COOC 2H 5+NaOH CH 3COONa+C 2H 5OH三、烃的衍生物的转化 四、常见有机反应的类型1. 取代反应有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
⑴卤代: ⑵硝化: ⑶磺化:O ||浓硫酸△无机酸催化剂 △O || 催化剂 △水浴加热△卤代烃 R —X 醇 R —OH 醛 R —CHO 羧酸RCOOH酯RCOOR ’水解 酯化氧化还原氧化 酯化 水解不饱和烃加成消去消去加成⑷分子间脱水:2. 加成反应有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
⑴碳碳双键的加成:⑵碳碳三键的加成:⑶醛基的加成:⑷苯环的加成:3. 加成聚合(加聚)反应相对分子质量小的不饱和化合物聚合成相对分子质量大的高分子化合物的反应。
⑴丙烯加聚:⑵二烯烃加聚:4. 消除反应有机化合物在一定条件下,从一个分子中脱去一个小分子(如水、卤化氢等)而生成不饱和(含双键或三键)化合物的反应。
5. 氧化还原反应在有机化学中,通常把有机物得氧或去氢的反应称为氧化反应;反之,加氢或去氧的反应称为还原反应。
⑴氧化反应:⑵还原反应:6. 酯化反应(亦是取代反应)酸和醇起作用,生成酯和水的反应7. 裂化反应在一定条件下,把相对分子质量大、沸点高的长链烃,断裂为相对分子质量小、沸点低的短链烃的反应。
五、通过计算推断有机物的化学式1.有机物的结构简式是在实验事实的基础上推断出来的。
一般情况下,先进行定性和定量实验,计算出该化合物的相对分子质量,求分子式。
然后再根据该有机物的性质、推导出结构。
确定有机化合物结构简式一般过程归纳如下:2.常用的化学计算的定量关系-CHO~2Ag、-CHO~2Cu(OH)2~Cu2O、-OH~Na~0.5H2、-COOH~Na~0.5H2C=C~H2、C≡C~2H2、苯环~3H2、-CHO~H2物质仪器除杂及收集注意事项乙烯可能含有杂质气体(CO2、SO2)可用NaOH溶液除去。
1、沸石(暴沸)2、温度计位置3、控制温度4、浓硫酸作用(催化剂、脱水剂、吸水剂)5、乙醇与浓硫酸体积比为1:3乙炔可能含有H2S等杂质气体,可用硫酸铜溶液(氢氧化钠溶液)除去。
1、水可用饱和NaCl溶液代替2、不能用启普发生器3、该反应为放热反应溴苯含有的溴、FeBr3等,用氢氧化钠溶液处理后分液、然后蒸馏。
1、催化剂(FeBr3)2、长导管的作用冷凝回流、导气3、右侧导管不能伸入溶液中4、右侧锥形瓶有白色烟雾硝基苯可能含有未反应完的苯、硝酸、硫酸,用氢氧化钠溶液中和酸,分液,然后用蒸馏的方法除去苯。
1、导管1的作用冷凝2、仪器2为温度计3、用水浴控制温度为60°C4、浓硫酸的作用催化剂、脱水剂、吸水剂乙酸乙酯1、浓硫酸的作用催化剂、脱水剂、吸水剂2、左边导管导气冷凝3、饱和碳酸钠吸收乙醇、乙酸,降低乙酸乙酯的溶解度4、右边导管不能接触试管中。
