(完整word版)初中常见化学式大全
初中化学式总结归纳

初中化学式总结归纳一、单质化学式1. 金属单质- 铁:Fe- 铜:Cu- 铝:Al- 镁:Mg- 锌:Zn等。
它们由原子直接构成,化学式直接用元素符号表示。
2. 稀有气体单质- 氦气:He- 氖气:Ne- 氩气:Ar。
也是由原子直接构成,化学式用元素符号表示。
3. 固态非金属单质(除碘外)- 碳(石墨、金刚石):C- 硅:Si。
由原子直接构成,化学式为元素符号。
4. 气态非金属单质(双原子分子)- 氢气:H₂- 氧气:O₂- 氮气:N₂- 氯气:Cl₂二、化合物化学式1. 氧化物- 水:H₂O- 二氧化碳:CO₂- 一氧化碳:CO- 二氧化硫:SO₂- 三氧化硫:SO₃- 氧化铜:CuO- 氧化铁(三氧化二铁):Fe₂O₃ - 四氧化三铁:Fe₃O₄- 氧化镁:MgO- 氧化铝:Al₂O₃。
氧化物中氧元素写在后面,另一种元素写在前面,原子个数比根据化合价确定。
2. 酸- 盐酸:HCl- 硫酸:H₂SO₄- 硝酸:HNO₃- 碳酸:H₂CO₃。
酸是由氢离子和酸根离子构成的化合物,氢离子写在前面。
3. 碱- 氢氧化钠:NaOH- 氢氧化钙:Ca(OH)₂- 氢氧化钾:KOH- 氢氧化镁:Mg(OH)₂。
碱是由金属离子(或铵根离子)和氢氧根离子构成的化合物,氢氧根写在后面。
4. 盐- 氯化钠:NaCl- 碳酸钠:Na₂CO₃- 碳酸钙:CaCO₃- 硫酸铜:CuSO₄- 氯化亚铁:FeCl₂- 氯化铁:FeCl₃- 硝酸钾:KNO₃- 硫酸铵:(NH₄)₂SO₄。
盐是由金属离子(或铵根离子)和酸根离子构成的化合物。
三、常见有机物化学式1. 甲烷:CH₄2. 乙醇(酒精):C₂H₅OH。
初三60个必背化学式

初三60个必背化学式化学是一门研究物质性质、组成以及变化的科学,它在现代社会中扮演着重要的角色。
为了更好地理解化学原理和应用,初三的学生应该掌握一些基本的化学式。
下面是60个初三必背的化学式,分为无机化学和有机化学两个部分。
一、无机化学1.水(H2O)2.氧气(O2)3.二氧化碳(CO2)4.氯化钠(NaCl)5.硫酸(H2SO4)6.硝酸(HNO3)7.苯酚(C6H5OH)8.硝化甘油(C3H5(NO3)3)10.氨(NH3)11.碳酸氢钠(NaHCO3)12.硝酸钾(KNO3)13.硫酸铜(CuSO4)14.亚硝酸钠(NaNO2)15.硫酸铁(Fe2(SO4)3)16.亚硫酸钠(Na2SO3)17.硝酸钠(NaNO3)18.氯化钾(KCl)19.碘化钾(KI)20.硫酸钠(Na2SO4)21.重铬酸钾(K2Cr2O7)22.氢氧化钠(NaOH)24.一氧化二氮(N2O)25.氟化钙(CaF2)26.氧化钙(CaO)27.氧化铜(CuO)28.五氧化二磷(P2O5)29.硝酸银(AgNO3)30.氮气(N2)31.二氧化硫(SO2)32.二氯甲烷(CH2Cl2)33.氯气(Cl2)34.氮氧化物(NOx)35.硝酸盐(NO3-)36.硫化氢(H2S)38.三氯甲烷(CHCl3)39.碳酸钙(CaCO3)40.二氯乙烯(C2H2Cl2)41.二硫化碳(CS2)42.碳酸亚铁(FeCO3)43.高锰酸钾(KMnO4)44.磷酸二氢钠(NaH2PO4)45.醋酸(CH3COOH)二、有机化学46.乙烯(C2H4)47.丙烷(C3H8)48.乙醇(C2H5OH)49.乙酸(CH3COOH)50.乙酸乙酯(C4H8O2)51.甲醇(CH3OH)52.甲酸(HCOOH)53.甲酸甲酯(HCOOCH3)54.甲酸乙酯(HCOOC2H5)55.乙酸丙酯(C5H10O2)56.丙酮(C3H6O)57.氯仿(CHCl3)58.苯(C6H6)59.甲苯(C7H8)60.醋酐(C4H6O3)这些化学式涵盖了初三学生需要了解的基本无机和有机化学化合物。
初中常见化学式大全已打印

初中常见化学式常见的化学式二、化合物常见的盐硝酸镁 Mg(NO3)2、硝酸铜Cu(NO3)2、 硝酸钙Ca(NO3)2、 亚硝酸钠 NaN03、碳酸钠Na2CO3、碳酸钙 CaCO3、碳酸镁MgC03、碳酸钾K2CO3 氢氧化钠NaOH 、氢氧化钙Ca(OH)2、 氢氧化钡Ba(OH)2、氢氧化镁Mg(OH)2、氢氧化铜Cu(OH)2、 氢氧化钾KOH 、氢氧化铝Al(OH)3 (常见的碱) 氢氧化铁氢氧化亚铁Fe(OH)3、Fe(OH)2 (常见有机物) 甲烷 乙炔 甲醇乙醇碱式碳酸铜 石膏熟石膏Cu2(OH)2CO3 、 CaSO4・2H2O 、 CaSO4・H2O 明矶、KAl(SO4)2.12H2O 、绿矶 FeSO4・7H2O(常见结晶水合物)蓝矶 CuSO4.5H2O 、碳酸钠晶体 Na2CO3.10H2O(常见化肥)尿素 CO(NH2)2、硝酸铵 NH4NO3、硫酸铵(NH4)2SO4、 碳酸氢铵NH4HCO3、磷酸二氢钾KH2PO4、 硝酸钾KNO3 沉淀: 红褐色沉淀 ---- Fe(OH)3 浅绿色沉淀 ----- F e(OH)2蓝色沉淀 ----- Cu(0H)2乙酸甲醛CH4 、C2H2 、 CH3OH 、C2H5OH 、CH3COOH 、CH2O白色沉淀 -------- C aC03 、BaC03、Mg(0H)2、AI(0H)3、Zn(0H)2、AgCI、BaS04(其中仅BaS04、AgCI 是不溶于HN03的白色沉淀).淡黄色沉淀(水溶液中)----S微溶于水 ------- C a(0H)2 、CaS04、Ag2S04物质的学名、俗名及化学式⑴金刚石、石墨:C ⑵水银、汞:Hg (3)生石灰、氧化钙:Ca0(4)干冰(固体二氧化碳):C02 (5)盐酸、氢氯酸:HCI⑹亚硫酸:H2S03 (7)氢硫酸:H2S(8) 熟石灰、消石灰:Ca(0H)2(9) 苛性钠、火碱、烧碱:Na0H(10) 纯碱、苏打:Na2C03碳酸钠晶体、纯碱晶体:Na2CO3.10H2O(11) 碳酸氢钠、酸式碳酸钠:NaHC03 (也叫小苏打)(12) 胆矶、蓝矶、硫酸铜晶体:CuS04.5H2O(13) 铜绿、孔雀石:Cu2(OH)2CO3 (分解生成三种氧化物的物质)(14) 甲醇:CH30H 有毒、失明、死亡(15)酒精、乙醇:C2H5OH(16)醋酸、乙酸(16・6C冰醋酸)CH3C00H (CH3C00-醋酸根离子)具有酸的通性(17) 氨气:NH3 (碱性气体)(18) 氨水、一水合氨:NH3・H20 (为常见的碱,具有碱的通性,是一种不含金属离子的碱)(19) 亚硝酸钠:NaN02 (工业用盐、有毒)常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4A KMnO4 为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷硫:淡黄色Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色; 凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
(完整版)初中化学必背化学式大全

CO: —氧化碳 C02:二氧化碳 S02:二氧化硫 Mn 02:二氧化锰S03:三氧化硫 H 2O 2:过氧化氢 Cu0 :氧化铜 Ca0:氧化钙 MgO:氧化镁 Hg0:氧化汞 Fe 203:氧化铁AI 2O 3:氧化铝H 20:水 P 205:五氧化二磷Fe 304:四氧化三铁酸:HCl :盐酸 H 2S04:硫酸 HN03:硝酸H 2CO 3:碳酸H 2S 亚硫酸CH 3C00H :醋酸碱:H He C N OF Ne Na Mg Al Si P SCl氢氦 碳氮氧氟 氖钠镁铝硅磷硫氯Ar K Ca Mn Fe Cu Zn Ag Ba Pt Au Hg I氩钾 钙锰铁 铜锌银钡铂 金 汞 碘2. 常见离子和化合物中元素的化合价:H+ Na+ K+ Ag+ NH4+氢离子 钠离子 钾离子 银离子 铵根离子Ca2+ Mg2+ Cu2+ Ba2+ Zn2+ Fe2+钙离子 镁离子 铜离子 钡离子 锌离子 亚铁离子Fe3+ Al3+ +3 价铁离子 铝离子Cl- OH- N03- 1价氯离子 氢氧根离子 硝酸根离子O2- SO42- C032- -2 价氧离子 硫酸根离子 碳酸根离子3. 常见物质的化学式与名称:单质:C:碳 S:硫 P:磷 Fe:铁 Mg:镁 Al:铝 Hg:汞Cu :铜 Ag:银 02:氧气 H 2:氧气 N 2:氮气 03:臭氧1. 元素符号: Zn氧化物:+1 价+2 价:锌 NaOH :氢氧化钠 Ca(OH) 2: 氢氧化钙KOH :氢氧化钾 NH 3 .H 2O 氨水Mg(OH) 2: 氢氧化镁 Fe(OH) 3:氢氧化铁Cu(OH) 2:氢氧化铜 Al(OH) 3:氢氧化铁盐酸盐:KCI:氯化钾NaCI:氯化钠KCI:氯化钾AgCI:氯化银CuCl2:氯化铜CaCl2:氯化钙MgCl2 :氯化镁Zn CI2:氯化锌BaCl2:氯化钡FeCl2:氯化亚铁AICI3:氯化铝FeCl3:氯化铁碳酸盐:CaC0 3:碳酸钙Na2CO3:碳酸钠NaHCO 3:碳酸氢钠BaC0 3:碳酸钡K2CO3:碳酸钾NH4HCO3:碳酸氢铵硫酸盐:Na2SO4:硫酸钠Zn SO4:硫酸锌MgSO4:硫酸镁CaS0 4:硫酸钙CuSO4:硫酸铜BaSO4:硫酸钡FeSO 4:硫酸亚铁Fe2(SO4)3:硫酸铁Al2(SO4)3:硫酸铝(NH 4)2SO4:硫酸铵Na2SO3:亚硫酸钠硝酸盐:AgNO3:硝酸银NaNO3:硝酸钠CU(NO3)2:硝酸铜KNO3:硝酸钾NH4NO3:硝酸铵NaNO2:亚硝酸钠钾盐:KMn O4:高锰酸钾K2M nO4:锰酸钾KCIO3:氯酸钾有机化合物:C2H5OH:乙醇C6H12O6:葡萄糖CH4:甲烷九年级化学方程式分类:1.碳充分燃烧:C+O2 点燃CO22.碳不充分燃烧:2C+O2 点燃2CO3.一氧化碳燃烧:2CO+O 2 点燃2CO24.产生一氧化碳:C+CO2 高温2CO5.硫燃烧:S+O2 ^燃SO26.红磷燃烧:4P+5O 2 点燃2P2O52H 2+O 2点燃 2H 2O 3Fe+2O 2 点燃 Fe 3O 4 2Mg+O 2 点燃 2MgO 4A1+3O 2 点燃 2AI 2O 3CH 4+2O 2 点燃 CO 2+2H 2O C 2H 5OH+3O 2 点燃 2CO 2+3H 2O C 6H 12O 6+6O 2 酶 6CO 2+6H 2O14. 高锰酸钾制氧气:2KMn 。
初中常见化学式大全
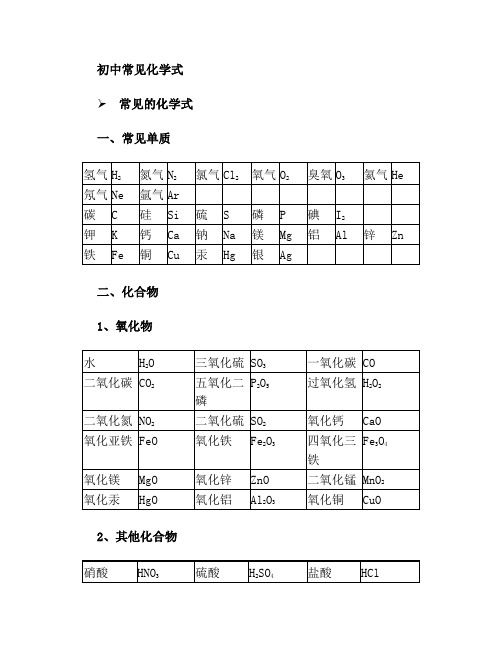
初中常见化学式➢ 常见的化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg O2点燃 2MgO2、铁在氧气中燃烧:3Fe 2O2点燃 Fe3O43、铝在空气中燃烧:4Al 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 O2点燃 2H2O5、红磷在空气中燃烧:4P 5O2点燃 2P2O56、硫粉在空气中燃烧: S O2点燃 SO27、碳在氧气中充分燃烧:C O2 点燃CO28、碳在氧气中不充分燃烧:2C O2点燃 2CO9、二氧化碳通过灼热碳层: C CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 H2O === H2CO312、生石灰溶于水:CaO H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na Cl2点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO2 2H2O O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 MnO2 O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑ O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe CuSO4 == FeSO4 Cu21、锌和稀硫酸反应(实验室制氢气):Zn H2SO4 == ZnSO4H2↑22、镁和稀盐酸反应:Mg 2HCl === MgCl2 H2↑23、氢气还原氧化铜:H2 CuO 加热 Cu H2O24、木炭还原氧化铜:C 2CuO 高温2Cu CO2↑25、甲烷在空气中燃烧:CH4 2O2 点燃 CO2 2H2O26、水蒸气通过灼热碳层:H2O C 高温H2 CO27、焦炭还原氧化铁:3C 2Fe2O3高温4Fe 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH CuSO4 == Cu(OH)2↓ Na2SO429、甲烷在空气中燃烧:CH4 2O2点燃CO2 2H2O30、酒精在空气中燃烧:C2H5OH 3O2点燃 2CO2 3H2O31、一氧化碳还原氧化铜:CO CuO加热Cu CO232、一氧化碳还原氧化铁:3CO Fe2O3高温2Fe 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 CO2==== CaCO3 ↓ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH CO2 ==== Na2CO3 H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 2HCl === CaCl2 H2O CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 2HCl=== 2NaCl H2O CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg O2点燃 2MgO2. 铁在氧气中燃烧:3Fe 2O2点燃 Fe3O43. 铜在空气中受热:2Cu O2加热 2CuO4. 铝在空气中燃烧:4Al 3O2点燃 2Al2O35. 氢气中空气中燃烧:2H2 O2点燃 2H2O6. 红磷在空气中燃烧:4P 5O2点燃 2P2O57. 硫粉在空气中燃烧: S O2 点燃 SO28. 碳在氧气中充分燃烧:C O2点燃CO29. 碳在氧气中不充分燃烧:2C O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO O2点燃 2CO211. 甲烷在空气中燃烧:CH4 2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH 3O2点燃2CO23H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电2H2↑ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO H2O CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 MnO2 O2↑17. 碳酸不稳定而分解:H2CO3 === H2O CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 CuO 加热Cu H2O20. 木炭还原氧化铜:C 2CuO 高温2Cu CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C 2Fe2O3 高温4Fe 3CO2↑22. 焦炭还原四氧化三铁:2C Fe3O4高温 3Fe 2CO2↑23. 一氧化碳还原氧化铜:CO CuO 加热 Cu CO224. 一氧化碳还原氧化铁:3CO Fe2O3高温2Fe 3CO225. 一氧化碳还原四氧化三铁:4CO Fe3O4高温 3Fe 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质酸 -------- 盐氢气(置换反应)26. 锌和稀硫酸Zn H2SO4 = ZnSO4 H2↑27. 铁和稀硫酸Fe H2SO4 = FeSO4 H2↑28. 镁和稀硫酸Mg H2SO4 = MgSO4 H2↑29. 铝和稀硫酸2Al 3H2SO4 = Al2(SO4)3 3H2↑30. 锌和稀盐酸Zn 2HCl === ZnCl2 H2↑31. 铁和稀盐酸Fe 2HCl === FeCl2 H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2 H2↑33. 铝和稀盐酸2Al 6HCl == 2AlCl3 3H2↑(2)金属单质盐(溶液) ------- 另一种金属另一种盐34. 铁和硫酸铜溶液反应:Fe CuSO4 === FeSO4 Cu35. 锌和硫酸铜溶液反应:Zn CuSO4 === ZnSO4 Cu36. 铜和硝酸汞溶液反应:Cu Hg(NO3)2 === Cu(NO3)2 Hg(3)碱性氧化物酸 -------- 盐水37. 氧化铁和稀盐酸反应:Fe2O3 6HCl === 2FeCl3 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 3H2SO4 === Fe2(SO4)3 3H2O39. 氧化铜和稀盐酸反应:CuO 2HCl ==== CuCl2 H2O40. 氧化铜和稀硫酸反应:CuO H2SO4 ==== CuSO4 H2O41. 氧化镁和稀硫酸反应:MgO H2SO4 ==== MgSO4 H2O42. 氧化钙和稀盐酸反应:CaO 2HCl ==== CaCl2 H2O(4)酸性氧化物碱 -------- 盐水43.苛性钠暴露在空气中变质:2NaOH CO2 ==== Na2CO3 H2O 44.苛性钠吸收二氧化硫气体:2NaOH SO2 ==== Na2SO3 H2O 45.苛性钠吸收三氧化硫气体:2NaOH SO3 ==== Na2SO4 H2O 46.消石灰放在空气中变质:Ca(OH)2 CO2 ==== CaCO3 ↓ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 SO2 ==== CaSO3↓ H2O(5)酸碱 -------- 盐水48.盐酸和烧碱起反应:HCl NaOH ==== NaCl H2O49. 盐酸和氢氧化钾反应:HCl KOH ==== KCl H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl Cu(OH)2 ==== CuCl2 2H2O51. 盐酸和氢氧化钙反应:2HCl Ca(OH)2 ==== CaCl2 2H2O52. 盐酸和氢氧化铁反应:3HCl Fe(OH)3 ==== FeCl3 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl Al(OH)3 ==== AlCl3 3H2O54.硫酸和烧碱反应:H2SO4 2NaOH ==== Na2SO4 2H2O55.硫酸和氢氧化钾反应:H2SO4 2KOH ==== K2SO4 2H2O56.硫酸和氢氧化铜反应:H2SO4 Cu(OH)2 ==== CuSO4 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 2Fe(OH)3==== Fe2(SO4)3 6H2O58. 硝酸和烧碱反应:HNO3 NaOH ==== NaNO3 H2O(6)酸盐 -------- 另一种酸另一种盐59.大理石与稀盐酸反应:CaCO3 2HCl === CaCl2 H2O CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 2HCl === 2NaCl H2O CO2↑61.碳酸镁与稀盐酸反应: MgCO3 2HCl === MgCl2 H2O CO2↑62.盐酸和硝酸银溶液反应:HCl AgNO3=== AgCl↓ HNO363.硫酸和碳酸钠反应:Na2CO3 H2SO4 === Na2SO4 H2O CO2↑64.硫酸和氯化钡溶液反应:H2S O4 BaCl2 ==== BaSO4↓ 2HCl (7)碱盐 -------- 另一种碱另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO4 66.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH (8)盐盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl AgNO3==== AgCl↓ NaNO371.硫酸钠和氯化钡:Na2SO4 BaCl2 ==== BaSO4↓ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 H2O === H2CO373.生石灰溶于水:CaO H2O === Ca(OH)274.氧化钠溶于水:Na2O H2O ==== 2NaOH75.三氧化硫溶于水:SO3 H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O 77.无水硫酸铜作干燥剂:CuSO4 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu O2点燃或Δ2CuO 红色金属变为黑色固体4Al 3O2点燃或Δ2Al2O3银白金属变为白色固体3Fe 2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe 3O2高温2Fe2O3C O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P 5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH42O2点燃2H2O CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2 5O2点燃2H2O 4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl 3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑ O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO H2O CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑ H2O CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn H2SO4=ZnSO4 H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe H2SO4=FeSO4 H2↑有大量气泡产生、金属颗粒逐渐溶解Mg H2SO4 =MgSO4 H2↑有大量气泡产生、金属颗粒逐渐溶解2Al 3H2SO4=Al2(SO4)3 3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3 3H2Δ 2Fe 3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 4H2 Δ3Fe 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 3H2Δ W 3H2O 冶炼金属钨、利用氢气的还原性MoO3 3H2ΔMo 3H2O 冶炼金属钼、利用氢气的还原性2Na Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2 Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 2NaOH=Cu(OH)2↓ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO O2点燃2CO2蓝色火焰煤气燃烧C CuO 高温2Cu CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3 3C高温4Fe 3CO2↑冶炼金属Fe3O4 2C高温3Fe 2CO2↑冶炼金属C CO2 高温2COCO2H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑ H2O 石蕊红色褪去Ca(OH)2 CO2= CaCO3↓ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 H2O CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓ H2O CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3 H2O CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO CO2↑工业制备二氧化碳和生石灰CaCO3 2HCl=CaCl2 H2O CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg O2点燃2MgO2. 铁在氧气中燃烧:3Fe 2O2点燃 Fe3O43. 铜在空气中受热:2Cu O2加热 2CuO4. 铝在空气中燃烧:4Al 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P 5O2点燃2P2O57. 硫粉在空气中燃烧: S O2 点燃SO28. 碳在氧气中充分燃烧:C O2点燃 CO29. 碳在氧气中不充分燃烧:2C O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO O2点燃 2CO211. 甲烷在空气中燃烧:CH4 2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH 3O2点燃 2CO2 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg O2 ↑14.加热高锰酸钾:2KMnO4加热K2MnO4 MnO2 O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑ O2 ↑17.生石灰溶于水英语六级作文:CaO H2O == Ca(OH)218.二氧化碳可溶于水: H2O CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg O2点燃2MgO20.铁和硫酸铜溶液反应:Fe CuSO4 === FeSO4 Cu21.氢气还原氧化铜:H2 CuO 加热 Cu H2O22. 镁还原氧化铜:Mg CuO 加热 Cu MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C O2点燃 CO224.木炭还原氧化铜:C 2CuO 高温2Cu CO2↑25.焦炭还原氧化铁:3C 2Fe2O3高温4Fe 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C O2 点燃 CO227.煤炉的中层:CO2 C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 2HCl == CaCl2 H2O CO2↑30.碳酸不稳定而分解:H2CO3 == H2O CO2↑31.二氧化碳可溶于水: H2O CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO CO2↑33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 CO2 === CaCO3↓ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO CuO 加热 Cu CO235.一氧化碳的可燃性:2CO O2点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl H2O CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 2O2点燃 CO2 2H2O38.酒精在空气中燃烧:C2H5OH 3O2 点燃2CO2 3H2O39.氢气中空气中燃烧:2H2 O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg O2点燃2MgO41.铁在氧气中燃烧:3Fe 2O2点燃 Fe3O442. 铜在空气中受热:2Cu O2加热2CuO43. 铝在空气中形成氧化膜:4Al 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn H2SO4 = ZnSO4 H2↑45. 铁和稀硫酸Fe H2SO4 = FeSO4 H2↑46. 镁和稀硫酸Mg H2SO4 = MgSO4 H2↑47. 铝和稀硫酸2Al 3H2SO4 = Al2(SO4)3 3H2↑48. 锌和稀盐酸Zn 2HCl == ZnCl2 H2↑49. 铁和稀盐酸Fe 2HCl == FeCl2 H2↑50. 镁和稀盐酸Mg 2HCl == MgCl2 H2↑51.铝和稀盐酸2Al 6HCl == 2AlCl3 3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe CuSO4 == FeSO4 Cu53. 锌和硫酸铜溶液反应:Zn CuSO4 ==ZnSO4 Cu54. 铜和硝酸汞溶液反应:Cu Hg(NO3)2 == Cu(NO3)2 Hg(3)金属铁的治炼原理:55.3CO 2Fe2O3 高温 4Fe 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 6HCl ==2FeCl3 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 3H2SO4 == Fe2(SO4)3 3H2O58. 氧化铜和稀盐酸反应:CuO 2HCl ==CuCl2 H2O59. 氧化铜和稀硫酸反应:CuO H2SO4 == CuSO4 H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl NaOH == NaCl H2O61. 盐酸和氢氧化钙反应:2HCl Ca(OH)2 == CaCl2 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl Al(OH)3 == AlCl3 3H2O63. 硫酸和烧碱反应:H2SO4 2NaOH == Na2SO4 2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO32HCl == CaCl2 H2O CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 2HCl == 2NaCl H2O CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 HCl== NaCl H2O CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 BaCl2 == BaSO4↓ 2HCl 2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH CO2 == Na2CO3 H2O 69.苛性钠吸收二氧化硫气体:2NaOH SO2 == Na2SO3 H2O 70.苛性钠吸收三氧化硫气体:2NaOH SO3 == Na2SO4 H2O 71.消石灰放在空气中变质:Ca(OH)2 CO2 == CaCO3↓ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 SO2 == CaSO3↓ H2O(2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 == CaCO3↓ 2NaOH3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe CuSO4 == FeSO4 Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 2HCl == 2NaCl H2O CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 HCl== NaCl H2O CO2↑(3)盐碱 -------- 另一种碱另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 == CaCO3↓ 2NaOH (4)盐盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl AgNO3== AgCl↓ NaNO3 78.硫酸钠和氯化钡:Na2SO4 BaCl2== BaSO4↓ 2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO2 Ca(OH)2 == CaCO3↓ H2O2、氢氧化钠在空气中变质:CO2 2NaOH = Na2CO3 H2O3、氢氧化钠溶液吸收二氧化硫:SO2 2NaOH==Na2SO3 H2O4、一氧化碳还原氧化铜:CO CuO Cu CO25、酒精燃烧:C2H5OH 3O2 2CO2 3H2O6、甲烷燃烧:CH4 2O2 CO2 2H2O。
完整版)初中化学必背化学式大全

完整版)初中化学必背化学式大全元素符号:H、He、C、N、O、F、Ne、Na、Mg、Al、Si、P、S、Cl、Ar、K、Ca、Mn、Fe、Cu、Zn、Ag、Ba、Pt、Au、Hg、I常见离子和化合物中元素的化合价:1价离子:H+、Na+、K+、Ag+、NH4+;2价离子:Ca2+、Mg2+、Cu2+、Ba2+、Zn2+、Fe2+;3价离子:Fe3+、Al3+;1价离子:Cl-、OH-、NO3-;2价离子:O2-、SO42-、CO32-常见物质的化学式与名称:单质:碳C、硫S、磷P、铁Fe、镁Mg、铝Al、汞Hg、锌Zn、铜Cu、银Ag、氧气O2、氮气N2、臭氧O3;氧化物:一氧化碳CO、二氧化碳CO2、二氧化硫SO2、二氧化锰MnO2、三氧化硫SO3、过氧化氢H2O2、氧化铜CuO、氧化钙CaO、氧化镁MgO、氧化汞HgO、氧化铁Fe2O3、氧化铝Al2O3;酸:盐酸HCl、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、亚硫酸H2S、醋酸CH3COOH;碱:氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化钾KOH、氢氧化镁Mg(OH)2、氢氧化铜Cu(OH)2、氨水NH3.H2O、氢氧化铁Fe(OH)3、氢氧化铝Al(OH)3;盐酸盐:氯化钾KCl、氯化钠NaCl、氯化银AgCl、氯化铜CuCl2、氯化钙CaCl2、氯化镁MgCl2、氯化锌ZnCl2、氯化钡BaCl2、氯化亚铁FeCl2、氯化铝AlCl3、氯化铁FeCl3;碳酸盐:碳酸钙CaCO3、碳酸钠Na2CO3、碳酸氢钠NaHCO3、碳酸钡BaCO3、碳酸钾K2CO3、碳酸氢铵NH4HCO3;硫酸盐:硫酸钠Na2SO4、硫酸锌ZnSO4、硫酸镁MgSO4、硫酸钙CaSO4、硫酸铜CuSO4、硫酸钡BaSO4、硫酸亚铁FeSO4、硫酸铁Fe2(SO4)3、硫酸铝Al2(SO4)3.化学实验中常用的化学物质包括硫酸铝(NH4)2SO4、硫酸铵Na2SO3、亚硫酸钠、硝酸盐如AgNO3、硝酸银NaNO3、硝酸钠Cu(NO3)2、硝酸铜KNO3、硝酸钾NH4NO3、硝酸铵NaNO2、亚硝酸钠钾盐KMnO4、高锰酸钾K2MnO4、锰酸钾KClO3、氯酸钾,以及有机化合物如乙醇C2H5OH、葡萄糖C6H12O6和甲烷CH4等。
九年级科学化学式大全

九年级科学化学式大全一、单质的化学式。
1. 金属单质。
- 铁:Fe。
- 铜:Cu。
- 铝:Al。
- 镁:Mg。
- 锌:Zn。
- 银:Ag。
- 金:Au。
- 汞(液态金属):Hg。
2. 非金属单质。
- 氢气:H₂。
- 氧气:O₂。
- 氮气:N₂。
- 氯气:Cl₂。
- 臭氧:O₃。
- 碳(石墨、金刚石):C。
- 硅:Si。
- 磷(白磷为P₄,红磷化学式习惯写为P)- 硫:S。
二、化合物的化学式。
1. 氧化物。
- 水:H₂O。
- 过氧化氢(双氧水):H₂O₂。
- 一氧化碳:CO。
- 二氧化碳:CO₂。
- 一氧化氮:NO。
- 二氧化氮:NO₂。
- 二氧化硫:SO₂。
- 三氧化硫:SO₃。
- 氧化铜:CuO。
- 氧化铁(三氧化二铁):Fe₂O₃。
- 四氧化三铁:Fe₃O₄。
- 氧化镁:MgO。
- 氧化铝:Al₂O₃。
- 二氧化锰:MnO₂。
2. 酸。
- 盐酸:HCl。
- 硝酸:HNO₃。
- 碳酸:H₂CO₃。
- 磷酸:H₃PO₄。
3. 碱。
- 氢氧化钠:NaOH。
- 氢氧化钙:Ca(OH)₂。
- 氢氧化钾:KOH。
- 氢氧化镁:Mg(OH)₂。
- 氢氧化铝:Al(OH)₃。
- 氢氧化铁:Fe(OH)₃(红褐色沉淀)- 氢氧化铜:Cu(OH)₂(蓝色沉淀)4. 盐。
- 氯化钠:NaCl。
- 碳酸钠:Na₂CO₃。
- 碳酸氢钠:NaHCO₃。
- 碳酸钙:CaCO₃。
- 硫酸铜:CuSO₄。
- 硫酸亚铁:FeSO₄。
- 硫酸铁:Fe₂(SO₄)₃。
- 硝酸银:AgNO₃。
- 氯化银:AgCl(白色沉淀)- 硫酸钡:BaSO₄(白色沉淀)- 氯化铵:NH₄Cl。
- 硝酸铵:NH₄NO₃。
- 碳酸铵:(NH₄)₂CO₃。
(完整word版)初中常见化学式大全,推荐文档

初中常见化学式➢常见的化学式初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2点燃 2CO9、二氧化碳通过灼热碳层:2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K22+O2↑172O 通电 2H2↑+O2↑1823 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4== ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2+CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2+3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233:Ca(OH)2+ CO2==== CaCO3↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3+H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2+H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O+CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H22点燃 2H2O6. 红磷在空气中燃烧:2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:2点燃 CO29. 碳在氧气中不充分燃烧:2点燃 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO22H2O12. 酒精在空气中燃烧:C2H52点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO215.3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4+MnO2+O2↑17. 碳酸不稳定而分解:H232O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑ 2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:34高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe23高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:34高温 3Fe+ 4CO2(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4= ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4= FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4= MgSO4+H2↑29. 铝和稀硫酸2Al+ 3H2SO4= Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2=== Cu(NO3)2+Hg(3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4=== Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3+H2O45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3+3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2==== CuSO4+2H2O57. 硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2H2O +CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4=== Na2SO4+H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4+BaCl2==== BaSO4↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3=== CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO45H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H24·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O 3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4甲烷和天然气的燃烧2C2H2+ 5O点燃2H2O +4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水4氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ4MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu223Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳Zn+ H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H 2SO 4 =MgSO 4 +H 2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H 2SO 4=Al 2(SO4)3+ 3H 2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe 2O 3+3H 2 Δ 2Fe +3H 2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢Fe 3O 4 +4H 2 Δ3Fe+ 4H 2O 黑色逐渐变为银白色英语翻译、试管壁有液体 冶炼金属、WO 3 +3H 2Δ W +3H 2O 冶炼金属钨、利用氢气的还原性 MoO 3 +3H 2 ΔMo +3H 2O 冶炼金属钼、利用氢气的还原性2Na+ Cl 2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、 H 2 +Cl 2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸CuSO 4 +2NaOH=Cu(OH)2↓+ Na 2SO 4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验2C +O 点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因 点燃2CO 2 蓝色火焰 煤气燃烧 C+ CuO 高温2Cu+ CO 2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属2Fe 2O 3+ 3C 高温4Fe+ 3CO 2↑ 冶炼金属 Fe 3O 4 +2C 高温3Fe+ 2CO 2↑ 冶炼金属 C+ CO2 高温2COCO 2+ H 223 碳酸使石蕊变红 证明碳酸的酸性小学三语文教学论文 H 2CO 3 ΔCO 2↑+ H 2O 石蕊红色褪去Ca(OH)2 +CO 2= CaCO 3↓+ H 2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁 CaCO 3 +H 2O+ CO 2 = Ca(HCO 3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化 Ca(HCO 3)2Δ CaCO 3↓+ H 2O +CO 2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.2NaHCO 3ΔNa 2CO 3+ H 2O +CO 2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头 CaCO 3 高温 CaO +CO 2↑ 工业制备二氧化碳和生石灰 CaCO 3 2+ H 2O +CO 2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢 初中化学方程式汇总 一、 氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg+ O 2 点燃 2MgO 2. 铁在氧气中燃烧:3Fe+ 2O 2 点燃 Fe 3O 4 3. 铜在空气中受热:2Cu+ O 2 加热 2CuO 4. 铝在空气中燃烧:4Al +3O2 点燃2Al 2O 3 5. 氢气中空气中燃烧:2H 2 +O 2 点燃 2H 2O 6. :4P +5O 2 点燃 2P 2O 5 7. 硫粉在空气中燃烧: S +O 2 点燃 SO 2 8. 碳在氧气中充分燃烧:2 点燃 CO 2 9. 碳在氧气中不充分燃烧:2 点燃 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O 2 点燃 2CO 211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O12. 酒精在空气中燃烧:C2H52点燃 2CO2+3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2↑14.加热高锰酸钾:2KMnO4加热 K242+O2↑(实验室制氧气原理1)15 H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+O2↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:44+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO282CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3== H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑33:Ca(OH)2 +CO2=== CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO235.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO32HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2+3H2O39.氢气中空气中燃烧:2H2+ O2点燃 2H2六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4= ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4= FeSO4+H2↑46. 镁和稀硫酸Mg +H2SO4= MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4= Al2(SO4)3+3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4+Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4+Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2== Cu(NO3)2+Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3+6HCl ==2FeCl3+3H2O57. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4 == Fe2(SO4)3+3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2+H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3+3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2+H2O+ CO2↑65.碳酸钠与稀盐酸反应: Na2CO3+2HCl == 2NaCl+ H2O+ CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑67. 硫酸和氯化钡溶液反应:H2SO4+BaCl2== BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3+H2O70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4+H2O71.消石灰放在空气中变质:Ca(OH)2+ CO2== CaCO3↓+H2O72. 消石灰吸收二氧化硫:Ca(OH)2 +SO 2 == CaSO 3↓+ H 2O (2)碱 酸-------- 盐 水(中和反应,方程式见上) (3)碱 盐 -------- 另一种碱 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液) 金属单质------- 另一种金属 另一种盐 74. 铁和硫酸铜溶液反应:Fe+ CuSO 4 == FeSO 4 +Cu (2)盐 酸-------- 另一种酸 另一种盐75.碳酸钠与稀盐酸反应: Na 2CO 3 +2HCl == 2NaCl +H 2O+ CO 2↑ 碳酸氢钠与稀盐酸反应:NaHCO 3 +HCl== NaCl+ H 2O +CO 2↑ (3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH (4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl↓+NaNO 3 78.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl 一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△点燃 点燃。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、氧气的性质:
1. 镁在空气中燃烧:2Mg + O2点燃2MgO
★2. 铁在氧气中燃烧:3Fe + 2O点燃Fe3O4
3. 铜在空气中受热:2Cu + O△2CuO
4. 铝在空气中燃烧:4Al + 3O点燃2Al2O3
★5. 氢气中空气中燃烧:2H2 + O2点燃2H2O
★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2点燃2P2O5
7. 硫粉在空气中燃烧:S + O2点燃SO2
8. 碳在氧气中充分燃烧: C + O2点燃CO2
9. 碳在氧气中不充分燃烧:2C + O2点燃2CO
10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO2
11.玻义耳研究空气的成分实验2HgO △2Hg+ O2 ↑
★12.加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑
2KCl+3O2↑★13.氯酸钾和二氧化锰共热制取氧气2KClO3MnO2
△
★14.过氧化氢二氧化锰催化剂条件下分解反应2H2O2 MnO2 2O+ O2 ↑二、自然界中的水:
★15.电解水(探究水的组成实验):2H2O 通电2H2↑+ O2 ↑16.生石灰溶于水:CaO + H2O = Ca(OH)2
17.二氧化碳可溶于水:H2O + CO2=H2CO3
三、质量守恒定律:
18.镁在空气中燃烧:2Mg + O点燃2MgO
★19.铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu
★20.氢气还原氧化铜:H2 + CuO △Cu + H2O
四、碳和碳的氧化物:
21. 碳在氧气中充分燃烧: C + O2点燃CO2
★22.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑23.焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑24.煤炉的底层: C + O2点燃CO2
25.煤炉的中层:CO2 + C 高温2CO
26.煤炉的上部蓝色火焰的产生:2CO + O2点燃2CO2
★27.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑28.碳酸不稳定而分解:H2CO3 = H2O + CO2↑
29.二氧化碳可溶于水:H2O + CO2=H2CO3
★30.高温煅烧石灰石(工业制CO2):CaCO3高温CaO + CO2↑
★31.石灰水与二氧化碳反应Ca(OH)2 + CO2 = CaCO3↓+ H2O ★32.一氧化碳还原氧化铜:CO+ CuO △Cu + CO2
★33.一氧化碳的可燃性:2CO + O2点燃2CO2
★34.碳酸钠与稀盐酸灭火器Na2CO3 + 2HCl =2NaCl +H2O +CO2↑
五、燃料及其利用:
★35.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O
★36.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O ★37.氢气中空气中燃烧:2H2 + O2点燃2H2O
六、金属
38.镁在空气中燃烧:2Mg + O2点燃2MgO
39.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4
40. 铜在空气中受热:2Cu + O△2CuO
41. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3
★42. 锌和稀硫酸(实验室制取氢气)Zn + H2SO4 = ZnSO4 + H2↑
★43. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
44. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
45. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
46. 锌和稀盐酸Zn + 2HCl = ZnCl2 + H2↑
47. 铁和稀盐酸Fe + 2HCl =FeCl2 + H2↑
48. 镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑49.铝和稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑
★50. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu
51. 锌和硫酸铜溶液反应:Zn + CuSO4 =ZnSO4 + Cu
52. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2 + Hg
★53.金属铁的治炼原理:3CO+ 2Fe2O3高温4Fe + 3CO2↑七、酸、碱、盐
★54. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O
★55. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O
56. 氧化铜和稀盐酸反应:CuO + 2HCl =CuCl2 + H2O
57. 氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O
★58.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O
★59. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O
60. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O
61. 硫酸和烧碱反应:H2SO4 + 2NaOH =Na2SO4 + 2H2O ★62.大理石与稀盐酸反CaCO3 +2HCl =CaCl2+H2O+CO2↑★63.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑64.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑★65. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl ★66.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 67.苛性钠吸收二氧化硫气体:2NaOH + SO2 =Na2SO3 + H2O 68.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O
★69.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O 70. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O ★71. 铁和硫酸铜溶液(波尔多液不能用铁桶装):Fe + CuSO4 = FeSO4 + Cu
★72.碳酸钠与稀盐酸检验NaOH变质Na2CO3+2HCl=2NaCl+H2O+CO2↑★73. 碳酸氢钠与稀盐酸(小苏打治疗胃酸过多)NaHCO3+HCl=NaCl+H2O+CO2↑
★74. 氢氧化钙与碳酸钠(检验NaOH变质):Ca(OH)2+Na2CO3=CaCO3↓+ 2NaOH
★75.氯化钠和硝酸银(区别食盐和蒸馏水):NaCl + AgNO3 =AgCl↓+ NaNO3★76.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl。
